Mucho se ha hablado y se ha escrito en los medios de comunicación acerca de las células madre. Pero ¿qué son las células madres? ¿De dónde se obtienen? ¿Qué retos plantean? La presente revisión pretende mostrar, de forma concisa, cómo se puede avanzar desde una célula madre a un tipo celular concreto como son las células productoras de insulina. Se analizarán los distintos protocolos utilizados en la actualidad y qué perspectivas presentan ante una futura terapia de la diabetes.
La ausencia de insulina es la causa de la diabetes tipo 1 y de parte de la diabetes tipo 2. Esta importante hormona es producida y secretada por las células beta del páncreas endocrino, por lo que la destrucción autoinmunitaria de estas células (diabetes tipo 1) o fallos en su funcionamiento (diabetes tipo 2) genera esta enfermedad. La inyección diaria de insulina es tan sólo un método paliativo y no supone, ni mucho menos, la cura de la enfermedad. Las células productoras de insulina de nuestro organismo, o células beta, funcionan de una manera muy exquisita, secretando la cantidad adecuada de la hormona en el momento justo. Eso no lo hace una simple inyección de insulina. Todo esto explica por qué los diabéticos desarrollan con el tiempo una serie de complicaciones asociadas, como son la nefropatía en el ámbito renal, la neuropatía en el sistema nervioso periférico, la retinopatía en la visión y numerosas alteraciones cardiovasculares.
Es evidente que si un tejido funciona mal o no funciona en absoluto, la opción es sustituirlo por uno nuevo. Esta es la base de los trasplantes de órganos. En este sentido, el Dr. James Shapiro (Universidad de Edmonton, Canadá) ha puesto a punto una nueva técnica de trasplante de islotes pancreáticos (estructuras donde se encuentran las células beta) en pacientes diabéticos. Este tipo de trasplante ha supuesto un notable avance, ya que ha permitido prescindir de la inyección de insulina durante más de 2 años a más del 80% de los pacientes intervenidos. El éxito de este protocolo se basa en utilizar un régimen inmunosupresor menos agresivo para las células beta trasplantadas y en el hecho de implantar tan sólo las estructuras productoras de insulina los islotes, en lugar del páncreas total, del cual el 99% no posee la capacidad de producir la citada hormona.
Ahora bien, cada paciente susceptible de trasplante necesita al menos 2-3 páncreas en buen estado procedentes de donantes fallecidos. Esto limita mucho la aplicabilidad de esta técnica quirúrgica, ya que el potencial número de donantes no podría cubrir la existente demanda. Esto es aplicable incluso en España, país que ocupa el primer lugar en el mundo en donaciones de órganos y donde, a su vez, se da una baja incidencia de diabetes. En España existen 35-40 donantes/millón de habitantes/año, lo que resulta alrededor de 1.350 donantes anuales. Siendo optimistas, podrían trasplantarse unos 200 diabéticos en un año, lo que queda muy lejos de los 100.000 diabéticos tipo 1 y de los 2.000.000 de diabéticos tipo 2. La conclusión es que son necesarias, por tanto, fuentes alternativas de tejido. En este sentido, las células madre embrionarias representan una posibilidad muy interesante, ya que cumplen 3 propiedades fundamentales:
Ser una fuente ilimitada de biomaterial por su capacidad de dividirse indefinidamente.
Poder diferenciarse a los más de 200 tipos celulares que contiene un organismo adulto y, en este sentido, muy posiblemente a células productoras de insulina.
Repoblar tejidos o adaptarse a determinados nichos una vez diferenciadas, lo que las hace una herramienta ideal para aplicar en trasplante.
Un cierto volumen de trabajo se ha realizado ya con células madre embrionarias de origen murino. Las células madre adultas representan otra alternativa a considerar, sin embargo, por el momento no han demostrado la plasticidad exhibida por las embrionarias. El reciente trabajo publicado por la Dra. Catherine Verfaillie (Universidad de Minnesota, EE.UU.) describe el aislamiento de un tipo celular multipotencial a partir de médula ósea humana. Este tipo celular ha mostrado una gran plasticidad, siendo capaz de diferenciarse a tipos celulares especializados como células mesenquimales, mesodermo visceral, neuroectodermo y, en menor medida, a endodermo que justamente es la capa embrionaria de la que derivan los islotes de Langerhans. Tampoco las células ductales pancreáticas aisladas por la doctora Susan Bonner-Weir (Facultad de Medicina de Harvard, EE.UU.) que son células adultas del propio páncreas capaces de diferenciarse a productoras de insulina, han mostrado una producción adecuada de la hormona.
Por tanto, no existe, por el momento, una fuente potencial de células adultas que tenga la capacidad de derivar in vitro hacia células productoras de insulina. Sin embargo, esto no quiere decir que no exista o que adoptando nuevas estrategias no se pueda optimizar la producción de insulina en las células madre adultas. En cualquier caso, el primer paso es caracterizar muy bien estas células para analizar sus posibilidades dentro del campo de la medicina regenerativa y de los trasplantes.
Obtención de células productoras de insulina
Las estrategias utilizadas por los diferentes laboratorios de investigación, hasta el momento, se pueden agrupar en tres grandes grupos:
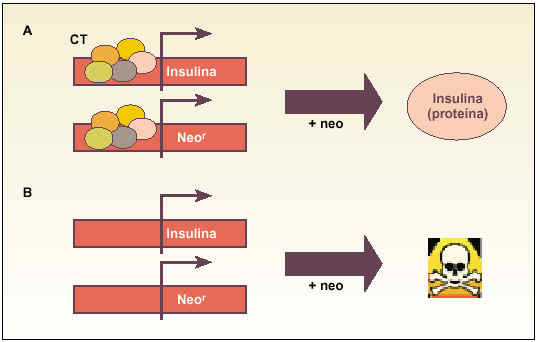
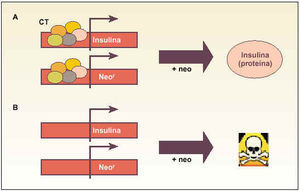
Trampas celulares (gating technology). Aproximación genética muy sencilla que intenta seleccionar un tipo celular específico, aprovechando la capacidad que tiene ese tipo para expresar un gen exclusivo y específico (fig. 1).
Fig. 1. Esquema explicativo del funcionamiento de las «trampas celulares» para obtener células productoras de insulina. Básicamente, se transinfectan las células con un gen que confiere resistencia a un antibiótico (p. ej., neomicina [Neo]). La idea es que las células (A) que expresen el gen endógeno de la insulina, debido a la presencia del complejo de transcripción (CT), expresarán al mismo tiempo el gen de resistencia y, al añadir neomicina al medio de cultivo, serán capaces de sobrevivir y expresar la proteína. Sin embargo, las células incapaces de expresar el gen endógeno de insulina (B) tampoco podrán expresar el gen de resistencia y, al añadir el antibiótico al medio de cultivo, serán eliminadas.
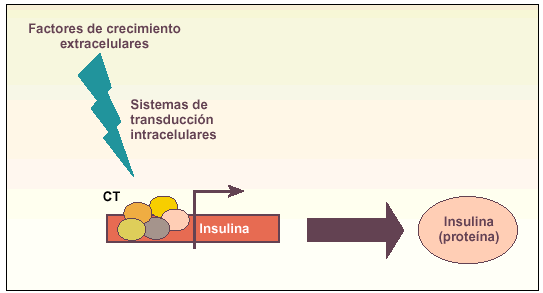
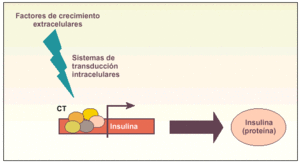
Métodos coaxiales. Producción de determinados tipos celulares mediante la modificación de diversos factores del medio de cultivo que son capaces de inducir diferenciación (fig. 2).
Fig. 2. Esquema explicativo del funcionamiento de los métodos coaxiales para obtener células productoras de insulina. La idea básica es añadir una serie de factores de crecimiento al medio de cultivo que, a través de diversos sistemas de comunicación intracelular (transducción de señales), sean capaces de inducir el complejo de transcripción (CT) del gen de la insulina y, por tanto, la producción de la hormona.
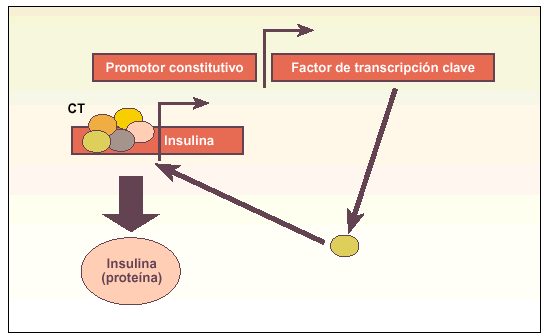
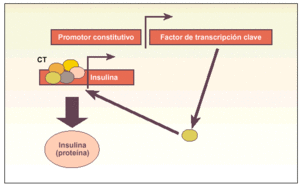
Métodos direccionales. Sistemas en los que se induce la expresión constitutiva o modulada de un gen maestro en el proceso diferenciador a un determinado tipo celular (fig. 3).
Fig. 3. Esquema explicativo del funcionamiento de los métodos direccionales para obtener células productoras de insulina. Estos métodos se basan en asegurar la expresión de un gen que codifica un factor de transcripción clave (p. ej., Pdx-1) para activar el complejo transcripcional (CT) del gen de la insulina, produciendo finalmente la hormona. Alternativamente, este factor de transcripción clave (p. ej., Pax-4) puede favorecer la aparición de algún tipo celular precursor, que posteriormente debe ser madurado in vitro a célula productora de insulina.
Hay que señalar que los diversos grupos de investigación que trabajan en el mundo sobre este campo no usan un método exclusivamente, sino una combinación de varios, aunque siempre hay uno predominante. A continuación, se va a analizar cada uno de los métodos con sus ventajas e inconvenientes para la obtención de células productoras de insulina.
Trampas celulares
Esta metodología ha sido utilizada por nuestro grupo para obtener células productoras de insulina a partir de células madre embrionarias de ratón. La estrategia se basa en conferir a las células que expresan el gen de la insulina la ventaja de resistir a un antibiótico añadido al medio de cultivo. Este antibiótico eliminaría por definición aquellos tipos celulares incapaces de expresar el gen de la insulina y, por consiguiente, permitiría seleccionar de forma positiva sólo las células que expresan la hormona. Esta estrategia ha sido además utilizada con éxito para aislar células similares a cardiomiocitos y neuronas.
Aunque los contenidos iniciales de insulina fueron relativamente bajos, la aplicación posterior de distintas estrategias «coaxiales» de maduración al cultivo permitió incrementar el contenido intracelular de la hormona en sólo algunos grupos celulares. Para ello, se añadió nicotinamida al medio de cultivo, se normalizó la concentración final de glucosa a 5 mM y se favoreció la formación de agregados celulares que facilitaran la interacción celular, de forma similar a lo observado en los islotes de Langerhans.
En cualquier caso, la aplicación de este tipo de estrategias para diferenciar in vitro células madre embrionarias es bastante novedosa y convendría hacer algunas consideraciones al respecto:
La aplicación de esta tecnología requiere la existencia de una proteína específica de un determinado tipo celular y que el gen codificador de esta proteína haya sido caracterizado. Esta caracterización génica debe centrarse, sobre todo, en las regiones reguladoras que en teoría serían las responsables de conferir la resistencia al antibiótico. Todo ello, permite trabajar con genes que se expresan en células diferenciadas, así como con genes que se expresan durante alguna de las etapas del desarrollo embrionario, permitiendo el aislamiento de células precursoras de algún linaje celular. El principal problema es encontrar genes específicos de un determinado tipo celular, así como disponer de las construcciones de ADN que contengan las regiones reguladoras para realizar la selección.
La expresión del gen director de la selección debe ser específica y única. Este es un punto crucial, ya que si el gen director se expresa durante el desarrollo de una forma temporal en otros tipos celulares, éstos podrían ser seleccionados por este sistema.
La regulación del transgén utilizado debe ser similar a la del gen endógeno. Dado que el transgen puede insertarse en sitios de libre acceso del genoma, su expresión puede verse influida por elementos reguladores cercanos de otros genes. Esto podría explicar en nuestro caso particular que los clones celulares obtenidos tengan diferentes contenidos en insulina y que haya que ensayar diversos clones para seleccionar uno que tenga contenidos óptimos, lo cual alarga el tiempo de manipulación del proceso.
El producto del gen utilizado durante la selección puede resultar tóxico para la célula que se está seleccionando. Este es un punto a tener en cuenta, sobre todo, cuando se usan genes trazadores como el que codifica la proteína fluorescente verde. La expresión de esta proteína en algunas células podría resultar tóxica.
En cualquier caso, este tipo de estrategias tiene un futuro muy interesante, ya que no se han explotado todas sus posibilidades en el campo de las células madre. Así, se podría utilizar un sistema trazador utilizando una estrategia similar para detectar células precursoras de determinados tejidos en modelos de animales transgénicos o en sistemas de cultivos celulares. Se puede dar además la posibilidad de combinar diferentes sistemas de resistencia con diferentes sistemas trazadores. También pueden utilizarse sistemas inducibles que permitan la expresión del gen de interés en un momento determinado del protocolo de selección. Finalmente, las construcciones pueden admitir genes de bioseguridad que permitirían la destrucción del tipo celular trasplantado si, por alguna razón, se observara un funcionamiento anómalo.
Métodos coaxiales
Estos métodos permiten el enriquecimiento de un determinado tipo celular mediante la modificación de diversos factores del medio de cultivo. En el campo de las células productoras de insulina, el método más utilizado ha sido el diseñado por el grupo del doctor Ron McKay (Instituto de Salud Mental de Bethesda, EE.UU.) y modificado posteriormente por el doctor Seung Kim (Universidad de Stanford, EE.UU.). Este protocolo se basa en la hipótesis de que las células que expresan nestina son precursoras in vitro de células neuronales y de células endocrinas pancreáticas. La nestina es una proteína que forma parte de neurofilamentos en diversos tipos celulares, incluyendo, desde luego, los precursores neuronales y teóricamente tejido pancreático endocrino, aunque este último punto parece ser más controvertido. El protocolo se divide en 5 fases:
Expansión de las células madre embrionarias en presencia de LIF (leukemia inhibitory factor). LIF es una citocina que se añade al medio de cultivo y que mantiene las células madre murinas desdiferenciadas, permitiendo su división indefinida.
Formación de cuerpos embrionarios. El cuerpo embrionario es una estructura esferoidal que las células madre forman espontáneamente cuando se cultivan en suspensión. Si esta estructura se forma en ausencia de LIF en el medio de cultivo, comienzan los procesos de diferenciación. No se conocen con exactitud los mecanismos, pero los gradientes de nutrientes y de oxígeno que se forman desde el exterior al interior del cuerpo embrionario deben desempeñar un papel fundamental todavía por dilucidar.
Selección de las células positivas a nestina. Para ello, se vuelven a sembrar las células en una superficie adherente y se cultivan en determinados medios definidos que favorecen la expresión del gen de la nestina. Estos medios contienen determinadas concentraciones de insulina, transferrina, selenio y fibronectina. Resulta curioso que la insulina actúe como factor diferenciador para conseguir células productoras de insulina. El mecanismo por el que se produce este fenómeno está por caracterizar y no está exento de controversia, tal y como indica el doctor Douglas Melton (Universidad de Harvard, EE.UU.).
Expansión de las células positivas a nestina. Para ello, el medio antes mencionado se enriquece añadiendo suplementos nutricionales definidos donde destaca la presencia de bFGF (factor de crecimiento básico de fibroblastos).
Maduración. Este paso se caracteriza por la inducción de la expresión de insulina. Para ello, se vuelven a cultivar las células en suspensión para que formen agregados, se elimina el bFGF del medio de cultivo y se añade nicontinamida. En el método empleado por el grupo del doctor Seung Kim se añade en este último paso LY294002 o wortmanina, inhibidores de la fosfatidil-inositol-3-cinasa, una proteína clave en el proceso de proliferación celular.
A pesar del calado y de la trascendencia ética, política y social del tema, el asunto de las células madre es una cuestión meramente científica
El protocolo diseñado por el doctor Ron McKay no consigue una población pura de células productoras de insulina, estimando la existencia de un 15-30% de células contaminantes de tipo neuroide. El contenido en insulina es bajo, pero mejora ostensiblemente con la modificación realizada por el doctor Seung Kim que, además, disminuye el porcentaje de células neuronales. Este es quizá el principal obstáculo de la utilización de los métodos coaxiales: que nunca se llega a obtener un tipo celular puro. Esto quizá sea debido al pleiotropismo de los factores de crecimiento utilizados. Por ejemplo el bFGF, utilizado en este sistema murino por el doctor Ron McKay, tiene un claro efecto proliferador, mientras que este mismo factor, utilizado en células madre humanas por otros grupos de trabajo, tiene un efecto diferenciador a ectodermo y mesodermo. Por tanto, todavía queda por establecer el cóctel de factores de crecimiento necesario para producir la diferenciación a células productoras de insulina, pero no sólo eso, sino también su concentración, la forma de combinarlos y el tiempo de exposición a los distintos tipos celulares.
Métodos direccionales
Estos métodos consisten en la expresión constitutiva o permanente de proteínas clave en la diferenciación de un determinado tipo celular. Para utilizar este tipo de estrategias es necesario manejar la información que llega de parte de los grupos que están estudiando el desarrollo embrionario de las células productoras de insulina. En estos estudios se ha podido identificar una serie de genes clave en este proceso como son los que codifican los factores de transcripción neurogenina-3, Pax-4 y Pdx-1.
La neurogenina-3 es un factor de transcripción que desempeña un papel fundamental en la neogénesis pancreática a partir del endodermo intestinal. Otros factores de transcripción de su misma familia, como neurogenina-1 y -2, son esenciales en el desarrollo de precursores sensoriales del sistema nerviosa periférico. Sin embargo, neurogenina-3 parece exclusiva del linaje pancreático endocrino, ya que su ablación en ratones transgénicos resulta en la agénesis de los islotes de Langerhans. Por complejos mecanismos moleculares y de señalización, neurogenina-3 controla el número de células que se diferencian en un momento determinado del desarrollo embrionario y el porcentaje de células que conservan su potencial proliferativo. Durante el desarrollo, los precursores, expresando neurogenina-3, progresan y se van comprometiendo a los distintos tipos celulares que forman el páncreas endocrino, como son las células alfa (que producen glucagón), las células beta (que producen insulina) y las células delta (que producen somatostatina). Sin embargo, para la progresión a células beta y delta, es necesaria la expresión de otro factor de transcripción, denominado Pax-4. En este sentido, el grupo de la doctora Anna Wobus (Universidad de Ulm, Alemania) consiguió expresar de forma constitutiva Pax-4 bajo el control del promotor de citomegalovirus en células madre embrionarias de ratón. Combinando esta estrategia con un sistema de selección y un sistema coaxial, consiguió obtener células productoras de insulina.
Otro factor clave en el proceso de diferenciación in vivo a célula beta es Pdx-1. Además este factor de transcripción es esencial para la expresión de diversos genes en la célula beta adulta, incluido el de la insulina. La desregulación del gen Shh por el factor Hlxb9 es crucial para la inducción de la expresión de Pdx-1 durante el desarrollo embrionario de la célula beta. Además, este proceso puede reproducirse in vitro con determinadas sustancias como la ciclopamina o anticuerpos específicos que anulan la expresión de Shh. En estas circunstancias, y bajo determinadas condiciones de cultivo, Pdx-1 se puede expresar en células madre embrionarias. La importancia de este factor de transcripción se apoya por experimentos realizados por la Dra. Sarah Ferber (Universidad de Tel-Aviv, Israel) en los que sobreexpresando mediante adenovirus recombinates Pdx-1 en hepatocitos adultos de ratón, se conseguía inducir modestamente la expresión del gen de la insulina en hígado.
Sin embargo, otras publicaciones han revelado que Pdx-1 no sería tan esencial como se esperaba y que, muy posiblemente, necesite la presencia de otros factores de transcripción. Así, por ejemplo, el antes mencionado grupo de la Dra. Anna Wobus consiguió expresar de forma constitutiva Pdx-1 bajo el control del promotor de citomegalovirus en células madre embrionarias, consiguiendo una producción modesta de insulina y mucho menor que cuando expresaba Pax-4. Utilizando sistemas virales diferentes de los usados por la Dra. Sarah Ferber, el grupo del Dr. Lawrence Chan (Universidad de Houston, EE.UU.) ha conseguido expresar Pdx-1 en hepatocitos de ratones diabéticos, induciendo una hepatitis fulminante en estos animales. Sin embargo, la expresión de otro factor, denominado NeuroD, indujo neogénesis y la aparición de agregados celulares capaces de producir insulina dentro del tejido hepático. Todos estos resultados sugieren que la utilización de Pdx-1 en protocolos de bioingeniería celular debe ser reconsiderada.
En definitiva, la aplicación de este tipo de metodología requiere no sólo disponer de genes que desempeñen papeles clave durante la diferenciación a célula beta, sino de tipos celulares donde estos genes funcionen de la forma más parecida a como lo hacen durante el desarrollo embrionario. Todos estos resultados parecen sugerir que estas estrategias direccionales necesitan más investigación básica y más colaboración entre distintas disciplinas para poder diseñar los protocolos más adecuados.
Conclusiones
A pesar del calado y la trascendencia ética, política y social del tema, el asunto de las células madre es una cuestión meramente científica y son aún muchos los interrogantes por responder y los retos por afrontar. En principio, todavía hay que ahondar mucho sobre el modelo animal y acumular más información antes de transferir esta tecnología a las células madre humanas. Hoy por hoy, no existe una estrategia única y es muy probable que la estrategia para dirigir células madre a células productoras de insulina será una combinación de las estrategias antes descritas y otras nuevas. No sólo habrá que controlar la producción de insulina, sino su secreción y la respuesta celular a situaciones de intensa demanda o de ayuno prolongado. El tema inmunológico deberá ser estudiado también, así como las cuestiones relacionadas con la bioseguridad, ideando herramientas moleculares que permitan solventar estos problemas de forma eficaz.
En definitiva, queda mucho por hacer, pero lo que es innegable es que las células madre han abierto nuevas puertas y han planteado nuevos retos a la investigación, vislumbrando un futuro esperanzador para la terapia no sólo de la diabetes, sino de muchas patologías.
Bibliografía general
Blyszczuk P, Czyz J, Kania G, Wagner M, Roll U, St-Onge L, Wobus AM. Expression of Pax4 in embryonic stem cells promotes differentiation of nestin-positive progenitor and insulin-producing cells. Proc Natl Acad Sci USA 2003;100:998-1003.
Bonner-Weir S, Taneja M, Weir GC, Tatarkiewicz K, Song K-H, Sharma A, O'Neil JJ. In vitro cultivation of human islets from expanded ductal tissue. Proc Natl Acad Sci USA 2000;97:7999-8004.
Ferber S, Halkin A, Cohen H, Ber I, Einav Y, Goldberg I, Barshack I, et al. Pancreatic and duodenal homeobox gene 1 induces expression of insulin genes in liver and ameliorates streptozotocin-induced hyperglycemia. Nature Medicine 2000;6:568-72.
Hori Y, Rulifson IC, Tsai BC, Heit JJ, Cahoy JD, Kim SK. Growth inhibitors promote differentiation of insulin-producing tissue from embryonic stem cells. Proc Natl Acad Sci USA 2002;99:16105-10.
Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-González XR, Reyes M, et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 2002;418:41-9.
Kojima H, Fujimiya M, Matsumura K, Younan P, Imaeda H, Maeda M, Chan L. NeuroD-betacellulin gene therapy induces islet neogenesis in the liver and reverses diabetes in mice. Nature Medicine 2003;9:596-603.
Lumelsky N, Blondel O, Laeng P, Velasco I, Ravin R, McKay R. Differentiation of embryonic stem cells to insulin-secreting structures similar to pancreatic islets. Science 2001;292:1389-94.
Shapiro AMJ, Lakey JRT, Ryan EA, Korbutt GS, Toth E, Warnock GL, Kneteman NM, et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a corticoid-free immunosuppressive regime. N Engl J Med 2000;343:230-8.
Soria B, Roche E, Berná G, León-Quinto T, Reig JA, Martín F. Insulin-secreting cells derived from embryonic stem cells normalize glycemia in streptozotocin-induced diabetic mice. Diabetes 2000;49:157-62.
Torrades S. La investigación con células madre. Offarm 2003;22:90-4.