El virus del papiloma humano es un virus formado por moléculas de ADN circular de 8.000 pares de bases de longitud y envueltas por una cubierta proteica compuesta por 2 moléculas (L1 y L2). El virus está adaptado a su tejido huésped natural, la célula epitelial en vías de diferenciación de la piel o de las mucosas y activa el funcionamiento celular en su propio beneficio.
Existen más de 120 tipos descritos del virus, que se diferencian en que los aminoácidos estructurales del fragmento L1 inmunogénico de sus cápsulas tienen una diferencia secuencial superior al 10%. Sólo 15 de ellos están considerados de alto riesgo para el desarrollo de cáncer de cuello de útero (CCU).
El papel causal del VPH en todos los CCU ha sido firmemente establecido, pero es necesario que se produzcan una serie de factores para que una infección cervical por VPH evolucione a cáncer: uso a largo plazo de anticonceptivos orales, actividad sexual, tabaquismo y coinfección con VIH. Otros factores probables son: coinfección por Chlamydia trachomatis, virus del herpes simple tipo 2, inmunosupresión y determinadas deficiencias nutricionales.
La prevalencia del VPH en la población femenina a nivel mundial se sitúa en un 10-15% a partir de los 30-35 años, con importantes diferencias territoriales. En España, la tasa media, en el segmento bajo, se sitúa alrededor del 3%. En edades más jóvenes la incidencia es más elevada, pero la mayoría de estas presencias virales desaparece espontáneamente sin dejar secuelas durante el primer o segundo año.
El objetivo final a largo plazo de la vacuna frente al VPH es la prevención del cáncer invasivo de cuello de útero. Otros objetivos asociados son la prevención de los otros cánceres relacionados con el VPH: vulva, vagina, ano y pene y, probablemente, orofaringe.
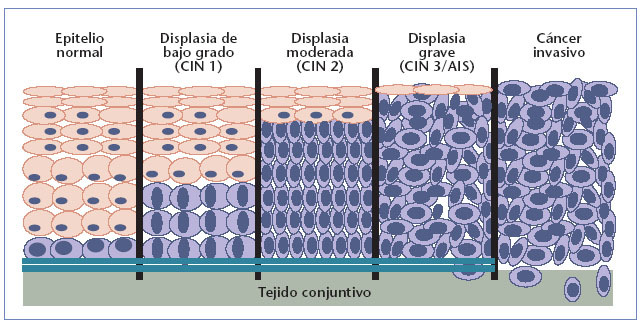
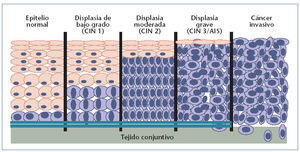
Desarrollo histológico del cáncer de cuello de útero
El objetivo a corto y medio plazo de la vacuna es la prevención de las lesiones precursoras del CCU: neoplasia intraepitelial de cuello de útero (CIN), especialmente la que se considera como lesión precursora necesaria (CIN 3). Además, una de las vacunas (la tetravalente) plantea la posibilidad de prevenir a corto plazo las verrugas/condilomas genitales y la papilomatosis respiratoria recurrente (PRR), causadas por los tipos 6 y 11 del VPH.
La citología en la prevención del cáncer de cuello de útero se ha considerado eficaz hasta el momento, aunque es un procedimiento mejorable, ya que la sensibilidad de la citología para CIN 3 no supera, en el mejor de los casos el 80%. Además, los cribados citológicos se han mostrado ineficaces en la prevención del adenocarcinoma de cuello de útero. En España se ha propuesto una nueva estrategia para el cribado, que incluye, en mujeres mayores de 35 años, la determinación del ADN del VPH por captura híbrida II, asociado a la citología.
En la actualidad se está evaluando la posibilidad de que la mejor prueba inicial de cribado pueda ser la determinación de ADN del VPH, muy sensible, con la citología en segundo nivel en la selección de conducta de los casos VPH+ y la colposcopia en tercero, recibiendo los casos con citología positiva. (Datos extraídos del Documento de Consenso de la Sociedades Científicas, 31 de enero de 2007.)
Vacunas para prevenir el VPHHay 2 vacunas para la prevención del VPH, ambas elaboradas con partículas similares al virus (VLP) del fragmento L1 de la cápside del VPH, inmunogénico, no oncogénico.
Gardasil. Comercializada por Sanofi Pasteur MSD, incluye VLP de los tipos 6, 11, 16 y 18. Utiliza una sal de aluminio como adyuvante. El esquema de vacunación recomendado tras el desarrollo clínico incluye 3 dosis intramusculares a los 0, 2 y 6 meses.
El programa de desarrollo clínico de Gardasil incluyó más de 27.000 voluntarios (adolescentes de 9-15 años de edad y mujeres de 16-26 años) en 33 países.
La eficacia de la vacuna fue evaluada en 4 ensayos clínicos de fases II y III, que incluyeron un total de 20.541 mujeres de 1626 años de edad reclutadas y vacunadas sin cribado previo para la presencia de infección por VPH.
Los resultados publicados, describen, a los 5 años de seguimiento, una eficacia mantenida del 96% (intervalo de confianza [IC] del 95%) frente a la infección persistente de VPH, una protección del 100% frente a CIN 1 y una y una eficacia del 100% (95% IC) frente a CIN 2-3 con confirmación histológica.
Este parámetro fue definido por las agencias reguladoras internacionales (FDA, OMS, EMEA) como único marcador clínico subrogado del cáncer cervical y, por tanto, requisito imprescindible para autorizar la indicación de la vacuna en la prevención del cáncer de cuello.
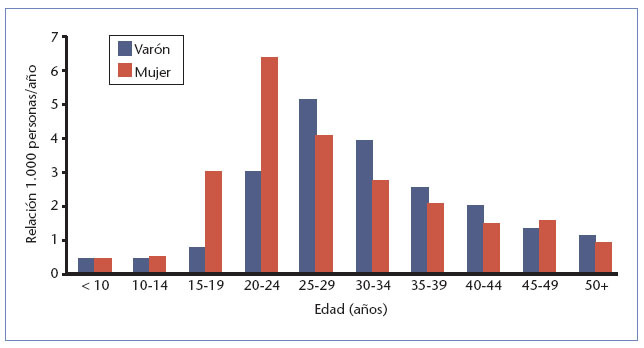
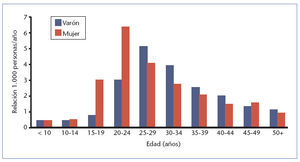
Verrugas genitales: prevalencia por edad en EE.UU. (2000)2
Recientemente se ha comunicado, con un seguimiento de 18 meses, una protección del 100% (IC del 95 %) frente a lesiones displásicas vulvares de alto grado (VIN) 2-3, VaIN 2-3 y verrugas genitales. Asimismo, se han presentado datos prometedores de reactividad cruzada de Gardasil para los tipos 45, 31, 52 y 58 del VPH, filogenéticamente próximos a los cubiertos por la vacuna.
Cervarix. Desarrollada y comercializada por GlaxoSmithKline, incluye VLP de los tipos 16 y 18. Utiliza como adyuvante AS04, una sal compuesta de aluminio y MPL, un lipopolisacárido al que se ha atribuido un incremento de la respuesta inmunogénica. La pauta de vacunación recomendada incluye 3 dosis intramusculares a los 0, 1 y 6 meses.
Los resultados publicados en fase II describen, a los 4-5 años de seguimiento, una eficacia del 100% (IC del 95%) frente a la infección persistente de VPH y una protección del 100% (IC del 95%) frente a CIN.
La vacuna bivalente -16/-18 ha mostrado resultados preliminares que sugieren un cierto grado de protección cruzada frente a la infección para los tipos -31 (54,5% de eficacia) y -45 (2% de eficacia) del VPH35.
Ambas vacunas, han tenido un alto grado de aceptación y de aplicabilidad, y no se han descrito efectos secundarios apreciables, locales o generales, que hayan provocado abandonos en una proporción significativa en las mujeres vacunadas.
Estas vacunas son estrictamente profilácticas: las mujeres VPH+ pueden vacunarse y no es necesario el cribado previo a la vacunación. Los datos disponibles muestran que el curso de la presencia viral no se modifica por la vacuna, aunque sí se ha detectado que la vacuna genera un incremento de la tasa de anticuerpos en estas mujeres.
Preguntas y respuestas¿Cuáles son las características generales de las vacunas frente al VPH?El fundamento de las vacunas profilácticas se basa en la formación de partículas semejantes al virus o VLP a partir de proteínas L1 del VPH autoensambladas, que forman una cápside vacía, una estructura tridimensional morfológicamente idéntica al virus natural, pero sin contenido de ADN. Así se consigue que la partícula obtenga una respuesta inmunógena, sin capacidad oncogénica ni de infección. Estas cápsides virales vacías inyectadas al huésped provocan una respuesta inmune muy elevada, efectiva y segura. Son vacunas profilácticas, sin ningún efecto terapéutico.
¿Cuántas vacunas están disponibles y cuál es su composición?En la actualidad se comercializan dos vacunas:
- Gardasil.Desarrollada por Merck y comercializada en Europa por Sanofi Pasteur MSD. Contiene VLP de los tipos 6, 11, 16 y 18 expresadas en células de levadura Saccharomyces cerevisiae CANADE 3C-5 (cepa 1895). Utiliza como adyuvante el hidroxifosfato sulfato de aluminio amorfo.
- Cervarix.Desarrollada y comercializada por GlaxoSmithKline. Contiene VLP de los tipos 16 y 18 expresados en baculovirus, que utiliza células Hi-5 Rix4446 derivadas de Trichoplusia ni. Utiliza como adyuvante el AS04, una formulación a base de hidróxido de aluminio y MPL, (3-deacetilado monofosforil lípido A), un lipopolisacárido.
Vacuna para la prevención de la displasia cervical de alto grado (CIN 2/3), carcinoma cervical, lesiones displásicas vulvares de alto grado (VIN 2/3) y verrugas genitales externas (condiloma acuminata) relacionadas causalmente con los tipos 6, 11, 16 y 18 del VPH. La indicación se basa en la demostración de la eficacia de Gardasil en mujeres adultas de 16-26 años de edad y en la demostración de la inmunogenicidad de Gardasil en niños y adolescentes de 9-15 años de edad. La eficacia protectora no se ha evaluado en varones.
¿Cuáles son las indicaciones y el tramo de edad de aplicación de Cervarix aprobados en la ficha técnica?Vacuna indicada para la prevención de la neoplasia cervical intraepitelial de alto grado (CIN 2/3) y cáncer de cerviz relacionados causalmente con los tipos 16 y 18 del VPH. La indicación se fundamenta en la demostración de la eficacia en mujeres de 15-25 años tras la vacunación con Cervarix y de la inmunogenicidad de la vacuna en niñas y mujeres de 10-25 años.
¿Por qué se considera óptimo vacunar a niñas preadolescentes?La inmunogenicidad en el tramo de edad inferior a 15 años es la más alta. Se ha relacionado en algunos modelos con la protección frente a CIN 2/3. Vacunar a los 18 años supone perder un 20% de la capacidad preventiva que se consigue cuando la vacuna se pone a los 12 años. Además, el máximo potencial preventivo de la vacuna se obtiene en población que no ha estado en contacto con el VPH, y en España la edad media de inicio de las relaciones sexuales es de 17 años.
¿Por qué el límite de edad aceptado para la vacunación es de 25-26 años?Es el límite superior en el diseño de las cohortes vacunadas en los ensayos clínicos publicados hasta ahora. Por tanto, se dispone de evidencia en este segmento de edad.
¿Qué se debe aconsejar a una mujer con más de 26 años que quiera vacunarse?La ficha técnica recoge que la edad de aplicación autorizada de Cervarix es entre 10 y 25 años, y la de Gardasil entre 9 y 26 años, recomendación que se basa en la evidencia disponible para ambas vacunas en estos grupos de edad. Por tanto, no debe haber recomendación proactiva de la vacunación fuera de estos límites de edad.
¿Es necesario hacer una determinación de VPH antes de vacunar?Hay acuerdo en no practicar determinación de VPH y/o citología antes de vacunar. En Europa, la posibilidad de que una mujer esté infectada por los 4 tipos vacunales de Gardasil tiende a ser 0. Menos de un 5% de mujeres lo están por dos tipos. Siempre quedará un importante remanente de protección. Practicar una determinación de VPH no debe recomendarse de forma pro-activa, aunque tiene que facilitarse si la mujer, después de recibir la información adecuada, lo solicita.
Una mujer que tenga o que haya sido tratada de un CIN, ¿puede ser vacunada?Sí. Obtendrá protección frente a los tipos con los que no haya contactado, e incluso frente al tipo causal de su CIN en el supuesto de que, después de ser tratada, lo haya eliminado, con lo cual evitará la reinfección.
Una mujer vacunada, ¿debe seguir con controles de diagnóstico precoz?Es importantísimo. La vacuna protege frente a un 70% de CCU causados por los tipos vacunales. Queda un 30% de CCU causado por tipos no vacunales. La vacuna reduce considerablemente la posibilidad de presentar un CCU, pero no la elimina.
¿Es segura?La vacuna es muy segura. Gardasil ha comunicado como reacciones adversas muy frecuentes (>10% casos): dolor, enrojecimiento e inflamación en el área de inyección y cefalea, mialgia y cansancio como síntomas generales. Cervarix ha comunicado las siguientes reacciones adversas: eritema, dolor e hinchazón en el área de inyección y pirexia como síntoma general. La mayoría de estas reacciones fueron de gravedad leve a moderada y no tuvieron una duración prolongada.
El perfil de seguridad exigido a las vacunas VPH por las agencias reguladoras es el más alto nunca exigido a una vacuna en su fase de desarrollo clínico.
Está en marcha un exhaustivo programa de farmacovigilancia poscomercialización para supervisar de forma activa y cuidadosa la tasa de beneficio/riesgo en la práctica clínica y para detectar cualquier signo de potenciales acontecimientos adversos. Este programa de vigilancia se lleva a cabo en estrecha coordinación con agencias reguladoras, autoridades nacionales y expertos independientes.
¿Cuánto tiempo puede permanecer la vacuna fuera de la nevera?Ambas vacunas deben conservarse a una temperatura de 2-8º C. El tiempo de permanencia fuera de esta temperatura que garantice su eficacia dependerá de las condiciones exteriores de temperatura, más largo cuanto más se acerque a la temperatura recomendada.
Además, tienen que conservarse en el embalaje original para preservarlas de la luz.
Ante cualquier duda es recomendable contactar con el departamento técnico del laboratorio farmacéutico fabricante.