Inhibidor del proteasoma para el tratamiento del mieloma múltiple
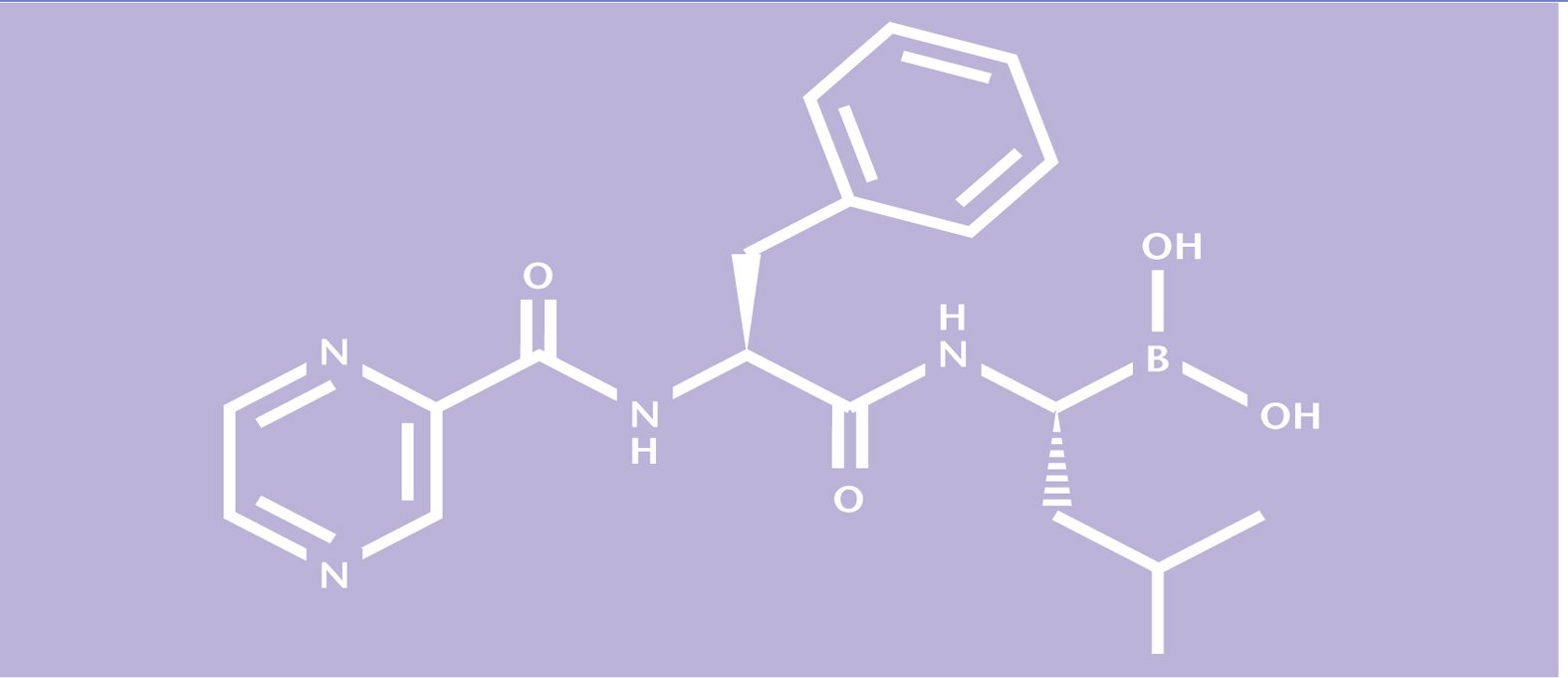
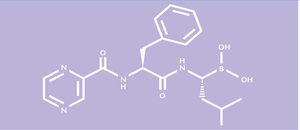
Bortezomib es un inhibidor del proteasoma, diseñado específicamente para inhibir la actividad quimotripsina del proteasoma 26S en células de mamífero. El proteasoma 26S es un complejo proteico de gran tamaño que degrada las proteínas ubiquitinadas. Se emplea para combatir el mieloma múltiple, que causa 10% de los cánceres hematológicos. Bortezomib pertenece a un nuevo grupo de medicamentos contra el mieloma múltiple, los inhibidores del proteasoma.
En aproximadamente el 20% de los pacientes, el mieloma múltiple se diagnostica por casualidad en ausencia de síntomas, usualmente después de realizar exámenes de laboratorio donde se revela un aumento de las concentraciones séricas de proteína. La mayoría de estos pacientes tiene un número bajo de células malignas y la quimioterapia se debe detener hasta que aparezca algún peligro de complicación. El mieloma progresa, un año después del diagnóstico, en la mayoría de los pacientes que presenta una o más lesiones óseas líticas al inicio del proceso. Sin embargo, la enfermedad se mantiene estable, normalmente, durante más de 5 años en los pacientes que no presentan lesiones óseas ni proteinuria de Bence Jones, o en los que tienen bajas concentraciones séricas de la proteína mielomatosa (< 3 g/dl). Independientemente de un estudio esquelético normal, la resonancia magnética de la columna vertebral muestra anormalidades en el 40% de los pacientes asintomáticos. Entre grupos comparables de pacientes, el tratamiento sistémico resulta igualmente efectivo tanto si se administra en el momento de realizar el diagnóstico como muchos meses más tarde. Esto sugiere que el aplazamiento del tratamiento no conlleva el crecimiento de células tumorales resistentes a los medicamentos.
Farmacodinamia
El bortezomib es un inhibidor del proteasoma. Se ha diseñado específicamente para inhibir la actividad quimotripsina del proteasoma 26S en células de mamífero. El proteasoma 26S es un complejo proteico de gran tamaño que degrada las proteínas ubiquitinadas. La vía ubiquitina-proteasoma desempeña un papel esencial en la secuencia del recambio de determinadas proteínas, ya que así mantiene la homeostasia en el interior de las células. La inhibición del proteasoma 26S evita esta proteolisis dirigida y afecta a múltiples cascadas de señalización intracelulares, lo que origina, en última instancia, la muerte de la célula neoplásica.
El bortezomib es muy selectivo para el proteasoma. En concentraciones de 10 µM, no inhibe ni los receptores ni las proteasas investigados, y su selectividad por el proteasoma es 1.500 veces superior a la que muestra por la siguiente enzima preferida. La cinética de inhibición del proteasoma se ha evaluado in vitro, y se ha demostrado que el bortezomib se disocia del proteasoma con una T1/2 de 20 min, lo que demuestra que la inhibición del proteasoma por el bortezomib es reversible.
La inhibición del proteasoma mediada por el bortezomib afecta de varias maneras a las células neoplásicas, mediante la alteración de las proteínas reguladoras que controlan la progresión del ciclo celular y la activación nuclear del factor nuclear kappa B (NF-kB). La inhibición del proteasoma causa detención del ciclo celular y de la apoptosis. El NF-kB es un factor de transcripción cuya activación es necesaria para muchos aspectos de la tumorogenia, incluido el crecimiento y la supervivencia celulares, la angiogenia, las interacciones intercelulares y de metástasis. En el mieloma, el bortezomib altera la capacidad de las células mielomastosas para interactuar con el microambiente de la médula ósea.
Los experimentos realizados demuestran que el bortezomib es citotóxico para distintos tipos de células neoplásicas y que las células cancerosas son más sensibles a los efectos proapoptóticos de la inhibición del proteasoma que las células normales. El bortezomib reduce el crecimiento tumoral in vivo en muchos modelos preclínicos de tumor, incluido el mieloma múltiple.
Farmacocinética
Después de una inyección intravenosa única, las concentraciones plasmáticas de bortezomib descienden según un patrón bifásico, caracterizado por una fase de distribución rápida, seguida de una fase de eliminación terminal más prolongada. La fase de distribución rápida tiene una vida media inferior a 10 min. En los seres humanos, la eliminación terminal del bortezomib tiene una vida media calculada que oscila entre 5 y 15 h. La exposición al bortezomib parece ser proporcional a la dosis en el intervalo posológico de 1,45 a 2,0 mg/m2, y se observan aumentos proporcionales a las dosis entre 1,0 y 1,3 mg/m2.
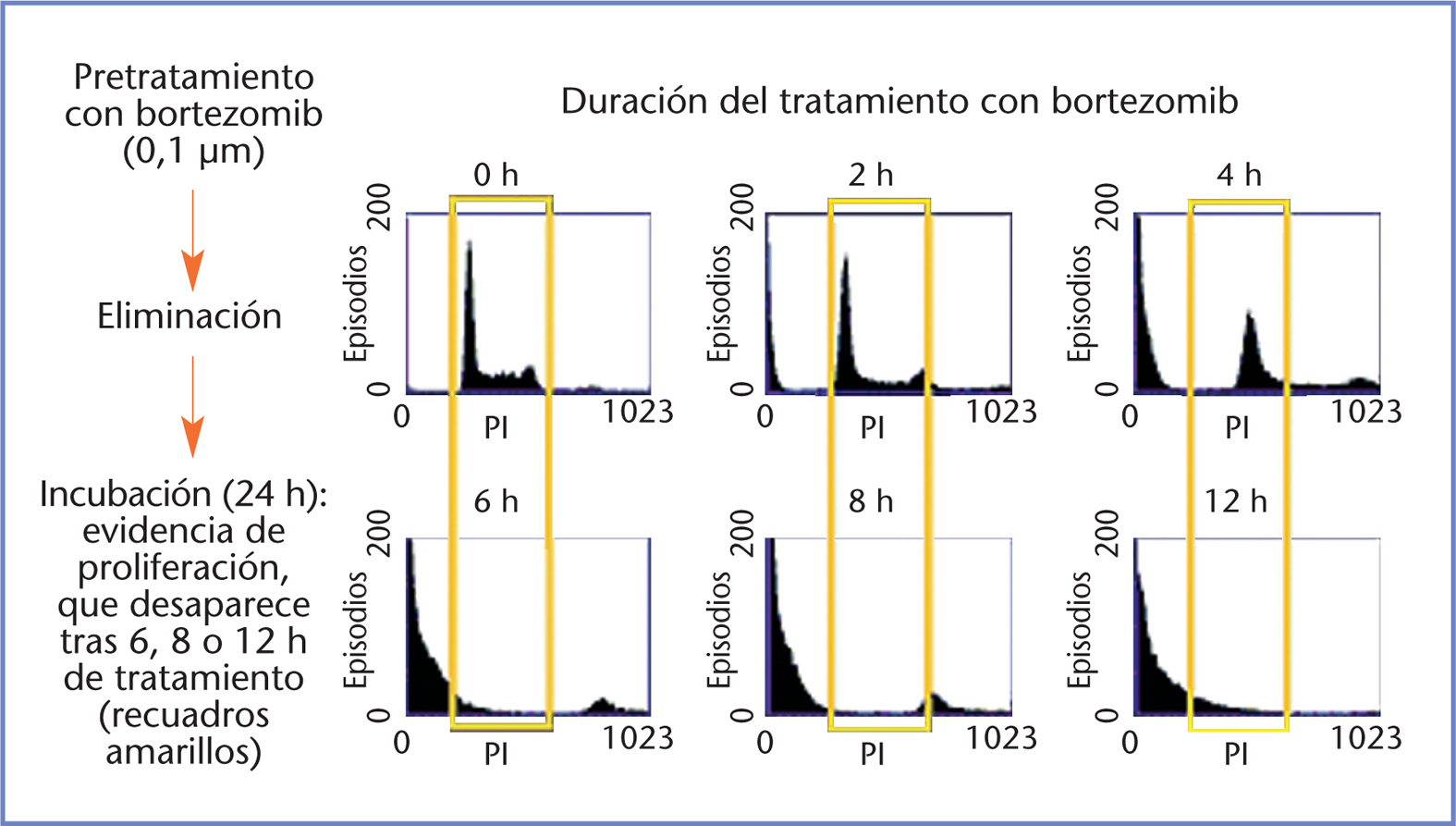
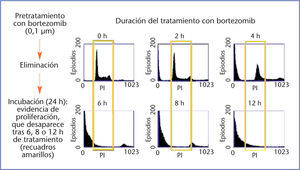
In vitro, la exposición a bortezomib produce apoptosis a corto plazo
En un grupo de pacientes con tumores sólidos (n = 17), tratados con bortezomib y gemcitabina, la eliminación terminal media del bortezomib después de la primera dosis (1,0 mg/m2) fue de 5,45 h, y la AUC0-24 media de 30,1 h x ng/ml.
Tras dosis múltiples de bortezomib, se observa un descenso del aclaramiento, que origina el correspondiente aumento de la vida media de eliminación terminal y del área bajo la curva (AUC). La administración repetida no tiene un efecto en la cinética inicial de distribución del bortezomib, por lo que no se observan cambios de la Cmáx calculada ni de la vida media de distribución. En los pacientes con tumores sólidos, la vida media de eliminación terminal media aumentó de 5,45 h a 19,7 h, y la AUC0-24 se elevó de 30,1 h x ng/ml a 54,0 h x ng/ml tras la primera y la tercera dosis del primer ciclo, respectivamente.
En el intervalo de concentración del bortezomib de 0,01 a 1,0 µg /ml, la unión in vitro a las proteínas del plasma humano fue, como promedio, del 82,9%. El porcentaje de bortezomib unido a las proteínas del plasma no fue proporcional a la concentración.
Las vías de eliminación del bortezomib no han sido evaluadas in vivo, pero in vitro, CYP3A4 y CYP2C19 son cuantitativamente las principales enzimas causantes del metabolismo del bortezomib. En la orina, sólo se recuperó una pequeña cantidad del fármaco original, y ni en la bilis ni en las heces apareció fármaco intacto.
Indicaciones terapéuticas
Bortezomid está indicado en el tratamiento de los pacientes con mieloma múltiple que han recibido, previamente, al menos dos tratamientos, y que presentan progresión de la enfermedad demostrada con el último de estos tratamientos.
La dosis inicial de bortezomid recomendada es de 1,3 mg/m2 de área de superficie corporal, dos veces a la semana durante dos semanas (días 1, 4, 8 y 11), seguidos de un período de descanso de 10 días (días 12-21). Este período de 3 semanas se considera un ciclo de tratamiento. Debe respetarse un intervalo de al menos 72 h entre las dosis consecutivas de bortezomid.
En los pacientes que tengan una respuesta completa confirmada, se aconseja la administración de dos ciclos adicionales de bortezomid después de la confirmación. También se recomienda que los pacientes que respondan, pero que no consigan una remisión completa, reciban un total de ocho ciclos de tratamiento con bortezomid.
El tratamiento deberá interrumpirse ante la aparición de cualquier toxicidad no hematológica de grado 3 o de toxicidad hematológica de grado 4, excluida la neuropatía.
Reacciones adversas
Doscientos cincuenta y seis pacientes recibieron bortezomid para el tratamiento del mieloma múltiple en monoterapia o en combinación con dexametasona. El 97% de los pacientes (n = 248) experimentó una reacción adversa (RAM) a bortezomid. Se notificaron RAM que obligaron a interrumpir el tratamiento en el 17% (n = 44) de los pacientes. Los motivos de la interrupción del tratamiento se distribuyeron de manera uniforme entre los tipos más frecuentes de toxicidad y fueron neuropatía periférica (4%), trombocitopenia (4%), diarrea (2%) y fatiga (2%). En los estudios en fase II sobre mieloma múltiple (n = 256), los pacientes con aclaramientos de creatinina calculados = 50 ml/min (n = 52) presentaron una incidencia mayor de acontecimientos adversos graves (60% frente al 51 y 41% en los grupos de 51-80 ml/min y > 80 ml/min, respectivamente), con mayor frecuencia de efectos cardíacos graves, aunque ninguno especialmente llamativo. La incidencia de acontecimientos adversos graves (AAG) fue mayor en pacientes con alteraciones renales antes del tratamiento. En este análisis, el acontecimiento adverso (AA) registrado con mayor frecuencia en el grupo con cifras de aclaramiento de creatinina más bajas fue la neutropenia, pero cuando se incluyeron la creatinina sérica y el recuento absoluto de neutrófilos en el análisis no se observó relación alguna.
Los pacientes de 51-65 años presentaron una incidencia similar de AA, AAG y suspensiones del tratamiento. Los menores de 50 años, un subgrupo de tamaño inferior, presentaron menos AAG y suspensiones, particularmente en lo que concierne a las clases de órganos y sistemas (COS) metabólico y vascular. El número de pacientes con alteración de las enzimas hepáticas (= 1,5 x límite superior normal [LSN] para Aspartato aminotransferasa [AST] y Alanina aminotransferasa [ALT]) fue demasiado pequeño para poder extraer conclusiones definitivas sobre la seguridad en pacientes con función hepática anormal.
Características de bortezomib
* Actúa a través de un novedoso mecanismo (es un inhibidor potente y específico del proteasoma)
* En modelos preclínicos, interrumpe las múltiples vías críticas para la supervivencia del tumor
* Hay evidencia de su actividad antitumoral solo o en combinación con agentes quimioterapéuticos (las células cancerosas son más sensibles a la inhibición del proteasoma)
* Se le han asociado toxicidades tratables en ensayos clínicos tempranos