Las amebas de vida libre se encuentran ampliamente distribuidas en la naturaleza, siendo multitud las especies aisladas de la tierra, aire, aguas tratadas para consumo, agua de mar o lagos de aguas termales. En el presente trabajo se abordan las características de las especies Naegleria fowleri Carter 1970 y varias especies de Acanthamoeba.
Entre las amebas de vida libre que tienen capacidad patógena para el hombre y, por tanto, denominadas anfizoicas por su capacidad de adaptación a la vida parasitaria destacamos dos géneros: Acanthamoeba y Naegleria descubiertas en 1965 por Fowler y Carter, respectivamente. Entre las especies pertenecientes a estos dos géneros destacamos, por la importancia que presentan en el hombre, Naegleria fowleri Carter 1970 y varias especies de Acanthamoeba.
Naegleria fowleri
Esta especie es la responsable de la meningoencefalitis amebiana primaria.
Etiología
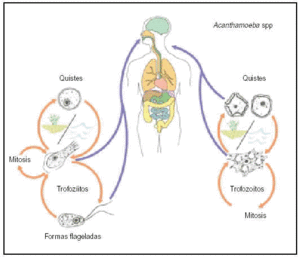
Dentro de su ciclo de vida (fig. 1) aparecen dos formas diferenciadas: los trofozoítos, que son móviles, y los quistes, que son uninucleados, circulares e inmóviles y además constituyen la forma de resistencia del parásito. Los trofozoítos aparecen bajo la forma ameboide, con capacidad reproductora y bajo la forma flagelada que presenta flagelos que debe perder para adquirir movilidad y capacidad reproductora.
Fig. 1. Ciclo biológico de Naegleria fowleri.
Epidemiología
Naegleria fowleri es un parásito de distribución cosmopolita1 que origina un problema de salud pública emergente, debido al importante número de individuos al que parasita. La mayor parte de los casos de meningoencefalitis amebiana primaria se han comunicado en distintos estados de Estados Unidos como Virginia, Florida, Georgia o California, y en países como Bélgica, República Checa, Australia, Nueva Zelanda, India, Nigeria o Tailandia2.
La mayor parte de los casos de amebosis originados por Naegleria fowleri suceden en personas que habían estado realizando actividades acuáticas como natación, buceo o esquí en piscinas, lagos o embalses. Si bien, se han dado casos en individuos que no habían estado en contacto con agua, postulándose así la transmisión de quistes viables por vía aérea.
Las temperaturas altas potencian el desarrollo de este parásito que puede vivir a temperaturas próximas a 45 ºC, por tanto, también puede estar presente en baños termales.
La cloración no resulta una medida eficaz en la destrucción del parásito, ya que puede seguir con vida en aguas cloradas.
Naegleria fowleri también parasita a animales como por ejemplo las ovejas, pero en ellas la parasitosis no es patógena.
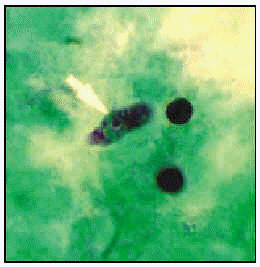
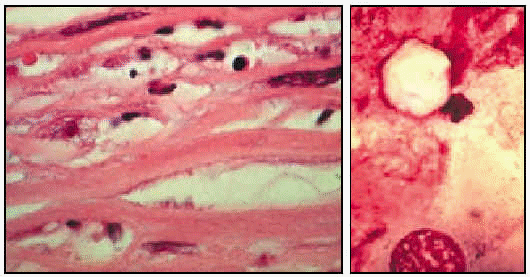
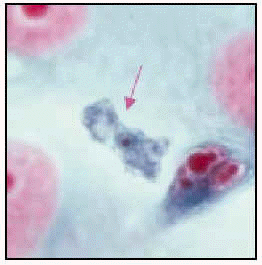
Naegleria fowleri. Trofozoíto en médula espinal (ticrómico).
Patología y sintomatología
En las autopsias realizadas a individuos parasitados la mayor parte de las amebas se han encontrado en el cerebro, especialmente en los senos maxilares y esfenoidales. Las zonas del cerebro parasitadas presentan una consistencia blanda y las meninges aparecen purulentas, los bulbos olfatorios presentan hemorragias, congestión y están necrotizados. No se han observado alteraciones en otras partes del cuerpo, aunque se han determinado alteraciones en pulmones o en el bazo secundarias a la infección cerebral.
Naegleria fowleri en cerebro (tinción con tricrómico).
Diagnóstico
Para llevar a cabo el diagnóstico de esta parasitosis se debe realizar una entrevista con el paciente que presuntamente está parasitado. En ella se debe consultar si ha estado en contacto los días anteriores con agua dulce que supuestamente pueda estar contaminada por el parásito. Una vez que esto se confirme, se debe aislar de inmediato el parásito en el líquido cefalorraquídeo, consiguiéndose así su identificación aplicando la técnica de Wright.
El cultivo del líquido cefalorraquídeo en una placa de agar no nutriente al 1,5% sembrada con Escherichia coli viva constituye un medio de vida similar al natural en donde Naegleria fowleri va a desarrollarse con facilidad. En preparaciones frescas no teñidas el parásito se diferencia fácilmente gracias a su gran movilidad.
Tratamiento
El fármaco al que con mayor frecuencia se le atribuye actividad frente a este parásito es la anfotericina B, si bien, no se conoce ningún tratamiento totalmente eficaz frente a Naegleria. Aunque se instaure el tratamiento de manera temprana e intensiva, la evolución de la infección suele ser fatal en la mayoría de los casos.
Profilaxis
Evitar el contacto con aguas termales o estancadas es la única medida de prevención eficaz para evitar contraer la parasitosis.
La hipercloración del agua no constituye una medida protectora cuando se presenta la parasitosis, pero cuando exista alguna duda sobre la inocuidad del agua utilizada en una piscina puede ser una medida de prevención la salinización al 0,7%.
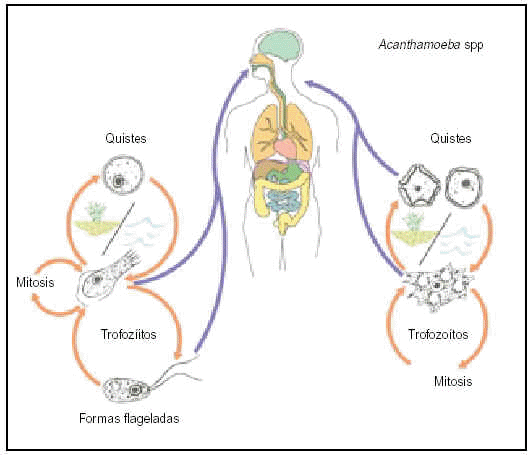
Acanthamoeba spp.
Este parásito que se encuentra en el aire, tierra y agua fue reconocido como agente patógeno ocular en 1973 y puede aislarse generalmente en las vías respiratorias altas de los seres humanos. Son resistentes a los desinfectantes, a los cambios de temperatura y a la desecación y han sido identificados incluso en el hielo polar.
Etiología
En su ciclo vital (ciclo biológico) se diferencia una fase de trofozoíto y una de quiste. Los trofozoítos tienen una forma variable y se desplazan emitiendo pseudópodos, que son extensiones citoplasmáticas también involucradas en la captación de los alimentos. Se reproducen por partición binaria asexuada y su enquistamiento se produce al quedar la ameba expuesta a cambios adversos en el entorno como pueden ser la falta de alimento, la desecación, pH inadecuado y presiones parciales de O2 bajas. El quiste es la forma latente del organismo identificable por la presencia de una pared celular. En ellos se observa una reducción de la actividad metabólica hasta valores muy bajos. Si el quiste rompe, se libera al parásito y esto sucede cuando las condiciones ambientales son de nuevo favorables.
Epidemiología
Se han identificado varias especies de Acanthamoeba causantes de queratitis y entre ellas destacamos además de Acanthamoeba cultbersoni, A. castellani, A. hatchetti o A. quina. En algunos casos también se han aislado en la córnea otras amebas como la Naegleria.
Este parásito es poco virulento, ya que existe inmunidad innata en el huésped y además el epitelio corneal constituye una buena barrera de defensa.
La mayor parte de casos confirmados, aproximadamente el 85%, están ligados al uso de lentes de contacto3,4, así la prevalencia del uso de lentes desechables entre los pacientes con queratitis por Acanthamoeba es muy elevada5,6. En el Reino Unido se ha asociado mayoritariamente al uso de lentes desechables con periodicidad mensual o bimensual5 y en fechas recientes se ha informado que en el Reino Unido la prevalencia llega a ser de 1/10.000 portadores de lentes de contacto por año parasitados. Las lentes de contacto blandas presentan un riesgo significativo y notablemente mayor si no se desinfectan, si se desinfectan menos de lo habitual o si se desinfectan usando medios que liberan cloro.
En las poblaciones que no utilizan lentes de contacto se han descrito los traumatismos agrícolas como factores de riesgo; se ha asociado esta infección corneal con lesiones oculares que estuvieron expuestas a agua o tierra contaminada a menudo en el medio rural.
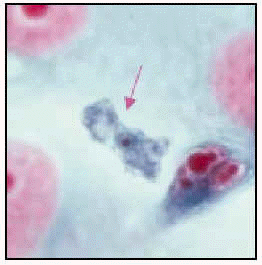
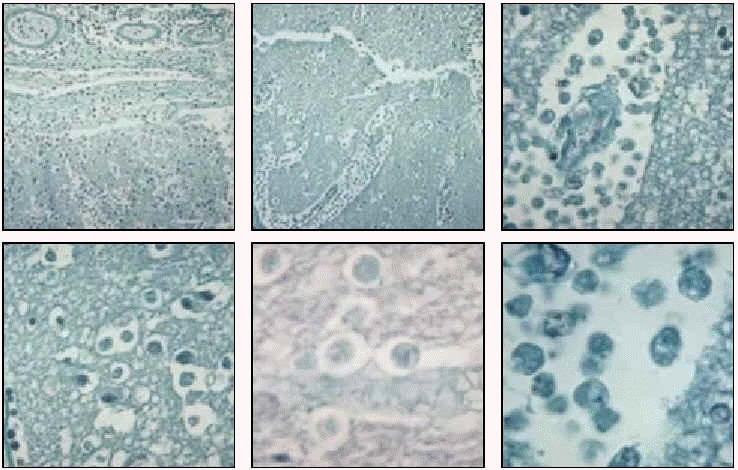
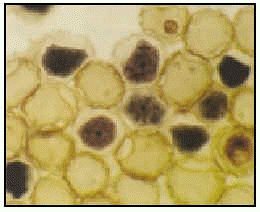
Acanthamoeba polyphaga. Trofozoíto en cultivo (ticrómico).
Clínica
Estas amebas de vida libre pertenecientes al género Acanthamoeba son los agentes causales de la encefalitis granulomatosa amebiana y de la queratitis amebiana. La primera de las patologías ocurre con más frecuencia en individuos inmunocomprometidos, mientras que la segunda lo hace en individuos sanos. La importancia de esta parasitosis ha ido en aumento con el paso del tiempo7. El paciente tipo aquejado de queratitis amebiana es un individuo joven y sano que frecuentemente es portador de lentes de contacto o que presenta exposición a agua contaminada. En este grupo de población se sugiere que el sistema inmunitario debería ser capaz de controlar la parasitosis8.
La forma más habitual de queratitis por Acanthamoeba es dolorosa e invalidante. Es frecuente que el tratamiento se retrase debido a diagnósticos erróneos tales como la queratitis por herpes simple o por hongos9. El pronóstico es bueno si se diagnostica pronto y se aplica el tratamiento médico de elección.
Antes de disponer de antiamebianos eficaces el pronóstico de la queratitis por Acanthamoeba era desolador y en muchos casos era necesario extirpar el globo ocular. En la actualidad que esto suceda es poco frecuente.
Acanthamoeba es una causa potencial de rinosinusitis en pacientes inmunodeprimidos10, si bien en individuos sanos es una causa rara11.
El quiste es la forma latente del organismo identificable por la presencia de una pared celular.
Tratamiento
La queratitis producida por Acanthamoeba es un proceso de difícil diagnóstico y tratamiento. Un buen pronóstico de esta parasitosis depende de un tratamiento temprano.
Las biguanidas12 y las diamidinas son los amebianos más eficaces, ya que además son quisticidas. Es aconsejable realizar un tratamiento inicial intensivo, ya que estas formas de vida parasitarias son más sensibles antes de que los quistes hayan madurado del todo, por tanto, la realización de un diagnóstico certero rápido es vital13. Entre las diamidinas disponibles se cuentan el isetionato de propamidina y la hexamidina. Las dos biguanidas que se utilizan son la polihexametilenbiguanida al 0,02% y la clorhexidina al 0,02%, pero su principal problema radica en que estos dos principios activos no están disponibles en el mercado y esto ha limitado su uso.
Además de los principios activos citados anteriormente existen otros que presentan una actividad muy limitada frente a las formas quísticas. Aquí nos estamos refiriendo a aminoglucósidos administrados por vía tópica, neomicina y paromomicina, e imidazoles también por vía tópica, miconazol al 1% y clotrimazol al 1%.
El papel de los corticoides es objeto de controversia14, ya que el tratamiento con estos medicamentos no es necesario en los casos iniciales que pueden responder a los antiamebianos. Sin embargo, la inflamación persistente puede mejorar de manera espectacular con la incorporación de dosis bajas de corticoides tópicos, como puede ser la prednisolona al 0,5%.
La instauración de un tratamiento inicial adecuado es muy importante, ya que iniciar un tratamiento erróneo deriva en una resistencia al tratamiento amebiano y dificultades para erradicar la infección15.
La combinación de trimetropim, sulfametoxazol, rifampicina y quetoconazol se ha ensayado en dos niños obteniéndose muy buenos resultados16.
En algunos individuos en los que el diagnóstico y el tratamiento fueron tardíos, ha sido necesaria la realización de una queratoplastia.
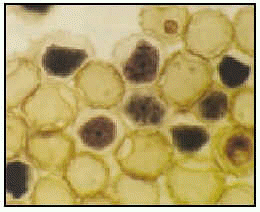
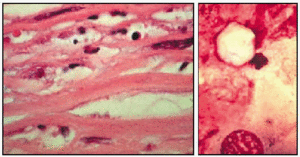
Queratitis por Acanthamoeba sp. (biopsia de córnea). El trofozoíto está a la izquierda; el quiste, a la derecha.
Prevención
La queratitis por Acanthamoeba se puede prevenir en la mayoría de los casos. En los portadores de lentes de contacto (más del 80% de los casos) podría haberse evitado si el sistema utilizado en la desinfección de las lentillas hubiese sido eficaz. Tanto el hecho de no desinfectar las lentes, como el de utilizar suero fisiológico no estéril o agua del grifo, o el empleo de un sistema de desinfección basado en el uso de cloro entraña un riesgo mayor para el desarrollo de la queratitis17,18.
La desinfección de las lentes de contacto y de sus recipientes tiene por objeto erradicar todas las bacterias y amebas. Los sistemas de desinfección por calor húmedo y los basados en la utilización de peróxido de hidrógeno son tanto trofozoicidas como quisticidas. El frotado manual de las lentillas es útil para romper las biopelículas y constituye una parte fundamental para el cuidado de las lentes y de sus recipientes.
Bibliografía general
The Medical Letter. Drugs for parasitic infections 2002.