El desarrollo de la farmacoterapia antiinfecciosa tiene su origen en la obra de Pasteur, Koch y Erhlich. Sus hitos fundamentales han sido las sulfamidas, la penicilina y los antibióticos, estos últimos introducidos más recientemente. En el presente trabajo se aborda el mecanismo de acción de los antibióticos, la resistencia bacteriana y la selección del antimicrobiano adecuado, así como el futuro de este grupo de medicamentos.
La actividad de un agente antiinfeccioso está definida por su espectro antibacteriano, es decir, el conjunto de microorganismos patógenos que se ven afectados por las concentraciones del antibiótico sin causarle toxicidad.
Origen y definición
Antibiótico
Sustancia química producida por un microorganismo, que desarrolla una actividad antimicrobiana. Su origen puede ser:
* Natural o biológico. Se obtiene de cultivos de microorganismos que pueden ser hongos o bacterias.
* Semisintético. A partir de un núcleo básico de un agente obtenido de forma natural, se modifican algunas de sus características químicas, para mejorar sus propiedades, por ejemplo, aumentar su actividad, ampliar su espectro de acción, facilitar su administración o disminuir los efectos indeseables.
Quimioterápico
Compuesto obtenido totalmente por síntesis química y que desarrolla actividad antimicrobiana.
Antimicrobiano
Es un término que incluye los compuestos obtenidos de forma natural o biosintética, así como los conseguidos totalmente en el laboratorio.
Un agente antimicrobiano debe cumplir tres condiciones como mínimo: poseer actividad antimicrobiana, desarrollarla a bajas concentraciones y ser tolerado por el huésped.
Actividad antiinfecciosa
Los agentes antimicrobianos se comportan de diversas maneras: como bactericidas y como bacteriostáticos.
Como bactericidas
Producen la muerte de los microorganismos responsables del proceso infeccioso. Pertenecen a este grupo los antibióticos β-lactámicos, aminoglucósidos, rifampicina, vancomicina, polimixinas, fosfomicina, quinolonas y nitrofurantoínas.
Como bacteriostáticos
Inhiben el crecimiento bacteriano, aunque el microorganismo permanece viable, de forma que, cuando se suspende el tratamiento, puede volver a recuperarse y multiplicarse.
El hecho de que un agente sea bactericida o bacteriostático depende de su mecanismo de acción y, por tanto, de su estructura, pero también contribuyen paralelamente otros factores:
* Concentración alcanzada en el sitio de la infección.
* Tipo de germen.
* Tamaño del inóculo.
* Tiempo de acción.
* Fase de crecimiento de la bacteria.
Así, los β-lactámicos sólo son bactericidas en la fase de crecimiento activo de la bacteria, mientras que las polimixinas son bactericidas en cualquier fase.
Un antibiótico bacteriostático puede comportarse como bactericida en determinadas condiciones favorables. Esto ocurre con los macrólidos.
Actualmente, existen tres categorías de antimicrobianos:
* Los que producen una acción bactericida poco relacionada con la concentración, como es el caso de los β-lactámicos y los aminoglucósidos, con los que se obtiene la máxima acción bactericida cuando se alcanzan concentraciones de 5 a 10 veces superiores que las CMI. El aumento en la concentración por encima de esto no se acompaña de mayor actividad ni de mayor duración del efecto postantibiótico.
* Los que poseen actividad bactericida concentración-dependiente, como los aminoglucósidos y las fluorquinolonas.
* Los que se comportan como bacteriostáticos: macrólidos, tetraciclinas y cloranfenicol, entre otros.
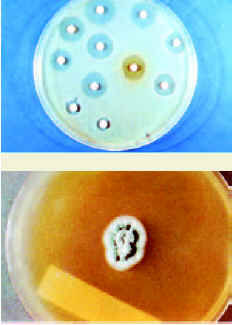
La actividad antibacteriana exige una normalización o cuantificación, que se consigue mediante los métodos utilizados in vitro para comprobar la susceptibilidad del microorganismo en relación con el antibiótico. Con estos métodos se define:
* La concentración mínima inhibitoria (CMI). Es la menor concentración de antibiótico capaz de inhibir el crecimiento de 105 bacterias en 1 ml de medio de cultivo, tras 18-24 horas de incubación.
* La concentración mínima bactericida (CMB). Es la menor concentración capaz de destruir o matar 105 bacterias en 1 ml de medio de cultivo, tras 18-24 horas de incubación.
* El punto de corte de sensibilidad. Es la concentración de antibiótico por debajo de la cual se considera sensible una determinada especie bacteriana.
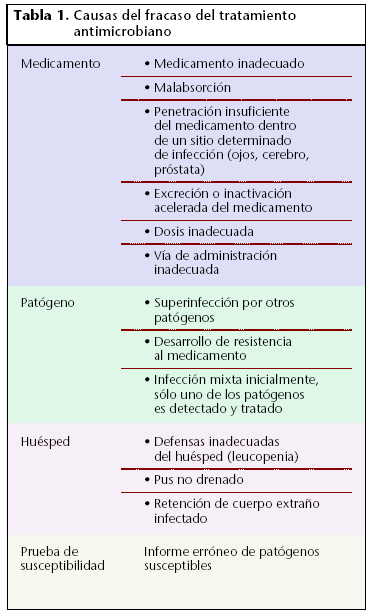
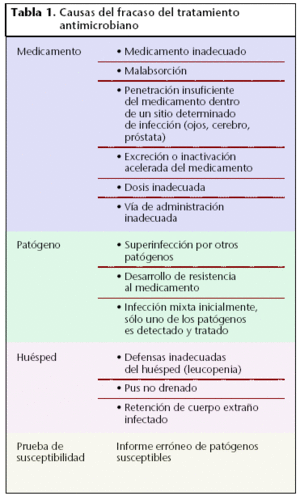
Las causas más habituales del fracaso antibiótico se recogen en la tabla 1.
Mecanismo de acción
Los mecanismos por los que los antibióticos alteran la biología de los microorganismos son los que a continuación detallamos.
Inhibición de la síntesis de la pared celular
Tiene lugar en diversas fases: β-lactámicos, fosfomicina, cicloserina, vancomicina, bacitracina.
Desorganización de la membrana citoplasmática
Polimixinas, anfotericina B y nistatina. La membrana celular constituye una barrera de permeabilidad y lleva a cabo funciones de transporte activo. Si la integridad funcional de la membrana se altera, los iones y macromoléculas se escapan y la célula se lesiona y muere. El empleo de agentes que afectan a la membrana celular en la terapéutica antiinfecciosa se debe al hecho de que determinadas membranas de algunas células y hongos se alteran con más facilidad que las de los animales, lo que permite una actividad quimioterápica selectiva. Las polimixinas son activas frente a bacterias gramnegativas y actúan como detergentes catiónicos sobre membranas ricas en fosfatidil-etanolamina y los poliénicos, tales como anfotericina B, nistatina, son activos frente a hongos.
Prueba de sensibilidad del organismo frente a los antibióticos.
Inhibición de la síntesis de proteínas
Por actuar sobre los ribosomas; en la subunidad 30 S: tetraciclinas; sobre la subunidad 50 S: cloranfenicol, eritromicina y lincosaminas; en ambas subunidades: aminoglucósidos. La síntesis de los ribosomas se realiza en tres etapas: iniciación, elongación, que comprende reconocimiento, transferencia y translocación, y terminación. El ribosoma 70 S, compuesto por dos subunidades, 30 S y 50 S, es la unidad funcional de la síntesis de proteínas en las bacterias, en tanto que los ribosomas de los mamíferos son 80 S y no se dividen en subunidades. Esto explicaría por qué los fármacos antimicrobianos pueden inhibir la síntesis en los ribosomas bacterianos, sin tener efecto sobre los ribosomas de los mamíferos. Los aminoglucósidos se fijan irreversiblemente a la subunidad 30 S de los ribosomas e inhiben la síntesis bacteriana, interfiriendo la fijación del ARNt y distorsionando el codón de ARNm, con lo que hay una lectura equívoca del mensaje genético y una síntesis de proteínas no funcionales. Las tetraciclinas se fijan a los ribosomas de los mamíferos. El cloranfenicol, la clindamicina y la eritromicina se fijan a la subunidad 30 S. El primero inhibe una peptidil-transferasa, la segunda, la iniciación, y los macrólidos, la translocación.
Interferencia en la síntesis y/o metabolismo de los ácidos nucleicos
Rifampicina (ARN-polimerasa ADN-dependiente), quinolonas (ADN-girasas), metronidazol y antivirales. Existen tres posibles mecanismos por los que los antimicrobianos pueden modificar la síntesis de los ácidos nucleicos.
* Interfiriendo la replicación del ADN.
* Impidiendo la transcripción.
* Inhibiendo la síntesis de metabolitos esenciales.
A través del primero, actúan las quinolonas, ya que inhiben la enzima ADN-girasa. Esta enzima corta la doble hélice del ADN cromosómico en fragmentos a los que superenrrolla en sentido negativo, para proceder al sellado de los extremos de ADN que fueron cortados. Las quinolonas impiden el cierre de los puntos de rotura. Los fármacos que inhiben la trascripción, como es el caso de la rifampicina y la actinomicina, actúan en la ARN-polimerasa. La rifampicina se fija en la subunidad B de esta enzima e impide su formación y la del complejo que inicia la trascripción, mientras que la actinomicina D bloquea la progresión de la ARN-polimerasa en cualquier fase.
Antimetabolitos que bloquean la síntesis de ácido fólico
Sulfamidas, sulfonas, pirimetamina y trimetoprima. Las sulfamidas inhiben la incorporación del PABA para la formación del ácido fólico, de aquí su efecto antibacteriano selectivo. Las diaminopirimidinas inhiben la dihidrofólicoreductasa e impiden el paso de ácido fólico a folínico (paso necesario para la síntesis de bases púricas y pirimidínicas). La utilización terapéutica de trimetoprima depende de la afinidad selectiva por la dihidrofólico-reductasa de gérmenes sensibles.
Resistencia bacteriana
Hay bacterias que no son afectadas por ningún antibiótico, bien porque carecen del sitio de acción o porque son inaccesibles. Esta situación se define diciendo que la bacteria es insensible o presenta resistencia natural.
Otras especies son sensibles al antibiótico, pero ello no impide que, en determinadas ocasiones, se aíslen variantes que no lo son y que crecen normalmente en presencia del antibiótico. En este caso se habla de resistencia adquirida.
Mecanismos generales de resistencia a antibióticos
Los mecanismos por los que se producen resistencias se pueden agrupar en los siguientes:
* Bloqueo del transporte de antibióticos. De esta forma, se consigue resistencia a la fosfomicina por pérdida del sistema de transporte del glicerol-fosfato.
* Modificación enzimática del antibiótico. El cloranfenicol se inactiva por una acetilación catalizada por una cloranfenicol-acetiltransferasa.
* Producción de una enzima alternativa, que evita el efecto inhibitorio (bypass). La resistencia a trimetoprima se consigue al producir una dihidrofolatoreductasa diferente, que deja sin efecto la inhibición de la dihidrofolato-reductasa normal de la bacteria.
* Expulsión del antibiótico por un mecanismo activo de bombeo. La tetraciclina se expulsa de forma activa del interior de bacterias resistentes.
* Modificación del sitio de acción del antibiótico. La metilación del ARN 23S en una posición determinada da lugar a resistencia a los macrólidos, que no pueden fijarse en el ribosoma y producir así su efecto inhibitorio.
Soluciones al problema de la resistencia
Durante las últimas décadas se han desarrollado nuevos antibióticos, derivados de los primitivos, con actividad antibacteriana ampliada. Las bacterias han respondido a ellos, generando nuevas versiones de genes de resistencia.
El conocimiento de los mecanismos de acción sugirió el diseño de fármacos que paralizasen estos procesos, como por ejemplo los inhibidores de las enzimas inactivantes de antibióticos. Pero las bacterias evolucionaron y produjeron nuevas enzimas bloqueadoras, que no eran inactivadas por los inhibidores. Se están investigando otras alternativas a los antibióticos, mediante la terapia antiinfeciosa, pero es muy probable que las bacterias ganen también esta batalla. Por ello, es mejor reducir el uso masivo de antibióticos. Tenemos que evitar la utilización indiscriminada e inapropiada de estos fármacos, y procurar tener el mejor conocimiento de los mecanismos de resistencias y de sus bases microbiológicas y genéticas.
Selección del antibiótico
El aumento progresivo en el número de antibióticos disponibles implica una mayor dificultad en su empleo, ya que exige conocer al detalle sus distintos aspectos: actividad antibacteriana, características farmacocinéticas, toxicidad, etc.
Identificación etiológica
Antes de iniciar el tratamiento con antibióticos, hay que asegurar la etiología de la fiebre, ya que ésta, no siempre es signo de infección y, aunque exista puede ser de etiología no tratable con antibióticos específicos, como es el caso de las infecciones virales. Una vez confirmada la fiebre, hay que investigar el microorganismo responsable por los datos clínicos y por estudios bacteriológicos. En las infecciones graves, mientras se esperan los resultados microbiológicos, se iniciará el tratamiento empírico con el antibiótico más eficaz y menos tóxico y se valorará la posibilidad de utilizar una asociación de antibióticos. Ante los resultados del estudio, se valorará la posibilidad de cambiar los tratamientos, aunque este cambio sólo debe realizarse cuando la evolución clínica del paciente no sea favorable.
Una vez identificado el germen, teniendo en cuenta que puede ser blanco de varios antibióticos, habrá que ver su grado de sensibilidad mediante métodos de valoración, antes señalados. Se dará preferencia a un antibiótico bactericida sobre otro bacteriostático, se preferirán antibióticos de espectro reducido, y se tendrá en cuenta su toxicidad.
Localización de la infección
Se trata de conseguir que la concentración del antibiótico en el sitio de la infección alcance, como mínimo, la concentración mínima inhibitoria que sea adecuada para el agente infectante. La concentración que alcanza un fármaco en un tejido determinado depende de varios factores. De ellos, los más importantes son la irrigación del tejido, la capacidad de difusión del fármaco y la inactivación debida a la presencia de pus o fibrina. La mala penetración en la barrera hematoencefálica (BHE) impide la utilización de muchos antibióticos. La mayoría atraviesa con dificultad la BHE, como es el caso de los antibióticos β-lactámicos, los aminoglucósidos, la eritromicina, la vancomicina y la anfotericina B. Cuando existe meningitis, la permeabilidad aumenta y se puede alcanzar concentraciones terapéuticas con algunos de ellos, como es el caso de penicilina G y cefalosporinas de tercera generación, mientras que con otros, es necesario recurrir a la administración intratecal o intraventricular, como es el caso de aminoglucósidos y la vancomicina.
En algunas ocasiones, como en el caso de las infecciones urinarias, la concentración de antibiótico en el lugar de la infección puede ser muy superior a la alcanzada en plasma o tejido.
Edad
La función renal varía con la edad. Así, está disminuida en el prematuro y en el recién nacido, se normaliza entre los 2 y los 12 meses, y vuelve a disminuir a medida que el organismo envejece, de ahí que en el anciano se deba vigilar las reacciones, que son concentración-dependientes, como alteraciones neurológicas, que producen concentraciones altas de β-lactámicos, la neutropenia de las penicilinas o la ototoxicidad de los aminoglucósidos.
Hay que tener en cuenta la escasa capacidad metabólica del recién nacido para inactivar el cloranfenicol, y si se administra a dosis infantiles habituales, puede desencadenar el síndrome gris. También en el neonato, las sulfamidas pueden competir con la bilirrubina en su fijación a la albúmina, desplazarla y provocar hiperbilirrubinemia capaz de ocasionar ictericia. Las tetraciclinas, por su avidez por el tejido óseo y dentario en formación, pueden perturbar el desarrollo y el crecimiento de estas estructuras. Por estas razones, deben evitarse en el embarazo y lactancia.
La capacidad metabólica del hígado puede estar disminuida en el anciano, así la hepatotoxicidad provocada por isoniazida aumenta con la edad. Este factor puede contribuir también a que haya variaciones en las secreciones ácidas del estómago, condicionando así la absorción de antibióticos que pueden ser inactivados en un pH ácido. La acidez gástrica en los niños menores de 3 años es menor y la frecuencia de la aclorhidria se eleva a partir de los 40 años. Por eso, y debido a que la penicilina G es inactivada con la acidez, la absorción de ésta y de otros β-lactámicos por vía oral puede estar aumentada en niños pequeños y en una proporción elevada en ancianos.
Embarazo y lactancia
Las penicilinas, cefalosporinas y eritromicina, no son teratógenas y pueden usarse en el embarazo. El metronidazol y la ticarcilina son teratógenos en animales. Las tetraciclinas presentan acción sobre huesos y dientes. También pueden provocar hepatotoxicidad en embarazadas. Los aminoglucósidos pueden llegar a lesionar la función auditiva del feto, efecto que sólo se ha observado en el caso de la estreptomicina administrada a madres tuberculosas, en las que el tratamiento es prolongado.
Aunque todos los antimicrobianos pasan a la leche materna, la gran mayoría se encuentra en menores concentraciones a las del plasma. Aun así, se debe evitar la presencia de sulfamidas y ácido nalidíxico, por riesgo de producir hemólisis en lactantes con deficiencia de glucosa-6-fosfato deshidrogenasa, de cloranfenicol en las primeras semanas del lactante y de metronidazol por el peligro de toxicidad neurológica. Las tetraciclinas se absorben con dificultad, pues suelen estar queladas.
Función renal
El impacto de la insuficiencia renal, sobre la eliminación del antibiótico, depende del grado en que éstos son excretados de forma activa sobre el riñón, ya sea por filtración, secreción o ambos mecanismos. El hecho de no tener en cuenta la reserva funcional renal del paciente, es origen de numerosas intoxicaciones por antibióticos. En este caso, basta con adaptar la dosis al grado de insuficiencia renal. Esto se consigue mediante la reducción de cada dosis o la prolongación del intervalo interdosis.
La eliminación renal difiere según los antibióticos y, por tanto, conviene distribuirlos en función de su grado de excreción.
Función hepática
En caso de insuficiencia hepática, habrá que reducir la dosis de los antibióticos que se eliminan por metabolización en el hígado. Éste es el caso del cloranfenicol, los macrólidos y las lincosaminas. La vida media de la rifampicina y de la isoniazida está prolongada en pacientes con cirrosis. La concentración biliar de los antibióticos puede disminuir en los pacientes con enfermedad hepática o con obstrucción biliar, como es el caso de la ampicilina y nafcilina.
Peculiaridades idiosincrásicas
Las peculiaridades genéticas o metabólicas influyen sobre el comportamiento terapéutico o tóxico del antibiótico. Esto ocurre con los pacientes que tienen un déficit de G-6-PD, en los que pueden ocasionar hemólisis las sulfamidas, la nitrofurantoína, la furazolidona, las sulfotas, el cloranfenicol y la cloroquina. En los acetiladores lentos, la isoniazida muestra mayor tendencia a producir neurotoxicidad.
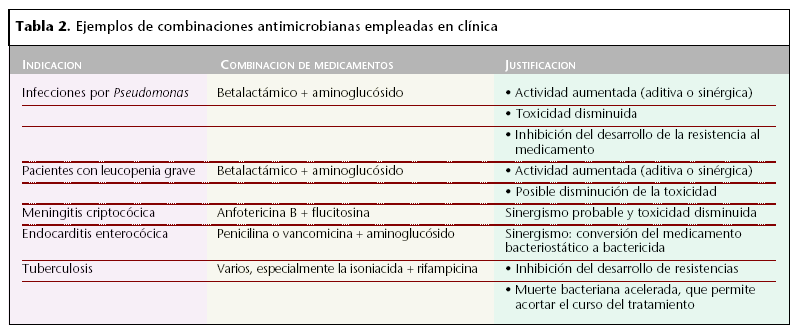
En la tabla 2 se muestran algunos ejemplos de combinaciones de agentes antimicrobianos empleados clínicamente.
Uso profiláctico
Quimioprofilaxis médica
Incluso en las circunstancias más favorables, la quimioprofilaxis médica no tiene la misma eficacia que la inmunoprofilaxis activa en la facilidad de empleo, el coste, la seguridad, la duración del efecto protector ni en el número de gérmenes que pueden ser tratados. La quimioprofilaxis estaría indicada cuando no hay inmunización posible, como en la fiebre reumática, o cuando la protección debe ser rápida y, por tanto, no susceptible de inmunización activa o pasiva. La quimioprofilaxis debe considerar muchos factores, como las defensas del huésped, el riesgo continuado o transitorio o la existencia de uno o varios agentes potencialmente infectantes. Se pueden considerar tres situaciones:
* La quimioprofilaxis durante el período de incubación de una infección. El ejemplo más característico es el paludismo. Entre las infecciones bacterianas se encuentra la meningitis meningocócica, tuberculosis en niños positivos a la tuberculina (isoniazida), prevención de la gonorrea o la sífilis después del contacto de personas infectadas, así como la escarlatina.
* Profilaxis de recaídas. Fiebre reumática, infecciones recurrentes del tracto urinario en mujeres jóvenes, endocarditis en pacientes con válvulas cardíacas dañadas o lesionadas, en intervenciones dentales quirúrgicas u otros procedimientos en los que se produce una elevada bacteriemia.
* Profilaxis de la complicación infecciosa. Neumonía por aspiración, tratamiento con corticoides a dosis elevadas (utilizándose penicilinas), pacientes neutropénicos, en quemaduras (utilizándose penicilina G a dosis elevadas para prevenir las infecciones por Streptococcus pyogenes o S. pneumoniae).
Quimioprofilaxis quirúrgica
Se han realizado estudios clínicos que demuestran la eficacia del empleo profiláctico de antimicrobianos en ciertos procedimientos quirúrgicos.
La infección de una herida operatoria aparece cuando un número crítico de bacterias se encuentran en la herida en el momento de su cierre, y ello depende de su virulencia, de la existencia de tejido pobremente vascularizado, de la presencia de cuerpos extraños y del estado del huésped. La profilaxis, debe tender a reducir el número de bacterias viables, con el objetivo de prevenir la infección.
Los principios básicos que deben tenerse en cuenta en estas condiciones son:
* El riesgo de la contaminación de la intervención. Así en la cirugía limpia no suele estar indicada la profilaxis, salvo en casos excepcionales, como implantación de prótesis cardiovasculares u ortopédicas, ni en la cirugía limpia contaminada, excepto en pacientes con alto riesgo. En la cirugía suciacontaminada, no se debe realizar la profilaxis, sino una pauta terapéutica específica. La profilaxis estará indicada, especialmente en la cirugía contaminada.
* Inicio del tratamiento. Se suele llevar a cabo inmediatamente antes de la intervención, aproximadamente 30 minutos, cuando la administración es endovenosa, o 24 horas antes, si la administración es oral.
* Duración. Existen pruebas que demuestran que el empleo continuado de los antimicrobianos después de la intervención es innecesario y, probablemente, peligroso. Suele ser suficiente una sola dosis, o en caso de intervenciones prolongadas y antimicrobianos de vida media corta, podría repetirse a las 3 horas sin superar, en ningún caso, las 24 horas.
* Elección del antibiótico adecuado. Hay que evitar el empleo de antimicrobianos de amplio espectro o para cepas resistentes. Así, se suele recomendar el empleo de cefalosporinas de primera generación, aminoglucósidos o metronidazol, en el caso de infecciones probables por anaerobios.
Perspectivas de futuro
El desciframiento de los genomas humanos y microbianos se realiza, en la actualidad, a un ritmo sin precedentes. La clave del éxito en la lucha contra la resistencia a antibióticos consiste en establecer un planteamiento integrado, que pueda explotar las nuevas oportunidades que ofrece la investigación genómica. Estas oportunidades se desarrollan en los nuevos proyectos de investigación del vi Programa marco (2002-2006). Esta nueva estrategia se centra en:
Nuevas clases de medicamentos antiinfecciosos
En los últimos años, no se ha descubierto ninguna clase de antibióticos. En la actualidad, el precio medio del desarrollo de un nuevo medicamento es de unos 500 millones de euros y los incentivos industriales parecen no bastar para asegurar esta barrera con suficiente celeridad como para asegurar la disponibilidad continuada de medicamentos antiinfecciosos eficaces. Es posible que las aplicaciones de la genómica nos aporten nuevas generaciones de medicamentos con mayor rapidez y a un menor precio.
Test de diagnóstico
La prescripción prudente de los antibióticos adecuados se logra, tan sólo, si los médicos tienen a su disposición tests de diagnóstico rápidos y asequibles para identificar a los patógenos y sus propiedades de resistencia. La moderna tecnología de ADN es esencial para acelerar el desarrollo de nuevos medios de diagnóstico más precisos que garanticen la creación de los incentivos adecuados para fomentar su uso.
Desarrollo de vacunas
El control de la infección mediante la vacunación es un modo indirecto muy eficaz y rentable para reducir la necesidad de antibióticos en primera instancia. La genómica abre un nuevo y prometedor camino para el desarrollo de vacunas.
Vigilancia
La vigilancia epidemiológica de la resistencia a los antibióticos, en patógenos humanos y animales, es un componente esencial de esta estrategia. Habrá que realizar un seguimiento del consumo de antibióticos y establecer un vínculo entre las conclusiones proporcionadas por los datos sobre resistencia y los resultados clínicos.
El problema de las resistencias
El problema de la resistencia a los antibióticos conlleva una amplia gama de consecuencias socioeconómicas y políticas. En él se tratan muchos aspectos de la economía de la sociedad y de la salud, como los hábitos de prescripción y la formación de los médicos, el pago de los gastos médicos y las expectativas de la opinión pública. Incluso va más allá de la medicina y se adentra en la higiene animal, la agricultura y la industria de los alimentos y temas medioambientales.
Política de antibióticos
El uso indiscriminado y el abuso en la utilización de los antimicrobianos dan lugar a una selección de cepas resistentes, por eliminación de la flora sensible. Este hecho es importante, de manera especial en el medio hospitalario, donde se emplean los antimicrobianos de amplio espectro y obliga a establecer una serie de normas que regulen su empleo para evitar la aparición de cepas multirresistentes y anular el grado de resistencia, que la presión selectiva del uso provoca. Todos los antimicrobianos tienen una vida media limitada que se acorta con la utilización descontrolada.
Bibliografía general
Allan JD. Combinaciones de antibióticos. Med Clin N Am 1987;6.
AMA Drug evaluations. Annual, 1991.
Barrio JL. Profilaxis de la infección quirúrgica. Medicine 1991;77:3044-8.
Edberg SC, Berger SA. Antibiotics and infections. Nueva York: Churchill Livingstone, 1983.
Franklin TJ, Snow GA. Biochemistry of antimicrobial action. Londres: Chapaman & Hall, 1981.
García-Rodriguez JA. Medicamentos antimicrobianos. Medicine 1990;71:2832-45.
Meyers BR. Antimicrobial prescribing. Princeton: Antimicrobial Prescribing, 1983.
Peterson PK, Verhoef J. The Antimicrobial Agents, Annual 1. Amsterdam: Elsevier, 1986.