El SÍNDROME DE MAY-THURNER (SMT), también conocido como síndrome de compresión de la vena ilíaca, se produce cuando la vena ilíaca común izquierda se encuentra comprimida a su paso entre la arteria ilíaca común derecha y las vértebras lumbares1. Los pacientes que padecen este síndrome están predispuestos a sufrir trombosis venosa profunda (TVP) y embolia pulmonar, conjuntamente conocidas como tromboembolia venosa (TEV).
La trombosis venosa iliofemoral representa, aproximadamente, el 25% de todas las TVP de las extremidades inferiores. En comparación con las TVP que se producen por debajo de la rodilla, la trombosis de la vena iliofemoral se relaciona con mayor riesgo de embolia pulmonar, disminución del riego sanguíneo y síndrome postrombótico1. Este artículo trata de los mecanismos del SMT y de los tratamientos intervencionistas de que se dispone para mejorar la calidad de vida de los pacientes y prevenir complicaciones potencialmente mortales.
Tromboembolia venosa en las noticiasCuando el periodista David Bloom, de 39 años, murió de embolia pulmonar en 2003 mientras cubría la invasión iraquí, la TEV adquirió protagonismo a nivel nacional cuando la difusión en los medios de comunicación destacaba la causa de la muerte de este joven2. Posteriormente, la Joint Commission, en asociación con el National Quality Forum en 2005, elaboró unas directrices para disminuir la incidencia de TEV3. En 2008, el Director General de Salud Pública de Estados Unidos reclamó nuevas iniciativas a nivel nacional para prevenir la TEV.
El tema de este artículo es la TVP iliofemoral aguda causada por el SMT. Aunque el riesgo más grave que se corre es la embolia pulmonar potencialmente mortal, la insuficiencia venosa crónica del síndrome postrombótico (SPT) consume presupuesto de la asistencia sanitaria, afecta negativamente a la calidad de vida y predispone a las personas a sufrir úlceras venosas crónicas y TVP recurrente1 (v. el cuadro Comprender el síndrome postrombótico y la insuficiencia venosa crónica).
Fisiopatología de la tromboembolia venosaLa enfermedad tromboembólica venosa puede comenzar con anomalías fisiológicas y/o anatómicas. Los elementos principales de los trombos son las plaquetas y la fibrina. Los trombos arteriales se diferencian de los trombos venosos en que los primeros suelen estar provocados por la rotura de la placa aterosclerótica u otra lesión de la íntima. Puesto que estos trombos, conocidos como coágulos blancos, son ricos en plaquetas, se tratan con medicamentos antiplaquetarios. En cambio, los trombos venosos (el tema de este artículo) o coágulos rojos son ricos en fibrina y contienen más glóbulos rojos, por lo que se tratan con anticoagulación4.
La mayoría de las TVP surgen del sistema venoso de las extremidades inferiores. Sin embargo, el SMT se asocia con TVP iliofemoral izquierda no provocada o insuficiencia venosa crónica4,5.
Algunos factores de riesgo predisponen a un individuo a la TEV. En el siglo xix, el médico Rudolf Virchow fue el primero en constatar la existencia de tres anomalías en la circulación sanguínea, por las cuales se corre mayor riesgo de trombosis venosa: estasis venosa, hipercoagulabilidad y lesión de células endoteliales de la pared vascular. Estos factores se conocen como la tríada de Virchow4,6.
Los factores de riesgo también pueden clasificarse como no modificables o modificables. Entre los factores de riesgo no modificables están la mutación del factor V de Leiden u otros estados de hipercoagulabilidad hereditarios, como deficiencia de proteína S, edad avanzada, sexo femenino y anomalías anatómicas que impiden la circulación venosa (como en el SMT)5. Los factores de riesgo modificables incluyen el uso del tratamiento hormonal de la menopausia o de anticonceptivos orales, la inmovilización prolongada, permanecer de pie durante mucho tiempo y la obesidad. La cirugía, el cáncer, el embarazo y la infección aguda también aumentan el riesgo4,7,8.
Examinar el síndrome de May-Thurner más detenidamenteEl SMT es un factor de riesgo anatómico que contribuye a la TEV, que se ha identificado a través de pruebas de diagnóstico por la imagen mejoradas. Aunque Virchow certificó su existencia en 1851, los médicos May y Thurner lo explicaron exhaustivamente un siglo después durante la realización de autopsias rigurosas9.
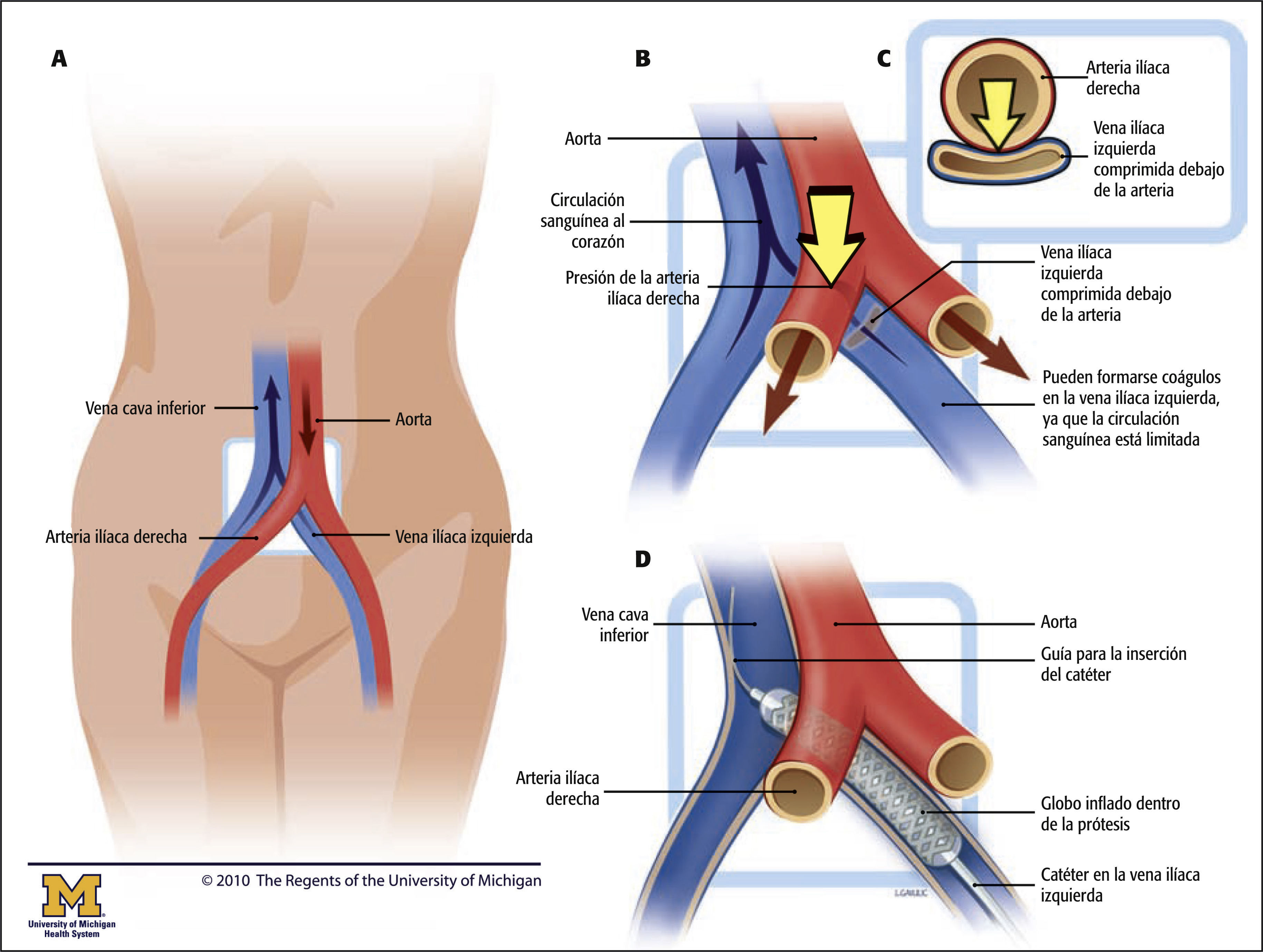
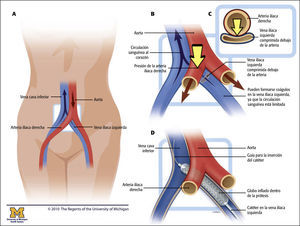
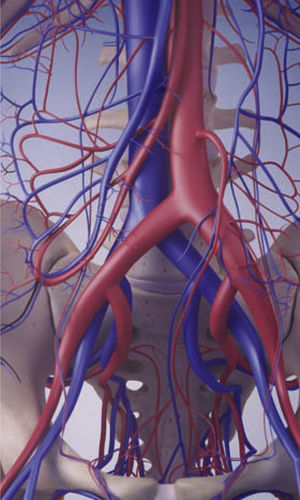
El SMT se produce en el momento en que la arteria ilíaca común derecha se sitúa sobre la vena ilíaca común izquierda y la comprime contra las vértebras lumbares subyacentes, lo que afecta a la circulación sanguínea y provoca estasis venosa y, potencialmente, TVP iliofemoral10. La lesión adicional de la íntima se produce en la vena ilíaca común izquierda a partir de las pulsaciones de la arteria ilíaca común derecha contigua10,11.
Aunque la investigación muestra que el SMT afecta a más del 20% de la población, a menudo no se tiene en cuenta en el diagnóstico diferencial de la TVP y con frecuencia se pasa por alto12. Sin embargo, se ha convertido en una variante anatómica ampliamente reconocida ya que se han desarrollado mejores modalidades diagnósticas e intervencionistas para la trombosis venosa.
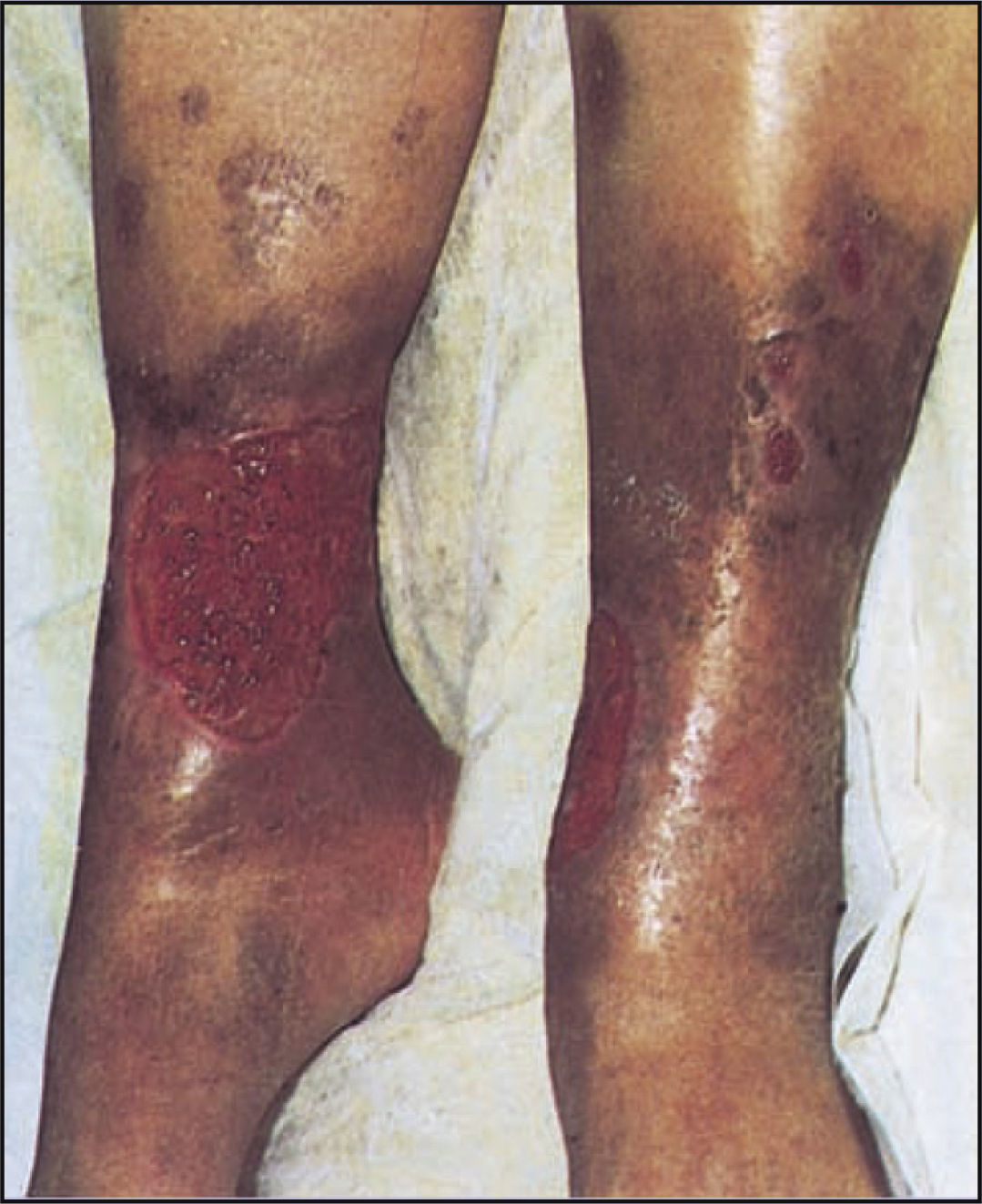
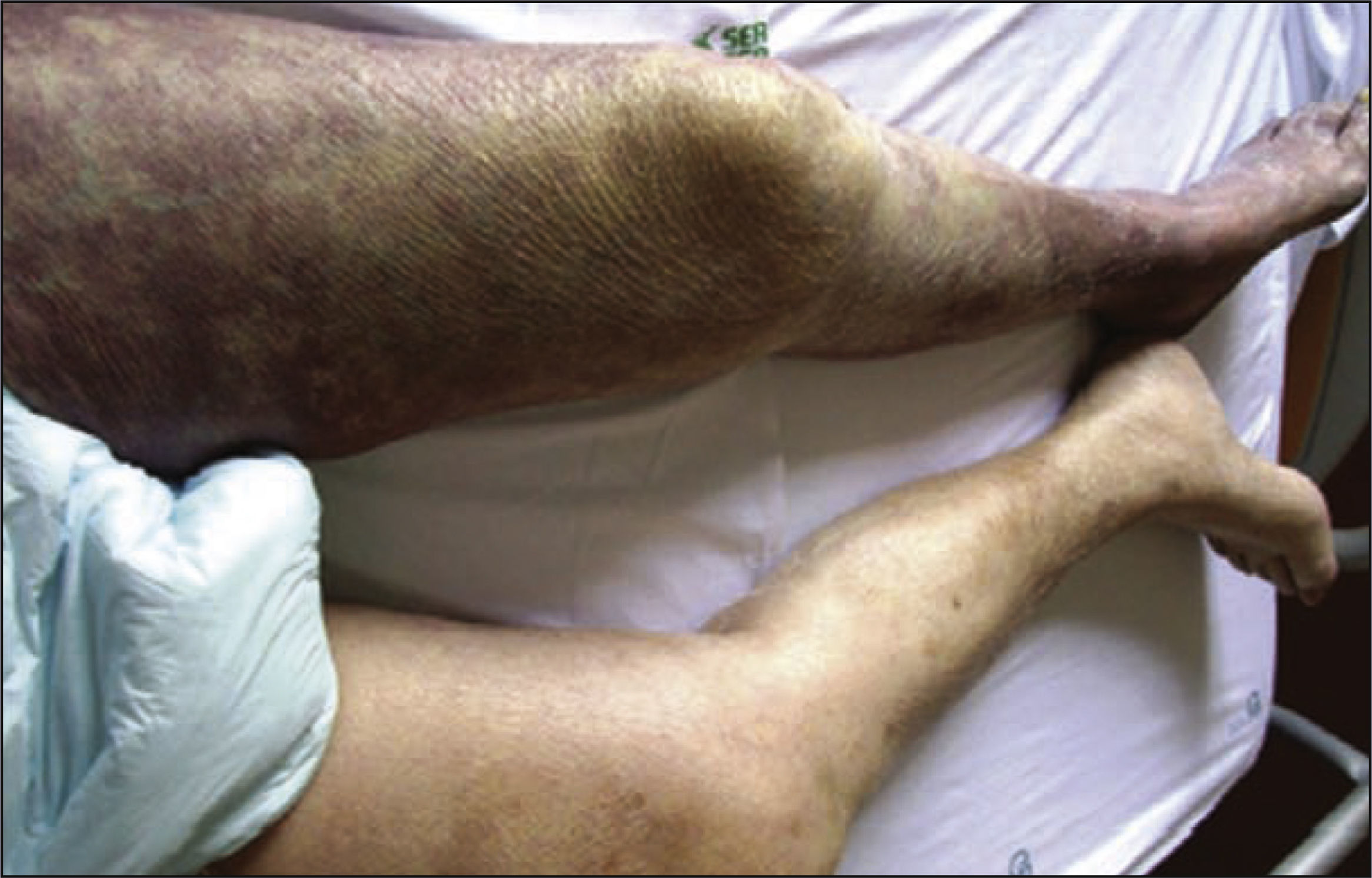
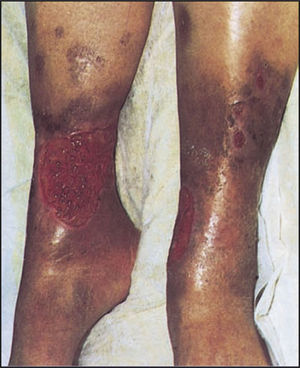
Anteriormente denominado síndrome posflebítico, el síndrome postrombótico (SPT) describe el desarrollo de síntomas y signos de insuficiencia venosa crónica después de la TVP, como dolor, dilatación venosa, edema, hiperpigmentación y otros problemas dermatológicos, y úlceras venosas. Entre los factores de riesgo se cuentan edad madura, antecedentes personales o familiares de trastornos venosos, posición de pie prolongada o sedentarismo, embarazo y edad avanzada. Los pacientes pueden quejarse de una sensación de pesadez o dolor en las piernas, calambres musculares y molestias en la piel, como sensación de opresión, picazón o piel seca. Los factores contribuyentes incluyen el reflujo que aparece por incompetencia valvular e hipertensión venosa por obstrucciones trombóticas. La profilaxis de la TVP, su tratamiento temprano y la prevención de la TVP recurrente reducen los riesgos asociados con esta complicación debilitadora y costosa.
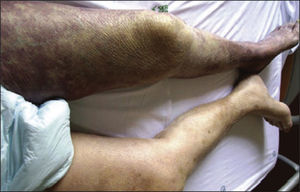
La primera presentación del SMT puede ser la TVP iliofemoral izquierda no provocada que cursa con dolor y edema de la extremidad inferior izquierda5. Menos frecuentemente, si la carga del coágulo proximal es grande, la afectación arterial denominada flegmasia cerúlea dolorosa puede producirse en la extremidad inferior afectada (v. el cuadro Flegmasia cerúlea dolorosa: rara, pero de mal agüero). Es necesaria una operación urgente para restablecer la circulación sanguínea arterial. Si no se trata, puede provocar hipotensión y evolucionar hacia un shock hipovolémico, y el paciente puede perder el miembro afectado o morir13.
Cuando la fase aguda de la TVP se resuelve, el paciente puede experimentar síntomas y signos persistentes como consecuencia de la insuficiencia venosa crónica de las extremidades inferiores, lo que repercute negativamente en los recursos económicos y en el estado de salud, el bienestar psicológico y la calidad de vida en general del paciente12,14.
DiagnósticoLos médicos de pacientes que presenten síntomas y signos relacionados con la enfermedad venosa crónica, con trombosis venosa aguda o sin ella, deben obtener un historial de salud detallado y realizar un examen físico12. El historial debe incluir preguntas relacionadas con la evolución de síntomas y signos, TVP anterior e identificación de factores de riesgo de TEV. En el examen físico debe llevarse a cabo una revisión exhaustiva y la palpación de las extremidades inferiores para observar los cambios en el color de la piel y en la temperatura, si existe edema unilateral y varices. Para evaluar la enfermedad arterial coexistente, deben palparse y evaluarse los pulsos femoral, poplíteo y de las arteria dorsal del pie y tibial posterior. También deben evaluarse los reflejos profundos del tendón, la fuerza muscular y la sensibilidad7,10.
Los estudios de laboratorio oportunos incluyen hemograma completo, perfil metabólico básico, pruebas de coagulación y un dímero D. Como producto de degradación de la fibrina, casi todos los pacientes con TEV presentan elevación del dímero D. Sin embargo, puesto que los pacientes hospitalizados a menudo tienen niveles elevados de dímero D por otros motivos, no es un dato específico para diagnosticar TEV y solo es útil cuando es negativo10.
La evaluación física debe realizarse junto con una ecografía de compresión de las extremidades inferiores10. Una limitación de la ecografía de compresión para diagnosticar el SMT consiste en que no detecta trombos aislados en la vena ilíaca o en la parte de la vena femoral del canal aductor. Otras pruebas de diagnóstico por la imagen que se pueden realizar para evaluar el grado de estenosis y los efectos hemodinámicos de la compresión de la vena ilíaca en el SMT incluyen10,12:
- •
Pletismografía de impedancia.
- •
Flebografía con contraste.
- •
Tomografía computarizada (TC).
- •
Ecografía intravascular.
- •
Flebografía por resonancia magnética.
La trombosis venosa iliofemoral extensa de las extremidades inferiores provoca dolor súbito en las piernas con cianosis, edema, gangrena venosa, síndrome compartimental y compromiso arterial. El retraso en el tratamiento puede provocar colapso circulatorio, shock, pérdida de la pierna y muerte.
Una vez que se establece un diagnóstico de TVP aguda como manifestación del SMT, debe procederse inmediatamente a llevar a cabo la anticoagulación en la mayoría de los pacientes, ya que un retraso en el tratamiento puede aumentar el riesgo de una embolia pulmonar potencialmente mortal5,15. Esta anticoagulación inicial debe continuar, al menos, durante 5 días15. Entre las opciones de tratamiento se cuentan heparina de bajo peso molecular (HBPM), como enoxaparina, fondaparinux, heparina no fraccionada i.v. (HNF) o HNF subcutánea. La anticoagulación oral con un antagonista de la vitamina K, como el acenocumarol, puede administrarse al mismo tiempo que la HBPM, el fondaparinux o la HNF durante 4-5 días. La anticoagulación oral a largo plazo se debe prescribir al menos durante 3 meses y puede continuarse durante 6-12 meses o, incluso, de manera indefinida en algunos pacientes. Entre las opciones de anticoagulación oral a largo plazo pueden citarse los inhibidores directos del factor X activado, como rivaroxabán; inhibidores de la trombina, como dabigatrán, y antagonistas de la vitamina K; Las opciones subcutáneas incluyen HBPM y fondaparinux15.
Antes del alta, hay que formar a los pacientes sobre el tratamiento médico que se les ha recetado y deben tratase los factores de riesgo modificables. Por ejemplo, se debe animar a los pacientes a que bajen de peso y a que realicen ejercicio con regularidad. Deben establecer estrategias para no permanecer sentados o de pie durante largos periodos y deben usar medias de compresión graduadas de uso médico a menos que estén contraindicadas. Si un paciente sigue un tratamiento hormonal, debe evaluarse e interrumpirse su uso si es posible. Aunque no se ha establecido un vínculo claro entre el riesgo de fumar y la TEV, se debe animar encarecidamente a los pacientes que dejen el hábito de fumar porque el tabaquismo afecta a las comorbilidades y a la mortalidad en general16.
Terapias intervencionistas y cuidados de enfermeríaSin corrección, la anomalía anatómica asociada con el SMT puede provocar TVP recurrente y otras complicaciones12. Además de la anticoagulación, la terapia fibrinolítica dirigida por catéter, con trombectomía dirigida por catéter o sin ella, puede ser una opción para pacientes con SMT y TVP iliofemoral extensa aguda o flegmasia cerúlea dolorosa con síntomas de menos de 2 semanas y buen estado funcional. La septostomía auricular con globo y la colocación de una prótesis intravascular se pueden utilizar para corregir la estenosis y restaurar la circulación sanguínea óptima en la vena ilíaca común izquierda estenosada5 (v. el cuadro síndrome de May-Thurner y colocación de una prótesis intravascular).
Las pruebas analíticas anteriores al procedimiento para pacientes con SMT intervenidos por flebografía con intervención intravascular deben incluir la evaluación de la función renal basal debido a la administración de medios de contraste intravasculares; un hemograma completo para detectar anemia y trombocitopenia, y pruebas de coagulación para establecer el tiempo de tromboplastina parcial activado y el tiempo de protrombina/índice internacional normalizado si se había iniciado la anticoagulación o si se había planificado la administración de tratamiento fibrinolítico. A los pacientes también se les deben realizar exámenes de detección de alergias, incluyendo antecedentes de cualquier reacción alérgica a medios de contraste. Asegúrese de que el paciente no tenga un acceso venoso periférico obstruido.
Los cuidados inmediatos después del procedimiento implican la toma frecuente de las constantes vitales y el control de síntomas y signos de hemorragia oculta. Evalúe el lugar de inserción del catéter por si existe hemorragia activa y signos de infección. Estimule el aporte de líquidos orales y administre los líquidos intravenosos según lo prescrito para prevenir la deshidratación y la nefropatía por contraste (NIC)17.
Antes del alta, se debe formar a los pacientes sobre la necesidad de realizar un seguimiento de los valores analíticos dependiendo del tipo de tratamiento anticoagulante prescrito. Enseñe a los pacientes los síntomas y signos de hemorragia durante el tratamiento anticoagulante y la importancia de cumplir con la medicación recetada, el mantenimiento de las citas para el seguimiento y el contacto con el médico por si surgen complicaciones potencialmente graves. A los pacientes también se les deben enseñar los síntomas y signos de TVP y embolia pulmonar, y qué hacer si estos se presentan. En cualquier caso, se deben fomentar modificaciones del estilo de vida.
El SMT implica la compresión de la vena ilíaca izquierda por la arteria ilíaca derecha (A, B y C) que se encuentra por encima de esta. El tratamiento del SMT incluye septostomía auricular con globo y la colocación de una prótesis, como se muestra en D.
Entre los riesgos relacionados con la intervención intravascular se pueden citar reacciones adversas agudas a medios de contraste intravasculares, hemorragia relacionada con el tratamiento fibrinolítico y la anticoagulación, trombosis de la prótesis intravascular temprana y tardía, migración de endoprótesis (rara) y NIC7.
Algunos estudios han identificado que la NIC es la tercera causa principal de lesión renal aguda experimentada por los pacientes en el entorno de atención aguda18. Según el American College of Radiology, no hay criterios uniformes para el diagnóstico de NIC17. Uno de los criterios utilizados con más frecuencia ha sido un aumento absoluto de 0,5 mg/dl sobre una base de creatinina sérica. Sin embargo, en los niveles de creatinina influyen otros factores, como el sexo, la raza y la edad. Tampoco está claro si la lesión renal aguda es el resultado directo de la exposición al contraste o está causada por una combinación de factores. Medicamentos como los antinflamatorios no esteroideos, la metformina y la anfotericina B pueden afectar a la función renal si se utilizan medios de contraste intravasculares, al igual que a la hipovolemia17,18. Las estrategias para prevenir la NIC incluyen evitar la hipovolemia y los antinflamatorios no esteroideos, que pueden aumentar la vasoconstricción renal19.
Estudio de casoM.K., de 54 años, tenía antecedentes de TVP iliofemoral izquierda a los 24 años mientras estaba embarazada. En aquel momento, se la trató con HNF hasta que dio a luz un niño sano. Inmediatamente después del parto se le recetó acenocumarol durante 6 meses.
Durante su segundo embarazo, M.K. se administró HNF subcutánea cada 12 horas como profilaxis de la TVP durante el segundo y tercer trimestres. Continuó con este régimen durante 3 meses después del parto sin que se repitiera la TVP. No era fumadora, mantenía un peso óptimo y realizaba ejercicio con regularidad. No tenía comorbilidades.
A los 40 años, M.K. experimentó edema, dolor, cansancio y una sensación de pesadez en la extremidad inferior izquierda, así como cambios en el color de la piel y varices. La flebografía por TC mostró una oclusión completa de la vena ilíaca común izquierda, congestión venosa pélvica y efectos secundarios venosos extensos. Se le diagnosticó de SMT y fue derivada para ser intervenida.
El síndrome de May-Thurner es un factor de riesgo anatómico que contribuye a la tromboembolia venosa, que se ha identificado a través de pruebas de diagnóstico por la imagen mejoradas.
Se colocó a la paciente, de manera satisfactoria, una prótesis intravascular de la vena ilíaca común izquierda y se le administró enoxaparina cada 12 horas y aspirina a diario. Continuó tomando enoxaparina durante los 6 meses posteriores a la colocación de la prótesis. Después de 6 meses, continuó tomando una dosis baja de aspirina a diario. El seguimiento a 1 año reveló la permeabilidad continuada de la prótesis y la paciente informó de mejoría de los síntomas, aumento de la tolerancia a la actividad y una mejora general de la calidad de vida.
Lograr resultados satisfactoriosA medida que se producen avances tecnológicos, la calidad de vida de los pacientes con SMT, a los cuales se interviene con un tratamiento intervencionista, mejora, pero la supervisión a largo plazo de la permeabilidad de la prótesis que se lleva es vital. La intervención temprana, el seguimiento a largo plazo y la formación del paciente son las claves para el éxito continuado. ■
En el Christiana Hospital del Christiana Care Health System de Newark, Delaware, Susan K. Adams es enfermera en Intervencionismo Vascular y Cardíaco, y también resource instructor en el Simulation Resource Center de la Universidad de Delaware. Inga Y. Sinyangwe es especialista en desarrollo de personal: servicio perioperatorio en el Christiana Care Health System de Newark, Delaware.
Las autoras y los editores declaran no tener ningún conflicto de intereses potencial, financiero o de otro tipo relacionado con este artículo.