APROXIMADAMENTE, EL 90% DE LOS 2 MILLONES de lesiones cerebrales anuales que se notifican en Estados Unidos se diagnostican como traumatismo craneoencefálico (TCE) leve1. Sin embargo, puesto que la mayoría de los casos de TCE leve no se notifican a los hospitales, no se conoce la verdadera incidencia2.
La Brain Injury Association of America explica que el TCE leve puede estar provocado por golpes directos en la cabeza, heridas de bala, sacudidas violentas de la cabeza o por la fuerza de una lesión del tipo del latigazo cervical. Tanto los traumatismos craneoencefálicos contusos (o cerrados) como los abiertos pueden producir TCE leve3. Aunque los términos conmoción cerebral y TCE leve a menudo se utilizan de manera indistinta, para mayor claridad en este artículo utilizaremos exclusivamente el término TCE leve3,4.
El TCE leve ha sido descrito como la “epidemia silenciosa” porque los problemas que se sufren después del traumatismo a menudo pasan inadvertidos o no se tratan, pero pueden comportar profundas consecuencias para el bienestar físico, mental, social y laboral a largo plazo de los pacientes1. Este artículo analiza la fisiopatología y el diagnóstico del TCE leve, la valoración de enfermería y la educación de pacientes con TCE leve.
Mecanismos del TCEUn TCE es una lesión cerebral provocada por un fuerte traumatismo en el cerebro o por la fuerza de una aceleración/desaceleración, así como por una explosión o latigazo cervical, que daña al cerebro con un traumatismo externo directo o sin él5,6. Como se explica en detalle más adelante, el TCE leve se describe como un tipo menos grave de TCE cuando se diagnostica en un principio y se caracteriza generalmente por síntomas y signos transitorios que, por lo general, mejoran con rapidez en 2 semanas y remiten por completo en 90 días, aunque un pequeño número de pacientes puede continuar presentando síntomas durante un año o más tiempo1,7.
Aunque la inmensa mayoría de los pacientes con TCE leve sobreviven y se recuperan, un pequeño grupo de ellos presentará una disfunción neurológica continua y morirá por la progresión de la lesión primaria. Entre los factores de riesgo de muerte asociados con el TCE leve pueden citarse la gravedad de la lesión primaria, la existencia de lesiones extracraneales y, lo que es más importante, el uso de anticoagulantes6,8.
Algunos de los principales efectos del TCE leve son inmediatos y se manifiestan a las pocas horas de la lesión, aunque los síntomas y signos máximos pueden presentarse desde horas hasta días después de la lesión9. Las alteraciones cognitivas son frecuentes, en especial en el ámbito del tiempo de reacción visual y motora, el procesamiento de la información, la memoria y la atención10.
A pesar de que la mayoría de los pacientes que sufren un único TCE leve se recuperan por completo, otros desarrollan un síndrome prolongado posterior a la conmoción cerebral u otras complicaciones a largo plazo que pueden ser incapacitantes10,11. Por ejemplo, los pacientes con un historial de impactos repetitivos en la cabeza subconcusivos pueden sufrir daños acumulativos que prolongan su recuperación o la convierten en una enfermedad crónica. En consecuencia, las enfermeras deben comunicar a los pacientes que incluso un TCE “leve” debe tomarse en serio y deben enseñarles la importancia de seguir las recomendaciones de tratamiento para prevenir más lesiones y asegurar una recuperación completa.
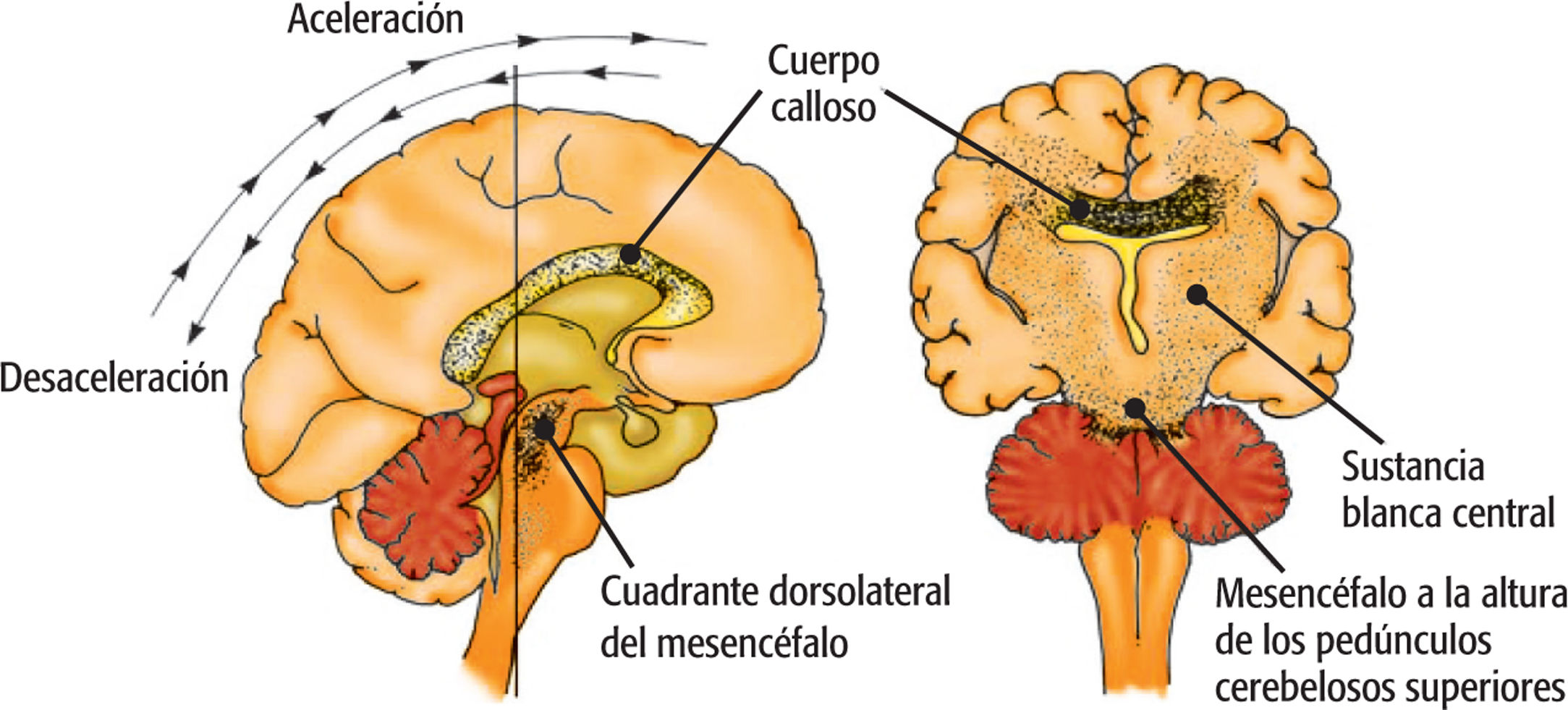
No hay dos TCE igualesLas propiedades físicas del tejido cerebral que se halla dentro de la bóveda craneal son factores determinantes del movimiento y la deformación del cerebro durante el impacto. Estas propiedades explican la variabilidad y el grado de lesión entre los individuos, y explican por qué no hay dos TCE iguales12–14.
Como su nombre indica, las lesiones cerebrales difusas no se localizan en un área del cerebro, sino que se distribuyen por todo el cerebro. El daño axonal difuso (DAD) se diagnostica por la aparición de una lesión axonal a nivel microscópico en regiones seleccionadas del cerebro como se puede apreciar en la resonancia magnética11,12. El DAD está provocado por la aceleración y desaceleración de tres tipos de fuerzas mecánicas que provocan tensión y cizallamiento de los axones en el cerebro:
- •
El daño lineal se produce como resultado de las fuerzas que hacen que la cabeza se mueva en una dirección anterior-posterior, como cuando se golpea la parte frontal o posterior de la cabeza.
- •
La aceleración rotacional se produce como resultado de fuerzas que hacen que la cabeza se mueva hacia los lados, como cuando se recibe un puñetazo en un lado de la cara o por la fuerza de una explosión.
- •
La desaceleración del impacto se produce cuando la cabeza desacelera con fuerza, como cuando la cabeza toca el suelo9.
Aunque el cerebro es uno de los mayores consumidores de oxígeno del cuerpo humano, no puede almacenar oxígeno, lo que lo convierte en especialmente sensible a cualquier reducción o interrupción del suministro de oxígeno15. Además, cuando el tamaño del cerebro se reduce con la edad, el espacio subdural se agranda. Ello puede aumentar el riesgo de todas las clasificaciones de TCE en adultos mayores16.
La combinación de las fuerzas de aceleración y desaceleración por la fuerza de un golpe directo en la cabeza pueden provocar un desajuste metabólico inducido por el traumatismo: un aumento de la necesidad de sustratos del metabolismo, incluido el oxígeno, acompañado simultáneamente por una disminución de la circulación sanguínea y el suministro de oxígeno. El desajuste metabólico provoca un déficit energético que produce síntomas y signos variables, pero con mayor frecuencia dolor de cabeza, mareos, trastornos del sueño, problemas cognitivos y dificultades emocionales, pero también puede provocar pérdida de conciencia y amnesia postraumática14. Los síntomas y signos asociados con el TCE leve están provocados por la alteración de la función cerebral en lugar de por un daño estructural grave.
Los vasos sanguíneos cerebrales son tan sensibles a la biomecánica de la lesión por cizalla como las neuronas. Cada neurona depende de la recepción de una fuente continua de glucosa y oxígeno; los capilares más pequeños son lo suficientemente grandes como para que un solo glóbulo rojo pueda suministrar oxígeno y glucosa. La lesión vascular puede provocar un trastorno de la regulación neural al alterar la respuesta hemodinámica necesaria para la función celular habitual9.
Como se mencionó anteriormente, un golpe directo en la cabeza no es el único mecanismo que puede producir un TCE. Otras causas que pueden citarse son las fuerzas de explosiones, como las que se producen en una batalla o en las guerras, que provocan que el cerebro se acelere, gire y desacelere. Diferentes áreas del cerebro se mueven a diferentes velocidades, lo que genera contusiones y lesiones por cizallamiento en los sensibles tejidos cerebrales13,14. Los síntomas y signos reflejan la gravedad y el alcance de las contusiones y lesiones por cizallamiento14.
Tras la lesión, el tejido cerebral necesita aún más oxígeno para sobrevivir y recuperarse. La lesión altera el metabolismo cerebral y vuelve a las neuronas más sensibles a la lesión ante la hipoxia, los radicales libres y la disfunción mitocondrial. Este es el comienzo de un proceso patológico que a veces requiere muchos años para resolverlo15.
Los TCE de cualquier grado son muy variables. Dos lesiones que superficialmente parecen muy similares por lo que respecta a mecanismo de la lesión y distribución y gravedad del daño pueden asociarse con resultados muy diferentes. Si bien el patrón específico del TCE varía, el resultado está relacionado con la edad en el momento de la lesión y la gravedad inicial de la lesión: los pacientes más jóvenes con lesiones menos graves por lo general tendrán una recuperación mejor. Los TCE más graves o repetidos se asocian con mayor riesgo de trastornos neurodegenerativos a largo plazo, como la enfermedad de Alzheimer, la encefalopatía traumática crónica (ETC) y la enfermedad de Parkinson12.
El daño axonal difuso (DAD) está considerado el tipo de lesión cerebral difusa más frecuente que se observa en un TCE grave. Sin embargo, el DAD también puede desencadenar muchas de las consecuencias conductuales del TCE leve17 (v. el cuadro Fuerzas mecánicas que provocan daño axonal difuso).
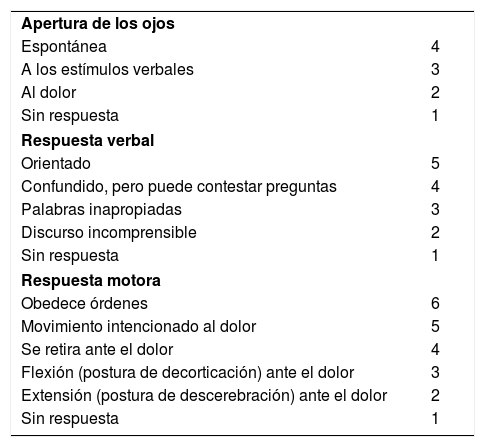
Diagnóstico de TCE leve: una cuestión de gravedadDespués de cualquier TCE sospechado o conocido, los síntomas y signos neurológicos iniciales se evalúan normalmente de acuerdo con las puntuaciones de la Escala de coma de Glasgow (GCS, Glasgow Coma Scale), considerado el método de referencia para la evaluación de la gravedad inicial del TCE. La puntuación de la GCS realizada en las 24 horas posteriores a la lesión y en serie ayuda a los profesionales clínicos a establecer el grado del TCE y a hacer el seguimiento de la mejora o el deterioro posterior (v. el cuadro Puntuación de la GCS).
Los pacientes reciben una puntuación total de la GCS que varía entre 3 y 15 según el grado de deterioro en tres campos (apertura de los ojos, respuesta verbal y respuesta motora) y las puntuaciones más bajas indican mayor deterioro. Las puntuaciones de 13 a 15 representan lesiones cerebrales leves compatibles con TCE leve. Las puntuaciones de 9 a 12 representan lesiones moderadas y las puntuaciones de 8 o menos representan un TCE grave15,18.
El American Congress of Rehabilitation Medicine fue el primero en establecer criterios de diagnóstico para el TCE leve y lo describió como una lesión traumática de la función cerebral que se manifestaba, al menos, por uno de los siguientes síntomas5:
- •
Pérdida de conciencia durante un período de tiempo.
- •
Pérdida de memoria por episodios que se producen inmediatamente antes o después de la lesión.
- •
Cualquier alteración del estado mental en el momento de la lesión, como desorientación o confusión.
- •
Déficits neurológicos focales, que pueden ser transitorios o no.
Para cumplir con los criterios del TCE leve, la mayoría de los expertos especifican pérdida de conciencia (si existe) que no dura más de 30 minutos, una puntuación de la GCS inicial de 13 a 15 y amnesia postraumática (u otros síntomas y signos neurológicos transitorios) que duran más de 24 horas1,18.
El TCE leve se puede clasificar como complicado (con evidencia radiográfica de lesión intracraneal) o sin complicaciones (sin evidencia radiográfica de lesión). Dicha diferenciación es importante porque ayuda a los médicos a establecer la necesidad de llevar a cabo más estudios de neuroimagen, proceder al ingreso hospitalario o realizar una intervención neuroquirúrgica15.
Según los datos actuales, los pacientes menores de 55 años con una puntuación en la GCS de ingreso de 15 que no toman ningún tipo de medicamento anticoagulante forman un grupo de bajo riesgo que podría considerarse de manera segura para no ingresar en la UCI con frecuentes pruebas neurológicas. Los pacientes que ingresan con una puntuación en la GCS inferior a 15 y los mayores de 55 años corren el riesgo de sufrir un deterioro neurológico importante y deben recibir tratamiento en la UCI19.
| Apertura de los ojos | |
| Espontánea | 4 |
| A los estímulos verbales | 3 |
| Al dolor | 2 |
| Sin respuesta | 1 |
| Respuesta verbal | |
| Orientado | 5 |
| Confundido, pero puede contestar preguntas | 4 |
| Palabras inapropiadas | 3 |
| Discurso incomprensible | 2 |
| Sin respuesta | 1 |
| Respuesta motora | |
| Obedece órdenes | 6 |
| Movimiento intencionado al dolor | 5 |
| Se retira ante el dolor | 4 |
| Flexión (postura de decorticación) ante el dolor | 3 |
| Extensión (postura de descerebración) ante el dolor | 2 |
| Sin respuesta | 1 |
Traumatismo craneoencefálico grave: puntuación de la GCS de 8 o menos.
Traumatismo craneoencefálico moderado: puntuación de la GCS de 9 a 12.
Traumatismo craneoencefálico leve: puntuación de la GCS de 13 a 15.Fuente: Centers for Disease Control and Prevention. Glasgow Coma Scale. www.cdc.gov/masstrauma/resources/gcs.pdf.
El TCE leve se describe a veces como un diagnóstico de exclusión porque los médicos deben descartar de forma sistemática otras causas potenciales de síntomas y signos. Además de completar un historial cuidadoso del episodio precipitante, los médicos deben registrar el curso y la naturaleza de síntomas y signos, realizar pruebas objetivas adecuadas para identificar explicaciones alternativas, como un trastorno médico o psiquiátrico existente previamente o coexistente20.
Posibles consecuencias a largo plazo de un TCE leveAunque la mejoría de los síntomas y signos del TCE leve suele producirse de manera muy rápida (por lo general, en unas 2 semanas, con una recuperación total esperada a los 90 días), entre el 10% y el 15% de los pacientes continúan sintomáticos durante mucho más tiempo18. Entre las consecuencias persistentes pueden citarse las siguientes:
•Síndrome posconmocional (SPC). El SPC se define como la persistencia de síntomas, como falta de concentración, mareos, cansancio, dolor de cabeza, trastornos del sueño, irritabilidad, ansiedad y estado de ánimo depresivo, que se prolongan más del período de recuperación normal de 90 días1,7. Hasta una tercera parte de los pacientes con TCE leve sufren SPC7. El ejercicio aeróbico suave por debajo del umbral de los síntomas puede acelerar la recuperación del SPC, incluso en aquellas personas que no practicaban ejercicio antes de la lesión14. Entre los pacientes que no se recuperan en 3 meses y sufren SPC se cuentan aquellos que sufrieron un mecanismo de lesión de gran impacto, pacientes con conmociones múltiples, los que presentan enfermedades neurológicas subyacentes y aquellos que no se recuperan con los tratamientos adecuados14.
- •
ETC. Pruebas convincentes sugieren que el TCE leve repetido puede estar asociado con cambios en el estado de ánimo, la cognición y la coordinación motora, que persisten durante meses o años, y pueden convertirse en ETC7. Este trastorno neurodegenerativo progresivo se asocia con síntomas neuropsiquiátricos a largo plazo, cambios de comportamiento y déficits cognitivos7,18,21. Un estudio realizado por Viano et al. mostró que, por término medio, en las conmociones cerebrales típicas relacionadas con el deporte, el cerebro se desplaza entre 4 y 8mm, lo que produce una fuerza de cizallamiento a las neuronas y los axones relacionados9.
- •
Síndrome de segundo impacto. Los pacientes pueden desarrollar un síndrome de segundo impacto cuando sufren un segundo impacto en la cabeza antes que los síntomas del primer impacto se hayan resuelto. Otra lesión durante este período podría ser mortal18,22. A los pocos minutos de un segundo impacto, puede producirse una hernia cerebral, seguida de coma y muerte. La morbilidad por síndrome de segundo impacto es del 100%; La mortalidad es del 50%23.
Los pacientes con TCE leve deben entender que el cerebro es muy vulnerable a nuevas lesiones durante la fase de recuperación, lo que se denomina ventana de vulnerabilidad. Incluso otro impacto en la cabeza subconcusivo en esta fase puede provocar complicaciones potencialmente letales, incluida la hiperemia cerebral debido a una alteración de la autorregulación vascular, edema cerebral y aumento de la presión intracraneal (PIC). Aunque no se conoce la incidencia exacta del síndrome de segundo impacto, médicos y pacientes deben reconocer el riesgo, y prevenirlo mediante un tiempo de recuperación adecuado después del TCE leve inicial23–25.
- •
Otros trastornos de salud. Los trastornos de salud recurrentes a largo plazo y asociados con el TCE leve son déficits neurocognitivos (atención, memoria, velocidad de procesamiento), trastorno de estrés postraumático, problemas de salud psicosocial, como consumo excesivo de alcohol, depresión mayor, deterioro del funcionamiento social y capacidad para trabajar, e ideas suicidas. También puede provocar epilepsia, dolor de cabeza y alteraciones de la personalidad o el comportamiento1,22.
La tomografía computarizada (TC) cerebral es la herramienta de diagnóstico estándar para evaluar la enfermedad intracraneal de pacientes con algún grado de TCE agudo. La incidencia de anomalías intracraneales en la TC asociada con el TCE leve varía entre el 0,7% y el 20%26,27. Un médico que está valorando la posibilidad de realizar una TC cerebral debe sopesar los pros y contras de forma individual: el uso excesivo de la TC aumenta la exposición a la radiación, pero si se es excesivamente conservador en su uso puede correrse el riesgo de no detectar lesiones potencialmente mortales28. La realización de TC cerebrales habituales en todos los pacientes con TCE leve requiere una gran cantidad de recursos y genera una exposición innecesaria a la radiación, dado el bajo porcentaje (se estima que el 1%) de pacientes con TCE leve que finalmente requieren intervención neuroquirúrgica29.
Se han elaborado varios grupos de criterios para ayudar a los médicos en la toma de decisiones adecuada sobre la TC en pacientes con TCE leve; por ejemplo, la Canadian CT Head Rule (CCHR), los New Orleans Criteria (NOC), los criterios de los Centers for Disease Conrtrol and Prevention (CDC) y los criterios Nexus II (National Emergency X-radiography Utilization Study).
El CCHR especifica siete factores clínicos que respaldan la decisión de realizar un escáner:
- •
Puntuaciones de la GCS inferiores a 15 2 horas después de la lesión.
- •
Presunta o conocida fractura con hundimiento del cráneo o abierta.
- •
Cualquier signo de fractura basal de cráneo.
- •
Vomitar 2 veces o más.
- •
Una edad de 65 años o superior.
- •
Amnesia retrógrada durante más de 30 minutos.
- •
Mecanismo peligroso de lesión, como colisión con vehículo motorizado, caídas o lesiones por explosiones27.
De acuerdo con los NOC, que se utilizan para pacientes con traumatismos craneales menores y una puntuación de la GCS de 15, los siguientes siete factores clínicos respaldan la decisión de realizar un escáner: dolor de cabeza, vómitos, convulsiones, intoxicación por alcohol o farmacológica, amnesia anterógrada persistente, edad superior a 60 años o lesión visible por encima de la clavícula6,27. La existencia de intoxicación se define clínicamente por dificultad para hablar, alcohol en la sangre o en el aliento, o nistagmo en presencia de otros indicadores de intoxicación por alcohol27.
Varios estudios han encontrado que el rendimiento general de la CCHR es superior a los NOC en pacientes con TCE leve27. De acuerdo con los criterios de los CDC, una TC de la cabeza sin contraste está indicada en pacientes con traumatismo craneal que sufren una pérdida de conciencia o amnesia postraumática si se presenta uno o más de uno de los siguientes síntomas: cefalea, vómitos, edad superior a 60 años, intoxicación por drogas o alcohol, déficits de memoria a corto plazo, evidencia física de traumatismo por encima de la clavícula, convulsión postraumática, puntuación de la GCS por debajo de 15, déficit neurológico focal o coagulopatía. Estos criterios se designan como principios generalmente aceptados para el tratamiento del paciente que reflejan un elevado grado de certeza clínica o recomendación de nivel A30.
Según los criterios Nexus II, la TC está indicada en pacientes con una importante fractura de cráneo que también presentan hematoma del cuero cabelludo, déficit neurológico, puntuación de la GCS de 14 o menos, comportamiento anormal, coagulopatía o vómitos continuos6.
El uso de imágenes cerebrales como marcador independiente de patología intracraneal en pacientes con traumatismos craneales cerrados generaría intervenciones innecesarias y un coste elevado para pacientes y hospitales. El coste de una TC cerebral sin contraste en un servicio de urgencias estadounidense varía entre 391 y 2.015 dólares29. Sin embargo, dada la ausencia de marcadores de diagnóstico específicos del TCE leve, la demanda de TC de cabeza es elevada. El suministro de escáneres de TC, aunque está ampliamente disponible en Estados Unidos, puede ser limitado en hospitales más pequeños, rurales y comarcales. La disponibilidad de estos escáneres desciende considerablemente en todo el mundo en países con recursos limitados y en áreas de guerra29.
Por desgracia, no se ha identificado ningún biomarcador único para el TCE, aunque se han propuesto múltiples biomarcadores en la bibliografía, que van desde marcadores de inflamación, como el factor de necrosis tumoral alfa y la interleucina 1 beta, hasta marcadores de activación de astrocitos, como los niveles B de unión al calcio S-100 (S-100B). Dada la complejidad de la respuesta intracraneal a la lesión, parece poco probable que un biomarcador individual sea lo suficientemente sólido para ser utilizado como prueba de diagnóstico clínico para establecer la existencia y la extensión de un TCE leve o cualquier grado de TCE. Sin embargo, un conjunto de biomarcadores basado en sangre, complementario y periférico, que conste de numerosos marcadores, puede indicar los pacientes con lesiones cerebrales estructurales que tienen mayor necesidad de tratamiento oportuno y avanzado29. Según las pautas de los CDC, se puede valorar no realizar una TC en pacientes con TCE leve que no presentan lesiones extracraneales importantes y un nivel sérico de S-100B inferior a 0,1μg/l, medido en las primeras 4 horas tras producirse la lesión30.
Valoración de enfermeríaEn la presentación y durante la fase aguda de cualquier TCE, la enfermera se centra en el mecanismo de la lesión y los antecedentes sanitarios existentes, así como en la evaluación de la permeabilidad de las vías respiratorias y la capacidad del paciente de proteger las vías respiratorias, el esfuerzo respiratorio, la efectividad y la circulación. La cabeza y el cuello deben estabilizarse si se sabe o se supone que existe lesión en la columna cervical.
Al registrar los antecedentes del paciente, la enfermera debe pedirle al paciente que describa el episodio y los detalles previos a este, y los que se han producido inmediatamente después. La respuesta puede ayudar a establecer el grado de amnesia, si existe. Los hallazgos se pueden registrar con una lista de comprobación de síntomas, como la Standardized Assessment of Concussion (SAC). Además de la amnesia y los síntomas y signos neurológicos, la SAC califica la fuerza, la sensibilidad y la coordinación de brazos y piernas. Se han elaborado herramientas de evaluación de la conmoción cerebral, como SCAT-3, para evaluar las lesiones de deportistas sobre el terreno6,31–34.
La enfermera también debe realizar una evaluación física completa para intentar diferenciar los TCE leves de las lesiones de otros sistemas orgánicos. Muchos de los síntomas y signos asociados con el TCE leve son inespecíficos, como dolor de cabeza, mareos y náuseas y vómitos, y pueden producirse sin que exista TCE leve u otro traumatismo, o pueden indicar una lesión diferente al TCE14,34.
La enfermera que realiza una evaluación neurológica de un paciente en quien se sospecha TCE leve debe registrar el nivel de conciencia, incluido el estado de alerta, la memoria a corto plazo y el recuerdo, la atención y la concentración, y la orientación respecto a sí mismo, la fecha, la hora, la ubicación y la situación6. El dolor de cabeza, los mareos, las anomalías de la visión, los vómitos y el desequilibrio son importantes indicaciones para alcanzar el diagnóstico.
También se debe proceder a una evaluación de los pares craneales, incluidos los movimientos extraoculares, la fuerza y la coordinación de las extremidades y la reactividad pupilar. La existencia de un déficit neurológico focal sugerirá la realización de más pruebas de diagnóstico, incluidas las imágenes cerebrales con TC cerebral sin contraste o, en algunos casos, neuroimagen multimodal, como la RM funcional14.
Las técnicas avanzadas de neuroimagen pueden mostrar redes neuronales y conectividad que subyacen al comportamiento y la cognición. Mediante la cartografía cerebral, estas técnicas avanzadas de neuroimagen pueden identificar anomalías que afectan a la conectividad funcional, lo que contribuye al desarrollo de un plan de atención individualizado para cada paciente8,14,35. La decisión de realizar un escáner, cuándo llevarlo a cabo y qué tipo de imagen diagnóstica se debe realizar depende del grado de las lesiones, los hallazgos de la evaluación neurológica y la estabilidad clínica general del paciente.
Plan de cuidados y educación del pacienteEnseñe a los pacientes y las familias que TCE leve y conmoción cerebral son términos que se utilizan indistintamente y que una conmoción cerebral es una lesión cerebral. Explíqueles que el TCE leve se define como un fenómeno autolimitado y que la recuperación se produce en los 3 meses posteriores al episodio causal en la mayoría de los pacientes que siguen todas las recomendaciones de tratamiento14,18,36.
Después del TCE leve, se indica descanso físico y cognitivo durante 3-5 días para favorecer la recuperación. Aunque es difícil, el descanso cognitivo consiste en evitar leer, enviar mensajes de texto, jugar a videojuegos y utilizar el ordenador. Explique a los pacientes con un trabajo escolar o académico que ajustar su horario diario puede ayudarles a regresar al horario académico previo a la lesión y a un nivel de actividad más rápido. Recomiéndeles que regresen gradualmente al trabajo o al colegio en lugar de intentar regresar inmediatamente a su nivel previo a la lesión. Si los síntomas empeoran con la actividad, recomiéndeles que disminuyan su actividad a un nivel donde los síntomas ya no aparezcan y esperen varios días antes de intentar aumentar la actividad14. El TCE leve es una lesión multifacética con complicaciones fisiopatológicas y neurológicas secundarias, potencialmente de larga duración, que afectan al comportamiento, las capacidades funcionales y la calidad de vida del paciente.
La progresión gradual desde una actividad física suave, como caminar o utilizar la bicicleta estática, hacia una actividad aeróbica más intensa, seguida de actividades de resistencia, fomentará la recuperación. Para los deportistas que han sufrido un TCE leve, la National Collegiate Athletic Association ha publicado un algoritmo del retorno gradual al entrenamiento deportivo específico después de una conmoción cerebral14.
Advierta a los pacientes sobre el peligro del síndrome de segundo impacto y recomiéndeles que eviten las actividades que podrían provocar un nuevo impacto en la cabeza, sobre todo durante el período de recuperación. Asegúrese de que entiendan que, aunque los cascos ayudan a protegerles de las lesiones en la cabeza y las fracturas de cráneo, no evitan las lesiones cerebrales provocadas por movimientos de latigazo cervical o rotatorios22.
Los tratamientos que se citan a continuación se aplican a síntomas y signos específicos comúnmente asociados con el TCE leve.
- •
Dolor de cabeza. El dolor de cabeza postraumático es un síntoma común del TCE leve; por tanto, enseñe a los pacientes y a sus familias cómo controlar el dolor de cabeza. El tratamiento temprano de la cefalea con una terapia efectiva prescrita por el médico es el tratamiento más importante de la cefalea postraumática. Este puede incluir analgésicos, como antiinflamatorios no esteroides (AINE). Sin embargo, advierta a los pacientes del uso excesivo de AINE y otros medicamentos de venta libre: aproximadamente, el 80% de los que se automedican en caso de dolor de cabeza postraumático no obtienen un alivio completo y pueden presentar un dolor de cabeza por un uso excesivo de medicamentos, también conocido como dolor de cabeza de rebote14. Recomiéndeles que comuniquen los dolores de cabeza intensos o persistentes al médico, que puede recetarles un analgésico alternativo o, en algunos casos, derivarlos a una unidad del dolor o a un especialista en dolor de cabeza14.
- •
Mareo. En el caso de aquellos pacientes que se quejan de mareos, las enfermeras deben establecer si estos están asociados con náuseas o con el movimiento. Aconséjeles que descansen durante 3-5 días y luego reanuden gradualmente la actividad física y cognitiva, y eviten actividades que puedan provocar otro traumatismo craneal durante el período de recuperación. Asegúreles que el mareo, por lo general, se resuelve espontáneamente con el tiempo. Los deportistas que se recuperan deben recibir pautas estrictas y específicas para reducir el riesgo de una nueva lesión14.
- •
Trastornos del sueño. Eduque a los pacientes que se quejan de trastornos del sueño con prácticas de higiene del sueño, como evitar los estimulantes y el alcohol, y restringir la exposición a la televisión o a cualquier tipo de pantallas iluminadas, como monitores de ordenador o teléfonos móviles, por lo menos, 1 hora antes de ir a dormir ya que la luz de estas pantallas puede inhibir la secreción de melatonina14,37. Aconseje que se acuesten a la misma hora todas las noches y que eviten las siestas durante el día. Hacer ejercicio suave aprobado por el médico, como caminar o utilizar la bicicleta estática antes de acostarse, puede ser beneficioso14.
Eduque a los pacientes sobre medicamentos, como la melatonina, que puedan prescribirse para controlar los trastornos del sueño. Adviértales de que la mayoría de los fármacos para dormir de venta libre contienen un antihistamínico (en general, difenhidramina) y no se recomiendan para las personas con TCE porque pueden provocar problemas de memoria y en nuevos aprendizajes14,38.
- •
Depresión. También frecuente después del TCE leve, la depresión puede estar relacionada con el episodio que causó la lesión, como un accidente automovilístico o una agresión, o el empeoramiento de una enfermedad depresiva existente antes de la lesión. Se ha notificado una incidencia de trastornos psicológicos, incluida la depresión, después del TCE leve desde tan baja como del 4% al 5% hasta tan alta como del 49% al 63%20. Una combinación de medicamentos, incluidos los inhibidores selectivos de la recaptación de serotonina, y la derivación a terapeutas adecuados pueden ser beneficiosas para los pacientes con depresión14.
- •
Problemas cognitivos, como olvido, distracción, pérdida de concentración y cansancio mental. Aconseje a los pacientes que eviten el alcohol durante la recuperación. La atención, la memoria, la resolución de problemas y los tiempos de reacción se ven afectados mientras alguien está bajo los efectos del alcohol. Los estudios han demostrado que algunas personas con SPC deben evitar la conducción hasta que los síntomas se resuelvan39. Si bien estos problemas deberían mejorar con el tiempo y el tratamiento adecuado, la derivación a un neuropsicólogo o a un programa de terapia cognitiva puede estar indicada si los síntomas persisten14.
- •
Disfunción sexual. Además de los problemas fisiológicos específicos, la disfunción sexual también abarca problemas de comportamiento, como impulsividad y comportamiento inadecuado, dificultades sexuales globales y emocionales, cambios en la libido y la frecuencia sexual17. Puesto que la lesión y el período de recuperación probablemente interrumpirán la vida personal y familiar del paciente, se debe elaborar un plan holístico y de colaboración para abordar todas las inquietudes y problemas14.
El TCE leve es una lesión multifacética con complicaciones fisiopatológicas y neurológicas secundarias, potencialmente de larga duración, que afectan al comportamiento, las capacidades funcionales y la calidad de vida del paciente. La investigación continua sobre todos los grados de TCE, incluido el TCE leve, tanto en la población civil como en la militar, brindará nuevos conocimientos que podrían derivar en mejores herramientas de diagnóstico y tratamientos, así como mejoras en la protección de la cabeza, automóviles más seguros e, incluso, entornos deportivos más seguros. Los pacientes y las familias pueden beneficiarse de la derivación a los terapeutas y programas posteriores al alta adecuados para favorecer la máxima recuperación y mejorar los resultados a largo plazo de esta población vulnerable. ■
Vincent M. Vacca, Jr., es profesor adjunto en el Massachusetts College of Pharmacy and Health Sciences University en Boston, Massachusetts.
Vincent Vacca ha revelado que se encuentra en el grupo de conferenciantes de Codman Neurosciences. Este artículo ha sido revisado y se han resuelto todos los conflictos potenciales o reales.