El ESÓFAGO DE BARRETT es una complicación de la enfermedad crónica por reflujo gastroesofágico (ERGE). Las estimaciones de la prevalencia del esófago de Barrett varían ampliamente entre el 0,4% y más del 20% de la población adulta en general, según las definiciones utilizadas y las poblaciones analizadas; los expertos no están seguros de su incidencia en todo el mundo1,2. En Estados Unidos, la aplicación de estimaciones de prevalencia general daría como resultado, aproximadamente, 3,3 millones de individuos con esófago de Barrett3.
Alrededor del 10% de los pacientes con reflujo crónico presentan esófago de Barrett4,5. No está claro por qué algunos pacientes con ERGE desarrollan esófago de Barrett mientras que otros no lo hacen6.
El esófago de Barrett se asocia con mayor riesgo de adenocarcinoma esofágico7,8 (v. el cuadro Determinar el riesgo de cáncer). La incidencia de este cáncer, que antes era poco frecuente, ha aumentado más del 500% desde la década de 1970. El cáncer continúa siendo muy letal, con una tasa de supervivencia a los 5 años de menos del 15%9,10.
La ablación por radiofrecuencia (ARF), un procedimiento mínimamente invasivo, se está afianzando como método de elección para tratar el esófago de Barrett entre los especialistas gastrointestinales. En este artículo se define el esófago de Barrett, se analiza la ARF y otras opciones de tratamiento, y se presentan los cuidados de enfermería para pacientes en tratamiento por este trastorno.
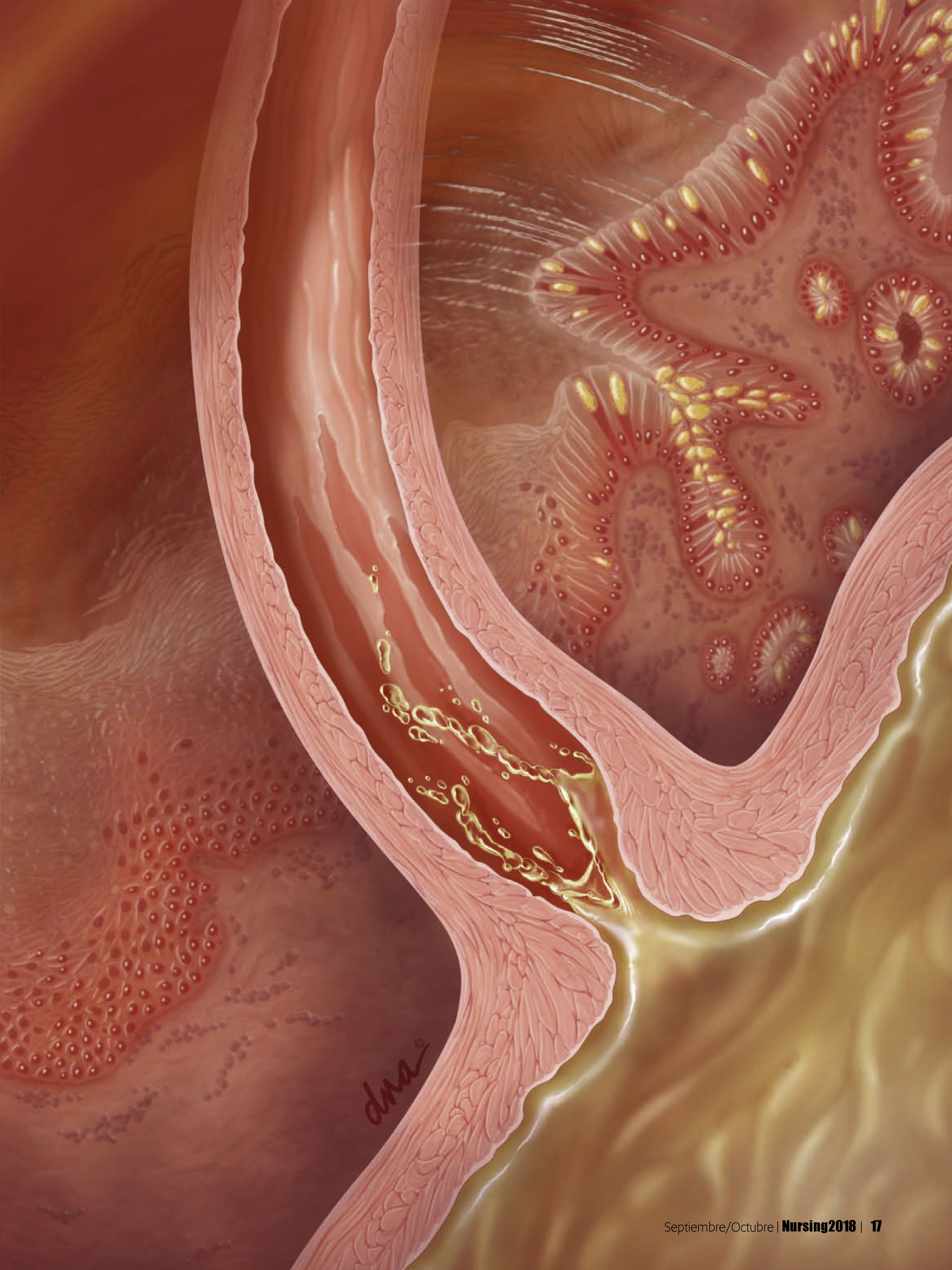
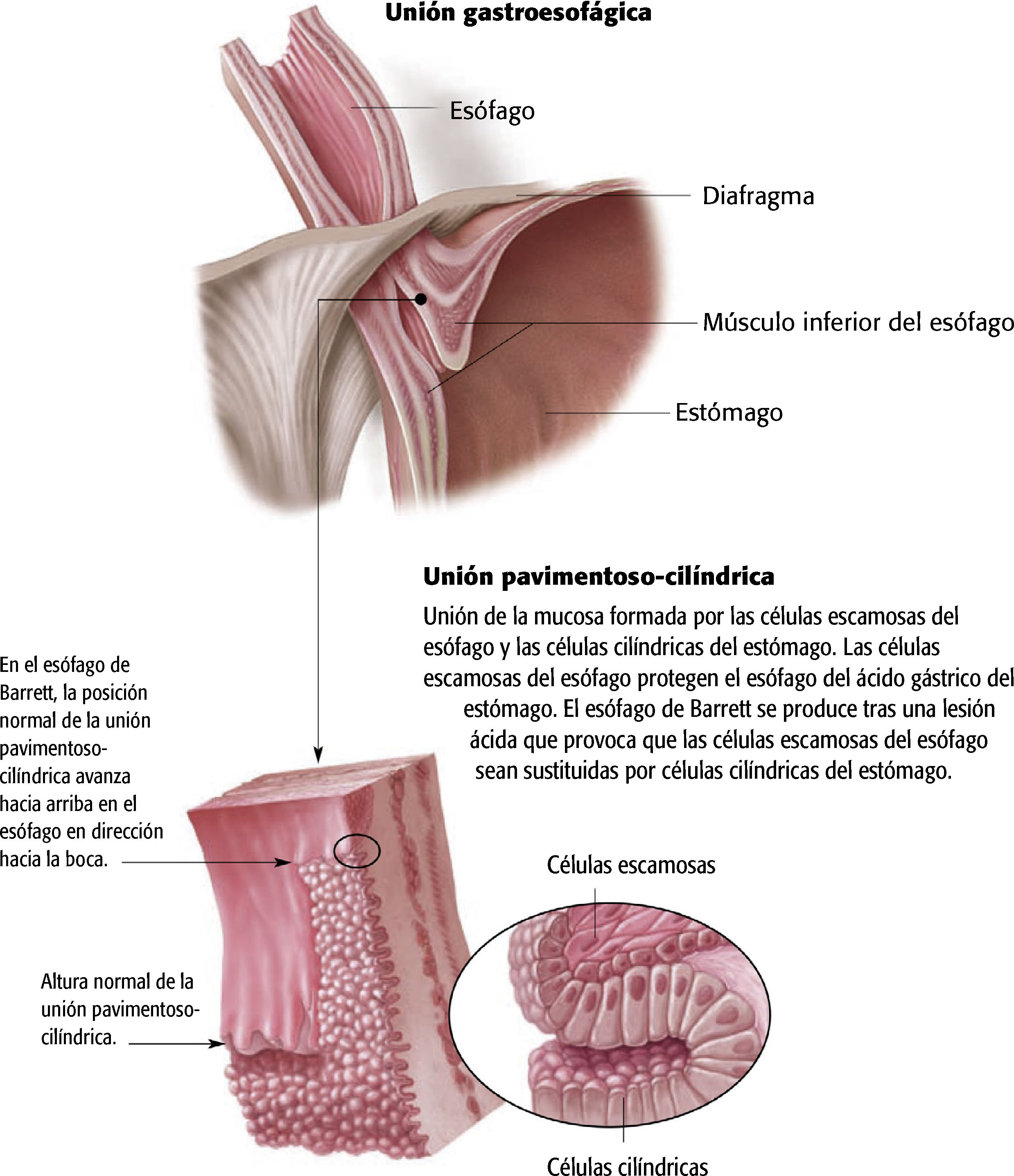
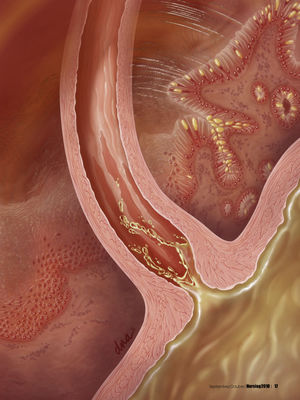
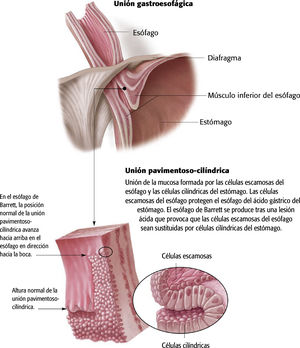
FisiopatologíaEl esófago de Barrett es una enfermedad precancerosa, en la cual el epitelio cilíndrico metaplásico que predispone a un paciente a desarrollar cáncer sustituye al epitelio pavimentoso estratificado que normalmente tapiza el esófago distal4,7,11. Este trastorno se origina a partir de una metaplasia, un proceso por el cual un tipo de célula completamente diferenciada ocupa el lugar de otra4.
El esófago de Barrett puede seguir el siguiente curso: epitelio de Barrett no displásico, displasia leve, displasia grave y adenocarcinoma7. El primer diagnóstico de los pacientes puede establecerse en cualquiera de estas etapas.
Se cree que la patogénesis del esófago de Barrett comienza con el reflujo gastroesofágico de ácido y bilis, que daña las células escamosas del esófago. La metaplasia puede desarrollarse como respuesta a la inflamación crónica. En la ERGE con esofagitis crónica por reflujo, las células escamosas del esófago dañadas se reemplazan por células cilíndricas2 (v. el cuadro Anatomía y fisiopatología normales del esófago de Barrett).
Características clínicas y diagnósticoEl esófago de Barrett a menudo se descubre en adultos de mediana edad y mayores durante las exploraciones endoscópicas. La media de edad en el momento del diagnóstico es 55 años2,12,13.
Se sospecha de la existencia de esófago de Barrett cuando una esofagogastroduodenoscopia revela mucosa cilíndrica en el esófago. Se pueden tomar piezas de biopsia con la finalidad de confirmar el diagnóstico4.
El esófago de Barrett se puede delimitar más como con segmento corto (<3cm) o con segmento largo (≥3cm) dependiendo de la distancia entre la unión gastroesofágica y la extensión más proximal de la metaplasia de Barrett4,13. El riesgo de adenocarcinoma varía en función de la longitud del esófago recubierto por la metaplasia de Barrett, aunque los pacientes con un esófago de Barrett con segmento largo corren mayor riesgo de malignidad4.
En la actualidad, los criterios de diagnóstico exigen una esofagogastroduodenoscopia para diagnosticar esófago de Barrett2. Las pruebas del endoscopista deben incluir el epitelio cilíndrico que recubre el esófago distal. Además, un examen histológico de piezas de biopsia del epitelio cilíndrico debe confirmar la evidencia de metaplasia intestinal2.
Últimamente, uno de los temas más discutibles de los criterios de diagnóstico del esófago de Barrett es la célula caliciforme, que generalmente reside en los intestinos. Aunque antes se pensaba que principalmente secretaban mucosidad, ahora se sugiere que las células caliciformes desempeñan un papel en el mantenimiento de la tolerancia inmunitaria a bacterias comensales y alimentos. Independientemente de su función, las células caliciformes poseen características morfológicas específicas, por las cuales son fácilmente identificables en piezas de biopsia. Por tanto, la célula caliciforme es un marcador de metaplasia intestinal cuando se identifica en muestras del estómago o el esófago14.
La mayoría de los pacientes diagnosticados de esófago de Barrett no desarrollan cáncer de esófago: la posibilidad de progresión a adenocarcinoma de esófago es de solo el 0,5% por año en pacientes sin displasia en biopsias de evaluación inicial. Si la enfermedad progresa a adenocarcinoma, el riesgo de metástasis a los ganglios linfáticos es del 1% al 2% cuando el adenocarcinoma se limita a la mucosa esofágica15.
Independientemente de la etapa de la enfermedad en el momento del diagnóstico, los pacientes necesitan vigilancia de por vida, incluida la detección con biopsias esofágicas a intervalos regulares. Las recomendaciones dependen de la existencia de displasia en estas muestras13.
1Tratamiento de ablación endoscópicaEl tratamiento de ablación endoscópica utiliza energía térmica, fotoquímica o de radiofrecuencia para extirpar el epitelio anómalo en el esófago de Barrett. La modalidad utilizada con más frecuencia es la ARF. Sin embargo, los métodos sin contacto (como la terapia fotodinámica o la crioablación) pueden ser necesarios de vez en cuando en pacientes con esófago tortuoso o estenosis esofágica13.
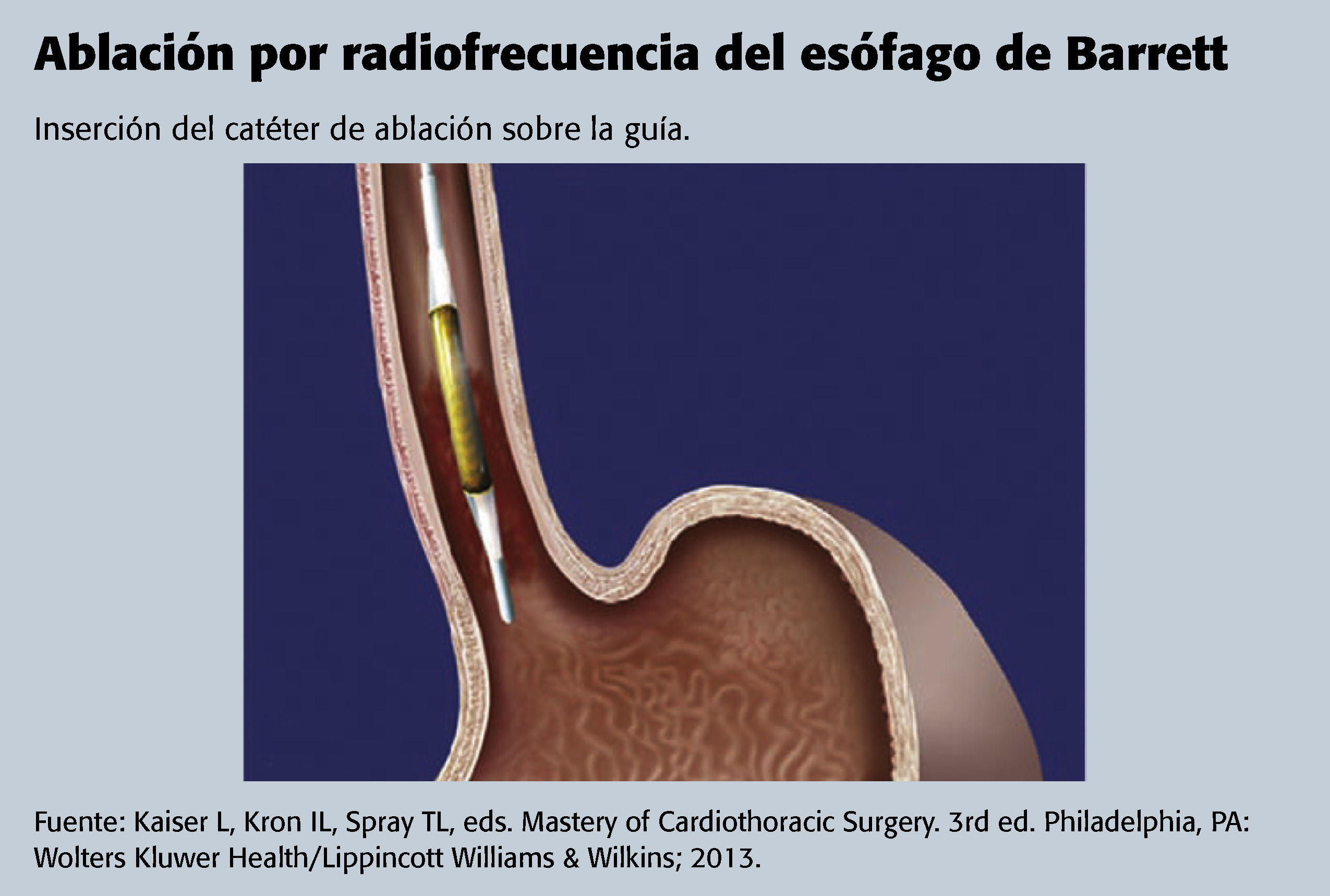
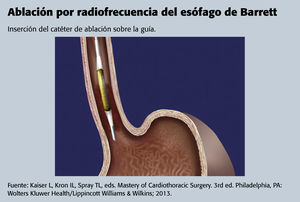
Por lo general, la ARF se lleva a cabo de forma ambulatoria, pues es un procedimiento mínimamente invasivo, aprobado por la Food and Drug Administration (FDA), que se utiliza para extirpar o extraer la capa superficial del esófago en el lugar donde se encuentran los tejidos cilíndricos metaplásicos del esófago de Barrett. La ARF generalmente se recomienda en la displasia grave y también se puede valorar su utilización para tratar la displasia leve14. Se genera necrosis por coagulación local mediante un circuito eléctrico y mandando diferentes corrientes de radiofrecuencia a los tejidos seleccionados16.
Los estudios han respaldado la eficacia, la durabilidad y la seguridad de la ARF en el tratamiento del esófago de Barrett11. Por ejemplo, la evidencia extrapolada del ensayo Ablation of Intestinal Metaplasia Containing Dysplasia (AIM) reveló que la ARF eliminaba la displasia leve en el 90% de los pacientes y la displasia grave en el 81% de los pacientes6,17. Del mismo modo, los investigadores del Academic Medical Center de Ámsterdam comunicaron resultados positivos de un ensayo aleatorio controlado que condujo a la finalización anticipada del estudio6.
En la mucosectomía endoscópica, el tejido de Barrett anómalo se levanta primero mediante la inyección de un líquido, como solución de cloruro sódico al 0,9% o epinefrina diluida, en el tejido submucoso y luego se elimina por succión a través del endoscopio. En el caso de anomalías de la mucosa, como nodularidad (áreas elevadas de tejido contiguo o en el esófago de Barrett), la mucosectomía endoscópica de estas anomalías debe realizarse antes de la ARF18.
En un pequeño grupo de pacientes con displasia grave (menos del 2%), existe la posibilidad de cáncer en los ganglios linfáticos cercanos o contiguos al esófago, que la ARF no puede curar19. El único tratamiento efectivo es la esofagectomía, que elimina el epitelio neoplásico, así como los ganglios linfáticos regionales y la malignidad oculta13.
La displasia grave en el esófago de Barrett se asocia con el 6% de riesgo anual de cáncer de esófago, por lo que la intervención está justificada en estos pacientes4. La American Gastroenterological Association y la American Society for Gastrointestinal Endoscopy recomiendan actualmente el tratamiento de erradicación endoscópica, que consiste en una combinación de resección endoscópica y modalidades ablativas en pacientes con displasia grave confirmada en lugar de mera vigilancia4.
La ARF es una opción de tratamiento de primera línea para aquellos pacientes con displasia grave después que se hayan eliminado las anomalías de la mucosa mediante mucosectomía endoscópica, así como también en pacientes con posresección temprana del cáncer6. El tratamiento de erradicación endoscópica con ARF es muy beneficiosa para aquellos pacientes con displasia grave para reducir el riesgo de progresión a cáncer4. Se están llevando a cabo estudios para analizar los factores predisponentes a la respuesta a las técnicas ablativas y para establecer el intervalo óptimo de vigilancia después de la aplicación de técnicas ablativas6.
Repercusiones en enfermeríaLa ARF generalmente se realiza de forma ambulatoria con el paciente sedado/con analgesia moderada. Las enfermeras deben estar bien informadas sobre la ARF para educar a los pacientes y sus familias, optimizar los resultados de los pacientes y mantener un entorno seguro y cómodo para los pacientes. Las consideraciones de enfermería abarcan la atención antes, durante y después del procedimiento.
• Antes del procedimiento. Un equipo multidisciplinario, que incluye gastroenterólogos, enfermeras, anatomopatólogos, cirujanos y anestesiólogos, trabaja en colaboración para optimizar los resultados de los pacientes. Los objetivos específicos del tratamiento y los posibles resultados deben comentarse antes del procedimiento con los pacientes y las familias como parte del proceso de consentimiento informado16.
La educación al paciente es parte integrante del procedimiento de ARF. Las enfermeras a menudo ofrecen la educación previa al procedimiento en el centro de salud. Una evaluación integral incluye consultas sobre trastornos como artritis, dolor de espalda, dolores de cabeza y otras afecciones frecuentemente tratadas con antiinflamatorios no esteroideos (AINE), que están contraindicados durante los 7 días posteriores al procedimiento.
El consentimiento informado incluye informar al paciente sobre posibles complicaciones, como perforación, hemorragia y aspiración; también se menciona la posibilidad de sufrir estenosis esofágica, recurrencia del esófago de Barrett y el hecho de que la ARF puede disminuir, pero no eliminar, el riesgo de cáncer en el futuro. Materiales adicionales, como enlaces a sitios web útiles y folletos impresos, pueden ayudar a disminuir la ansiedad del paciente y corregir conceptos erróneos sobre la ARF. Se debe aconsejar a los pacientes que se organicen para que un acompañante los lleve a casa después del procedimiento.
Se solicitarán pruebas analíticas antes de la ARF, entre las cuales se hallarán un hemograma completo y el perfil de coagulación5,16. Se deben informar al médico de los valores anómalos. Debe evaluarse cuidadosamente a los pacientes que toman antiagregantes plaquetarios o anticoagulantes, como ácido acetilsalicílico, clopidogrel, heparina y sus análogos, warfarina y anticoagulantes orales directos, como dabigatran, para establecer los riesgos de hemorragia. Entre las contraindicaciones del procedimiento se encuentran coagulopatía incorregible e infecciones no controladas16.
Se debe evaluar por separado a los pacientes con tratamientos antiplaquetarios o anticoagulantes para establecer si se continuará con los medicamentos antes del procedimiento. El momento de suspender los anticoagulantes es personal según la medicación y el trastorno específico que requiera anticoagulación. El gastroenterólogo que trata al paciente con el asesoramiento de cardiología establecerá la programación de la interrupción y la reinstauración de la anticoagulación.
Las pautas de anestesia y sedación/analgesia son específicas del servicio. Las enfermeras deben comprobar que se lleva dieta absoluta y determinar hasta qué momento se pueden tomar líquidos. Algunos centros permiten beber líquido hasta 2 horas antes del procedimiento, mientras que otros recomiendan que los pacientes no tomen nada después de la medianoche5,16.
Debe establecerse el acceso venoso y la enfermera debe anticipar la administración de líquidos y medicación por vía intravenosa según lo previsto. Entre los medicamentos que se utilizan con frecuencia en el procedimiento se encuentran midazolam i.v. (una benzodiazepina) y fentanilo i.v. (un opioide)5. El propofol, generalmente administrado por un anestesiólogo o una enfermera anestesista, a menudo se utiliza para la sedación. El glicopirrolato, un anticolinérgico de acción prolongada, usualmente se administra para reducir las secreciones.
Las secreciones orales pueden ser abundantes durante el procedimiento, por lo que los pacientes necesitarán succión frecuente para evitar la aspiración. El oxígeno suplementario y el equipo de succión deben prepararse para que estén disponibles para su uso inmediato. El personal debe estar preparado para mantener la monitorización continua de la frecuencia cardíaca, la presión arterial, la frecuencia respiratoria y la saturación de oxígeno, que deben registrarse, al menos, cada 5 minutos. La capnografía puede utilizarse para detectar rápidamente las reacciones adversas relacionadas con la sedación del procedimiento20.
• Durante el procedimiento. Durante la ARF, se colocará al paciente en posición de decúbito lateral izquierdo. En cuanto a otros procedimientos esofagogastroduodenales, las enfermeras son responsables de mantener la anestesia mediante el manejo de las vías respiratorias y el control de la sedación/analgesia.
Al inicio de la ablación y posteriormente, la enfermera registra la medición de la parte superior del tejido de Barrett que se observa, medido desde los dientes incisivos del paciente, así como la ubicación de la unión esofagogástrica, definida por la parte superior de los pliegues gástricos. El endoscopista pasa estas mediciones a la enfermera durante la parte inicial de la técnica ablativa. Esta información se registra y se conserva en el servicio de endoscopia y en la historia clínica del paciente para consultas futuras ya que a menudo son necesarios varios tratamientos para extirpar todo el tejido enfermo y el paciente puede necesitar tratamiento en más de un centro.
Puesto que el perímetro del esófago es variable entre pacientes y no es uniforme en toda su longitud, se lleva a cabo un cálculo del tamaño después de la observación y medición del tejido de Barrett. Se pasa un catéter de calibrado y un dispositivo con globo al esófago del paciente y luego se conecta al generador de energía. El globo de calibrado se pasa milímetro a milímetro al esófago y se infla a cada milímetro. El generador de energía mide el perímetro del esófago a cada milímetro y el tamaño del globo recomendado en cada milímetro21.
El registro de los datos obtenidos durante la fase de dimensionamiento es una importante función de enfermería. De acuerdo con estos datos, el intervencionista elige el tamaño de globo adecuado para realizar la ablación21.
Después de este paso, se reintroduce el endoscopio y se irriga el tejido de Barrett con N-acetilcisteína para reducir la cantidad de mucosidad que recubre el esófago. El catéter de ablación se introduce junto al endoscopio en el esófago. Se repite la ablación hasta que se haya tratado todo el tejido de Barrett21.
En los tratamientos posteriores, el paso de calibrado se repite solo si el paciente todavía presenta epitelio de Barrett periférico residual. Si solo quedan restos de distribución irregular, se utiliza un catéter de ablación focal a través del endoscopio para “retocar” el tejido de Barrett al cual la ablación inicial no accedió porque el esófago no es un cilindro perfecto. Es esencial llevar un registro meticuloso: el tamaño del globo, la cantidad total de centímetros eliminados, la configuración de la máquina y la dosis de energía (julios) deben registrarse con precisión21.
El fabricante del globo periférico ha introducido un dispositivo actualizado que elimina por completo la necesidad del proceso de calibrado. En el nuevo dispositivo, el electrodo de radiofrecuencia rodea el globo de calibrado. El globo se infla a una presión óptima programada previamente y luego se aplica la energía a través del generador. Este dispositivo más nuevo requiere una actualización del software del generador. No todos los centros han actualizado el software, ya que esto requiere una inversión adicional. Sin embargo, se espera la adopción universal de este nuevo catéter de ARF con globo22.
• Después del procedimiento. Entre los efectos adversos relacionados con la ARF pueden citarse estenosis esofágicas, hemorragia esofagogastroduodenal y dolor torácico, pero en general se considera un procedimiento de bajo riesgo18. La enfermera debe controlar las constantes vitales, evaluar los síntomas y signos de hemorragia, mantener la hidratación por vía intravenosa durante 30-60 minutos y realizar una evaluación del dolor.
Por lo general, no son necesarios los analgésicos después del procedimiento. Si la enfermera piensa que los analgésicos pueden estar indicados, el endoscopista debe evaluar al paciente antes de administrar cualquier medicamento. Los pacientes pueden recibir una solución de enjuague bucal, que consiste en lidocaína viscosa, hidróxido de aluminio y difenhidramina, para aliviar el dolor de garganta5.
Se espera que los pacientes permanezcan en la unidad de cuidados postanestésicos aproximadamente durante 1 hora.
Instrucciones cuando se recibe el altaLos pacientes y otras personas allegadas deben recibir instrucciones específicas sobre el tratamiento posthospitalario. Por ejemplo, se debe instruir a los pacientes, familiares o cuidadores para que se pongan en contacto con su médico de inmediato para comunicar si existe dolor torácico, dificultad al tragar, dolor abdominal, fiebre, hemorragia, dificultad al respirar o vómitos23. Informe a los pacientes de que es de esperar que sientan dolor o tengan alguna dificultad al tragar durante la recuperación.
Eduque a los pacientes respecto a los medicamentos que les han recetado, entre los cuales se encuentran:
- •
Paracetamol líquido oral con codeína, hidrocodona u oxicodona, o sin ella durante 7 días si precisa.
- •
Suspensión oral de sucralfato cuatro veces al día durante 1-2 semanas. El sucralfato se adhiere al tejido esofágico lesionado por la ablación y lo protege del reflujo ácido cuando cicatriza18.
- •
Un inhibidor de la bomba de protones (IBP), como omeprazol o esomeprazol, para facilitar la cicatrización de la mucosa lesionada y regenerar el epitelio pavimentoso. Los pacientes generalmente tomarán un IBP dos veces al día durante 8 semanas y luego una vez al día como tratamiento de mantenimiento18. Indique a los pacientes que tomen el IBP antes de comer y completen el tratamiento completo incluso si se alivian los síntomas10,11.
Los pacientes pueden experimentar fiebre baja durante los primeros días después del procedimiento. Indíqueles que se tomen la temperatura tres veces al día y que comuniquen si tienen fiebre superior a 38,3°C16.
Habitualmente, los pacientes reciben instrucciones de no tomar AINE, incluido ácido acetilsalicílico, durante 7 días. En general, otros anticoagulantes se mantienen hasta la mañana siguiente al procedimiento.
Por regla general, el intervencionista determina cuándo puede reanudar el paciente su dieta después del procedimiento. Normalmente, los pacientes reciben instrucciones de tomar únicamente líquidos fríos o a temperatura ambiente, no calientes y nunca con gas, durante 24 horas y luego toman gradualmente una dieta blanda, si la toleran, durante 1 semana, para pasar finalmente a una dieta normal18.
La mayoría de los pacientes puede reanudar su nivel normal de actividad al cabo de 24 horas. Adviértales de que no conduzcan ni participen en otras actividades que requieran mantenerse alerta durante las 24 horas posteriores al procedimiento. Según lo indicado, deles cita para que acudan al seguimiento una semana después del procedimiento.
Cuidado continuoLos pacientes con esófago de Barrett necesitan vigilancia y tratamiento de por vida23,24. Las enfermeras que cuidan a estos pacientes deben ofrecerles apoyo y educarlos sobre el tratamiento de su enfermedad9,10. Ello incluye instruirlos sobre la importancia de los controles endoscópicos regulares y el seguimiento indicado por el especialista y el médico de atención primaria, en función del grado inicial de displasia18. La gestión de la nutrición y el estilo de vida, que incluyen dejar de fumar y controlar el peso, también son una parte fundamental del plan de enseñanza12.
En la actualidad, el cáncer de esófago es el octavo cáncer más frecuente en todo el mundo y se considera agresivo con una tasa de supervivencia baja. En el presente afecta a más de 450.000 personas en todo el mundo3,4,25. En comparación con otros cánceres, el cáncer de esófago es relativamente infrecuente. Es la undécima causa principal de muerte por cáncer en Estados Unidos10.
La mayoría de los cánceres de esófago son de células escamosas o adenocarcinomas. El esófago de Barrett puede ser un precursor del adenocarcinoma esofágico y comparte muchos de los factores de riesgo4. Aunque la incidencia del carcinoma de células escamosas del esófago está disminuyendo en Estados Unidos, la incidencia del adenocarcinoma que surge a partir del esófago de Barrett ha aumentado considerablemente desde los años setenta del siglo pasado10,25.
Para reducir las posibilidades de reflujo, a los pacientes se les debe enseñar a comer platos más pequeños y con mayor frecuencia para prevenir la distensión gástrica, y a evitar las comidas y bebidas ácidas, como cítricos, productos del tomate, café y alimentos picantes, porque estos alimentos y bebidas pueden irritar la mucosa esofágica. También se deben evitar los alimentos grasos, el alcohol, la menta y el chocolate ya que pueden relajar el esfínter esofágico inferior o retrasar el vaciado gástrico12,23.
Enseñe a los pacientes a mantener una posición erguida durante 2-3 horas después de comer y a dormir con la cabecera de la cama elevada entre 15 cm y 25 cm12. Si el paciente solicita atención sanitaria por un problema digestivo a cualquier otro médico durante los 6 meses posteriores a la ARF, debe informar al médico de este procedimiento porque el esófago aún no ha cicatrizado y se debe intentar evitar lesiones.
Por último, lleve a cabo la conciliación de medicamentos con regularidad y refuerce la importancia de cumplir con el tratamiento prescrito.
El tratamiento dura toda la vidaPuesto que el esófago de Barrett es un trastorno de por vida, los pacientes necesitan un tratamiento adecuado y un control continuo. Las enfermeras que cuidan a estos pacientes deben trasladar la evidencia a la práctica para mejorar la seguridad del paciente y mejorar los resultados. Para obtener más información, visite www.cc.nih.gov/drd/rfa. ■
Diane McDevitt es profesora titular de Enfermería en el Kingsborough Community College de Brooklyn, NY, y subdirectora de Enfermería del Richmond University Medical Center en Staten Island, NY. Médico especialista certificado en Medicina Interna y Gastroenterología, Albert Mason es asesor en gastroenterología y hepatología en el St. Rose Siena Hospital de Henderson, Nevada.
Los autores y los planificadores declaran no tener ningún conflicto de intereses potencial, económico o de otro tipo.