EL TRASPLANTE RENAL en Estados Unidos cuesta 4500 millones de dólares cada año1,2. El mantenimiento del funcionamiento del aloinjerto renal requiere inmunosupresión de los receptores del trasplante, lo que los hace más propensos a infecciones frecuentes y oportunistas, en especial durante el primer año después del trasplante3. Cuando se producen infecciones, muchos pacientes presentan síntomas subclínicos, como febrícula (o sin fiebre), síntomas constitucionales mínimos y posiblemente pruebas de laboratorio negativas4. Por esta razón, si se sospecha alguna infección, los pacientes deben ser tratados hasta que se descarte la infección con un alto grado de certeza4.
Este artículo describe cómo la prevención de infecciones ayuda a reducir la disfunción del aloinjerto renal y los costes médicos adicionales. Repase las estrategias de prevención descritas en este artículo, entre las cuales se describen la profilaxis antimicrobiana y el control ambiental.
Dimensión del problemaEl trasplante renal es cada vez más frecuente en Estados Unidos debido al envejecimiento de la población y al creciente número de pacientes con diabetes mellitus e hipertensión, las dos principales causas de insuficiencia renal1. En 2013 se realizaron 17 600 trasplantes renales en Estados Unidos, incluyendo los procedimientos que implican el trasplante de órganos adicionales1. En diciembre de 2013, otros 86 965 pacientes estaban en lista de espera para recibir un trasplante de riñón1.
Según la información más reciente del U.S. Renal Data System, se esperaba que la mortalidad por infección confirmada en pacientes trasplantados de riñón fuera de 2,0 por 1000 por años de trasplante. Esto significa, por ejemplo, que de 1000 pacientes que han recibido un trasplante hace 1 año o de 500 pacientes que han tenido un trasplante hace 2 años, y así sucesivamente, dos de ellos presentarán una infección confirmada. El mismo informe menciona una mortalidad de 18,2 por 1000 por años de trasplante por causas desconocidas o no establecidas1.
No solo la inmunosupresión a largo plazo oculta síntomas y signos clínicos de infección, como la fiebre, sino que la disminución en la respuesta de los anticuerpos, incrementada en el paciente inmunosuprimido, también disminuye la fiabilidad de las pruebas serológicas4. A la luz de esta información, es probable que la tasa real de fracaso de aloinjertos renales y la mortalidad de estos pacientes sean considerablemente mayores de lo que sugieren las estadísticas actuales.
En los receptores de trasplante, incluso las infecciones subclínicas con organismos como el citomegalovirus (CMV) y el virus de Epstein-Barr (EBV) pueden provocar una reducción marcada de la función del aloinjerto renal, pero debido a la presentación subclínica quizá no lleguen a ser clasificadas como infecciones4. Estos mismos factores reducen la probabilidad de un diagnóstico y un tratamiento a tiempo3.
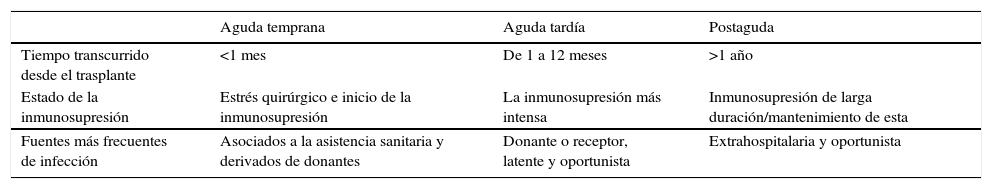
El riesgo de infección no solo depende del estado de inmunosupresión, sino del momento de la exposición. Inmediatamente después de la intervención quirúrgica, los pacientes inmunosuprimidos no pueden inactivar los patógenos exógenos introducidos. Durante el periodo de inmunosupresión más intensa, las infecciones latentes desarrolladas previamente por el sistema inmunitario del paciente pueden reactivarse. En la inmunosupresión a largo plazo, el paciente es vulnerable a patógenos en el medio ambiente.
| Aguda temprana | Aguda tardía | Postaguda | |
|---|---|---|---|
| Tiempo transcurrido desde el trasplante | <1 mes | De 1 a 12 meses | >1 año |
| Estado de la inmunosupresión | Estrés quirúrgico e inicio de la inmunosupresión | La inmunosupresión más intensa | Inmunosupresión de larga duración/mantenimiento de esta |
| Fuentes más frecuentes de infección | Asociados a la asistencia sanitaria y derivados de donantes | Donante o receptor, latente y oportunista | Extrahospitalaria y oportunista |
En los pacientes que requieren inmunosupresión, el riesgo de infección es mayor durante el primer año tras el trasplante debido a las grandes dosis de fármacos inmunosupresores utilizados para prevenir el rechazo al aloinjerto renal5. El efecto acumulativo de múltiples factores en estos primeros meses provoca un estado general de inmunosupresión en los receptores de trasplante3. Algunos de estos factores son:
- •
Factores no modificables, como la edad y la predisposición genética. El trasplante a edades más tempranas se ha asociado con mayores tasas de infección postransplante6.
- •
Comorbilidades, como trastornos metabólicos o autoinmunes. Por ejemplo, la diabetes mellitus puede continuar después del trasplante o puede desarrollarse después del trasplante y aumentar el riesgo de infección debido a la disminución de la respuesta inmunitaria, relacionada con la hiperglucemia6,7.
- •
Dispositivos médicos invasivos y sondas, como sondas urinarias permanentes, drenajes quirúrgicos y dispositivos de acceso venoso central. Estos dispositivos aumentan el riesgo de infecciones con estafilococos y cándidas3,8–10.
- •
Tratamiento inmunosupresor. La duración, el efecto acumulativo, la dosificación y el tipo de terapia utilizada, como anticuerpos biológicos, inhibidores de la calcineurina, glucocorticoides y fármacos antiproliferativos o antimetabolitos, pueden afectar al estado clínico del paciente y aumentar el riesgo de infección3.
Debido a la interacción de múltiples factores, especialmente las estrategias de dosificación predominantes de las terapias inmunosupresoras, el marco temporal del riesgo de infección entre los receptores de trasplante se puede dividir en tres fases postoperatorias (v. el cuadro Riesgos, fase a fase).
En la fase aguda temprana, los pacientes corren el mayor riesgo de infecciones relacionadas con la asistencia sanitaria, generalmente de tipo bacteriano6. La inmunosupresión es más intensa en la fase aguda tardía, cuando los mayores riesgos se deben a la exposición de los receptores o donantes a los virus antes del trasplante y a las infecciones oportunistas. Durante la fase posaguda, la inmunosupresión no suele ser tan intensa, a menos que se produzca un problema con un posible rechazo al aloinjerto renal. La mayor variación en la susceptibilidad se produce durante esta fase3,4,6,11.
Profilaxis antiinfecciosaA causa de la creciente prevalencia de organismos resistentes a los fármacos y a la dificultad del diagnóstico precoz de infección en pacientes inmunosuprimidos, la prevención de infecciones es el mejor enfoque. Un enfoque multifacético de la prevención de infecciones consiste en la detección eficaz de candidatos y donantes de trasplantes, la profilaxis antimicrobiana, el control ambiental y la diligencia en el diagnóstico.
La primera medida preventiva consiste en adoptar una norma universal, que incluya la detección eficaz de donantes respecto a la exposición a algunos agentes infecciosos latentes, como CMV, EBV, el virus del herpes simple (VHS) y el virus BK, que podrían reactivarse en un huésped inmunodeprimido3,6,11–13. En la actualidad, las recomendaciones de práctica clínica para el cribado pretrasplante incluyen pruebas en todos los posibles receptores de trasplante de exposición previa a infecciones víricas por virus de la hepatitis B y C, CMV, EBV, VIH y virus de la varicela zóster (VZV), pero estas pruebas muchas veces no incluyen infecciones víricas consideradas menos propensas a poner en peligro la vida y que no descartarían de inmediato la posibilidad de trasplante13–15. No está claro que la detección de estos virus ofrezca alguna protección adicional, ya que los virus latentes no serían necesariamente detectables en pruebas de detección rentables13. El beneficio más probable de esta detección sería saber la necesidad de una profilaxis antivírica prolongada y mayor control de la reinfección.
Siguiendo las recomendaciones de la American Society of Transplantation, el receptor del trasplante debe mantener el estado de vacunación adecuado. Si es posible, los futuros receptores deben vacunarse al menos 4 semanas antes del trasplante y la inmunosupresión para que puedan recibir vacunas vivas, cuando estén indicadas, y desarrollar la respuesta inmunitaria más fuerte posible16. Como mínimo, entre las vacunas recomendadas se cuentan las de la varicela, gripe, hepatitis B y antineumocócica4. Administrar vacunas habituales de refuerzo para enfermedades como el sarampión, las paperas y la rubéola, la difteria, el tétanos y la tos ferina, así como el virus de la polio, puede ser beneficioso. Si el paciente vive en un área con mayor prevalencia de otros virus oportunistas, deben considerarse las vacunaciones correspondientes4. Si el receptor no puede recibir todas las vacunas antes del trasplante, el personal sanitario debe ser consciente del momento adecuado para vacunar y evitar vacunas vivas, comenzando entre 2 y 6 meses después del trasplante16.
Además de la vacunación, la profilaxis antimicrobiana habitual de los receptores de trasplante renal frente a los organismos observados con más frecuencia puede ayudar a reducir el riesgo de infección durante el primer estadio después del trasplante. Actualmente, las mejores prácticas indican la profilaxis universal con antivíricos y antifúngicos que comienzan en el momento del trasplante o inmediatamente después12. Por desgracia, los antivíricos no matan ni reducen los virus latentes ya presentes en el tejido donado o receptor antes del trasplante. Durante el periodo de inmunosupresión más intensa, la fase aguda tardía, el sistema inmunitario ya no puede mantener la estasis con estos virus latentes, que pueden reactivarse después12.
La respuesta de los anticuerpos, incrementada en el paciente inmunosuprimido, también disminuye la fiabilidad de las pruebas serológicas.
Los antivíricos prescritos con más frecuencia son ganciclovir y valganciclovir, que son eficaces para prevenir la infección por CMV de nueva aparición y para reducir las infecciones por HSV, VZV, herpesvirus humano (HHV)-6 y HHV-7, y EBV12. La duración del tratamiento profiláctico debe determinarse en función del estado inmunitario del paciente y la necesidad de dosis mayores de tratamientos inmunosupresores.
Si un paciente desarrolla CMV durante el primer año tras el trasplante, es posible que el médico deba considerar la posibilidad de reducir el régimen de inmunosupresión del paciente a los niveles más bajos posibles mientras se conserve la función del aloinjerto12.
Reducir al mínimo los factores ambientalesDurante el primer año después del trasplante, los profesionales sanitarios deben tener un cuidado adicional y tratar de reducir al mínimo el riesgo de infección del paciente por factores ambientales y dispositivos invasivos. El manejo óptimo del cuidado de la herida es extremadamente importante para prevenir infecciones en el lecho quirúrgico. Si no se producen complicaciones, la mayoría de los pacientes puede ducharse 48 horas después de la intervención quirúrgica17. Antes del alta, enseñe a los pacientes los cuidados adecuados del lecho quirúrgico.
Los dispositivos invasivos, como sondas urinarias y dispositivos de acceso venoso central, pueden introducir organismos como estafilococos y cándidas. Estos dispositivos deben utilizarse durante el menor tiempo posible para un tratamiento eficaz10.
Los miembros del sistema sanitario siempre tratan de aumentar el cumplimiento de los profesionales sanitarios en relación con la higiene adecuada de las manos para prevenir la propagación de la infección. Esto es especialmente importante en el caso de aquellos que cuidan a receptores de trasplante. Los centros donde se cuida a estos pacientes deben introducir estrategias de cumplimiento dirigidas por colegas para lograr un cumplimiento mejor y reducir la infección cruzada entre los pacientes18,19.
Los controles ambientales no se limitan al personal. Un estudio reciente sugirió que la mala higiene de las manos de los pacientes podría contribuir a la propagación de la infección debido al contacto directo entre pacientes en áreas comunes y a la contaminación inadvertida de los profesionales sanitarios durante la interacción con aquellos20.
Educación sobre el riesgo del pacienteTanto antes como después de la intervención quirúrgica, enseñar a los receptores de trasplante y a los cuidadores la necesidad de reducir al mínimo los riesgos abordando los factores de riesgo modificables pertinentes. Estos incluyen el tabaquismo, la obesidad, el mal estado nutricional y un control glucémico deficiente18,21. Enseñar a los pacientes que, además de aumentar el riesgo general para la salud, como las enfermedades cardiovasculares, fumar interfiere en la cicatrización de heridas y disminuye la perfusión de órganos por la vasoconstricción21. Los pacientes deben dejar de fumar al menos 4 semanas antes de la intervención quirúrgica si es posible22.
Puesto que el estado nutricional tiene un efecto considerable sobre la cicatrización de las heridas, anime a los pacientes con sobrepeso y obesidad a reducir su índice de masa corporal de una manera segura y nutricionalmente sana. Eduque a todos los pacientes sobre la mejora de su estado nutricional en la medida en que sea posible.
Los pacientes con diabetes necesitarán un seguimiento continuo de los niveles de glucemia porque la hiperglucemia puede dificultar sobremanera la cicatrización de las heridas. Los niveles de glucemia pueden aumentar debido al tratamiento con esteroides posquirúrgico7,21.
Anime a los pacientes con sobrepeso y obesidad a reducir su índice de masa corporal de una manera segura y nutricionalmente sana.
Ir más alláA pesar de los incansables esfuerzos de las enfermeras, es imposible prevenir todas las infecciones en los receptores de trasplante. El cuidado de estos pacientes requiere mayor diligencia en cuanto a la prevención y tratamiento de infecciones. Las infecciones víricas simples que pueden causar molestias menores en pacientes inmunocompetentes pueden tener efectos graves tanto en la función del aloinjerto renal como en la mortalidad del paciente tras el trasplante. ■
Los autores declaran no tener ningún conflicto de intereses económicos relacionado con este artículo.