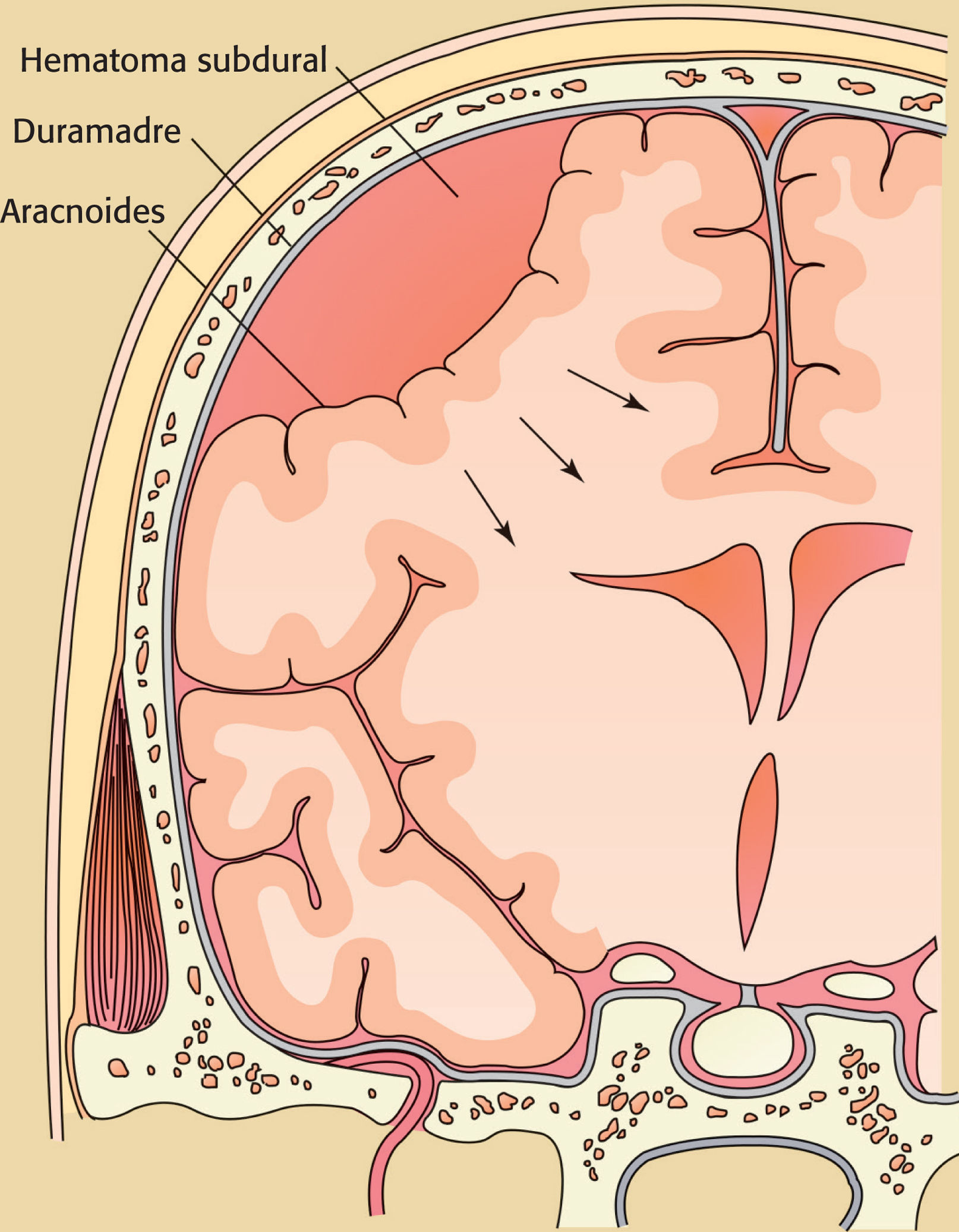
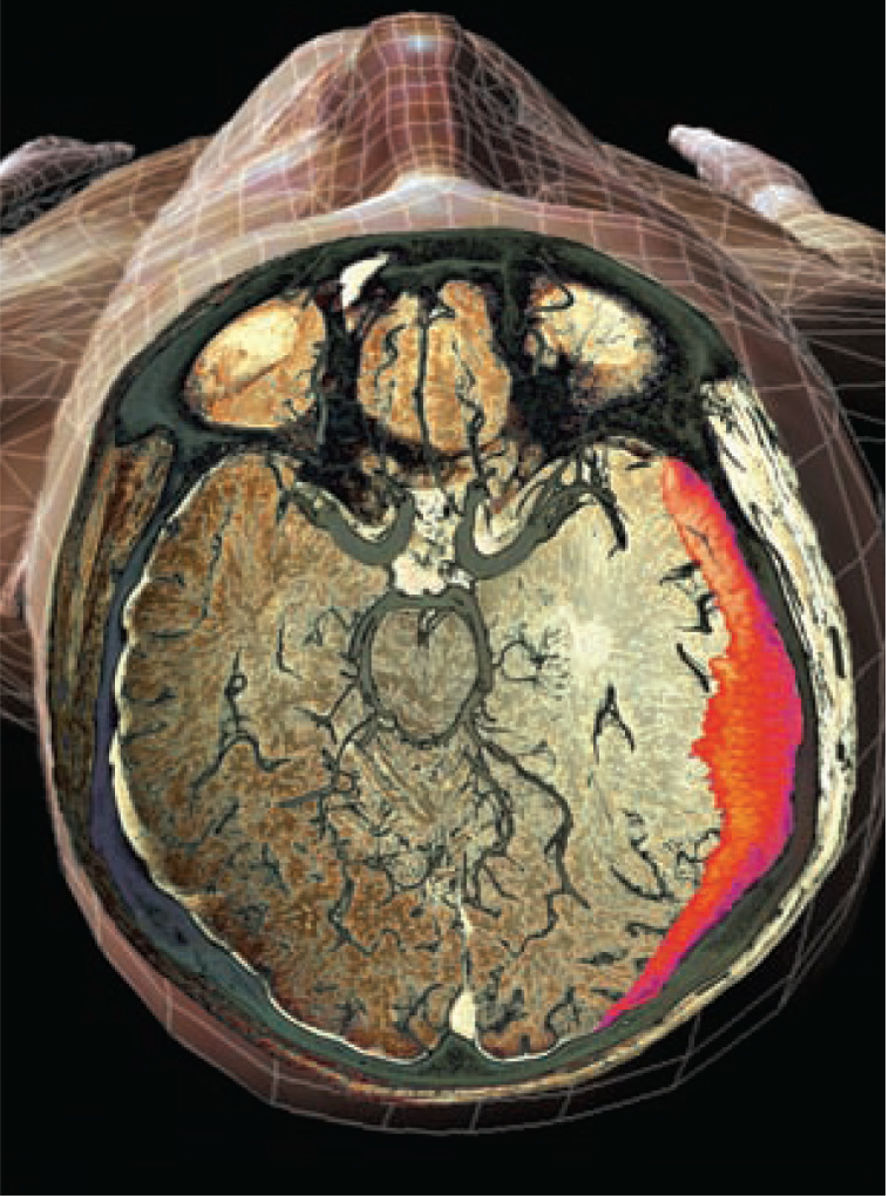
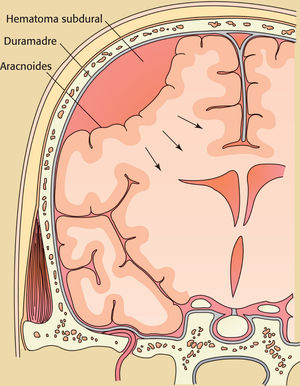
El HEMATOMA SUBDURAL (HSD) se caracteriza por una acumulación de sangre o hemoderivados en el espacio entre la duramadre y la capa aracnoidea o de la piamadre del cerebro. Puede producirse espontáneamente o a consecuencia de un traumatismo craneal u otras patologías.
Un HSD se clasifica como agudo, crónico o subagudo según el momento de aparición y las imágenes del cerebro. La morbimortalidad asociada con el HSD aumenta con la edad y el consumo de anticoagulantes, así como con el tratamiento antiplaquetario1-3.
El HSD crónico (HSDc) en adultos, el tema de este artículo, generalmente se desarrolla de 2 a 3 semanas después del suceso causal y, a menudo, tiene mal pronóstico. Dado que el diagnóstico y el tratamiento inmediatos son fundamentales para prevenir la discapacidad o la muerte, este artículo analiza las evaluaciones e intervenciones de enfermería que pueden mejorar los resultados del paciente con HSDc.
Hematoma subdural: insospechadamente frecuenteLos datos recopilados por la Oficina del Censo de Estados Unidos muestran que la incidencia de HSD casi se duplica entre los 65 y los 75 años, y continúa aumentando en personas mayores de 80 años. La incidencia de HSD es máxima entre la quinta y la séptima décadas de la vida4.
La media de edad de los pacientes con HSDc es 63 años y el 69% de ellos son mayores de 65 años. Se espera que la incidencia de HSDc aumente a medida que la población continúe envejeciendo4 (v. El cuadro Hematoma subdural crónico: una amenaza creciente para los adultos mayores).
Varias causas y factores predisponentes están asociados con el HSDc. Entre estos pueden citarse atrofia cerebral, edad avanzada, sexo masculino, traumatismo craneal, consumo de determinados medicamentos, consumo de alcohol y crisis epilépticas (v. el cuadro Factores de riesgo del hematoma subdural crónico).
De manera análoga al HSD agudo, que generalmente está causado por un traumatismo, el HSDc a menudo se asocia con un traumatismo craneal. Las caídas son la causa más común de todos los traumatismos craneoencefálicos, incluido el HSD. La incidencia de caídas alcanza el punto máximo, tanto en hombres como en mujeres, entre los 75 y los 79 años5.
Se ha notificado una incidencia de traumatismo craneal leve que alcanza el 80% de los pacientes con HSDc, aunque muchos de ellos apenas recuerdan el suceso causal o no lo recuerdan en absoluto5,6. Aproximadamente, el 38% de los pacientes con HSDc solo presentan antecedentes de traumatismo craneal menor o no pueden recordar ningún traumatismo craneal previo7. Independientemente de si son conscientes de un traumatismo discreto, la mayoría de los pacientes con HSDc sufrieron un traumatismo leve sin pérdida de conciencia, lo que sugiere que también pueden mostrar una susceptibilidad intrínseca al desarrollo de HSD6,7.
Los efectos sistémicos de la anticoagulación y el tratamiento antiplaquetario son factores de riesgo conocidos del HSDc. Un 75% de los tipos primarios de HSDc espontáneos o no traumáticos se diagnostican en pacientes que toman estos medicamentos. En estudios poblacionales se estima que los pacientes que reciben tratamiento anticoagulante oral corren un riesgo de 4 a 15 veces mayor de HSDc8.
Un HSD en el contexto de la anticoagulación puede expandirse rápidamente. Si la anticoagulación no se corrige rápidamente, el HSD creciente puede producir un cuadro clínico grave o la muerte6,8.
Según los Centers for Disease Control and Prevention, en 2010 había 40 millones de personas mayores de 65 años en Estados Unidos27,28. Se prevé que la población de mayor edad aumente hasta los 72 millones en 2030, lo que representará casi el 20% de la población total de Estados Unidos. La población de más edad, definida como aquella de 85 años o mayor, pasó de algo más 100.000 en 1900 a 5,5 millones en 2010. La Oficina del Censo de Estados Unidos prevé que la población de 85 años o mayor podría crecer a 19 millones en 205028.
Se espera que la incidencia de HSDc aumente como consecuencia del envejecimiento de la población. Las tendencias actuales de envejecimiento pronostican que, cuando la población mayor de 65 años corresponda al 20-25% de la población, el HSDc superará los tumores cerebrales primarios y metastásicos para convertirse en la afección neuroquirúrgica más frecuente. Se prevé que esto ocurra en 2030 en Estados Unidos5,7.Fuente: Pillitteri A. Maternal and Child Nursing. 4th ed. Filadelfia, Pensilvania: Lippincott Williams & Wilkins; 2003.
El sangrado lento desde el sistema venoso de baja presión hasta el espacio subdural es el mecanismo fisiopatológico que provoca el HSDc. El HSDc generalmente se desarrolla de 2-3 semanas a varios meses después del suceso causal3,4,9.
La velocidad relativamente lenta del sangrado permite que una gran cantidad de sangre, productos de la descomposición de la sangre, líquido cefalorraquídeo (LCR) y líquido extraído por ósmosis de los tejidos circundantes se acumulen en el espacio subdural antes de que aparezcan los síntomas y signos clínicos. Con el paso del tiempo, el HSDc puede aumentar todavía más debido a un sangrado venoso continuo o recurrente, lo que genera complicaciones graves, como un aumento de la presión intracraneal (PIC)3,4,9.
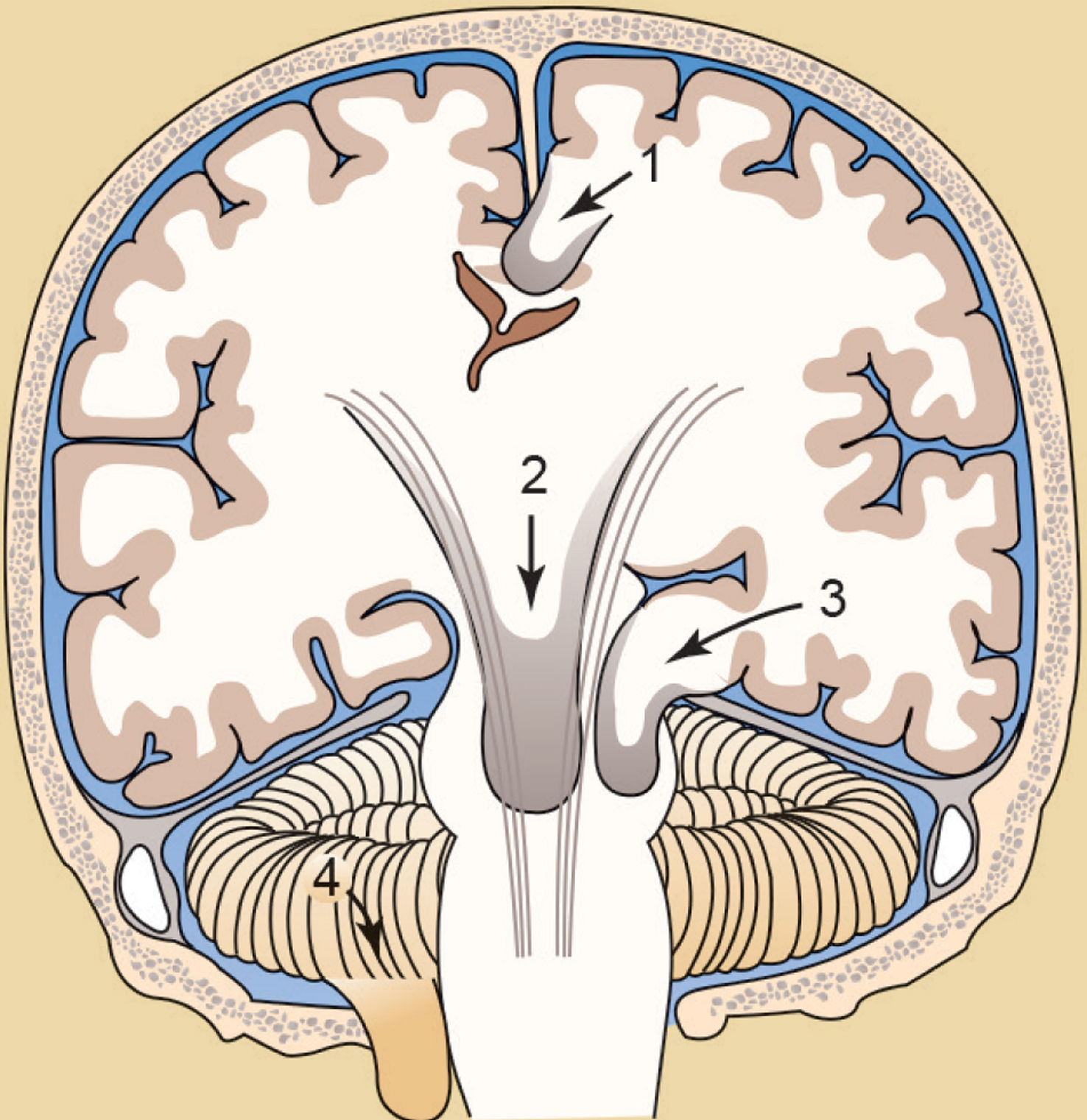
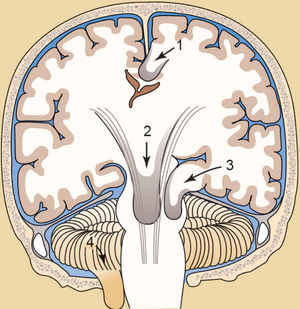
Al igual que otras masas que se agrandan dentro del cráneo, rígido y no expandible, el HSD puede volverse mortal si aumenta la PIC. La compresión del tejido cerebral provoca isquemia cerebral, apoplejía, desplazamiento del tejido cerebral y hernia cerebral. Dos tipos comunes de hernia cerebral asociados con el HSD son la hernia subfalcial (circunvolución del cuerpo calloso) y la hernia transtentorial (tentorial)10 (v. el cuadro Síndromes herniarios cerebrales).
Manifestaciones clínicasEn ocasiones, la presentación del HSDc puede parecerse a la de un accidente cerebrovascular o una demencia rápidamente progresiva3,4. Muchos pacientes con HSDc presentan numerosos síntomas y signos, entre los cuales se encuentran dolor de cabeza (que evoluciona en gravedad), trastornos de la marcha, paresia y confusión aguda. La presentación también puede incluir signos focales neurológicos, afasia, crisis epilépticas y cambios importantes del nivel de conciencia, incluido el coma3,4,11,12. Además, los pacientes con HSDc corren el riesgo de sufrir hemorragia intracerebral, crisis epilépticas y exacerbación de comorbilidades presentes, especialmente cuando el HSDc está asociado con el tratamiento anticoagulante7,11-14. Hasta el 20% tiene consecuencias neurológicas adversas que provocan una discapacidad permanente e importante13.
Sustancias farmacológicas
- •
Antagonistas de la vitamina K, como la warfarina
- •
Nuevos anticoagulantes orales, como el dabigatrán
- •
Medicamentos antiplaquetarios, como la aspirina
- •
Simpaticomiméticos, como la pseudoefedrina
Mecanismo de la lesión
- •
Síncope
- •
Caídas
- •
Accidentes automovilísticos
Enfermedades previas
- •
Atrofia cerebral
- •
Enfermedad cerebrovascular
- •
Hipertensión
- •
Ateroesclerosis
- •
Tumor maligno
Circunstancias predisponentes
- •
Edad avanzada
- •
Cirugía de derivación del LCR
- •
Actividad convulsiva
- •
Punción lumbar
- •
Consumo de bebidas alcohólicas
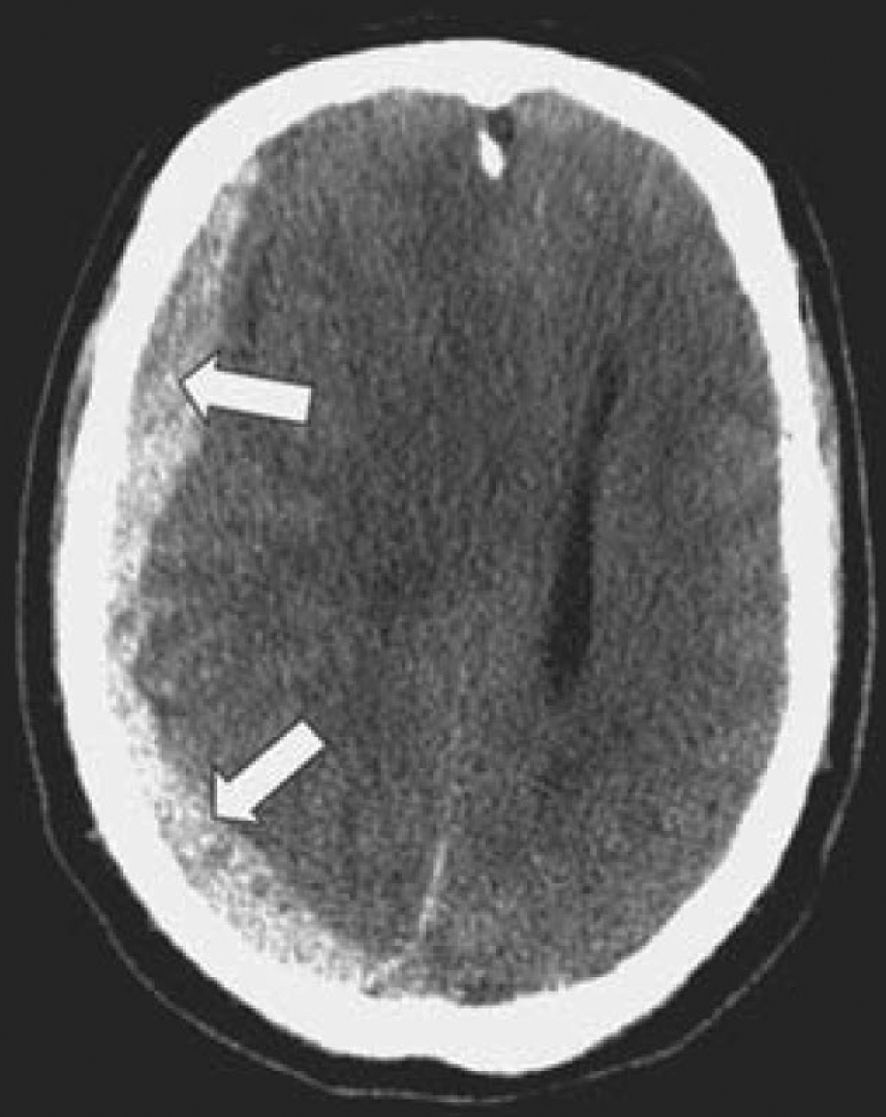
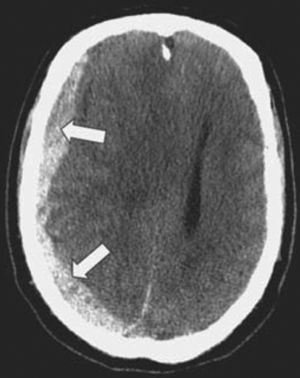
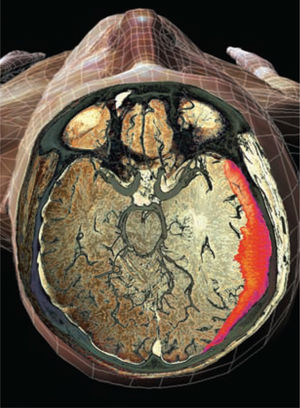
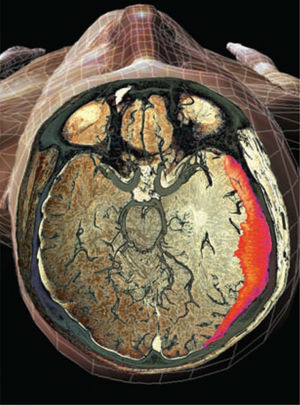
La tomografía computarizada (TC) del encéfalo sin contraste es la prueba de diagnóstico por la imagen de primera elección. Puesto que el HSDc se desarrolla durante 2-3 semanas o más, los HSDc aparecen como lesiones en forma de media luna isodensas o hipodensas (más claras) que deforman la superficie cerebral en la TC15 (v. el cuadro El hematoma subdural en la tomografía computarizada).
Con el paso del tiempo, el HSDc presentará membranas vasculares de encapsulación. El sangrado recurrente de vasos pequeños y frágiles dentro de estas membranas vasculares explica el aumento de algunos HSDc, por lo que permanecen y aumentan con el tiempo4,6,11.
La resonancia magnética no se utiliza habitualmente para el diagnóstico de HSDc, pero puede realizarse cuando se sospecha HSD y no se muestra en la TC4,15.
Hernia de la circunvolución del cuerpo calloso debajo de la hoz del cerebro [1], hernia central o transtentorial [2], hernia tentorial del lóbulo temporal en la escotadura tentorial [3] y hernia infratentorial de las amígdalas cerebelosas [4].Fuente: Porth CM. Essentials of Pathophysiology 4th ed. Philadelphia, PA: Wolters Kluwer Health; 2014.
Dado que muchos adultos mayores con HSDc también presentan comorbilidades crónicas y con frecuencia complicadas, el tratamiento requiere la colaboración entre neurólogos, neurocirujanos, enfermeras en neurociencias, especialistas en rehabilitación y otros, como un trabajador social y un coordinador asistencial, según el estado clínico del paciente3,11. Al igual que en cualquier situación de urgencia, se llevan a cabo actuaciones inmediatas para apoyar el ABC: vías respiratorias (airway), respiración (breathing) y circulación (circulation), para mejorar la presión arterial y la hemodinámica, y normalizar el estado de coagulación4. La corrección de la coagulopatía existente es fundamental para reducir el riesgo de sangrado continuo o recurrente6.
Además de la interrupción inmediata de todos los tratamientos anticoagulantes y antiplaquetarios, se iniciará una estrategia específica de neutralización de la acción de los anticoagulantes de acuerdo con el mecanismo de acción del agente específico14. Entre las actuaciones pueden citarse la perfusión de concentrado de complejo protrombínico, plasma fresco congelado o vitamina K.
La neutralización de la acción de los nuevos anticoagulantes orales innovadores es necesaria solo en casos de hemorragia potencialmente mortal o cirugía de urgencias14,16. Para los pacientes que toman nuevos anticoagulantes orales en ausencia de expansión aguda del hematoma potencialmente mortal, la cirugía debe retrasarse hasta 24 horas después de la última dosis si es posible. Este retraso debe extenderse a 48 horas si el paciente también presenta insuficiencia renal17. El fragmento de anticuerpo monoclonal humanizado específico de dabigatrán, idarucizumab, se ha aprobado recientemente para pacientes tratados con dabigatrán cuando se necesita la neutralización de la acción de los anticoagulantes en la cirugía de urgencias o en intervenciones urgentes, o en casos de hemorragia incontrolable o con riesgo de muerte16-18.
Para los pacientes que toman medicamentos antiplaquetarios, como la aspirina o el clopidogrel, existe evidencia disponible para apoyar un retraso del tratamiento de 7 a 10 días, si es posible, y permitir así la producción de plaquetas completamente funcionales. Si el tratamiento no puede retrasarse, las pautas de la American Society of Hematology recomiendan la transfusión de plaquetas preoperatoria6. Otras fuentes de coagulación y disfunción plaquetaria que pueden existir en pacientes con HSD deben tratarse en colaboración con hematólogos. La intervención quirúrgica puede estar indicada o no, y se determina caso a caso6,7,11.
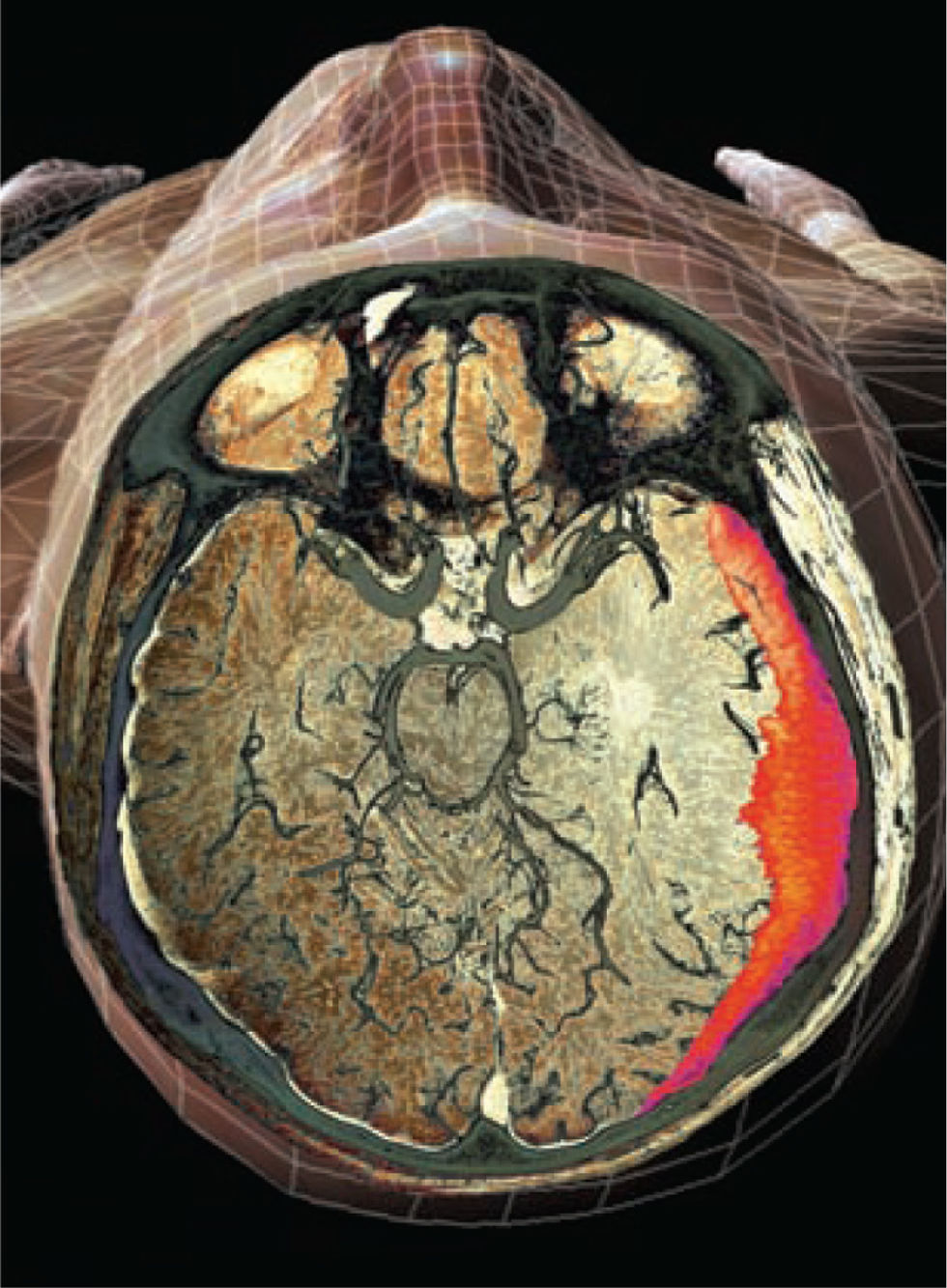
La tomografía computarizada del encéfalo revela lesiones hiperdensas semilunares (v. flechas) con un efecto de edema/masa.Fuente: Hickey JV. Clinical Practice of Neurological & Neurosurgical Nursing. 7th ed. Philadelphia, PA: Wolters Kluwer Health; 2013.
Según el consenso general, los pacientes con síntomas y signos que pueden atribuirse al HSDc confirmado radiológicamente deben tratarse mediante cirugía11. Si bien algunos informes describen el tratamiento no quirúrgico exitoso del HSDc, los expertos generalmente están de acuerdo en que la mayoría de los pacientes con HSDc requieren drenaje quirúrgico porque la propia existencia del hematoma sugiere el fracaso o la incapacidad de los mecanismos fisiológicos para reabsorberlo de manera natural. Aunque hoy día no existen pautas específicas sobre las indicaciones de cirugía en el HSDc, todas las personas sintomáticas deben considerarse posibles candidatos quirúrgicos6.
Se recomienda el vaciamiento quirúrgico en cualquier caso de HSD confirmado por imágenes radiológicas con un grosor máximo igual o superior a 1 cm, o con un desplazamiento de la línea media del tejido cerebral de 0,5 cm o superior. En el caso de un HSD que no cumpla con esos criterios, se puede indicar el vaciamiento quirúrgico rápido si el paciente tiene una puntuación en la escala de coma de Glasgow (GCS, Glasgow Coma Scale) de 8 o menos (lesión cerebral grave) y cumple uno de los siguientes criterios:
- •
Un descenso de 2 puntos o más en la puntuación de la GCS desde el momento de la lesión hasta la presentación hospitalaria.
- •
Pupilas asimétricas o fijas y dilatadas.
- •
PIC superior a 20 mmHg (normal, de 0 a 15 mmHg)6,11.
Consulte la puntuación de la escala de coma de Glasgow (GCS) para obtener más detalles sobre la puntuación de la GCS.
El control de la PIC está indicado después de una reanimación y estabilización de urgencia satisfactorias en pacientes con una lesión cerebral traumática, incluyendo el HSD, con una puntuación en la GCS de 3 a 8 y una TC anómala que revela hematomas, contusiones, hinchazón, hernia o cisternas basales comprimidas19. El aumento de la PIC asociado con la reducción del torrente sanguíneo cerebral produce hipoperfusión del tejido cerebral, lo que provoca infartos o accidentes cerebrovasculares potencialmente letales4.
Una vez que el control de la PIC está listo, los objetivos del tratamiento son mantener la PIC por debajo de 20 mmHg y la presión de perfusión cerebral entre 50 y 70 mmHg para lograr y mantener una perfusión y oxigenación cerebral adecuadas1,20.
| Abre los ojos | |
| Espontáneamente | 4 |
| A los estímulos verbales | 3 |
| Al dolor | 2 |
| Sin respuesta | 1 |
| Respuesta verbal | |
| Orientado | 5 |
| Confundido, pero puede responder preguntas | 4 |
| Palabras inadecuadas | 3 |
| Discurso incomprensible | 2 |
| Sin respuesta | 1 |
| Respuesta motora | |
| Obedece órdenes | 6 |
| Movimiento intencional al dolor | 5 |
| Se retira del dolor | 4 |
| Flexión (postura de decorticación) al dolor | 3 |
| Extensión (postura de descerebración) al dolor | 2 |
| Sin respuesta | 1 |
Lesión cerebral grave ---- Puntuación GCS de 8 o menos
Lesión cerebral moderada ---- Puntuación GCS de 9 a 12
Lesión cerebral leve ---- Puntuación GCS de 13 a 15Fuente: Centers for Disease Control and Prevention. https://www.cdc.gov/masstrauma/resources/gcs.pdf.
La cirugía para tratar un HSDc sintomático puede comportar una mejoría rápida de los síntomas y signos, y un resultado favorable en más del 80% de los pacientes4,21. Si a ello se suma un riesgo quirúrgico relativamente bajo, el vaciamiento quirúrgico es, hoy día, el pilar del tratamiento de los pacientes sintomáticos11. Sin embargo, el método óptimo de tratamiento quirúrgico del HSDc continúa siendo un área de investigación continua6. Las tres principales técnicas quirúrgicas son:
- •
Craneotomía con broca espiral que implica pequeñas aberturas (<10 mm) con un taladro manual.
- •
Craneotomía con orificio de trepanación con aberturas de 10 a 30 mm.
- •
Craneotomía abierta que implica aberturas más grandes.
La técnica de la craneotomía con broca espiral implica la creación de una pequeña craneotomía con un taladro manual y un drenaje del sistema cerrado. La ventaja de esta técnica es que se puede realizar con anestesia local junto a la cama, lo que la convierte en una opción atractiva para un adulto mayor con múltiples comorbilidades11.
La craneotomía con orificio de trepanación implica la creación de dos orificios de trepanación, generalmente perforados con una separación de 5 a 8 cm en el mismo lado que el HSDc. Este procedimiento se lleva a cabo con anestesia total. El HSDc se irriga con solución salina hasta que el efluente salga limpio y se introduzca un drenaje de silicona suave en el espacio subdural y se conecte a un sistema de drenaje pasivo cerrado que se retira después de 48 horas aproximadamente11.
La craneotomía abierta, que también requiere anestesia general, implica la creación de un colgajo de hueso libre mayor (>30 mm) para permitir la irrigación directa y el vaciamiento del hematoma. Tras la irrigación y el vaciamiento, el colgajo óseo se reemplaza y se sujeta6,11. Si un edema cerebral importante se asocia con craneotomía abierta para el tratamiento del HSDc, la membrana dural puede dejarse abierta o sustituirse con duraplastia, y el colgajo óseo se puede dejar para permitir la dilatación cerebral. Conocida como hemicraniectomía descompresiva, se realiza para controlar la PIC, mejorar la distensibilidad cerebral y aumentar la perfusión cerebral22.
El riesgo acumulativo de recurrencia de un hematoma subdural es del 15%, aproximadamente, y por lo general se produce durante el primer año después del suceso causal.
Complicaciones postoperatoriasEntre el 11% y el 19% de los pacientes desarrollan crisis epilépticas después de la cirugía para controlar el HSDc, pero el uso de fármacos antiepilépticos para la profilaxis de las crisis epilépticas en pacientes con HSDc continúa siendo controvertido6. Se ha demostrado que la profilaxis preoperatoria con fármacos antiepilépticos reduce la tasa de crisis epilépticas postoperatorias, pero no afecta al desarrollo a largo plazo de la epilepsia postraumática. Actualmente, no se recomienda el uso profiláctico de estos fármacos en pacientes sin antecedentes de crisis epilépticas11,23.
Entre las complicaciones quirúrgicas pueden citarse lesión cerebral focal, apoplejía, nueva hemorragia subdural o intracraneal aguda, crisis epilépticas, infección del lecho quirúrgico, empiema subdural y neumocefalia. Además de estas, entre las posibles complicaciones postoperatorias se encuentran las relacionadas con la anestesia general, el hematoma recurrente o residual, la hipertensión intracraneal, la infección de la herida, la pérdida de LCR, la meningitis, el absceso cerebral, los déficits neurológicos residuales, como los trastornos del habla o el déficit motor, la disfunción del esfínter intestinal y vesical, y cambios de comportamiento. Varios estudios han demostrado una relación considerable entre la edad del paciente y las complicaciones postoperatorias, lo que significa que las complicaciones aumentan con la edad avanzada24.
Aunque los resultados quirúrgicos en pacientes con HSDc son generalmente favorables, la mortalidad perioperatoria varía del 1,2% al 11%. La mortalidad a 1 año en pacientes con HSDc puede alcanzar hasta el 32%, dependiendo de factores como las comorbilidades y la puntuación de la GCS11. Los datos sugieren que una puntuación en la GCS en el momento del ingreso de 9 o más en pacientes a los que se realiza un tratamiento quirúrgico para el HSDc se asocia con un buen resultado a los 6 meses después de la operación. Sin embargo, una recurrencia en el mismo período se asocia con resultados deficientes11,12.
La recurrencia del HSD es una preocupación importante, ya que se notifican tasas del 3,8% al 30%6. Entre los factores predisponentes a la recidiva pueden citarse el sexo masculino, la edad avanzada, la hipertensión, el consumo de alcohol, la diabetes, la cirrosis, la insuficiencia renal, la coagulopatía y el tratamiento quirúrgico del HSD primario. La exposición a medicamentos como las estatinas y los tratamientos anticoagulante y antiplaquetario también aumentan el riesgo de recurrencia del HSD. El riesgo acumulativo de recurrencia de un HSD es del 15%, aproximadamente, y por lo general se produce durante el primer año después del suceso causal25.
Tratamiento médicoAlgunos pacientes con síntomas y signos leves o pequeños hematomas pueden recibir tratamiento médico. Este planteamiento incluye observación, evaluaciones continuas y manejo de complicaciones como el edema cerebral. Debido a la conocida naturaleza inflamatoria del HSDc, los corticoesteroides pueden ser útiles como tratamiento complementario, como alternativa a la intervención quirúrgica, pero su función continúa estando mal definida6,7,11.
La decisión sobre si debe tratarse el HSDc de forma quirúrgica o no quirúrgica se basa en gran medida en la opinión de expertos, únicamente con evidencia escasa disponible para tomar decisiones. En un grupo grande y heterogéneo de pacientes con HSDc no tratado quirúrgicamente, un estudio encontró que, aproximadamente, 1 de cada 8 pacientes fue hospitalizado otra vez con un nuevo HSDc o con un HSDc que empeoraba en 90 días. Aproximadamente, la mitad de estos reingresos provocaron un vaciamiento quirúrgico del hematoma, y 1 de cada 20 reingresos, más o menos, se tradujeron en fallecimiento. El riesgo de estos resultados fue considerablemente mayor después de HSDc no traumático que después de HSDc traumático porque los primeros se asocian con mayor edad y más comorbilidades6,26.
Los HSDc no traumáticos se presentan en aquellas personas que quizá toleren peor la existencia de un HSDc no drenado y se beneficiarían del tratamiento quirúrgico. Las recomendaciones actuales para el tratamiento quirúrgico frente al no quirúrgico se basan en los síntomas clínicos y el tamaño radiográfico de la lesión. Sin embargo, la inclusión de la etiología del HSDc como un factor cuando se trata de decidir tratamiento quirúrgico del HSDc frente al no quirúrgico puede ser beneficiosa. Las conclusiones de un estudio sugieren que, en el contexto de la práctica actual, los pacientes con HSDc no traumático presentan peores resultados cuando no se tratan quirúrgicamente que los pacientes con HSDc traumático6,26.
El HSDc es un trastorno neurológico frecuente en adultos mayores y su incidencia va en aumento debido al envejecimiento de la población y al mayor uso de medicamentos anticoagulantes y antiplaquetarios.
Consideraciones de enfermeríaAl atender a pacientes con HSDc, la enfermera debe comprender los riesgos de deterioro neurológico, como la expansión o recurrencia del HSD. Esto puede producirse espontáneamente o causado por factores como hipertensión no controlada, tos, vómitos o caídas. Los cuidados de enfermería de estos pacientes deben ser integrales, ya que corren el riesgo de sufrir muchas complicaciones, como alteración de los ciclos de sueño-vigilia, trastornos de la nutrición, dolor, confusión, delirio, caídas, lesiones por presión, disfagia, deterioro o pérdida de los reflejos protectores de las vías respiratorias, infección, apoplejía y tromboembolia venosa.
Las enfermeras deben estar preparadas para realizar el ingreso y las evaluaciones neurológicas estandarizadas en serie, que incluyen:
- •
Estado mental.
- •
Funciones de los pares craneales.
- •
Sistema nervioso motor.
- •
Sistema sensorial.
- •
Reflejos osteotendinosos, abdominales y cutáneos plantares.
Las enfermeras también deben mantener la integridad y la precisión del sistema de control de la PIC, y notificar las elevaciones de presión por encima de los parámetros establecidos1. Estas evaluaciones continuas son esenciales tanto para establecer una valoración inicial como para permitir la detección de cambios que pueden indicar deterioro neurológico. Puesto que estos cambios pueden señalar una catástrofe neurológica inminente, deben comunicarse de inmediato, investigarse exhaustivamente y tratarse con rapidez. La evaluación neurológica debe incluir la evaluación de un nuevo dolor de cabeza o la mayor gravedad de un dolor de cabeza existente; mareo; cambios del nivel de conciencia o memoria, así como el deterioro de la capacidad de comprensión, no poder hablar con claridad ni seguir órdenes. La enfermera debe estar atenta a la evidencia de crisis epilépticas en esta población. Mantenga las precauciones frente a las crisis epilépticas, controle los niveles séricos de los fármacos antiepilépticos si se le han recetado al paciente y esté preparada para responder de inmediato si se produce una crisis epiléptica3.
En colaboración con el médico, la enfermera debe mantener la normovolemia mediante la administración de líquidos isotónicos i.v. para reforzar la perfusión cerebral sin empeorar el edema cerebral. Evite administrar líquidos hipotónicos i.v. porque aumentan el edema cerebral.
Mantenga la cabeza y el cuello del paciente alineados y sin la opresión de dispositivos como los collarines cervicales. Eleve la cabecera de la cama a 45° aproximadamente a menos que esté contraindicado. Estas estrategias favorecen el drenaje venoso cerebral, ayudan a controlar la PIC y facilitan la reabsorción del HSDc.
La enfermera debe evaluar al paciente para detectar la existencia de dolor mediante una escala estándar validada de calificación de la intensidad del dolor. El médico, el farmacéutico y la enfermera colaboran en una estrategia de tratamiento del dolor con el objetivo de controlar el dolor sin sedación excesiva, lo que podría provocar que la evaluación neurológica fuera difícil de realizar e interpretar.
En el caso de pacientes postoperatorios con drenaje subdural, la enfermera debe evaluar el lecho quirúrgico para detectar síntomas y signos de fugas o infecciones, garantizar la permeabilidad del sistema de drenaje y controlar el apósito. La enfermera también debe asegurar y proteger el drenaje de un desplazamiento o extracción accidental, controlar la cantidad y las características del drenaje y comunicar cualquier anomalía, como la falta de drenaje o el drenaje excesivo.
La educación del paciente y la familia debe incluir una explicación de la evaluación neurológica y el plan de tratamiento, y abordar las preguntas y expectativas del paciente y su familia24.
Se requiere trabajo en equipoEl HSDc es un trastorno neurológico frecuente en adultos mayores y su incidencia va en aumento debido al envejecimiento de la población y al mayor uso de medicamentos anticoagulantes y antiplaquetarios. Los pacientes con HSDc cada vez más son tratados por equipos multidisciplinarios, que incluyen neurólogos, neurocirujanos, enfermeras en neurociencias, farmacéuticos, fisioterapeutas y especialistas en rehabilitación. Todos los miembros del equipo deben estar familiarizados con la presentación, el diagnóstico y el tratamiento de todos los tipos de HSD. Se requiere más investigación para refinar el tratamiento actual del HSDc, incluida la exploración de técnicas mínimamente invasivas y tratamientos complementarios que podrían reducir la reagudización y la necesidad de cirugía11,12. ■
Vincent M. Vacca, Jr., es profesor adjunto en la Massachusetts College of Pharmacy and Health Sciences University en Boston, Massachusetts, e Isabel Argento es enfermera en la Unidad de Cuidados Intensivos de Quemados/Traumatología/Quirúrgicos en el Brigham and Women's Hospital, también en Boston.
Los autores y los editores declaran no tener ningún conflicto de intereses potencial, económico o de otro tipo relacionado con este artículo.