Los trastornos respiratorios relacionados con el sueño son frecuentes en pacientes con ictus isquémico y constituyen un factor de riesgo independiente de mal pronóstico.
ObjetivoEstimar la posible relación entre la apnea-hipopnea del sueño durante la fase aguda del infarto y el pronóstico clínico, vital y funcional de los pacientes con infarto cerebral total de circulación anterior.
Pacientes y métodosSe realizó un estudio descriptivo observacional en 35 pacientes adultos ingresados en la Unidad de ictus del Hospital Arnaldo Milián Castro desde marzo de 2017 a marzo de 2018. El registro polisomnográfico se obtuvo dentro de las primeras 72 horas de inicio de los síntomas. El pronóstico global y sus categorías se evaluaron utilizando las escalas de NIHSS, Barthel y Ranquin. Los datos se procesaron mediante el software SPSS versión 15.0. De la estadística inferencial se aplicaron el test de independencia basado en la distribución chi cuadrado y la prueba t de Student. El método de regresión logística se utilizó para determinar si el índice de apnea-hipopnea del sueño (IAH) era un predictor pronóstico independiente.
ResultadosEl 83,33% (10/12) de los pacientes apneicos severos y ninguno de los que presentaron un IAH normal, fallecieron (X2=13,24; p=0,003). El IAH se correlacionó positivamente con las puntuaciones alcanzadas en la escala de NIHSS (r=0,405; p=0,016), Ranquin (r=0,546; p=0,016), y de manera negativa con el índice de Barthel (r=-0,526; p=0,021). En los pacientes con mayor IAH la probabilidad de morir (X2=13,24; p=0,003), presentar un pronóstico clínico muy grave (X2=10,18; p=0,015), y/o un pronóstico funcional malo a los 3 meses del infarto (X2=5,63; p=0,015) fue significativamente superior. El incremento de una unidad en el valor del IAH multiplicó en 1,13 el riesgo de evolucionar desfavorablemente (OR=1,13).
ConclusionesLa apnea del sueño durante la fase aguda del infarto cerebral total de circulación anterior constituye un factor independiente de mal pronóstico.
Sleep disordered breathing are frequent in stroke patients and they are an independent risk factors of fatal outcome.
ObjectiveTo estimate the possible relationship between apnea-hypopnea sleep during acute phase of infarction and clinical, vital and functional prognosis of patients with total anterior circulation infarction.
Patients and methodsA descriptive observational study in 35 adult patients was made in the stroke unit of Arnaldo Milián Castro Hospital between March of 2017 and March 2018. Polysomnographic recordings was obtained within 72 hours of symptom-onset. Overall prognosis and its categories was evaluated using National Institutes of Health Stroke Scale, Barthel Index and modified Rankin Scale. The data was processed using SPSS software version 15.0. From the inferential statistics was applied the Independence Test based on the Chi-square distribution and the Student's t test. Logistic regression was used to determine if apnea-hypopnea index (AHI) was a significant independent predictor of overall prognosis.
ResultsTenth out of 12 (83.33%) patients with severe sleep apnea and any one of patients with a normal AHI expired (X2=13.24; p=.003). Significant and positive correlation was found between AHI and National Institutes of Health Stroke Scale (r=0.405; p=.016), and Ranquin score (r=0.546; p=.016), but negative correlation was found between AHI and Barthel Index score (r=-0.526; p=.021). Patients with severe sleep apnea had a higher probability of death (X2=13.24; p=.003), having a worse clinical prognosis (X2=10.18; p=.015) and a bad functional prognosis at 3 months of follow-up (X2=5.63; p=0.015). Each one unit increase in AHI was estimated to increase unfavorable prognosis risk in 1.13 (OR=1.13).
ConclusionsApnea-hypopnea sleep during acute phase of total anterior circulation infarction is an independent factor of unfavorable prognosis.
El pronóstico tras un accidente cerebrovascular (ACV) isquémico continúa siendo desfavorable, más aún en aquellas oclusiones de grandes vasos, quienes son responsables de tres quintas partes de la dependencia y más de nueve décimas de la mortalidad atribuidas al infarto cerebral1.
Establecer el pronóstico de pacientes en fase aguda del ictus isquémico puede ser un complejo ejercicio de estimación ya que intervienen varias e interrelacionadas variables que deben ser consideradas.
En este sentido el establecimiento de una relación definitiva entre los trastornos respiratorios relacionados con el sueño (TRRS) y los eventos cerebrovasculares agudos, es motivo de análisis en varias investigaciones. Aunque se ha demostrado que la apnea del sueño se asocia de forma independiente con un mayor riesgo de infarto cerebral, también la apnea del sueño no tratada puede contribuir al deterioro neurológico agudo, subagudo y a largo plazo en pacientes con ictus isquémico2.
Los mecanismos patogénicos implicados en dicho fenómeno incluyen: aumento del estrés oxidativo, desregulación metabólica, aumento de la activación simpática, hipercoagulabilidad, aumento de la agregación plaquetaria, y disfunción endotelial vascular3–12.
Dos grandes estudios transversales, el Sleep Heart Health Study y el Wisconsin Sleep Cohort Study encontraron asociación entre los TRRS y el ACV, revelando que por cada unidad que aumenta el índice de apnea-hipopnea (IAH) el riesgo de ACV se incrementa en un 6%13,14. La American Heart Association, desde 2014, recomienda la detección de apnea obstructiva del sueño (AOS) para la prevención del ictus y sugiere que el tratamiento podría ser razonable15.
Varios autores consideran que los TRRS representan un factor pronóstico independiente asociado con un desenlace fatal después de un episodio de apoplejía16–18.
En 1996, Good et al.19 ya aseveraban que la desaturación de la oxihemoglobina arterial (SaO2) se correlacionaba con una menor capacidad funcional medida por el índice de Barthel (IB) al alta y a los 3 y 12 meses del ictus. En 2003, se divulgó que los pacientes con apnea del sueño y ACV tenían menor capacidad funcional en comparación con los pacientes sin apnea del sueño, y también tenían períodos más largos de hospitalización y rehabilitación20. Un año después Parra et al.21 publicaron que el IAH>30 es un factor independiente de peor supervivencia, argumentando que después de un primer ACV por cada una unidad adicional de IAH, aumentaba en un 5% el riesgo de mortalidad. En 2010 Mansukhani et al.22 coinciden en que el diagnóstico previo de apnea-hipopnea del sueño (AHS) es un predictor independiente de un peor resultado funcional tras un ictus, asociándose a puntuaciones 1,2 puntos más altas en la escala modificada de Ranquin (mRS) al alta hospitalaria.
Los TRRS pueden inducir daño en el área de penumbra isquémica debido a una disminución y variación en el flujo sanguíneo cerebral durante las apneas, lo que se ha comprobado mediante el examen Doppler transcraneal23. En este sentido, Valipour et al.24 han observado disminuciones en la oxigenación cerebral durante las apneas e hipopneas, que también podrían contribuir a afectar el área de la penumbra y alterar el pronóstico.
Ensayos clínicos para evaluar el efecto de la terapia con presión positiva continua en las vías aéreas (CPAP) en pacientes con infarto cerebral y AOS han resultado en un incremento de la supervivencia a los 5 años y una disminución media en el puntaje de la escala de déficit neurológico de 0,38 puntos, en los primeros 30 días del ictus isquémico agudo25,26.
Teniendo en cuenta que la identificación de factores pronóstico en los pacientes con ictus puede dotar de herramientas útiles para la planificación de estrategias terapéuticas durante la fase aguda y la rehabilitación, y considerando las evidencias anteriormente objetadas, pretendemos con el presente estudio: 1) estimar la posible relación entre la AHS durante la fase aguda del ictus y el pronóstico clínico, vital y funcional de los pacientes con infarto cerebral total de circulación anterior (ITCA), ingresados en la Unidad de Ictus del Hospital Arnaldo Milián Castro durante el periodo de marzo del 2017 hasta marzo 2018, y 2) proponer un modelo explicativo del pronóstico global en los pacientes con ITCA.
Pacientes y métodosPoblaciónSe realizó un estudio descriptivo observacional, y diseño longitudinal en pacientes en edad adulta con el diagnóstico de ITCA, que fueron ingresados en la Unidad de Ictus del Hospital Provincial Arnaldo Milián Castro durante el período de marzo de 2017 a marzo de 2018. Para establecer dicho diagnóstico se tomaron como referencia los criterios clínicos de extensión y localización señalados por el Oxfordshire community stroke Project27, posteriormente confirmados mediante tomografía axial computarizada o resonancia magnética nuclear. Los pacientes y/o familiares responsables han firmado un consentimiento informado, aprobado por el Comité de Ética del Hospital.
La población estuvo constituida por 62 pacientes y se incluyeron quienes tenían un tiempo de inicio de los síntomas ≤ 72 h y habían otorgado el consentimiento informado para participar en el estudio. Los criterios de selección tuvieron en cuenta la ausencia de lo siguiente: 1) ACV isquémico vertebrobasilar, 2) ictus isquémico y/o hemorrágico previos, 3) puntuación en la mRS premórbida ≥ 3 puntos, 4) lesiones cerebrales estructurales confirmadas por los medios imageneológicos (tumor cerebral, abscesos cerebrales, HIP, hematomas subdurales, hidrocefalia), 5) pacientes con un tiempo de sueño registrado menor de 120 min.
A través de un muestreo simple aleatorizado se seleccionaron 35 pacientes.
Variables y procedimientosLos pacientes fueron caracterizados según variables clínico-demográficas, relacionadas con la lesión isquémica y variables cardiorrespiratorias. El IAH se determinó en las primeras 72 h del ictus. La severidad del déficit neurológico durante el ingreso se evaluó mediante la escala de National Institutes of Health Stroke Scale (NIHSS). Posteriormente a los 3 meses del infarto se evaluaron la dependencia en las actividades de la vida diaria y el nivel de incapacidad de los sobrevivientes utilizando el IB y la mRS, respectivamente. Dichas evaluaciones permitieron establecer 2 grupos pronósticos (pacientes con pronóstico favorable/no favorable).
Variables clínicas y demográficas: edad, sexo, color de la piel, antecedentes patológicos personales (hipertensión arterial, diabetes mellitus, tabaquismo, alcoholismo, fibrilación auricular, cardiopatía isquémica, insuficiencia cardiaca, infarto del miocardio).
Variables relacionadas con la lesión isquémica: volumen del infarto según tomografía axial computarizada o resonancia magnética nuclear (arteria cerebral media-M1 o carótida interna-distal), lateralidad (izquierdo o derecho) y subtipos etiológicos según el Grupo Español de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología28 (aterotrombótico, cardioembólico, indeterminado).
Variables cardiorrespiratorias: promedio de frecuencia cardiaca, promedio de presión arterial media y el tiempo transcurrido durante el sueño con una saturación de la hemoglobina menor de 90%.
El IAH se obtuvo mediante un registro polisomnográfico continuo de ocho h, realizado en las primeras 72 h del ictus a través de un dispositivo de poligrafía de tipo SOMNOmedicsGmbH-Am Sonnenstuhl 63-D-97236 Randersacker. El IAH se categorizó de la siguiente forma: normal (<5), ligero (IAH=5-14), moderado (IAH=15-29) y severo (IAH≥30).
Para definir la variable pronóstico global se tuvo en cuenta:
Pronóstico vital: (fallecido: sí/no).
Pronóstico clínico: muy grave (≥ 3 complicaciones y NIHSS ≥20); grave (<2 complicaciones y NIHSS<20).
Pronóstico funcional:
Bueno: IB≥60 y mRS≤3 a los 3 meses del infarto.
Aceptable: IB=21-59 y mRS=4 a los 3 meses del infarto.
Malo: IB≤20 y mRS=5 a los 3 meses del infarto.
La variable pronóstico global fue discretizada de la siguiente manera: (favorable y no favorable). Los pacientes fallecidos serán ubicados independientemente en el grupo pronóstico no favorable.
FavorablePacientes que cumplan al menos uno de los siguientes criterios: ≤2 complicaciones, NIHSS<20, IB>20 y mRS≤4 a los 3 meses del infarto.
No favorablePacientes que cumplan los siguientes cuatro criterios: ≥3 complicaciones, NIHSS ≥20, IB≤20, mRS=5 a los 3 meses del infarto.
Análisis estadístico de la informaciónLos datos fueron procesados mediante el software SPSS versión 15.0. La información resultante se presentó en tablas y gráficos estadísticos en los que se muestran frecuencias absolutas y porcentajes, así como la media y la desviación estándar cuando las variables se medían en una escala cuantitativa. Los datos categóricos o cualitativos se analizaron mediante el test de independencia basado en la distribución chi cuadrado. Se determinó la significación exacta o por el método de Monte Carlo cuando no se cumplía la premisa de la prueba de que menos del 25% de las celdas tenían frecuencias esperadas menores que cinco. Para comparar las medias de una variable correspondientes a dos grupos independientes se utilizó la prueba t de Student para muestras independientes con la condición de que los valores de la misma se distribuyen normalmente en cada uno de los grupos. En caso de que fallara el supuesto de la normalidad de los datos se utilizó la prueba de Mann-Whitney. Se determinaron el coeficiente de correlación lineal de Pearson y el coeficiente de correlación de Spearman. Para la elaboración del modelo pronóstico se utilizó el método de regresión logística binaria multivariada. Extensivo para todos los test se tiene que de acuerdo al valor de la significación (p) correspondiente al estadígrafo de las pruebas de hipótesis usadas se consideró el resultado como:
Muy significativo: si p es menor que 0,01.
Significativo: si p es mayor o igual que 0,01 y menor que 0,05.
No significativo: si p es mayor o igual que 0,05.
ResultadosSe estudiaron un total de 35 pacientes con ITCA, 17 mujeres (48,6%) y 18 hombres (51,4%), con una edad media de 74,3±8,2 años. La prevalencia de la AHS fue de un 80% (28/35), de ellos el 17,1% (6/35) eran apneicos ligeros, el 28,6% (10/35) apneicos moderados y el 34,3% (12/35) apneicos severos.
El 45,7% (16/35) sufrieron tres o más complicaciones y en el 85,7% (30/35) el déficit neurológico fue grave (NIHSS ≥20).
El 45,7% (16/35) fallecieron; el 71,4% (25/35) evolucionaron a un grado de dependencia severo (IB≤20) y el 54,3% (19/35) a un nivel de incapacidad moderado o mayor (mRS≥3) a los 3 meses del ictus.
Finalmente el 54,29% de la serie (19/35) presentaron un pronóstico global no favorable a los tres meses del infarto cerebral.
De las variables clínico-demográficas y cardiorrespiratorias estudiadas únicamente la edad, el promedio de PAM y el T90 durante el sueño difirieron significativamente entre los pacientes con pronóstico global favorable y no favorable (p<0,05). La edad media de los pacientes con pronóstico global no favorable fue de 78,2±7,5 años, y de 69,6±6,3 años en los pacientes con pronóstico favorable.
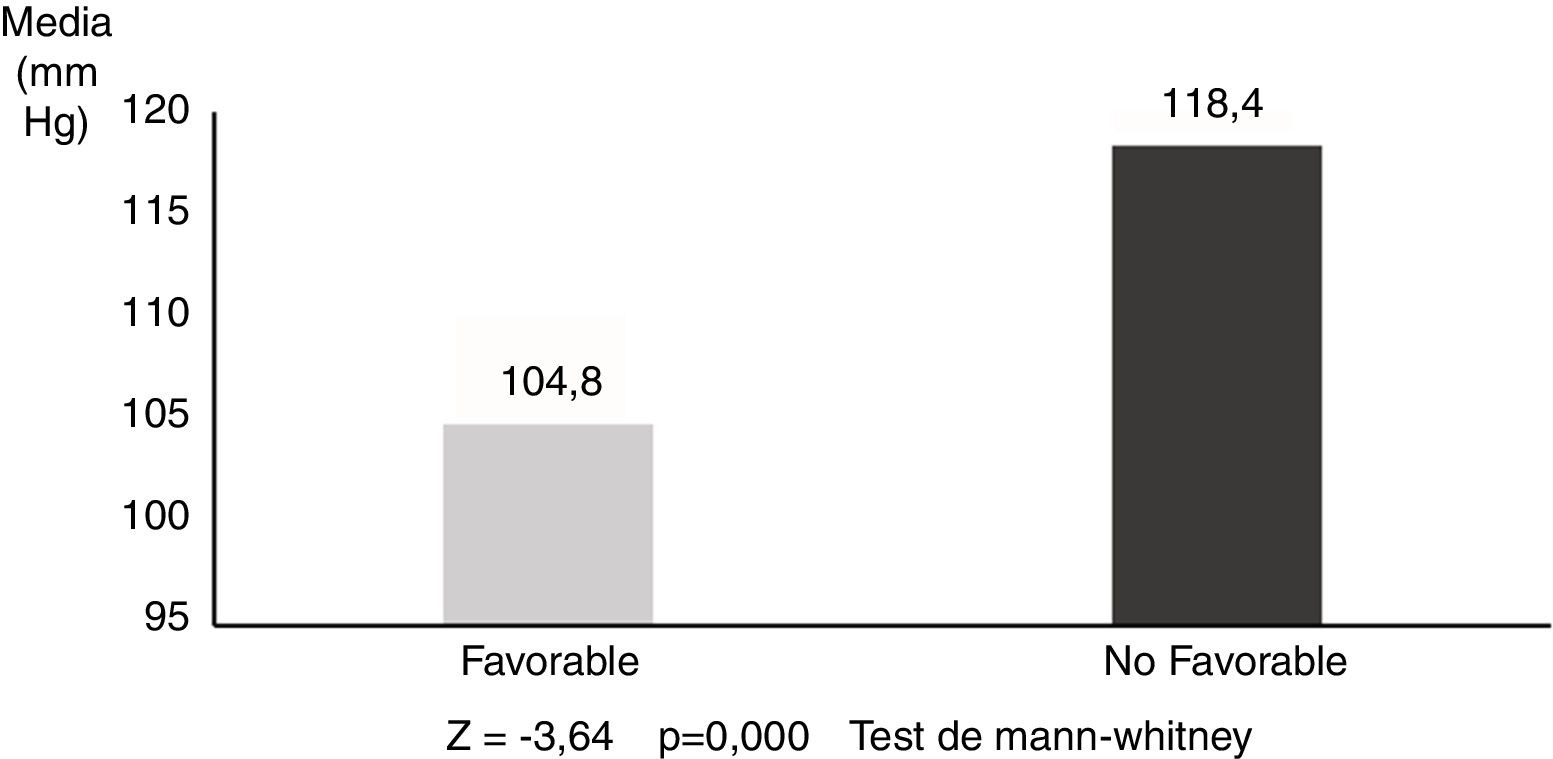
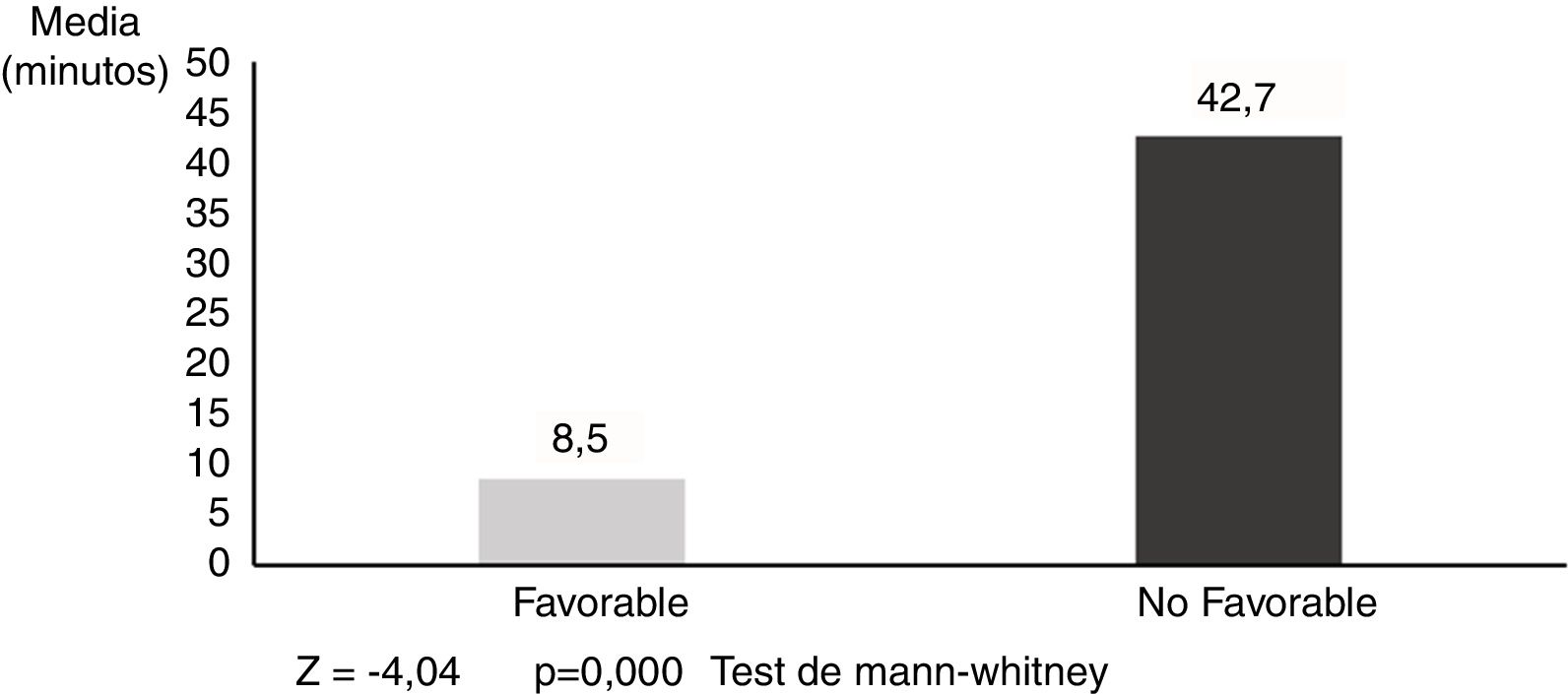
La PAM media en los pacientes con resultados no favorables fue de 118,4±12,8mmHg, y de 104,8±10,0mmHg en los que tuvieron un pronóstico favorable (Z=-3,64; p=0,000) (fig. 1). Las diferencias fueron aún más pronunciadas con respecto al T90, siendo 42,7±21,9 min en los pacientes con pronóstico no favorable y 8,5±12,6 min en los pacientes con evolución favorable (Z=-4,04; p=0,000) (fig. 2).
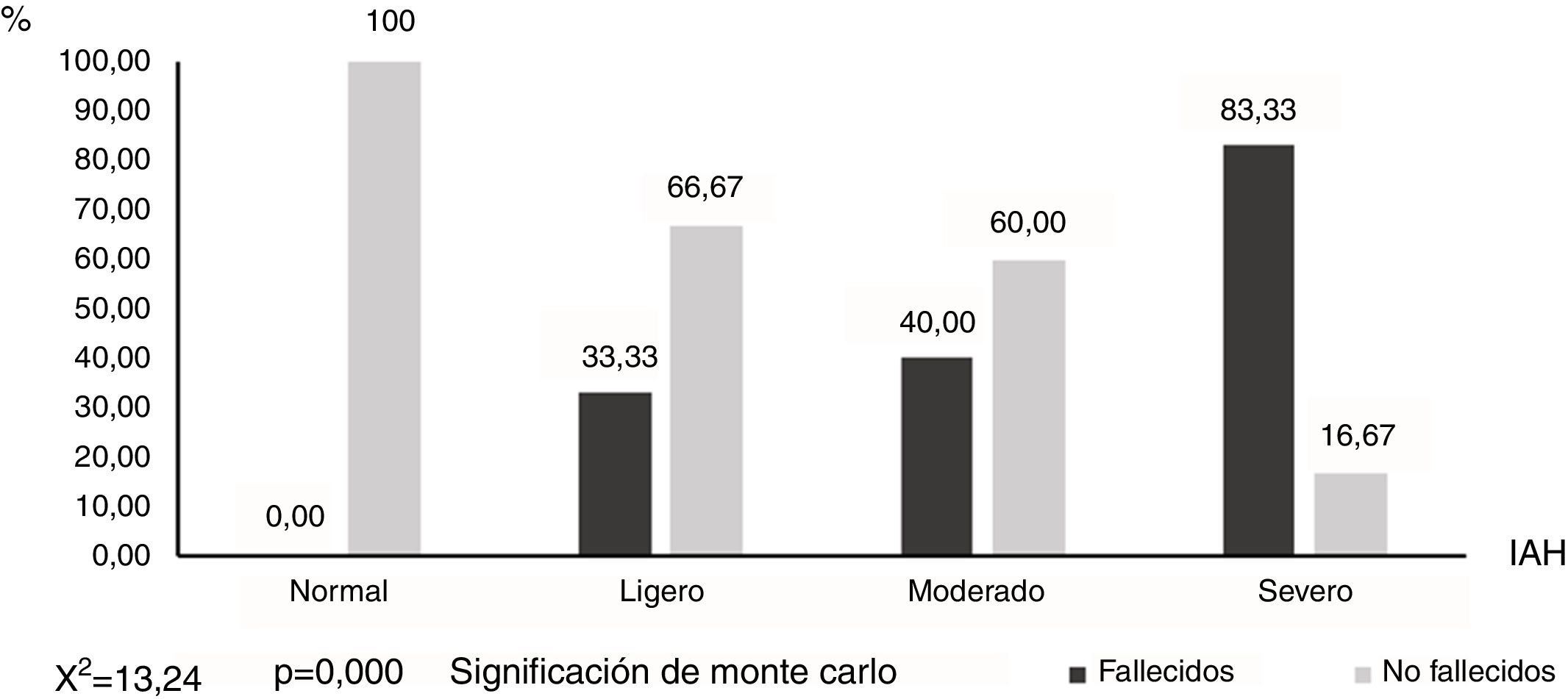
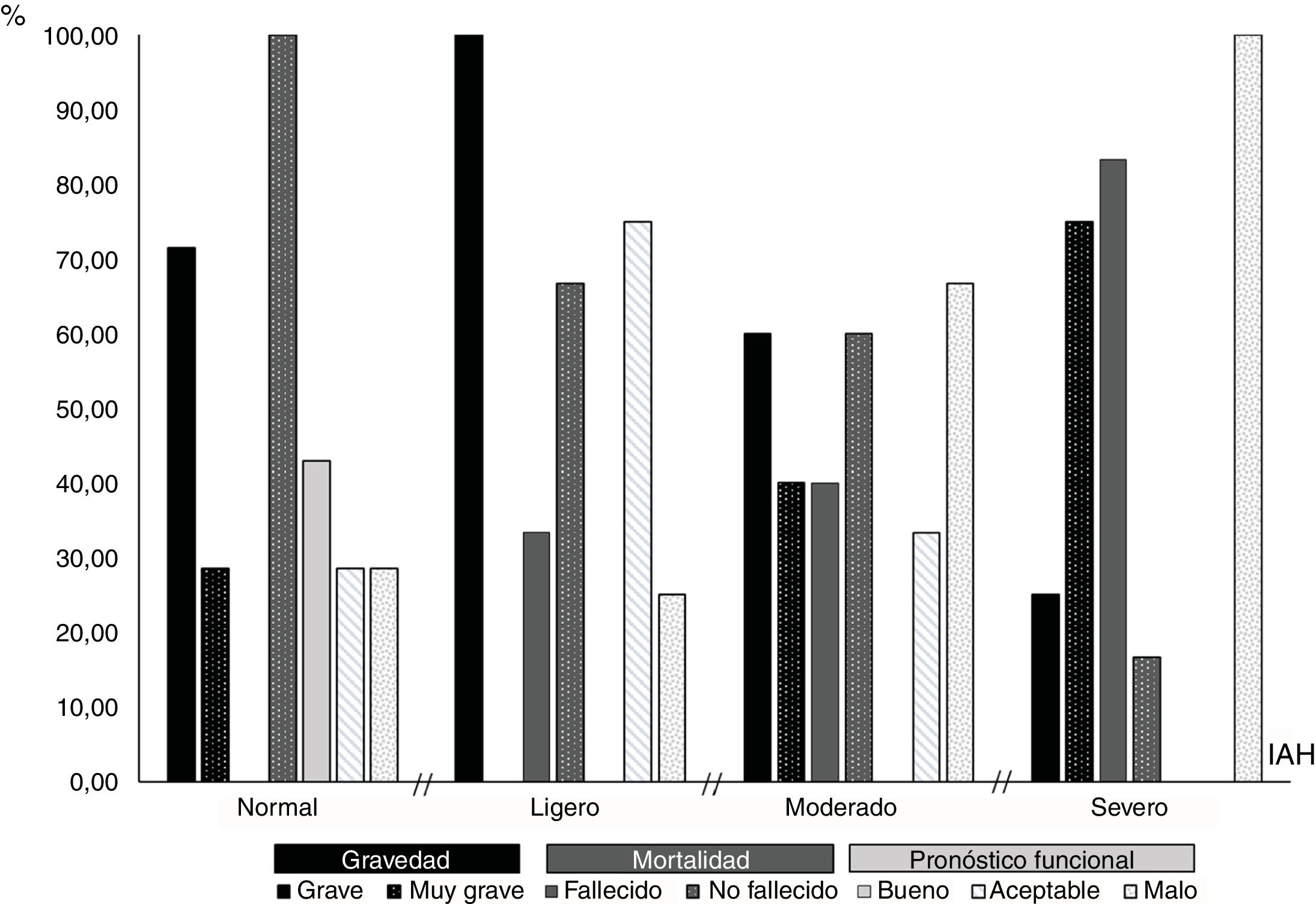
El porcentaje de pacientes fallecidos se incrementó significativamente a medida que aumentaba el IAH (fig. 3), de modo que el 83,33% (10/12) de los pacientes apneicos severos (IAH≥30) y ninguno de los que presentaron un IAH normal (0/7), fallecieron (X2=13,24; p=0,003).
En relación al IAH el 100,00% de los pacientes apneicos severos y el 100,00% de los que presentaron un IAH normal, tuvieron un pronóstico global no favorable y favorable, respectivamente En consecuencia, la probabilidad de que los pacientes con ITCA tuvieran un pronóstico global no favorable fue mayor en quienes el IAH era superior (X2=19,55; p=0,000).
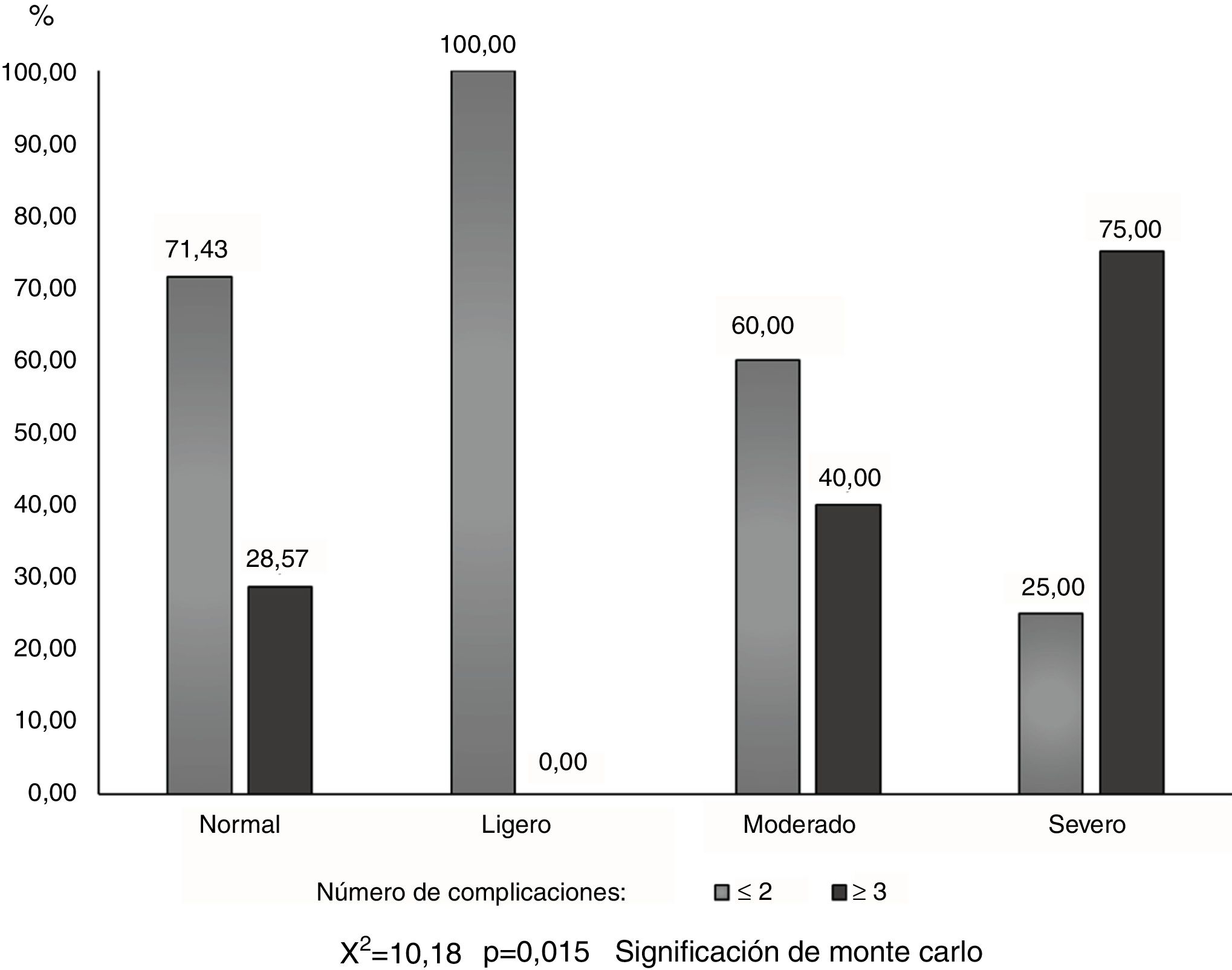
El IAH mostró diferencias significativas entre los pacientes con dos o menos complicaciones, y los que presentaron una suma de tres o más (X2=10,18; p=0,015), de forma tal que el 75% (9/12) de los pacientes apneicos severos tuvieron tres o más complicaciones, mientras que ninguno de los apneicos leves presentaron esta cifra (fig. 4).
Se demostró una correlación significativa y positiva, utilizando el coeficiente de correlación de Pearson, entre el déficit neurológico medido a partir de la escala de NIHSS y el IAH durante el sueño (r=0,405; p=0,016). Igualmente, el IAH se correlacionó significativamente, esta vez de manera negativa, con las puntuaciones alcanzadas en el IB (r=-0,526; p=0,021), y de manera positiva con la mRS (r=0,546; p=0,016), de modo que el incremento del IAH se asoció a un mayor nivel de dependencia en las actividades básicas de la vida diaria y mayor grado de incapacidad a los 3 meses del ictus (tabla 1).
El análisis de la relación entre cada una de las dimensiones que forman parte del pronóstico global y el IAH demostró que en los pacientes apneicos severos la probabilidad de morir (X2=13,24; p=0,003), presentar un pronóstico clínico muy grave (X2=10,18; p=0,015), y/o un pronóstico funcional malo a los 3 meses del infarto (X2=5,63; p=0,015) fue significativamente superior (fig. 5).
El análisis de regresión logística, correspondiente al modelo explicativo del pronóstico global en función de variables que habían ostentado una asociación significativa en el análisis univariado, demostró que el IAH es un factor asociado de manera independiente al pronóstico global no favorable (Wald=3,95; p=0,047), de forma tal que el incremento de una unidad en el valor del IAH multiplica en 1,13 el riesgo de un resultado no favorable en los pacientes con ITCA (OR=1,13), con un nivel de sensibilidad de 78,9% y especificidad de 81,3%. Los datos se ajustaron al modelo logístico (p del test de Hosmer y Lemeshow=0,971) (tabla 2).
Resultados del análisis de regresión logística correspondiente al modelo explicativo del pronóstico global
| Variables en la ecuación | B | E.T. | Wald | gl. | p | OR | IC 95,0% para OR | |
|---|---|---|---|---|---|---|---|---|
| Inferior | Superior | |||||||
| IAH | 0,122 | 0,061 | 3,951 | 1 | 0,047 | 1,130 | 1,002 | 1,274 |
| Promedio de TA media | 0,045 | 0,042 | 1,192 | 1 | 0,275 | 0,956 | 0,881 | 1,037 |
| Edad | 0,024 | 0,055 | 0,180 | 1 | 0,671 | 1,024 | 0,918 | 1,141 |
| T90 | 0,051 | 0,035 | 2,158 | 1 | 0,142 | 1,052 | 0,983 | 1,127 |
Significación: prueba de Omnibus=0,000; test de Hosmer y Lemeshow=0,971; R2 de Nagelkerke=0,672; sensibilidad=78,9%; especificidad=81,3%.
Porcentaje de clasificación correcta=80,0%
Ecuación de modelo de regresión logística binaria: (Prob [desfavorable]: probabilidad de que el pronóstico global sea no favorable).
Prob(desfavorable)11+e−(0,122IAH−0,045TAMp+0,024Edad+0,051T90)
Para evaluar la eficacia del modelo como clasificador se elaboró la curva ROC (fig. 6), siendo el área bajo la misma superior a 0,90, de manera muy significativa p=0,000), lo que sugiere que el modelo es eficaz.
DiscusiónUna revisión sistemática e integral de la literatura realizada por Birkbak et al.18, brinda datos coincidentes a los alcanzados en el presente estudio al establecer el IAH como un predictor de resultados adversos graves después del ACV isquémico en términos de mortalidad, recuperación neurológica temprana, duración de la hospitalización y riesgo de eventos cerebrovasculares recurrentes.
Según la autora el aumento de la mortalidad en pacientes apneicos graves con infarto cerebral parte de la mayor incidencia de complicaciones cardiovasculares, metabólicas, infecciosas y tromboembólicas en dichos individuos. Los mecanismos fisiopatológico que han sido utilizados para explicar las consecuencias devastadoras de la AHS, se apoyan en la hiperactividad nerviosa simpática, el estrés oxidativo, la inflamación sistémica y la disfunción endotelial.
Según Rusek et al.29 el aumento del tono simpático durante los episodios de apnea/hipopnea y por tanto la vasoconstricción provocada por las catecolaminas circulantes, producen modificaciones en el flujo microvascular, cuyo resultado final es una prolongación de las distancias de difusión del oxígeno, lo cual provoca áreas de hipoxia tisular en los sitios de tejido más vulnerables.
En el estudio de Varadharaj et al.30, utilizando biopsia de glúteo en 19 pacientes con AHS, demostraron desacoplamiento de la enzima óxido nítrico sintetasa y reducción de su cofactor tetrahidrobiopterina (BH4), resultando en sobreproducción de agentes reactivos de oxígeno, lo cual conlleva a la disfunción endotelial en pacientes con AHS. Igualmente Ifergane et al.31 en 43 pacientes con ACV agudo detectaron entre los pacientes con un IAH≥15 niveles más altos de factor de necrosis tumoral, interleucina-6 e inhibidor del activador del plasminógeno-1.
Según Alexandrov et al.32, los episodios de apnea ocasionan hipercapnia y desaturaciones repetitivas de oxígeno en el tejido isquémico cerebral, lo cual agrava la hipoperfusión en el área cerebral lesionada mediante un mecanismo de robo de flujo sanguíneo desde el área isquémica a las áreas no isquémicas.
En el presente estudio los pacientes con mayor IAH presentaron peor déficit neurológico, y por tanto puntuaciones superiores en la escala de NIHSS. Coherentemente Sherbakov et al.33 demostraron en 101 pacientes con ACV isquémico agudo que quienes presentaban AHS tenían mayor volumen de infarto un déficit neurológico más severo según NIHSS. Según Ifergane et al.31 la escala de déficit neurológico aumenta en 12,5% en el grupo de pacientes con AHS en comparación con 17,6% en pacientes sin AHS. Asimismo Camilo et al.34 observaron una correlación positiva entre el NIHSS y el tiempo de sueño en posición supina en pacientes con apnea obstructiva del sueño posicional después de un ACV.
Según la autora el aumento en la gravedad del déficit neurológico en pacientes apneicos graves con infarto cerebral puede ser explicado por el resquebrajamiento del mecanismo de autorregulación del flujo cerebral ocasionado por el trastorno respiratorio.
Durante la fase aguda del infarto cerebral puede existir una progresión de la necrobiosis hacia las áreas de penumbra isquémica, facilitado, según los estudios de Doppler transcraneal, por una persistencia de la estenoclusión arterial y fallo de la circulación colateral y del mecanismo de autorregulación cerebral, el cual es esencial para mantener un flujo sanguíneo cerebral adecuado ante los cambios en la hemodinamia sistémica y así evitar la hipoperfusión o hiperperfusión dañina del tejido cerebral35. Dicho mecanismo está especialmente afectado en los pacientes apneicos, donde los estudios con Doppler transcraneal han revelado un incremento del índice de pulsatibilidad y una disminución de la velocidad del flujo sanguíneo cerebral al final de la diástole, ambos relacionados con una disminución de la compliance cerebrovascular36.
En la presente investigación, mayores índices de apnea-hipopnea se asociaron a un aumento en el número de pacientes con 3 o más complicaciones. Resultados similares obtuvieron Hermann et al.37 cuya literatura brinda datos suficientes para establecer la AHS como un predictor negativo de los resultados después de un ACV isquémico en términos de mortalidad y riesgo de complicaciones.
Dewan et al.38 plantean que la hipoxemia intermitente y el aumento del tono simpático provocado por la AHS, ocasiona un incremento de la resistencia a la insulina y por tanto elevación de los niveles de glucemia.
Según Steinhorst et al.39 el aumento de la actividad adrenérgica, la disfunción del sistema renina-angiotensina, la disfunción endotelial, la hipoxemia y la interrupción del sueño explican la mayor incidencia y prevalencia de HTA nocturna en pacientes con AHS. Asimismo la investigación realizada por Palamarchuk et al.40 en pacientes con infarto cerebral demostró que los eventos apneicos se asocian a reducción de la barorrespuesta durante el sueño y aumento general de la PA sistólica y diastólica, con un descenso disminuido o una elevación de la presión arterial nocturna durante los primeros 3 días después del inicio del ACV.
Por otra parte, la AHS está fuertemente implicada en los mecanismos que median la ateroesclerosis, la hiperviscosidad sanguínea y la hipercoagulabilidad, lo cual aumenta el riesgo de eventos tromboembólicos como la trombosis venosa profunda y el embolismo pulmonar41.
Con respecto a las complicaciones cardiovasculares, Fox et al.42 demostraron en pacientes con insuficiencia cardiaca congestiva, que los trastornos respiratorios incrementan el riesgo de arritmias cardiacas y muerte súbita. Los mecanismos fisiopatológicos que demuestran la contribución de la AHS en el origen y progresión de las enfermedades cardiovasculares son la hipoxemia intermitente severa, acidosis, aumento de la presión arterial y vasoconstricción simpática, cambios simultáneos en las presiones transmural, intratorácica y cardiaca43.
El ictus se sitúa como la tercera causa de discapacidad a nivel mundial, suponiendo un 1,6% del total de la discapacidad ajustada por años de vida para el ictus isquémico44. En el presente estudio, la evaluación del pronóstico funcional a los 3 meses del infarto cerebral, demostró que la AHS aumenta el riesgo de presentar un pronóstico funcional malo. Coincidentemente Camilo et al.45 publicaron que la AHS grave se relaciona de forma independiente con un resultado funcional a largo plazo pobre (mRS>2) después de seis meses del ACV.
Según la autora los mecanismos que pudieran explicar la influencia negativa de la AHS en la recuperación funcional de los pacientes con infarto cerebral incluyen: aumento de la fatiga y somnolencia diurna excesiva, depresión, cefalea matinal, y problemas de concentración y de memoria, todos ellos elementos que forman parte del cortejo sintomático de la AHS, y que obviamente repercuten negativamente en las terapias de rehabilitación.
Buratti et al.46 aseguran que el deterioro cognitivo y los trastornos de memoria están comúnmente relacionados con AOS. Recientemente Duffy et al.47 demostraron en 24 adultos mayores sometidos a test psicométrico, polisomnografía nocturna y espectroscopía por resonancia magnética, que el aumento de los niveles de GSH/Cr (glutatión/creatina) en la corteza cingulada anterior se correlacionan significativamente con mayor índice de apnea-hipopnea y con peor funcionamiento ejecutivo, lo que sugiere que el estrés oxidativo resultante de los eventos de apnea/hipopnea representa un factor de riesgo de deterioro cognitivo y funcional.
Cada día son mayores las evidencias de que los pacientes con AHS e infarto cerebral presentan mayor déficit neurológico, mayor riesgo de muerte y pobre resultado funcional con la terapia de rehabilitación comparado con los pacientes no apneicos48,49.
En conclusión, la AHS incrementa la probabilidad de muerte dentro de los 3 meses después del ACV isquémico, se relaciona positivamente con la gravedad del estado neurológico y el número de complicaciones durante la fase aguda del ictus, se asocia a un mayor grado de incapacidad y nivel de dependencia en las actividades de la vida diaria a los tres meses del ictus, y representa un factor pronóstico independiente relacionado con una evolución no favorable. Por lo tanto, el diagnóstico temprano y tratamiento oportuno de la AHS en pacientes con infarto cerebral, cimenta las bases para el desarrollo de futuras estrategias terapéuticas promisorias de un pronóstico favorable para estos pacientes.
Investigaciones futuras deberían realizarse con muestras amplias y multicéntricas.
FinanciaciónPrestación del Polisomnógrafo SOMNOmedicsGmbH-Am Sonnenstuhl 63-D-97236 Randersacker por el Departamento de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los pacientes y familiares que colaboraron en el estudio, incluso en momentos de incertidumbre y dolor.






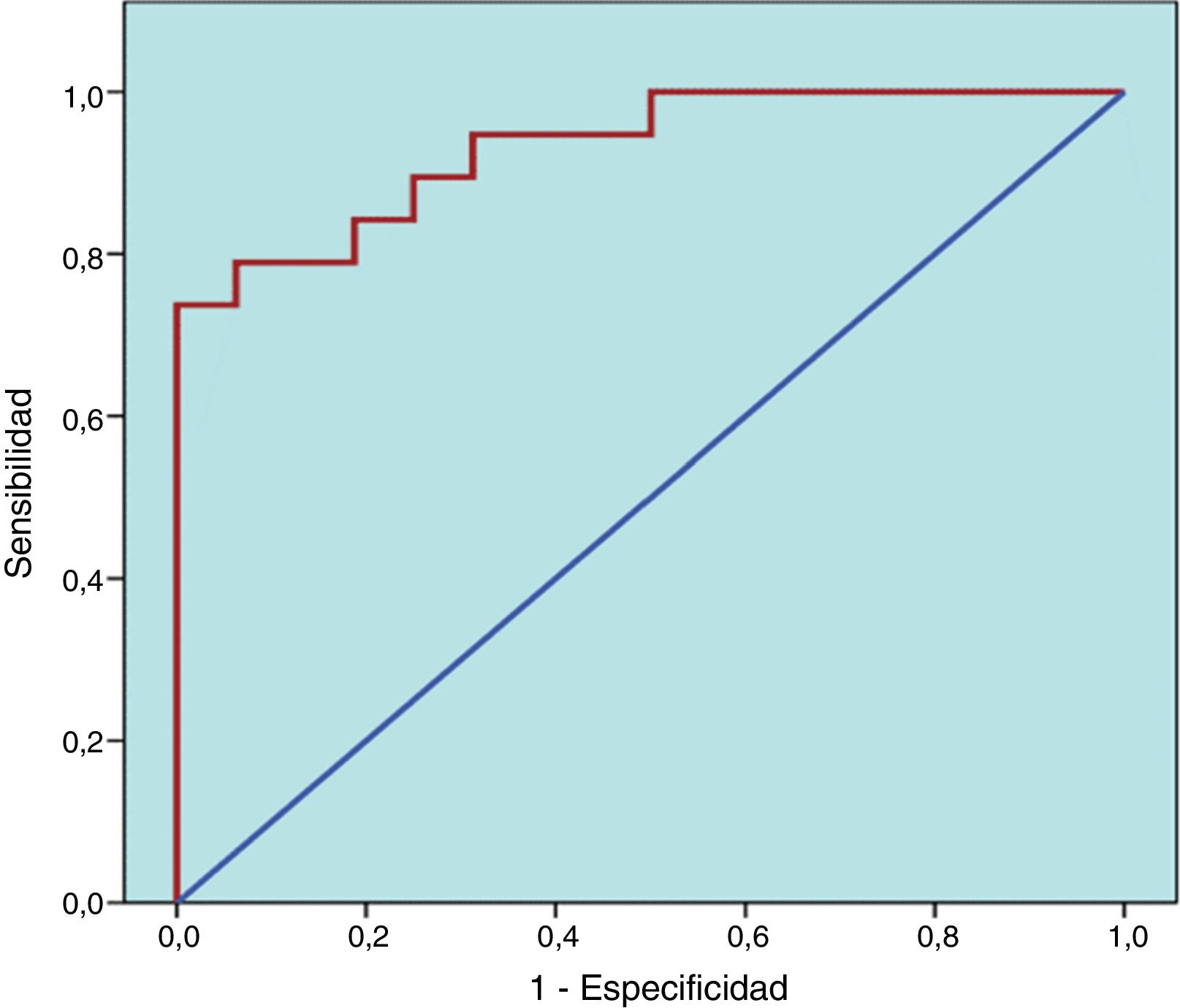







![Curva ROC correspondiente al modelo de regresión logística confeccionado. Área bajo la curva= 0,931. p=0,000. Intervalo de confianza al 95%: [0,852; 1, 00]. Curva ROC correspondiente al modelo de regresión logística confeccionado. Área bajo la curva= 0,931. p=0,000. Intervalo de confianza al 95%: [0,852; 1, 00].](https://static.elsevier.es/multimedia/18530028/0000001200000002/v1_202006160636/S1853002819300874/v1_202006160636/es/main.assets/thumbnail/gr6.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
