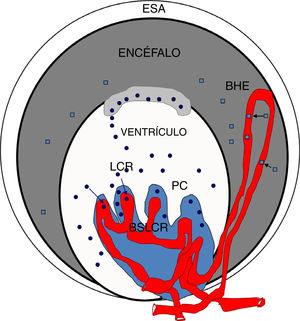
Los plexos coroideos, los vasos sanguíneos y las barreras cerebrales están íntimamente relacionados tanto morfológica como funcionalmente. Por otro lado, la hipertensión produce cambios en el flujo sanguíneo y en los pequeños vasos y capilares cerebrales. El propósito de la presente revisión es estudiar los efectos de la hipertensión arterial sobre los plexos coroideos y las barreras cerebrales.
DesarrolloLos plexos coroideos (PC) son una estructura del cerebro situada en los ventrículos cerebrales, altamente conservada filogenética y ontogénicamente. Los PC se desarrollan temprano durante la embriogénesis y constituyen una barrera funcional en las primeras semanas de gestación. Están compuestos por tejido epitelial altamente vascularizado, cubiertos por microvellosidades y su función principal es la producción del líquido cefalorraquídeo (LCR). El sistema nervioso central se encuentra aislado y protegido por la barrera hematoencefálica (BHE) y por la barrera sangre-LCR (BSLCR). Mientras que la BHE se localiza al nivel de las células endoteliales en la microvasculatura del encéfalo, la BSLCR está formada por las células epiteliales de los plexos coroideos. La hipertensión arterial crónica induce una remodelación vascular para adaptarse a los valores elevados de presión arterial, con lo que se evita el riesgo de hiperperfusión ante presiones elevadas, pero se incrementa el riesgo de isquemia a presiones bajas; en cambio, en las personas normotensas la circulación cerebral se autorregula y el flujo sanguíneo permanece constante y se mantiene la integridad de la BHE.
ConclusionesLa hipertensión arterial induce variaciones en los plexos coroideos que afecta al estroma, los vasos sanguíneos, la producción de LCR y agrava el deterioro de los PC producidos por envejecimiento. Además, la hipertensión también produce alteraciones en las barreras cerebrales que son más ostensibles en la BSLCR que en BHE; estos daños de las barreras cerebrales se podrían determinar detectando los niveles en sangre de S100β y TTRm.
The choroid plexuses, blood vessels, and brain barriers are closely related both in terms of morphology and function. Hypertension causes changes in cerebral blood flow and in small vessels and capillaries of the brain. This review studies the effects of high blood pressure (HBP) on the choroid plexuses and brain barriers.
DevelopmentThe choroid plexuses (ChP) are structures located in the cerebral ventricles, and are highly conserved both phylogenetically and ontogenetically. The ChPs develop during embryogenesis, forming a functional barrier during the first weeks of gestation. They are composed of highly vascularised epithelial tissue covered by microvilli, and their main function is cerebrospinal fluid (CSF) production. The central nervous system (CNS) is protected by the blood-brain barrier (BBB) and the blood–CSF barrier (BCSFB). While the BBB is formed by endothelial cells of the microvasculature of the CNS, the BCSFB is formed by epithelial cells of the choroid plexuses. Chronic hypertension induces vascular remodelling. This prevents hyperperfusion at HBPs, but increases the risk of ischaemia at low blood pressures. In normotensive individuals, in contrast, cerebral circulation is self-regulated, blood flow remains constant, and the integrity of the BBB is preserved.
ConclusionsHBP induces changes in the choroid plexuses that affect the stroma, blood vessels, and CSF production. HBP also exacerbates age-related ChP dysfunction and causes alterations in the brain barriers, which are more marked in the BCSFB than in the BBB. Brain barrier damage may be determined by quantifying blood S-100β and TTRm levels.
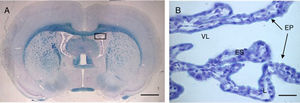
Los plexos coroideos están formados por un epitelio monoestratificado (fig. 1) y un estroma o eje vasculofibroso central. Las células epiteliales son cuboides, con un núcleo redondeado, que puede ser centralobasal. Poseen numerosas mitocondrias, siendo más numerosas en la parte basal y en los polos apicales, ocupando el 15% del citoplasma en los primates1–4. El número total de células epiteliales se ha estimado en unos 100 millones y miden y aproximadamente 15μm de alto2,5.
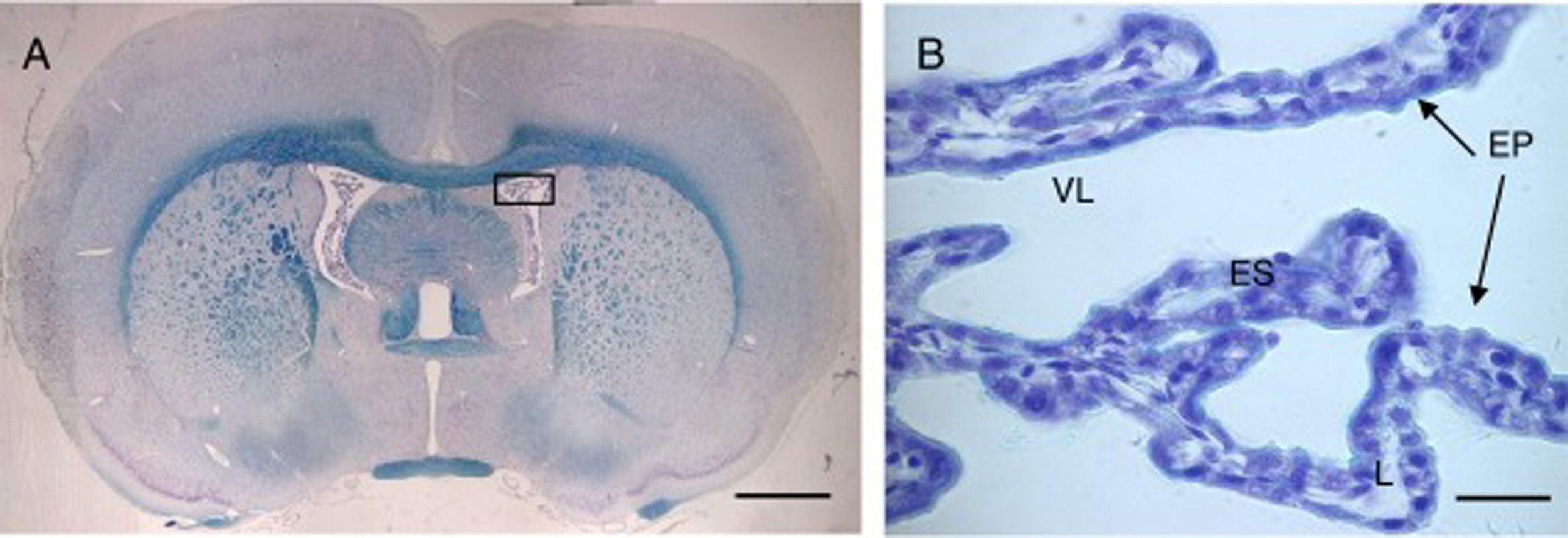
Imagen de microscopia óptica de un corte coronal del cerebro de rata con tinción Klüver-Barrera, donde podemos observar los ventrículos laterales y en su interior el plexo coroideo. El recuadro muestra la imagen ampliada del plexo 64× con la misma tinción.
Barra de escala: A=1600μm; B=40μm.
EP: epitelio coroideo; ES: estroma L: luz; VL: ventrículo lateral.
Las células epiteliales presentan en el polo apical numerosas microvellosidades entrelazadas de diámetro uniforme y pocos cilios. La superficie de las microvellosidades del plexo coroideo (PC) en las ratas es de unos 75cm2, algo cercano a la superficie total (155cm2) de los capilares de la barrera hematoencefálica6. En el polo basal del epitelio se encuentra la membrana baso-lateral que lo separa del estroma. El estroma contiene numerosas interdigitaciones, con numerosas fibras de colágeno iv, escasas células dendríticas, macrófagos, fibroblastos y grandes capilares con un endotelio fenestrado2. Los PC poseen una gran irrigación, siendo en ratas casi 10 veces mayor el flujo sanguíneo en los PC que a la corteza cerebral7. En humanos el aporte de sangre al PC del ventrículo lateral procede de las arterias coroideas anteriores y coroideas posteriores, mientras que la sangre drena en la vena coroidea. La arteria coroidea anterior es generalmente una rama de la carótida interna, y la arteria coroidea posterior es una rama de la arteria cerebral posterior. La arteria coroidea posterior también suministra sangre al plexo coroideo del tercer ventrículo8.
Funciones del plexo coroideoLos PC presentan funciones tales como la formación de líquido cefalorraquídeo (LCR), secreción de numerosas moléculas9 y la reabsorción de sustancias desde el LCR10, y constituye una barrera selectiva entre la sangre y el LCR, la barrera sangre-LCR (BSLCR) que probablemente participa en la vigilancia inmune del cerebro11,12. Las células epiteliales de los PC tienen un papel predominante en todas estas tareas y en la síntesis de gran número de proteínas del LCR, incluyendo prostaglandinas y factores de crecimiento1,2. Por otro lado, una BSLCR eficiente depende de la eficacia de las uniones epiteliales estrechas; estudios realizados en la última década apoyan la hipótesis de que una desregulación funcional de los PC, y consecuentemente de la BSLCR, puede ser un mecanismo común involucrado en la fisiopatología de una gran variedad de trastornos neurológicos13.
Además, las células epiteliales de los PC expresan numerosas proteínas de transporte en sus polos apical y basal, lo que permite la entrada y salida de moléculas y la eliminación de aniones y cationes orgánicos del LCR, evitando así la acumulación de sustancias potencialmente perjudiciales en el cerebro12,14. Los PC participan en procesos de reparación cerebral a través de la secreción de sustancias neuroprotectoras, y actúan como un lugar para la neurogénesis, lo que sugiere un papel importante en la reparación y en el reemplazo celular en el sistema nervioso central15,16.
Secreción de péptidos y proteínas por los plexos coroideosLos PC sintetizan un gran número de neuropéptidos, factores de crecimiento y citoquinas17,18(tabla 1). Una de las principales proteínas sintetizadas por los PC es la transtiretina (TTR). La TTR es una proteína que se encuentra principalmente en el plasma sanguíneo y en LCR19–21. Los principales lugares de síntesis de TTR son el hígado, el plexo coroideo y el epitelio pigmentario de la retina. La TTR sintetizada por el hígado es secretada a la sangre, donde actúa como una proteína transportadora de la hormona tiroidea22. La TTR sintetizada por el PC se secreta al LCR y está involucrada en el transporte de la hormona tiroidea desde la sangre al cerebro22–25.
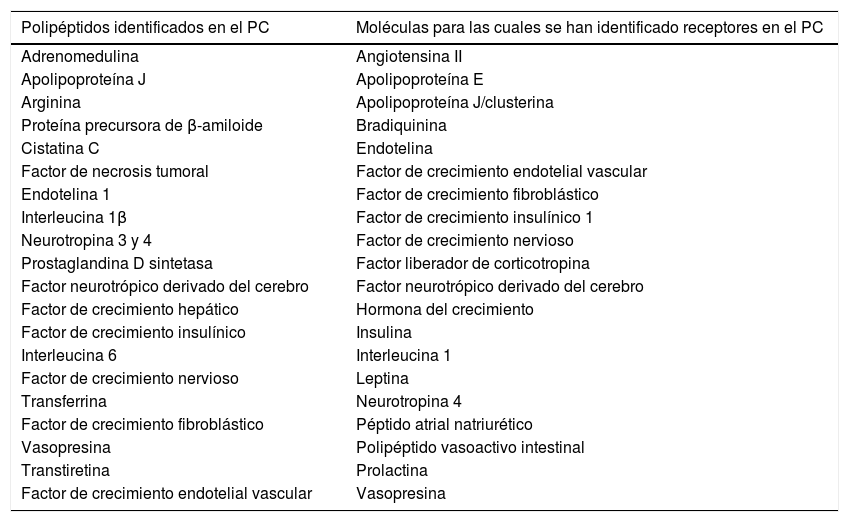
Polipéptidos identificados en el plexo coroideo y moléculas para las cuales se han identificado receptores en el plexo coroideo
| Polipéptidos identificados en el PC | Moléculas para las cuales se han identificado receptores en el PC |
|---|---|
| Adrenomedulina | Angiotensina II |
| Apolipoproteína J | Apolipoproteína E |
| Arginina | Apolipoproteína J/clusterina |
| Proteína precursora de β-amiloide | Bradiquinina |
| Cistatina C | Endotelina |
| Factor de necrosis tumoral | Factor de crecimiento endotelial vascular |
| Endotelina 1 | Factor de crecimiento fibroblástico |
| Interleucina 1β | Factor de crecimiento insulínico 1 |
| Neurotropina 3 y 4 | Factor de crecimiento nervioso |
| Prostaglandina D sintetasa | Factor liberador de corticotropina |
| Factor neurotrópico derivado del cerebro | Factor neurotrópico derivado del cerebro |
| Factor de crecimiento hepático | Hormona del crecimiento |
| Factor de crecimiento insulínico | Insulina |
| Interleucina 6 | Interleucina 1 |
| Factor de crecimiento nervioso | Leptina |
| Transferrina | Neurotropina 4 |
| Factor de crecimiento fibroblástico | Péptido atrial natriurético |
| Vasopresina | Polipéptido vasoactivo intestinal |
| Transtiretina | Prolactina |
| Factor de crecimiento endotelial vascular | Vasopresina |
Adaptada de Chodobski y Szmydynger-Chodobska15.
El descubrimiento de una barrera vascular entre la circulación sanguínea y el sistema nervioso central, barrera hematoencefálica (BHE), se remonta a hace más de 100 años, cuando en la década de 1880 Paul Ehrlich26 descubrió que cuando se inyectaba en el sistema vascular ciertos tintes, estos llegaban a todos los órganos, excepto al cerebro y a la médula espinal26. Ehrlich26 interpretó estos resultados como una falta de afinidad del sistema nervioso por estos colorantes. Sin embargo, poco después, Goldmann27 demostró que cuando los mismos tintes se inyectaban en el LCR llegaban fácilmente al tejido nervioso, pero no a cualquier otro tejido, lo que sugiere que, una vez dentro del SNC, los tintes no pasaban a la circulación sanguínea. Estudios adicionales demostraron que agentes neurotóxicos afectaban a la función cerebral solo cuando se inyectaban directamente en el cerebro, pero no cuando se inyectaban en el sistema vascular28,29. Solo con el avance de la microscopia electrónica fue posible correlacionar la localización ultraestructural de la BHE con las células endoteliales de los vasos cerebrales30.
El LCR está separado del sistema vascular por la BSLCR, mientras que la BHE, responsable de mantener la homeostasis del cerebro, se encuentra entre el parénquima cerebral y el sistema vascular. Aunque ambas barreras tienen funciones similares, difieren con respecto a sus propiedades morfológicas y funcionales. Ambos sistemas de barrera son permeables no solo para moléculas pequeñas, sino también para macromoléculas y células circulantes. El transporte de moléculas a través de la BHE y la BSLCR se regula mediante difusión pasiva (por ejemplo, albúmina, inmunoglobulinas) y transporte facilitado o activo (por ejemplo, glucosa). Asimismo, la BSLCR podría ser una posible vía para la administración de fármacos en el SNC31,32. El volumen de espacio extracelular, el taponamiento de potasio, la circulación de LCR y la absorción de líquido intersticial están regulados principalmente por canales de acuaporina-4, que están localizados abundantemente en las interfaces sangre-cerebro y cerebro-LCR32–36.
Las barreras cerebrales se consideran protectoras del sistema nervioso central, impidiendo o restringiendo la entrada de moléculas no deseadas. Pero, hoy en día, esta descripción no especifica por completo el dinamismo de las barreras cerebrales, como son la regulación de transportadores, la señalización entre las células endoteliales y estructuras neurovasculares y, muy importante, en la regulación de la composición del LCR a través del plexo coroideo durante el desarrollo y el envejecimiento37.
La composición de LCR muestra un alto rango dinámico, y los niveles de proteínas distintas varían debido a varios factores influyentes, como el sitio de producción (cerebral o derivado de la sangre), el sitio de muestreo (ventricular o lumbar), el flujo de LCR (BSLCR función), las fluctuaciones diurnas de la tasa de producción de LCR y, finalmente, el tamaño molecular de las proteínas derivadas de la sangre (IgM vs. albúmina) y el ritmo circadiano (glucosa, prostaglandina D sintasa)33–36.
La mayoría de los estudios realizados en las barreras cerebrales han sido sobre la BHE, sin embargo, otros autores destacan la importancia de la BSLCR constituida por las células epiteliales de los PC y sus uniones, las cuales conforman una verdadera barrera selectiva entre la sangre y el LCR33–36. Durante la embriogénesis su permeabilidad es más elevada, lo que permite que entren en el encéfalo compuestos de bajo peso molecular con más facilidad que en la edad adulta. Durante el desarrollo embrionario los PC ocupan un volumen proporcionalmente mayor que el cerebro, siendo esencial para la adecuada formación del sistema nervioso, debido a la secreción al líquido cefalorraquídeo de morfógenos, mitógenos y factores de crecimiento específicos10,34–36.
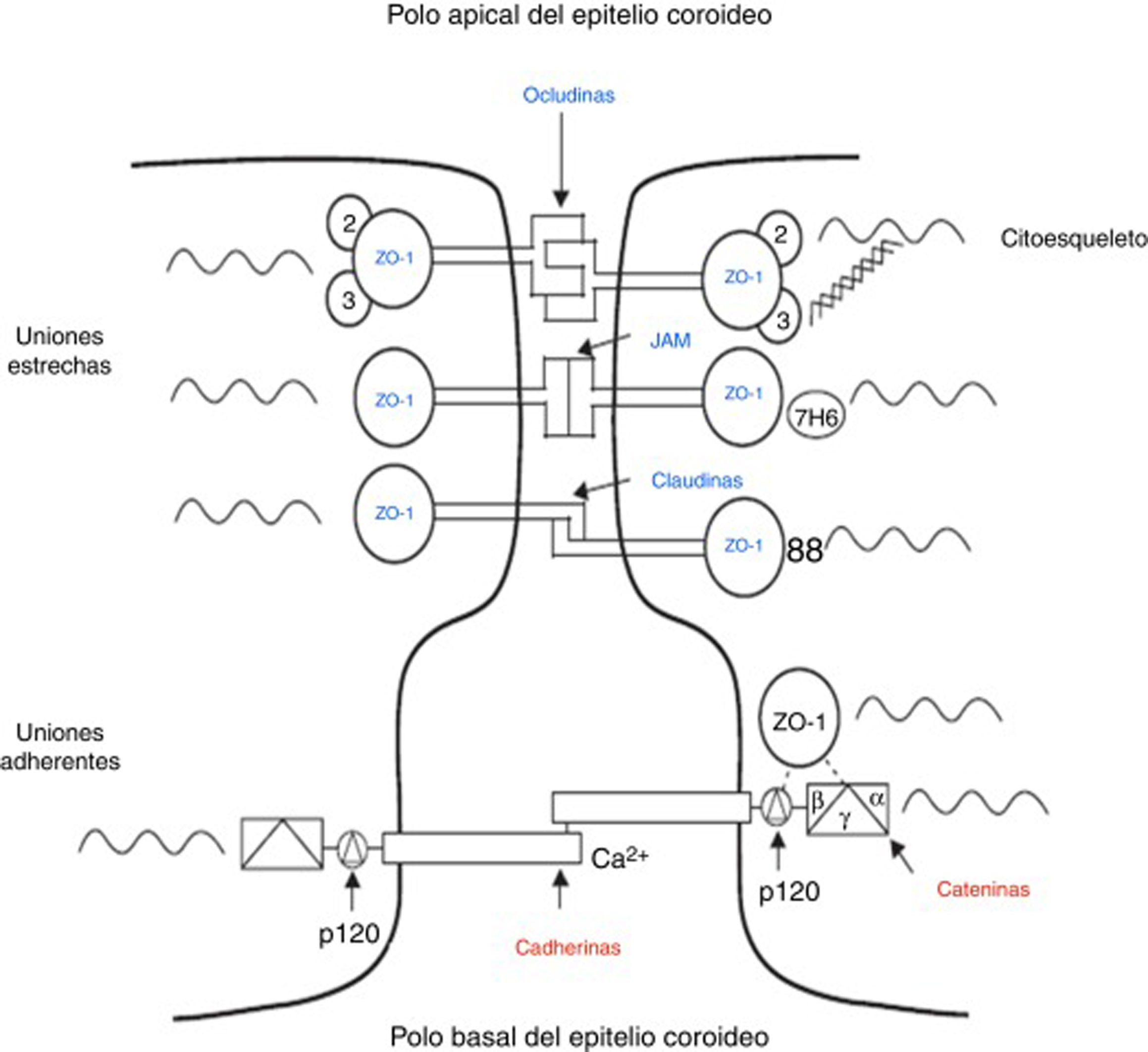
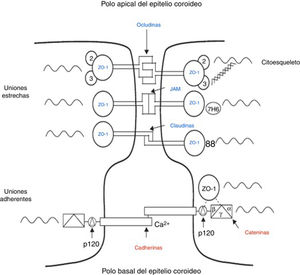
Las uniones intercelulares de las células epiteliales de los PC (fig. 2) están compuestas por uniones estrechas y uniones adherentes38. Las uniones estrechas están constituidas por 3 proteínas: claudinas, ocludinas y moléculas de adhesión, las uniones adherentes están formadas por las cadherinas. Las proteínas asociadas citoplasmáticas accesorias, llamadas proteínas de la zonula occludens, en el caso de las uniones estrechas y cateninas para las uniones adherentes, conectan las proteínas de transmembrana con el citoesqueleto de la célula (fig. 2)38,39. Estas uniones son las responsables del mantenimiento de la integridad estructural del epitelio formando la barrera sangre-líquido cefalorraquídeo (fig. 2).
Diagrama esquemático de las uniones estrechas y uniones adherentes presentes entre las células del epitelio coroideo. Modificada de Vorbrodt y Dobrogowska39.
La BSLCR impide la difusión pasiva de TTR desde la sangre al LCR, por lo tanto, la TTR que se encuentra en el líquido cefalorraquídeo se produce casi únicamente en el plexo coroideo40. En las ratas las concentraciones séricas de TTR son 10 veces más altas que las concentraciones en el LCR, pero la proporción de proteína TTR en el LCR (estimada en el 25% de las proteínas intraventriculares) es mucho más alta que la proporción de proteína de TTR en el suero (estimada en un 0,5% de las proteínas totales)40. In vitro, la TTR constituye el 20% de las proteínas recién sintetizadas y el 50% de las proteínas secretadas por el plexo coroideo36. El nivel de TTR en el LCR es menor que en el plasma (15mg/ml frente a 200mg/ml); estos datos apoyan la idea de que el LCR no es un ultrafiltrado de plasma, sino una secreción activa del PC41.
Por otro lado, ciertos investigadores como Hladky y Barrand42 refieren que aunque la BHE es vital para una función cerebral efectiva, está menos claro que los PC sean necesarios en el adulto. Por lo tanto, aunque la secreción por los PC explica la mayor parte de la entrada neta de fluido en el cerebro, una disposición adecuada de transportadores en la BHE podría producir fácilmente una secreción similar. Uno debe buscar razones algo más sutiles para tener los plexos coroideos como la principal fuente de LCR. En primer lugar, puede permitir que la BHE sirva a las necesidades locales, sin las restricciones de tener que mantener la secreción de fluido, por ejemplo en respuesta a cambios en la actividad nerviosa. En segundo lugar, evita la necesidad de proporcionar vías y suficientes gradientes de presión para el flujo a través del parénquima de todo el fluido que ingresa en el cerebro. En tercer lugar, la secreción de fluidos directamente en los ventrículos puede ayudar a mantener su permeabilidad. Tener tales espacios de volumen variable con poca resistencia al flujo entre ellos permite compensar los cambios en el volumen sanguíneo durante los ciclos cardíaco y respiratorio, y en respuesta a cambios en la postura. También se debe tener en cuenta que los PC son necesarios para secretar fluido durante el desarrollo del SNC, y puede ser una solución económica para permitirles seguir haciéndolo en el adulto42,43.
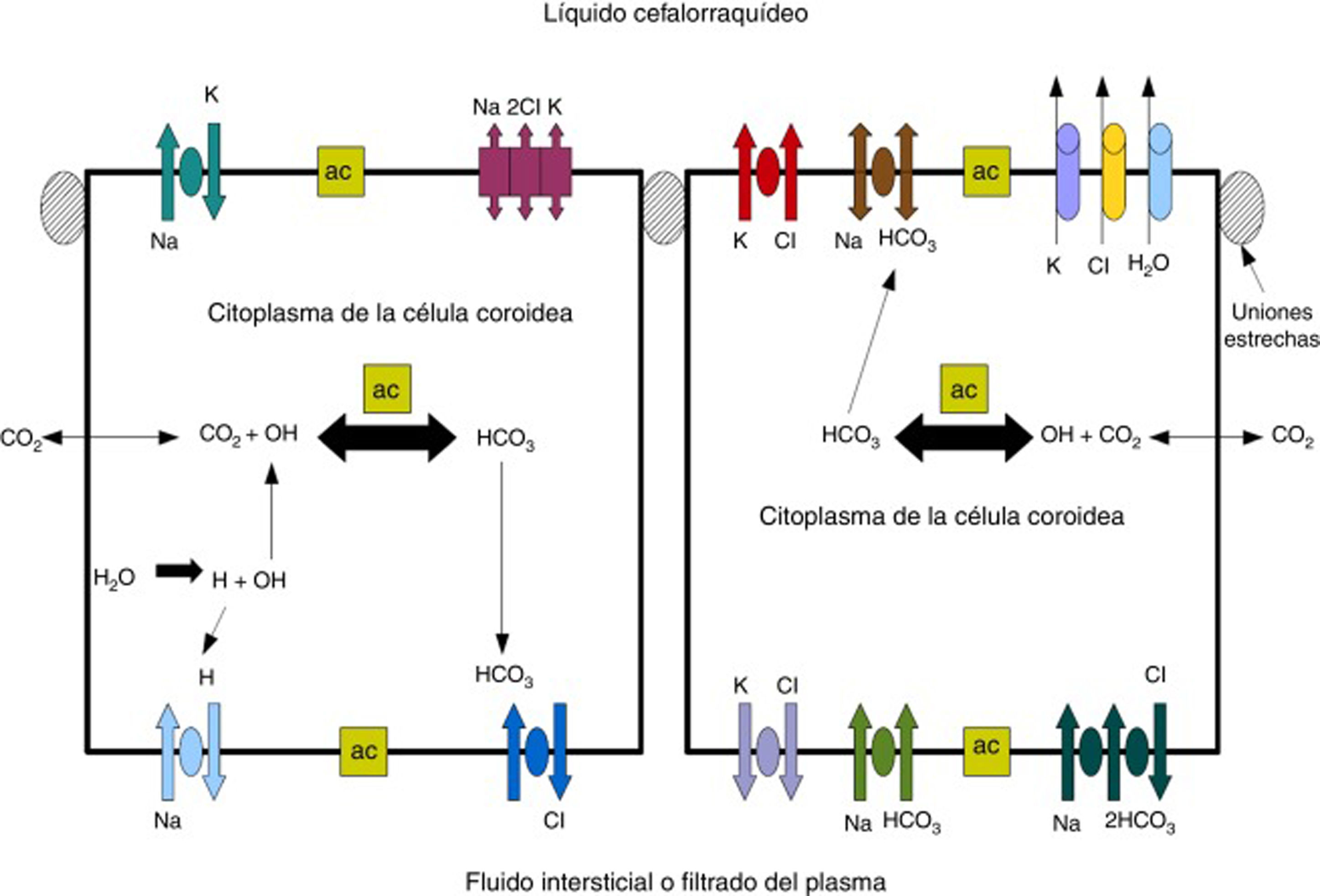
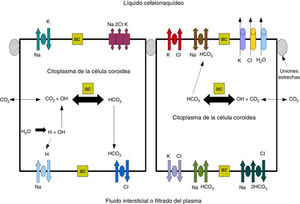
Líquido cefalorraquídeoEl LCR se produce en los PC de los ventrículos cerebrales en 2 fases: primero la filtración pasiva de líquido a través de capilares del PC facilitado por presión hidrostática44 y, segundo, una secreción de proteínas activa del epitelio del PC hasta el ventrículo5,44–50. La producción de LCR es de unos 3 y 350μl/min en la rata y el hombre respectivamente45,50–54 (fig. 3).
Esquema mostrando el transporte de iones en la PC para generar la formación de LCR. Adaptado de Johanson et al.52.
Una de las proteínas más importante para la filtración pasiva del líquido a través del PC es el canal de agua acuaporina-1 (AQP1). Esta proteína ha sido identificada en el polo apical de las membranas de las células epiteliales del plexo coroideo, aunque puede variar su localización durante el desarrollo embrionario y en casos de hidrocefalia o dilatación ventricular50–56. Las acuaporinas son una familia de proteínas integrales de membrana que funcionan como canales de agua. La producción en los PC de líquido cefalorraquídeo se basa en la participación activa de un gradiente osmótico; este gradiente osmótico es impulsado principalmente por la anhidrasa carbónica y la Na+/K +ATPasa48–52. En la membrana apical la AQP1 permite que el agua siga el gradiente osmótico, por lo que es muy importante para la transferencia de agua a través de los PC45–51. La AQP1está implicada en el mantenimiento de esta permeabilidad osmótica, la cual se reduce sobre 4,8 veces en ratones mutantes que no expresan AQP157,58. En estos ratones mutantes la producción de LCR fue aproximadamente un 20% menos que en el tipo salvaje (0,38±0,02 vs. 0,30±0,01l min-1). La presión del LCR también fue un 56% menor en ratones mutantes que no expresan AQP142,52,53. El LCR no es un simple ultrafiltrado de la sangre, ya que su composición es diferente de la del plasma56. Se compone de un 99% de agua, tiene una concentración de proteínas mucho más baja (≈ 350mg/l) que en el suero (70.000mg/l), los niveles de Na+, K+, Ca++ y HCO3- son más bajos que en el plasma y alrededor del 80% de las proteínas del LCR están presentes en el plasma sanguíneo. El 70% del LCR se origina en el PC, y el resto proviene del parénquima cerebral por las vías menores43,50–60.
El mantenimiento del fluido intersticial y la pureza de la composición del LCR dependen de mecanismos de aclaramiento eficiente. Debido a que el sistema nervioso central carece de capilares linfáticos, la eliminación de los metabolitos y toxinas mediada por el LCR es esencial para la función neuronal. El plexo coroideo desempeña un papel importante en la eliminación de sustancias nocivas. Esto ocurre de 3 formas: en primer lugar, la reabsorción por transportadores en la membrana apical del epitelio del PC remueve activamente aniones orgánicos y péptidos del LCR ventricular61–63. Este aclaramiento por parte del PC complementa la reabsorción activa de los metabolitos no necesarios, desde el fluido intersticial a los capilares cerebrales64. En segundo lugar, la continua elaboración de LCR que fluye a través del interior del cerebro actúa como mecanismo de drenaje, disminuyendo la concentración de los metabolitos que pasan a los ventrículos13,65,66. Un tercer aspecto del aclaramiento de toxinas es la de los metabolitos que están circulando por el LCR y pasan través de la interfaz aracnoidea-linfático-venosa52,67.
Efectos de la hipertensión arterial en el sistema nervioso centralLa circulación cerebral posee mecanismos de control que garantizan que el cerebro reciba una cantidad adecuada de sangre en todo momento; por lo tanto, si la demanda energética del cerebro se incrementa debido al aumento de la actividad neuronal, el flujo sanguíneo cerebral (FSC) también aumenta; este fenómeno se denomina hiperemia68. En condiciones normales el FSC es aproximadamente de 50-60ml/100g/min69. El aumento en el flujo se produce para incrementar el suministro de nutrientes, eliminar desechos metabólicos y disipar el calor producido por la actividad cerebral, pero también puede influir en la actividad neuronal a través de efectos sobre los astrocitos68,70.
El FSC se define como capacidad de la sangre necesaria para la perfusión de tejido cerebral de manera adecuada y viene determinado por la siguiente fórmula: FSC=presión de perfusión cerebral/resistencias vasculares cerebrales.
La presión de perfusión cerebral (PPC) se define como la presión necesaria para perfundir el tejido nervioso para un buen funcionamiento metabólico, representa la diferencia entre la presión en la arterial en la circulación cerebral y la presión venosa de retorno. En condiciones normales la presión venosa de retorno es mínima y, por lo tanto, la PPC es similar a la presión arterial sistémica. De esta manera, con una PPC normal los cambios en el FSC son debidos a cambios en las resistencias vasculares cerebrales (RVC)71.
En las personas normotensas la circulación cerebral se autorregula; es decir, en un límite amplio, entre 50 y 150mmHg de presión arterial (PA) media, el flujo sanguíneo permanece constante con el objeto de mantener la integridad de la barrera hematoencefálica72. Este proceso está regulado por el calibre de las pequeñas arterias y arteriolas, que se contraen al aumentar la PA y se dilatan cuando esta disminuye. La remodelación vascular que acompaña a la hipertensión arterial (HTA) crónica hace que la autorregulación se adapte a los valores elevados de PA, desplazándose la curva de autorregulación a la derecha, con lo que se evita el riesgo de hiperperfusión ante presiones elevadas, pero se incrementa el riesgo de isquemia a presiones bajas73. Algunos estudios apuntan a que esta alteración es reversible con ciertos fármacos hipotensores74.
El flujo sanguíneo cerebral de ratas espontáneamente hipertensas (SHR) es reducido, ya desde los 4 meses de edad se puede ver comprometida la circulación cerebral75. Una posible explicación a la reducción del FSC en la hipertensión puede ser debida a una aterosclerosis de las arterias carótidas que puede contribuir a un suministro insuficiente de sangre al cerebro. Sea cual sea el mecanismo subyacente una reducción de FSC parece acompañar siempre la hipertensión crónica76–79. Los modelos animales ofrecen una buena posibilidad para revelar los posibles mecanismos subyacentes que vinculan un reducido FSC y el estado de los capilares en el cerebro. Por ejemplo, la ligadura permanente de ambas arterias carótidas comunes de las ratas se postuló como un modelo de hipoperfusión cerebral crónica, donde el suministro de sangre al cerebro se reduce a alrededor del 70%80,81. Igualmente, se ha observado en ratas hipertensas anomalías estructurales en los vasos cerebrales que se manifiestan como engrosamiento de la membrana basal, después de 14 meses de hipoperfusión cerebral, por acumulación de colágeno en los vasos sanguíneos del hipocampo82. Por lo tanto, se sugiere una relación funcional entre la reducción del FSC crónica y el daño capilar cerebral, donde la hipoperfusión cerebral es el factor desencadenante de las alteraciones ultraestructurales y deformidades vasculares75. Estos resultados proporcionan una evidencia adicional a la interacción causal entre la reducción crónica del FSC y la degeneración microvascular en condiciones de hipertensión.
A pesar del fenómeno fisiológico de autorregulación cerebral, el aumento sostenido de las cifras de PA, característico de la HTA establecida, comporta una vasoconstricción mantenida en las arteriolas y pequeñas arterias cerebrales, la cual determinará la existencia de cambios estructurales en los vasos y favorecerá la aparición de diversos tipos de lesiones cerebrales. Estos cambios se caracterizan, fundamentalmente, por una reordenación de las capas de células musculares lisas de la pared de los vasos, fenómeno que conocemos como «remodelado vascular», a los que se le une además cambios estructurales adaptativos y degenerativos, tales como aterosclerosis, arteriosclerosis, engrosamiento de la pared arterial, disminución de la luz arterial e hipertrofia de la musculatura lisa71,82–85.Conforme el estrechamiento de la luz de los vasos avanza se produce una disminución de la perfusión cerebral, lo que puede ocasionar pequeños infartos lacunares y/o cambios isquémicos en la sustancia blanca periventricular o profunda, denominados leucoaraiosis86,87. La hipertensión también conduce a la rigidez vascular, un proceso que aumenta el contenido de colágeno88. Por último, también se han descrito en ratas hipertensas variaciones de la proteínas del LCR y de ciertos órganos circunventriculares, además de los PC, como son el órgano subfornical que carece de BHE y el órgano subcomisural que tiene una efectiva BHE89–91.
El propósito de la presente revisión es estudiar los efectos de la HTA en la estructura, morfología y funciones del plexo coroideo. Asimismo, tratar de interpretar si dichos efectos se manifiestan en las barreras cerebrales y si son más relevantes en la BSLCR que en la BHE.
DesarrolloEfectos de la hipertensión arterial en la estructura y morfología del plexo coroideoEn ratas espontáneamente hipertensas se produce un aumento del estroma, aplanamiento epitelial y un mayor diámetro de la luz de los vasos sanguíneos en los PC (SHR) al compararlas con las controles; además, estos cambios se agravaban con el avance de la edad, ya que a los cambios que ocasiona la HTA se le unen los del envejecimiento86,92–94. Sin embargo, habría que destacar que el incremento del diámetro de la luz vascular en el plexo coroideo producido por HTA es contrario a lo que se describe para otros vasos cerebrales, donde el diámetro de la luz disminuye por efecto de la HTA95–97. Así, en trabajos previos al estudiar los vasos sanguíneos se clasificaron en diferentes rangos de diámetro: un primer grupo de vasos de tamaño pequeño de diámetro de luz del vaso entre 5,0-15μm, un segundo grupo de vasos de tamaño medio acotado entre 15 y 30μm y un tercer grupo en vasos de tamaño grande de diámetro de la luz superior a las 30μm. Encontrándose que el tamaño medio de la luz de los vasos en ratas hipertensas fue mayor en los 3 rangos elegidos respecto a las controles, e incluso en las ratas controles no se hallaron vasos de diámetro superior a 30μm94-97. Según estos resultados podríamos decir que la HTA y la hipoperfusión cerebral tienen efecto de disminución del diámetro de la luz de los vasos parénquima cerebral, sin embargo, en los vasos de los plexos coroideos ocurre lo contrario. Probablemente debido a que los PC poseen una estructura muy vascularizada, reciben 10 veces más aporte de flujo sanguíneo que los vasos cerebrales, lo que la haría una estructura más sensible a los cambios de perfusión sanguínea7,97. Sobre este efecto contradictorio se podría pensar que el aumento del diámetro de la luz podría ser un mecanismo compensatorio a la falta de oxígeno y nutrientes causados por una mala perfusión cerebral, y no necesitaría disminuir su diámetro para mantener una presión de flujo como ocurre en el cerebro. Por esa razón pensamos que el PC es una estructura mucho más sensible a la disminución de la perfusión sanguínea que los vasos encefálicos, y que se producen mayores cambios en los PC que en el resto de vasos en el cerebro.
Efectos de la hipertensión arterial en las funciones del plexo coroideoLos cambios morfológicos debidos al efecto de la HTA pueden inducir cambios en la secreción, función y expresión de proteínas en los plexos coroideos.
La transtiretina representa el 25% de las proteínas sintetizadas por el plexo coroideo y el 5% de las proteínas presentes en el LCR47, por lo que la expresión de esta es indicativa de cómo estaría la función de secreción del PC. La transtiretina está disminuida en los PC del animal hipertenso de mediana edad respecto al control, lo que puede indicar que esa función secretora está reducida, pero el dato más llamativo es el pequeño aumento de TTR que se produce en el animal hipertenso de mayor edad con respecto al control, lo que podría ser un mecanismo compensatorio a la pérdida de TTR en el LCR de las ratas hipertensas debido a la disrupción de la BSLCR, como se verá más adelante93.
La formación de LCR es una de las funciones más importantes de los PC, y como habíamos descrito en la introducción la AQP1, localizada en el polo apical del epitelio de los PC, es la encargada del paso del agua de la sangre al LCR por un mecanismo transcelular, por tanto, la AQP1 sería un buen indicador para evaluar la producción de LCR57. Trabajos previos indican que la expresión de AQP1 aumenta en la rata hipertensa con respecto al control. Estos datos podrían explicar la dilatación ventricular que se produce en SHR descrita por Ritter98, y por consiguiente, podría ser debido a que la HTA aumenta el agua en el plexo coroideo en SHR, siendo este exceso de agua eliminado por el PC, y de ahí el aumento de AQP193,94,99,100. Pero también se produce una disminución de la AQP1 según avanza la edad, que se podría relacionar con una reducción del flujo de agua a través de los PC como consecuencia de la disminución de la producción de LCR en el envejecimiento, lo cual podría significar una reducción en la producción, y consecuentemente de la circulación de LCR por parte de los PC con la hipertensión y el envejecimiento, afectando a la eliminación de sustancias tóxicas del cerebro a través del LCR y a su reabsorción92,94. Se podría deducir que los cambios estructurales y morfológicos producidos en los PC debido a la HTA, junto con el envejecimiento, acelerarán el deterioro de procesos como la formación de LCR.
Estudios realizados en ratas envejecidas demostraron que las microvellosidades de las células epiteliales coroideas disminuyeron considerablemente en número y tamaño respecto a los jóvenes; además, estos cambios solo se produjeron en el plexo coroideo del ventrículo lateral y del tercer ventrículo, no siendo visibles en el plexo coroideo del cuarto ventrículo92. Un estudio reciente ha detectado la presencia de AQP1 en el LCR, lo que sugiere que la aparición de esta proteína puede ser debida a una pérdida de microvellosidades en el epitelio coroideo, cuyo contenido pasaría al LCR y que incluiría la AQP196. Curiosamente, en trabajos previos se ha encontrado una relación entre la cantidad de AQP1 presente en los PC y la cantidad encontrada en el LCR, de tal manera que cuanto mayor era el marcaje de AQP1 en los PC menor era la cantidad presente en el LCR, y que cuanto menor era el marcaje de esta en el PC, mayor cantidad encontrábamos en el LCR del mismo animal94,101. Asimismo, unas de las pocas referencias sobre la presencia de AQP1 en el LCR la relaciona con la pérdida de microvellosidades y la consiguiente liberación AQP1 desde el epitelio coroideo con el envejecimiento101. Por lo tanto, podemos pensar que la HTA produce un envejecimiento acelerado, mayor pérdida de microvellosidades en el epitelio y la consiguiente pérdida de AQP1, lo que produce un efecto negativo en la circulación del LCR.
Efectos de la hipertensión arterial sobre las barreras cerebralesExisten investigaciones previas que plantean que existe una alteración de las barreras cerebrales por causa de la hipertensión arterial; precisamente mediante la sacarosa marcada radiactivamente se ha evaluado la permeabilidad de las barreras cerebrales y se describe que existe una disrupción mayor en la BSLCR que en la BHE93,100,102, de lo que se podría deducir que la HTA produce más daños en las estructuras cerebrales que forman la BSLCR, es decir en el PC, que en las estructuras que forman la BHE. Utilizando otros métodos, como el descrito por Marchi et al.103, se evaluó también la permeabilidad a la BSLCR utilizando la presencia de la transtiretina monomérica de 14kilo Dalton (kDa) en sangre. La transtiretina es una proteína homotetramérica formada por subunidades, por lo que la podemos encontrar en forma de tetrámero (55kDa), dímero (28kDa) y monómero (14kDa), en la sangre la TTR se presenta principalmente de forma tetramérica (TTRt), mientras que en el LCR es principalmente manométrica (TTRm)103. Marchi et al.97 utilizaron los niveles de TTRm en suero para evaluar la apertura de la BSLCR, al inducir una disrupción en la BSLCR utilizando manitol. Basándose en que la propia HTA produciría esa apertura en la BSLCR, se ha observado la TTRm claramente disminuida en el LCR de la rata hipertensa, en comparación con el control, y al contrario una gran cantidad de TTRm en la sangre de las ratas hipertensas y muy poca en la de las ratas control93,94. Según diversos trabajos se podrá afirmar que existe un trasvase de TTR monomérica desde el LCR a la sangre en la hipertensión, debido a una posible disrupción de la BSLCR por efectos de la HTA93,94,103.
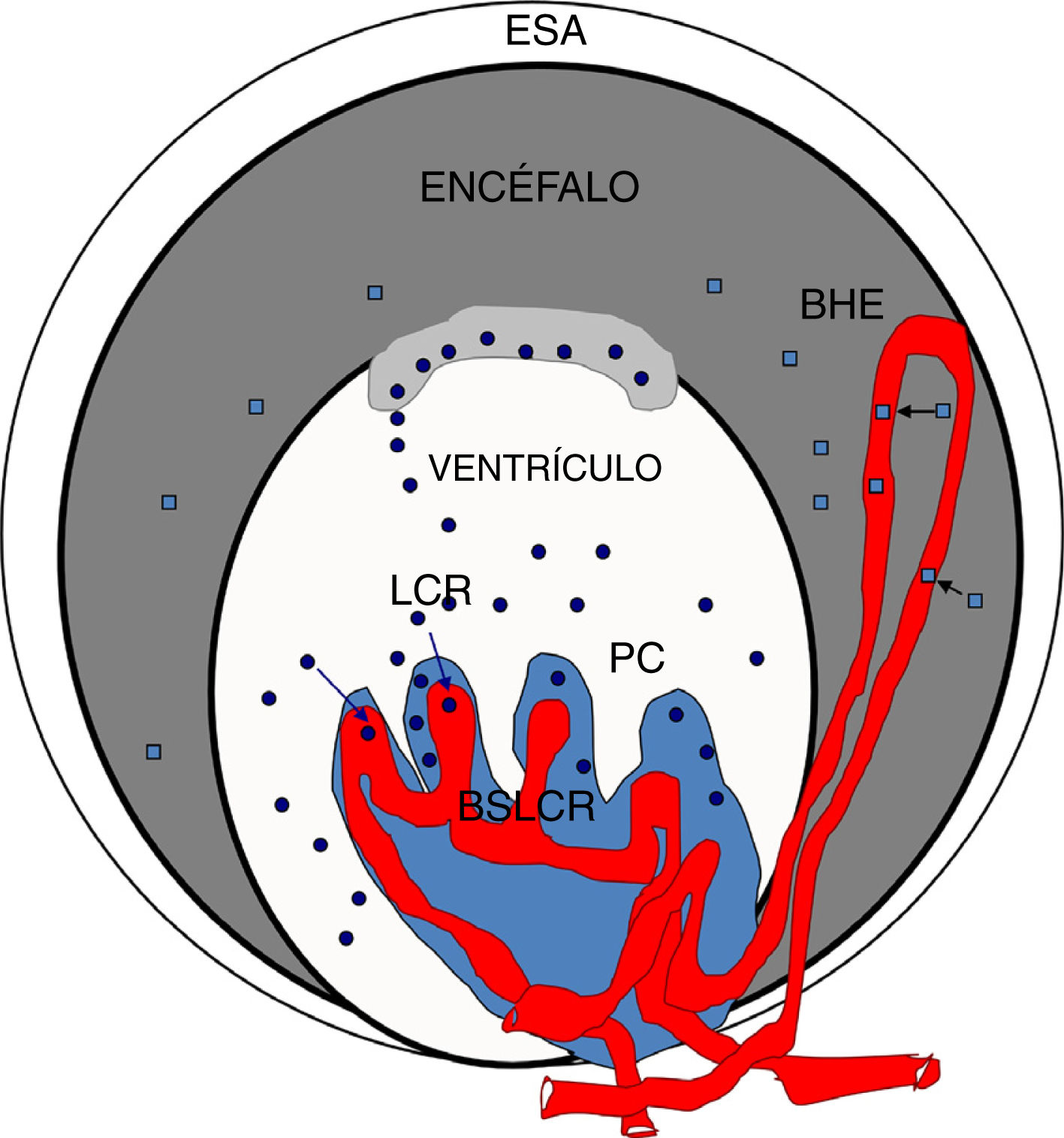
Para evaluar los cambios en la BHE en la hipertensión se han analizado los niveles de la proteína S100β en la sangre de los hipertensos. Ya que según algunos autores la S100β se encuentra en la sangre en bajas cantidades y su concentración aumenta en condiciones patológicas, esta proteína es principalmente expresada en los pies de los atrocitos y se libera a la sangre cuando existe una disrupción de la BHE, aunque también es detectada en el LCR98,100,103–107. Así, se describe un aumento de esta proteína en sangre en los animales hipertensos respecto a los controles, lo que indicaría que también existe un daño en la BHE de las ratas SHR. Coincidiendo con Al-Sarraf94 se podría decir que el daño es mayor en la BSLCR que en la BHE, ya que la cantidad de TTR monomérica proveniente del LCR que pasa a la sangre es casi el doble que la S100β que aparece en la sangre de los hipertensos, y las diferencias entre los hipertensos y los controles son mayores con la TTR que con la S100β (fig. 4).
Esquema de la barreras cerebrales y posibles biomarcadores de su disrupción: BHE: barrera hematoencefálica; BSLCR: barrera sangre-líquido cefalorraquídeo; LCR: líquido cefalorraquídeo; PC: plexos coroideos; S-100 β: proteína de unión al Ca (es escasa en el suero); TTRm: transtiretina monomérica de 14kDa.
Lo que se indica mediante cuadrados: S 100β disrupción BHE; lo que se indica mediante círculos: TTRm disrupción BSLCR.
Fuente: González-Marrero et al.94, Al-Sarraf y Philip100, Marchi et al.103.
Por otro lado, de acuerdo con varios trabajos, un aumento de ciertas proteínas como albúmina, inmunoglobulina G (IgG) y haptoglobina puede ser causado por un daño en la BSLCR, permitiendo su paso al LCR59,60,94,100,104. En un estudio proteómico previo de los líquidos cefalorraquídeos de ratas hipertensas se encontraron diferencias en estas proteínas, donde la albúmina, la IgG y la haptoglobina estaban aumentadas en el LCR de la rata hipertensa88. Estos datos demuestran que la HTA produce un aumento en algunas proteínas plasmáticas en el LCR, lo que apoya también que existe una disrupción de la BSLCR. En estos trabajos también se describe que la hipertensión producía una acumulación de IgG en los PC, lo que indicaría también que la hipertensión crónica ocasiona un daño de la BSLCR, con un incremento de su permeabilidad93,94.
ConclusionesLa hipertensión induce cambios morfológicos en el PC, cambios que acentúan las variaciones producidas por envejecimiento, debido a la disminución de la perfusión cerebral que produce la hipertensión. Mediante el análisis de la expresión de la TTR y la AQP1 se puede decir que la hipertensión arterial disminuye la capacidad secretora y de producción de LCR por parte del PC. Además, determinando los niveles de S100β y TTRm en suero y LCR se ha podido comprobar la disrupción de las barreras cerebrales en la HTA, y que los cambios que se producen en la BSLCR son más significativos cuanto mayor es el tiempo de duración de la hipertensión sin tratamiento, siendo mayor la alteración en la BSLCR que en la BHE. Estudios posteriores deberían incidir en el uso clínico de estos biomarcadores para ver el estado de las barreras cerebrales, que podrían aclarar si estos cambios se evitarían o disminuirían en la hipertensión tratada.
FinanciaciónEste trabajo ha sido subvencionado por la Fundación Canaria Instituto de Investigación y Ciencias (INIPRO), proyecto: n.° 03/14.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.