La enfermedad renal crónica (ERC) puede provocar anemia e inducir afectaciones neurológicas. La eritropoyetina humana recombinante (rHuEPO) se utiliza en el tratamiento de la anemia en la ERC. Sin embargo, existe poca evidencia de los efectos de la rHuEPO sobre la conducta y las funciones cognitivas en la ERC. El objetivo de este estudio fue evaluar el efecto del tratamiento con rHuEPO sobre las funciones sensoriomotoras y cognitivas en un modelo de ERC.
MétodosRatas macho de la cepa Wistar fueron asignadas a 4 grupos: control y ERC, con y sin tratamiento con rHuEPO (1.050 UI/kg de peso, una vez por semana durante 4 semanas). Las pruebas conductuales de laberinto acuático de Morris, campo abierto y cinta adhesiva se realizaron de manera simultánea a la inducción del daño renal y el tratamiento. Mientras que la determinación de marcadores de función renal y anemia se realizaron al término del estudio.
ResultadosEl tratamiento con rHuEPO redujo el daño en el riñón y corrigió la anemia en las ratas con ERC. En las pruebas conductuales, el tratamiento con rHuEPO redujo la disfunción sensoriomotora observada en los animales con ERC. Por otra parte, en los animales con ERC y tratamiento con rHuEPO resolvieron el laberinto en menor tiempo en comparación a los grupos control.
ConclusionesEl tratamiento con rHuEPO reduce el daño en el riñón, corrige la anemia y reduce la disfunción sensoriomotora y cognitiva en los animales con ERC.
Chronic kidney disease (CKD) can cause anaemia and neurological disorders. Recombinant human erythropoietin (rHuEPO) is used to manage anaemia in CKD. However, there is little evidence on the effects of rHuEPO on behaviour and cognitive function in CKD. This study aimed to evaluate the impact of rHuEPO in sensorimotor and cognitive functions in a CKD model.
MethodsMale Wistar rats were randomly assigned to 4 groups: control and CKD, with and without rHuEPO treatment (1050 IU per kg body weight, once weekly for 4 weeks). The Morris water maze, open field, and adhesive removal tests were performed simultaneously to kidney damage induction and treatment. Markers of anaemia and renal function were measured at the end of the study.
ResultsTreatment with rHuEPO reduced kidney damage and corrected anaemia in rats with CKD. We observed reduced sensorimotor dysfunction in animals with CKD and treated with rHuEPO. These rats also completed the water maze test in a shorter time than the control groups.
ConclusionsrHuEPO reduces kidney damage, corrects anemia, and reduces sensorimotor and cognitive dysfunction in animals with CKD.
El deterioro cognitivo es una complicación frecuente entre las personas que presentan enfermedad renal crónica (ERC). Algunas de estas alteraciones son déficits de atención, problemas en la habilidad verbal y problemas en el aprendizaje y la memoria1. La información epidemiológica indica que más del 60% de los individuos con ERC tienen altas probabilidades de desarrollar desórdenes cerebrovasculares, los cuales potencian el deterioro cognitivo y la demencia2-4.
Los principales factores patogénicos de las alteraciones neurológicas relacionadas con la ERC son las altas concentraciones de toxinas urémicas circulantes5, las citocinas proinflamatorias y las especies reactivas de oxígeno2, las cuales provocan cambios en los sistemas de neurotransmisión serotoninérgicos y colinérgicos así como en la inflamación y disfunción endotelial6. Estos factores son capaces de afectar al sistema nervioso en todos sus niveles, propiciando alteraciones neurológicas como la encefalopatía urémica, problemas cognitivos y desórdenes neuromusculares, como la mononeuropatía, la polineuropatía y la miopatía7.
En una etapa avanzada de la enfermedad renal puede presentarse una anemia severa conocida como anemia renal, la cual es ocasionada por una deficiencia en la producción de eritropoyetina (EPO) por el riñón8-10. Diversos trabajos han reportado que la anemia tiene un impacto negativo en la función cognitiva11,12, debido a la reducción en la capacidad de acarreo de oxígeno lo que promueve un suministro inadecuado del mismo al cerebro13. La hipoxia crónica provoca toxicidad derivada del estrés oxidativo, la que aunada a la acumulación de toxinas urémicas7,14, incrementa la degeneración neuronal12,15. El tratamiento para la anemia en pacientes con ERC, es el uso de agentes estimuladores de eritropoyesis, como la EPO recombinante humana (rHuEPO)10.
Si bien la EPO tiene una función esencial en la eritropoyesis, se han descrito otras funciones no eritropoyéticas, como las actividades antinflamatoria16 y antiapoptótica17, como estimulador de la neurogénesis y la diferenciación neuronal en estadios tempranos del desarrollo18, así como protector tisular de riñón19 y cerebro20,21.
Los efectos neuroprotectores de este factor de crecimiento se han demostrado tanto en modelos celulares17,22, como en diversos modelos animales, en los que el tratamiento con rHuEPO fue capaz de promover la angiogénesis, la neurogénesis y la migración de precursores neurales hacia la zona de lesión, así como la inhibición de la apoptosis a través de la supresión de la secreción de glutamato y la modulación del calcio intracelular23-28. De manera interesante, en estudios clínicos, se ha reportado que la administración de rHuEPO disminuye el deterioro cognitivo a través de la mejora en la memoria y los problemas en el aprendizaje29-31.
En algunos modelos animales de ERC se han evidenciado problemas motores32, así como del aprendizaje y la memoria33. Sin embargo, existe poca evidencia de los efectos neuroprotectores de la EPO en la ERC, por lo que el objetivo de este trabajo fue evaluar el efecto del tratamiento con rHuEPO sobre la actividad sensoriomotora, la memoria y el aprendizaje, cuando es administrada de manera simultánea a la inducción del daño renal en un modelo ERC.
MétodosSujetosSe utilizaron 24 ratas macho de la cepa Wistar (ENVIGO RMS), con peso entre 250-300g al inicio de los experimentos. Se alojaron en cajas de policarbonato translúcidas en un bioterio con temperatura ambiente (25 ± 2 ∘C) y ciclo de luz oscuridad de 12/12h. El acceso al agua y al alimento fue ad libitum. Todas las manipulaciones experimentales se realizaron de acuerdo con los estándares éticos internacionales basados en la Guide for care and use of laboratory animals y nacionales basados en la NOM-062-ZOO-1999, con el código de aprobación interno CICUAL-2016-019.
Grupos experimentales y tratamientosLas ratas fueron asignadas aleatoriamente a los siguientes grupos de estudio: I) control + placebo (n = 5); II) control + rHuEPO (n = 5); III) ERC + placebo (n = 7), y IV) ERC + rHuEPO (n = 7). La inducción de la ERC se realizó mediante la administración de adenina a una dosis de 100mg/kg/día durante 28 días por vía orogástrica34,35. A su vez, los grupos i y iii fueron tratados con placebo (solución salina), mientras que los grupos ii y iv recibieron tratamiento rHuEPO a una dosis de 1,050 UI/kg de peso, mediante inyección subcutánea dorsal, una vez por semana durante 4 semanas. Todas las pruebas conductuales se realizaron de manera simultánea a la inducción del daño renal y el tratamiento.
Toma de muestras, determinación de parámetros bioquímicos y hematológicosAl término del tratamiento y las pruebas conductuales, los animales se colocaron en jaulas metabólicas para la recolección de orina durante 24 h. Posteriormente, se realizó la eutanasia de los animales por sobredosis de anestésico (40-60mg/kg pentobartital sódico vía i.p.), se colectó sangre total con EDTA y suero. Finalmente, se disecaron, midieron y pesaron los riñones. Las determinaciones de creatinina y urea se realizaron por el método de química seca en el equipo Vitros® 250 Ortho Clinical Diagnostics, mientras que la medición de hemoglobina, hematocrito, eritrocitos y reticulocitos se realizó con el analizador hematológico KX-21N Sysmex Corporation.
Prueba de campo abiertoLa prueba de campo abierto permite evaluar de manera general la actividad locomotora y la ansiedad de los animales36. Para realizar la prueba se utilizó un aparato de campo abierto de color blanco de 50cm×50cm×50cm. Las ratas fueron colocadas en el centro del piso del aparato y se les permitió explorar libremente durante 3 min. Las ratas se videograbaron para su posterior análisis. Terminada la prueba, las ratas fueron colocadas en sus respectivas jaulas y el aparato de ensayo se limpió en su totalidad con etanol al 70% después de cada prueba. Los componentes de comportamiento a evaluar fueron: 1) el tiempo de exploración; 2) el tiempo de latencia; 3) el número de intentos de escape y 4) el acicalamiento.
Prueba de remoción de cinta adhesivaEsta prueba permite la evaluación de las funciones somatosensorial y la motora. La prueba consiste básicamente en colocar cinta adhesiva en las extremidades (delanteras o traseras); el desempeño del animal es evaluado mediante la determinación del tiempo necesario para sentir y remover los adhesivos37,38. La prueba consistió en 3 repeticiones por día durante 3 días. A las ratas se les colocaron 2 cintas adhesivas de igual tamaño en las patas anteriores. Las respuestas táctiles se midieron por el tiempo del contacto inicial con la cinta y el tiempo que esta tardó en removerse la cinta. Las ratas que no lograron quitarse las cintas dentro de 60 s se consideraron incapaces de la remoción y se les removió la cinta.
Prueba de laberinto acuático de MorrisEsta prueba se desarrolló en una piscina circular (110cm de diámetro y 60cm de altura) llena de agua (temperatura de 23 ± 2°C) de acuerdo a Tothova et al. con las siguientes modificaciones39. El laberinto se dividió virtualmente en 4 cuadrantes y en la pared de cada cuadrante se colocó una figura geométrica para que funcionara como una pista externa para la orientación del animal. En el centro de alguno de los cuadrantes se colocó una plataforma cuadrada de 10cm×10cm de policarbonato. Las ratas recibieron una fase de entrenamiento que consistió de 4 sesiones diarias durante 3 días seguidos, en donde se les permitió nadar libremente durante un minuto entrando en cada ocasión por cada uno de los 4 cuadrantes para que encontraran la plataforma visible a 1 cm del nivel del agua y en la última prueba la plataforma se sumergió 1 cm sobre el nivel del agua. Los animales que no fueron capaces de llegar a la plataforma dentro de 60 s fueron guiados y colocados sobre ella durante un tiempo de 20 s para permitir la orientación espacial. Cada ensayo fue videograbado para su posterior análisis y los parámetros a evaluar fueron el tiempo de llagada a la plataforma y la distancia recorrida.
Análisis estadísticoLos datos de función renal y anemia fueron analizados mediante ANOVA de una vía, mientras que los datos de las pruebas de actividad locomotora y nado fueron analizados mediante ANOVA de 2 vías para muestras repetidas tomando como factores el tratamiento y los días de entrenamiento. Se consideran las diferencias significativas cuando se alcanzaron valores de p ≤ 0,05 y se aplicó la prueba post hoc de Tukey. Los resultados son presentados como la media ± el error estándar.
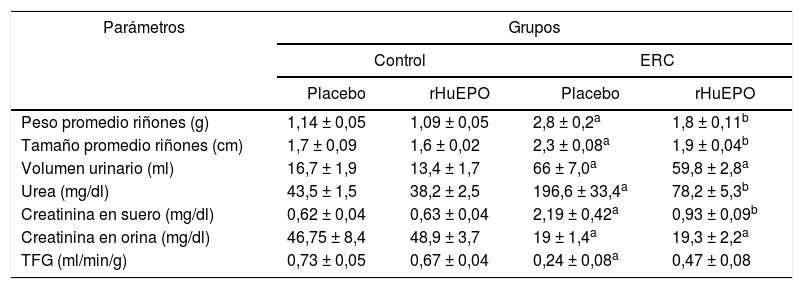
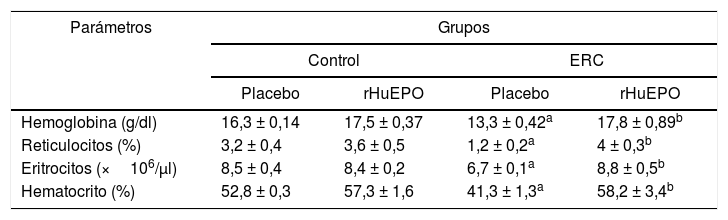
ResultadosEl tratamiento con eritropoyetina humana recombinante reduce el daño en riñón y corrige la anemia renal en las ratas con enfermedad renal crónicaEl análisis de datos de función renal reveló que los animales con ERC presentaron una pérdida significativa de peso corporal (datos no mostrados), así como una disminución de los niveles de creatinina en orina (p < 0,05) y un incremento de creatinina y urea en el suero (p < 0,05). Así mismo, se encontró un incremento del volumen urinario (p < 0,05), así como del tamaño y el peso de los riñones en un 39 y un 152%, respectivamente, en comparación con el grupo control. Esto se traduce en una reducción de la tasa de filtración glomerular (TFG) del 66%, lo que demuestra una pérdida de la función renal en estos animales (tabla 1). Por otra parte, en los parámetros hematológicos se encontró que los animales con ERC presentaron una disminución significativa en las concentraciones de hemoglobina del 21%, del 25% en el hematocrito, el 21% de eritrocitos y el 65% de reticulocitos respecto al grupo control (p < 0,05) (tabla 2).
Marcadores de función renal
| Parámetros | Grupos | |||
|---|---|---|---|---|
| Control | ERC | |||
| Placebo | rHuEPO | Placebo | rHuEPO | |
| Peso promedio riñones (g) | 1,14 ± 0,05 | 1,09 ± 0,05 | 2,8 ± 0,2a | 1,8 ± 0,11b |
| Tamaño promedio riñones (cm) | 1,7 ± 0,09 | 1,6 ± 0,02 | 2,3 ± 0,08a | 1,9 ± 0,04b |
| Volumen urinario (ml) | 16,7 ± 1,9 | 13,4 ± 1,7 | 66 ± 7,0a | 59,8 ± 2,8a |
| Urea (mg/dl) | 43,5 ± 1,5 | 38,2 ± 2,5 | 196,6 ± 33,4a | 78,2 ± 5,3b |
| Creatinina en suero (mg/dl) | 0,62 ± 0,04 | 0,63 ± 0,04 | 2,19 ± 0,42a | 0,93 ± 0,09b |
| Creatinina en orina (mg/dl) | 46,75 ± 8,4 | 48,9 ± 3,7 | 19 ± 1,4a | 19,3 ± 2,2a |
| TFG (ml/min/g) | 0,73 ± 0,05 | 0,67 ± 0,04 | 0,24 ± 0,08a | 0,47 ± 0,08 |
Los datos son presentados como medias ± error estándar (N = 24).
Los valores de p representan los resultados del análisis de varianza ANOVA de una vía. Cuando p < 0,05, se consideró una diferencia significativa.
Datos hematológicos
| Parámetros | Grupos | |||
|---|---|---|---|---|
| Control | ERC | |||
| Placebo | rHuEPO | Placebo | rHuEPO | |
| Hemoglobina (g/dl) | 16,3 ± 0,14 | 17,5 ± 0,37 | 13,3 ± 0,42a | 17,8 ± 0,89b |
| Reticulocitos (%) | 3,2 ± 0,4 | 3,6 ± 0,5 | 1,2 ± 0,2a | 4 ± 0,3b |
| Eritrocitos (×106/μl) | 8,5 ± 0,4 | 8,4 ± 0,2 | 6,7 ± 0,1a | 8,8 ± 0,5b |
| Hematocrito (%) | 52,8 ± 0,3 | 57,3 ± 1,6 | 41,3 ± 1,3a | 58,2 ± 3,4b |
Los datos son presentados como medias ± error estándar (N = 24).
Los valores de p representan los resultados del análisis de varianza ANOVA de una vía. Cuando p < 0,05, se consideró una diferencia significativa.
El tratamiento con rHuEPO reduce de manera significativa el incremento de creatinina y la concentración de urea en el suero observada en los animales con ERC (p < 0,05). Así mismo, se observó que el tratamiento con rHuEPO previene la hipertrofia de los riñones al disminuir 1,5 veces el peso y 1,2 veces el tamaño renal respecto los animales del grupo ERC sin tratamiento (tabla 1). De manera adicional, se observó que los animales tratados con rHuEPO disminuyeron el volumen urinario (9,4%) y aminoraron la TFG en un 33%, aunque sin ser estadísticamente significativo (tabla 1). De manera paralela, se evidenció que el tratamiento con rHuEPO en los animales con ERC fue capaz de corregir la anemia renal, ya que los niveles de hemoglobina, reticulocitos, eritrocitos, así como el porcentaje del hematocrito, regresaron a los niveles basales del grupo control (tabla 2).
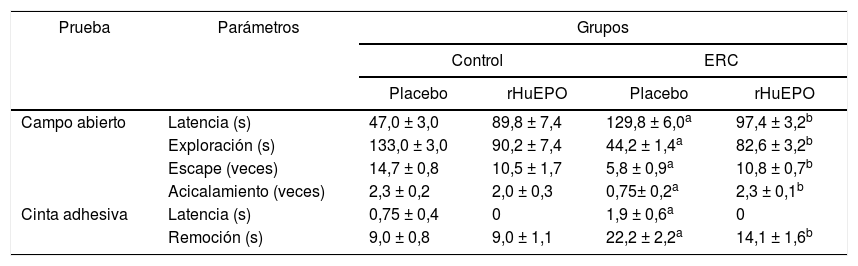
El tratamiento con eritropoyetina humana recombinante reduce la disfunción sensoriomotora de los animales con enfermedad renal crónicaLos animales con ERC incrementaron los tiempos de latencia en las pruebas de campo abierto y cinta adhesiva, aumentando con ello los tiempos de inactividad respecto a los animales del grupo control (p < 0,05) (tabla 3). Estos animales también redujeron de manera significativa los tiempos de exploración, intentos de escape y las veces de acicalamiento en la prueba de campo abierto (p < 0,05); de igual forma, incrementaron el tiempo de remoción de la cinta adhesiva demostrando una respuesta táctil tardía en comparación con el grupo control (p < 0,05) (tabla 3).
Pruebas de conducta sensoriomotora
| Prueba | Parámetros | Grupos | |||
|---|---|---|---|---|---|
| Control | ERC | ||||
| Placebo | rHuEPO | Placebo | rHuEPO | ||
| Campo abierto | Latencia (s) | 47,0 ± 3,0 | 89,8 ± 7,4 | 129,8 ± 6,0a | 97,4 ± 3,2b |
| Exploración (s) | 133,0 ± 3,0 | 90,2 ± 7,4 | 44,2 ± 1,4a | 82,6 ± 3,2b | |
| Escape (veces) | 14,7 ± 0,8 | 10,5 ± 1,7 | 5,8 ± 0,9a | 10,8 ± 0,7b | |
| Acicalamiento (veces) | 2,3 ± 0,2 | 2,0 ± 0,3 | 0,75± 0,2a | 2,3 ± 0,1b | |
| Cinta adhesiva | Latencia (s) | 0,75 ± 0,4 | 0 | 1,9 ± 0,6a | 0 |
| Remoción (s) | 9,0 ± 0,8 | 9,0 ± 1,1 | 22,2 ± 2,2a | 14,1 ± 1,6b | |
Los datos son presentados como medias ± error estándar (N = 24) de la última sesión de prueba. Los valores de p representan los resultados del análisis de varianza ANOVA de una vía. Cuando p < 0,05, se consideró una diferencia significativa.
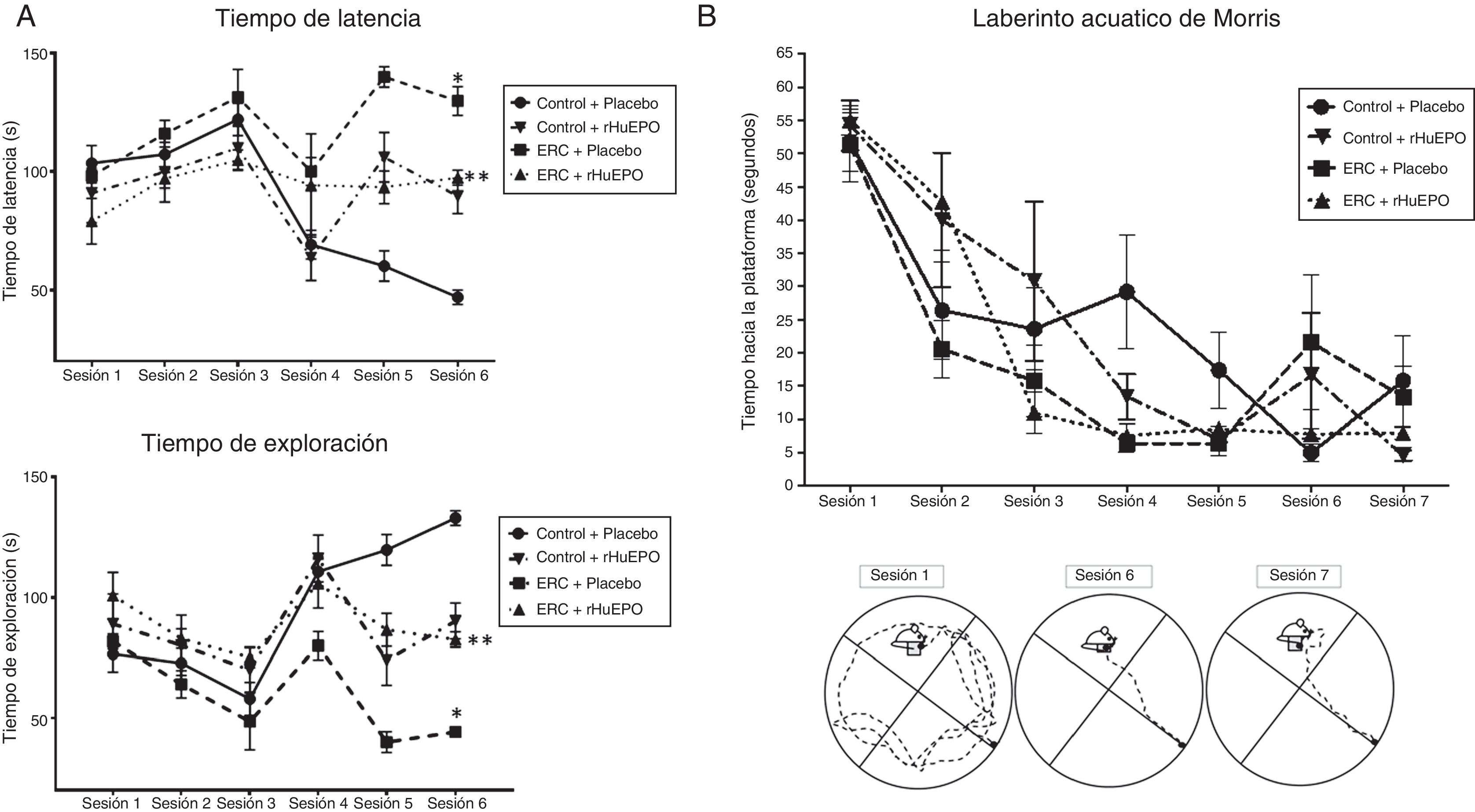
El tratamiento con rHuEPO incrementó de manera significativa los intentos de escape y las veces de acicalamiento en la prueba de campo abierto (p < 0,05), y redujo el tiempo de remoción de la cinta adhesiva respecto a los animales sin tratamiento (tabla 3). De manera interesante, el tratamiento con rHuEPO redujo los tiempos de latencia en ambas pruebas e incrementó el tiempo de exploración observado en los animales con ERC (p < 0,05) (fig. 1A).
Pruebas de conducta. A) Prueba de campo abierto. Se muestran los tiempos de latencia y exploración en cada una de las sesiones. B) Prueba de laberinto acuático de Morris. Se muestran el tiempo de nado hacia la plataforma en cada una de las sesiones y el recorrido representativo de los animales hacia la plataforma.
Los datos son presentados como medias ± error estándar (N = 24). Los valores de p representan los resultados del análisis de varianza ANOVA cuando p < 0,05 se consideró una diferencia significativa *ERC vs. control y **ERC + rHuEPO vs. ERC.
En la prueba del laberinto acuático se encontró una disminución significativa del tiempo de nado hacia la plataforma entre las sesiones de entrenamiento 1 y 4 para todos los grupos de estudio (p < 0,05). Aunque todos los animales mostraron una disminución significativa en el tiempo de nado para encontrar la plataforma en las pruebas 5 a 7, el tratamiento con rHuEPO redujo de manera consistente los tiempos de nado hacia la plataforma a partir de la tercera sesión en los animales con ERC (fig. 1B).
DiscusiónEl objetivo de este trabajo fue evaluar los efectos del tratamiento simultáneo de rHuEPO sobre las funciones sensoriomotoras y cognitivas en un modelo de ERC. La ERC se caracteriza por anormalidades de la estructura y la función renal40. En este estudio se encontró que la administración de adenina –utilizada para la inducción ERC– incrementó las concentraciones de urea y creatinina en suero; redujo la TFG y provocó anemia renal, lo que coincide con lo reportado previamente para este modelo32,41. El tratamiento con rHuEPO en las ratas con ERC corrigió la anemia y disminuyó el daño renal de manera similar a Coldewey et al., quienes encontraron que la administración de EPO atenuaba la disfunción renal aguda en un modelo murino de sepsis42.
Debido a que las pruebas conductuales se realizaron de manera simultánea a la inducción del daño renal, se logró observar una disfunción sensoriomotora progresiva, ya que los animales con ERC presentaron un incremento paulatino de los tiempos de latencia en las pruebas conductuales, además de una reducción en la capacidad de remoción de la cinta adhesiva, los tiempos de exploración, los intentos de escape y las veces de acicalamiento. Estos efectos son similares a lo descrito por Mazumder et al. y Karthick et al., quienes observaron que los animales con daño renal presentaban un mayor tiempo de inactividad (2-3 veces) en las pruebas de conducta33,43. Los cambios en el comportamiento durante la ERC pudieran ser atribuidos a un incremento de las concentraciones de urea en el plasma y a una reducción de la TFG, lo que generaría un estado neurotóxico debido a la acumulación de las toxinas urémicas, promoviendo la neurodegeneración2,44. Así también, estos cambios pudieran estar asociados al estado anémico en la enfermedad renal, lo que contribuye a la reducción del suministro de oxígeno al cerebro y, por lo tanto, a una mayor distribución de las toxinas urémicas alterando el metabolismo cerebral12,45.
Si bien algunos trabajos no se lograron observar los efectos del tratamiento con EPO sobre las funciones cognitivas46,47, diversos estudios sí demuestran efectos favorables sobre las funciones motoras, el aprendizaje y la memoria25,27,33,48.
Nuestros resultados demuestran que el tratamiento con rHuEPO reduce los tiempos de latencia e incrementa los tiempos de exploración, además de reducir el tiempo de remoción de la cinta adhesiva, por lo que demuestra una mejora del daño sensoriomotor presente en los animales con ERC. Esto, de manera similar a trabajos previos, donde el tratamiento preventivo con una dosis única de EPO mejoró el desempeño de los animales en las pruebas de motricidad tanto en modelos de trauma cerebral inducido28,46 e isquemia49, así como en un modelo de ERC inducido por la administración de adenina, donde el tratamiento simultáneo y postratamiento con EPO mejoró los efectos sobre la conducta33.
Finalmente, es importante mencionar que en este estudio se encontró una ligera alteración de las funciones cognitivas de la memoria y el aprendizaje durante la inducción de la ERC. De acuerdo con lo reportado por Tothova et al., la duración del estudio es importante para observar las alteraciones cognitivas en ratas con daño renal39. A diferencia de otros estudios, donde se pudo observar una mayor afectación de la memoria y el aprendizaje después de varias semanas de establecida la falla renal50,51. Esto se debe a que el deterioro cognitivo se encuentra asociado a la severidad de la ERC a consecuencia la uremia y el estado anémico, lo que conlleva a un estado crónico de hipoxia en el cerebro52.
En conclusión, aunque se observaron ligeros cambios en las funciones cognitivas después de 4 semanas, la inducción del daño renal con adenina provocó cambios sensoriomotores progresivos en estos animales. El tratamiento simultáneo con rHuEPO corrigió la anemia y redujo la uremia y el daño en el riñón; lo que puede estar asociado a la disminución de disfunción sensoriomotora observada en los animales con ERC.
FinanciaciónEste fue un proyecto apoyado por el Fondo Sectorial de Investigación para la Educación (Ciencia Básica SEP-CONACyT) con el número 243118, cuyo responsable técnico es la Dra. Ana Laura Márquez.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.