La inflamación relacionada con la angiopatía amiloide es una entidad caracterizada por una respuesta inflamatoria alrededor de los depósitos de beta amiloide de la microcirculación cerebral.
MétodosRevisión retrospectiva de una serie de pacientes con inflamación relacionada con angiopatía amiloide, que cumplieran criterios clínico-radiológicos o con diagnóstico histopatológico confirmado.
ResultadosSe incluyeron siete pacientes, cinco varones, con edad media de 79 años. El inicio fue agudo o subagudo en seis de los casos. La clínica más frecuente fue deterioro cognitivo (n = 6), alteraciones de conducta (n = 5), crisis epilépticas (n = 5), focalidad neurológica (n = 4) y cefalea (n = 2). El líquido cefalorraquídeo fue anormal en tres de cinco casos (pleocitosis linfocitaria e hiperproteinorraquia). Las imágenes de resonancia magnética cerebral más frecuentes consistieron en microhemorragias (n = 7), hiperintensidades subcorticales en secuencia T2-FLAIR (n = 7) y realce leptomeníngeo (n = 6). La afectación fue bilateral en tres de los casos, con predominio en regiones parieto-occipitales (n = 5). Se realizó una tomografía por emisión de positrones (PET) de amiloide en dos pacientes, resultando positiva en uno. Se obtuvo la confirmación histopatológica mediante una biopsia en dos de los casos. Todos los sujetos recibieron tratamiento inmunosupresor, objetivándose una respuesta clínica y radiológica inicial favorable, con recaída radiológica en dos de los casos tras la retirada del tratamiento, y mejorando tras la reinstauración.
ConclusionesEl diagnóstico resulta imprescindible de cara a iniciar un tratamiento precoz, ya que ha demostrado mejorar el pronóstico y disminuir las recurrencias. Si bien el diagnóstico definitivo es histopatológico, los criterios clínico-radiológicos permiten el diagnóstico de esta entidad sin necesidad de biopsia.
Cerebral amyloid angiopathy–related inflammation (CAA-ri) is an entity characterised by an inflammatory response to β-amyloid deposition in the walls of cerebral microvessels.
MethodsWe conducted a retrospective review of a series of patients with a diagnosis of CAA-ri according to histopathological study findings or clinical-radiological diagnostic criteria.
ResultsThe study included 7 patients (5 men) with a mean age of 79 years. Disease onset was acute or subacute in 6 patients. The most frequent symptoms were cognitive impairment (n = 6), behavioural alterations (n = 5), epileptic seizures (n = 5), focal neurological signs (n = 4), and headache (n = 2). Cerebrospinal fluid was abnormal in 3 patients (lymphocytic pleocytosis and high protein levels). The most frequent MRI findings were microbleeds (n = 7), subcortical white matter hyperintensities on T2-FLAIR sequences (n = 7), and leptomeningeal enhancement (n = 6). Lesions were bilateral in 3 patients and most frequently involved the parieto-occipital region (n = 5). Amyloid PET studies were performed in 2 patients, one of whom showed pathological findings. Two patients underwent brain biopsy, which confirmed diagnosis. All patients received immunosuppressive therapy. An initially favourable clinical-radiological response was observed in all cases, with 2 patients presenting radiological recurrence after treatment withdrawal, with a subsequent improvement after treatment was resumed.
ConclusionsEarly diagnosis of CAA-ri is essential: early treatment has been shown to improve prognosis and reduce the risk of recurrence. Although a histopathological study is needed to confirm diagnosis, clinical-radiological criteria enable diagnosis without biopsy.
La angiopatía amiloide cerebral (AAC) se produce por depósito de beta-amiloide (Aβ) en la capa media y adventicia de la microcirculación de la corteza cerebral y las leptomeninges, especialmente en arteriolas, capilares y, menos frecuentemente, en vénulas1,2. Existe una complicación de la AAC conocida como inflamación relacionada con angiopatía amiloide cerebral (AA-ri). La AA-ri es una entidad rara, aunque cada vez más reconocida, caracterizada por una respuesta inflamatoria vascular o perivascular alrededor de los depósitos de amiloide3. Se han descrito dos subtipos patológicos de AA-ri: la AAC inflamatoria (AACI), definida por una inflamación perivascular, sin destrucción de los vasos, y la angeítis relacionada con β-amiloide (ARBA), cuando la afectación es transmural o intramural, a menudo con formación de granulomas, constituyendo un proceso angiodestructivo. Recientemente, algunos autores han propuesto incluir a la ARBA como un subgrupo dentro de la vasculitis primaria del sistema nervioso central, mientras que otros la engloban dentro de un continuo en el espectro de la AA-ri4, siendo frecuente que un mismo paciente presente a la vez características de ambas entidades5,6.
En este trabajo, nos proponemos describir los aspectos clínicos más importantes de esta entidad poco frecuente, así como las características de imagen e histopatológicas, tratamiento y pronóstico, a partir de la información obtenida de una serie de siete casos de nuestro centro con AA-ri, así como una revisión narrativa de la literatura.
Pacientes y métodosDiseño del estudio, localización y participantesEn este estudio retrospectivo, llevado a cabo en un único centro, se identificaron todos los pacientes con diagnóstico de AA-ri valorados en un hospital universitario entre los años 2005 y 2020.
Recogida de datos y variablesSe incluyó a los sujetos si cumplían con los criterios diagnósticos clínico-radiológicos propuestos por Auriel et al.7 en 2016 para AA-ri probable o posible (tabla 1), o si tenían diagnóstico histopatológico confirmado. Los principales datos demográficos y clínicos se recopilaron del registro hospitalario, que desde el 2011 solo utiliza medios de registro electrónicos, que incluyen datos de pacientes hospitalizados y ambulatorios. En la recogida de datos se incluyeron las siguientes variables:
- 1)
Demográficos: edad en el momento del diagnóstico, sexo y año del diagnóstico.
- 2)
Antecedentes personales relevantes.
- 3)
Clínica más frecuente a destacar: deterioro cognitivo, alteración de conducta, crisis epilépticas, focalidad neurológica, cefalea y otros síntomas como alucinaciones visuales, auditivas o insomnio.
- 4)
La forma de aparición de la clínica se definió como: aguda (< 48 horas), subaguda (entre 48 horas y cuatro semanas) o crónica (> cuatro semanas).
- 5)
Parámetros analíticos, en concreto se registraron los valores de velocidad de sedimentación globular (VSG) como reactante de fase aguda e indicador de inflamación en cuatro pacientes.
- 6)
Valores de líquido cefalorraquídeo (LCR), que se analizó en cinco casos, utilizando métodos estandarizados de recolección, centrifugación y almacenamiento.
- 7)
Pruebas de imagen, llevadas a cabo en todos los pacientes: una tomografía axial computarizada (TAC) craneal al inicio y resonancia magnética (RMN) cerebral, con secuencias T2-FLAIR y difusión (DWI) entre otras, así como tras la administración de contraste. La presencia y número de microhemorragias se evaluó en secuencia de susceptibilidad magnética (SWAN) y/o eco de gradiente.
- 8)
Estudio electroencefalográfico (EEG), llevado a cabo en cinco pacientes.
- 9)
Tomografía por emisión de positrones (PET) de amiloide con Florbetapir: se realizó en dos de los casos.
- 10)
Datos histopatológicos mediante biopsia cerebral en dos de los sujetos.
- 11)
Tratamiento: revisión de los tratamientos recibidos, tanto sintomáticos como inmunomoduladores.
- 12)
Datos de seguimiento, incluyendo los resultados principales, el estado de discapacidad evaluado mediante la escala Rankin modificada (mRs) y/o la presencia de recurrencia clínica o radiológica.
Criterios diagnósticos clínico-radiológicos de inflamación relacionada con angiopatía amiloide (AA-ri)
| Diagnóstico | |
|---|---|
| AA-ri probable | 1. Edad ≥ 40 años2. Presencia de ≥ 1 de las siguientes características clínicas: cefalea, disminución del nivel de consciencia, alteraciones conductuales, focalidad neurológica o crisis; la presentación no es atribuible directamente a una hemorragia intracraneal aguda3. RMN muestra hiperintensidades de sustancia blanca unifocales o multifocales (corticosubcorticales o profundas) que son asimétricas y se extienden a la sustancia blanca subcortical; la asimetría no se debe a la hemorragia intracraneal pasada4. Presencia de ≥ 1 de las siguientes lesiones hemorrágicas corticosubcorticales: macrohemorragias, microhemorragias cerebrales o siderosis cortical superficial5. Ausencia de neoplasia, infección u otra causa |
| AA-ri posible | 1. Edad ≥ 40 años2. Presencia de ≥ 1 de las siguientes características clínicas: cefalea, disminución del nivel de consciencia, alteraciones conductuales, focalidad neurológica o crisis; la presentación no es atribuible directamente a una hemorragia intracraneal aguda3. RMN muestra hiperintensidades de sustancia blanca que se extienden a la sustancia blanca subcortical4. Presencia de ≥1 de las siguientes lesiones hemorrágicas corticosubcorticales: macrohemorragias, microhemorragias cerebrales o siderosis cortical superficial5. Ausencia de neoplasia, infección u otra causa |
RMN: resonancia magnética.
Fuente: modificado de Auriel et al.7
Se realizó una búsqueda en PubMed y Medline el 30 de septiembre del 2020 en busca de artículos que describieran las principales características clínicas, radiológicas, histopatológicas y terapéuticas de la AA-ri. Se usaron los términos «inflammatory cerebral amyloid angiopathy» o «amyloid angiopathy-related inflammation» o «amyloid-beta-related angiitis». Las búsquedas electrónicas se complementaron con la búsqueda manual entre las referencias de los artículos relevantes.
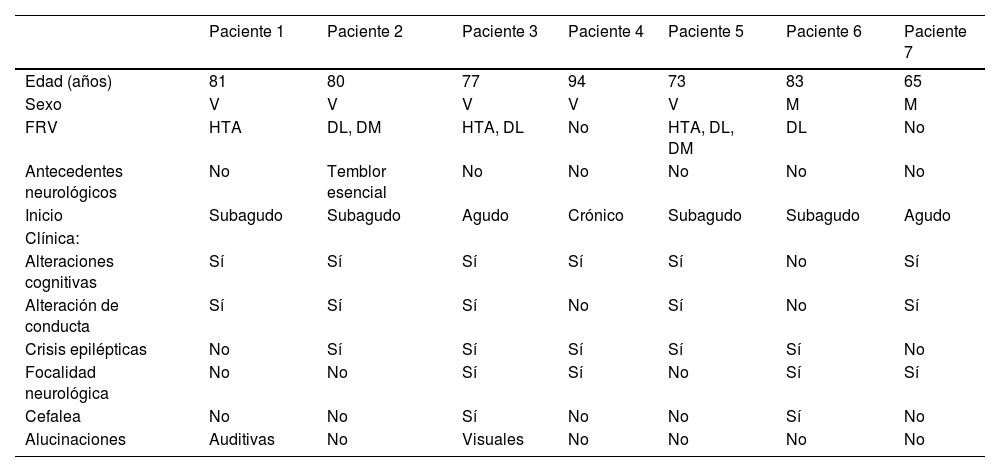
ResultadosSe incluyeron siete pacientes, de los cuales cinco fueron varones. Los principales datos demográficos y antecedentes se resumen en la tabla 2. La edad media al diagnóstico fue 79 años (rango 65 a 94). De ellos, dos tenían diagnóstico definitivo (confirmación histológica) y en cinco era probable, de acuerdo con los criterios de Auriel et al.7 (tabla 1). Entre los antecedentes personales más relevantes, destacaban los factores de riesgo vascular, como hipertensión arterial en tres de los pacientes y diabetes mellitus en dos. Ninguno tenía historia previa de deterioro cognitivo, epilepsia ni otros antecedentes neurológicos relevantes y en ninguno de los casos existía diagnóstico previo de AAC.
Principales datos demográficos y clínicos de los pacientes
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | |
|---|---|---|---|---|---|---|---|
| Edad (años) | 81 | 80 | 77 | 94 | 73 | 83 | 65 |
| Sexo | V | V | V | V | V | M | M |
| FRV | HTA | DL, DM | HTA, DL | No | HTA, DL, DM | DL | No |
| Antecedentes neurológicos | No | Temblor esencial | No | No | No | No | No |
| Inicio | Subagudo | Subagudo | Agudo | Crónico | Subagudo | Subagudo | Agudo |
| Clínica: | |||||||
| Alteraciones cognitivas | Sí | Sí | Sí | Sí | Sí | No | Sí |
| Alteración de conducta | Sí | Sí | Sí | No | Sí | No | Sí |
| Crisis epilépticas | No | Sí | Sí | Sí | Sí | Sí | No |
| Focalidad neurológica | No | No | Sí | Sí | No | Sí | Sí |
| Cefalea | No | No | Sí | No | No | Sí | No |
| Alucinaciones | Auditivas | No | Visuales | No | No | No | No |
DL: dislipemia; DM: diabetes mellitus; FRV: factores de riesgo vascular; HTA: hipertensión arterial; M: mujer; V: varón.
Las características clínicas también se exponen en la tabla 2, destacando los síntomas de deterioro cognitivo (n = 6), alteración de conducta (n = 5), crisis epilépticas (n = 5), focalidad neurológica (n = 4) y cefalea (n = 2). Menos frecuentes fueron otros síntomas como las alucinaciones visuales (n = 1), auditivas (n = 1) o el insomnio (n = 1).
Los resultados de las pruebas complementarias se resumen en la tabla 3. En cuanto a parámetros de laboratorio, se detectó VSG discretamente elevada en dos de cuatro muestras analizadas. El LCR fue anormal en tres de cinco pacientes a los que se les realizó punción lumbar.
Principales características de las pruebas complementarias
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | |
|---|---|---|---|---|---|---|---|
| VSG | 37 | 13 | 11 | - | 16 | - | - |
| LCR | |||||||
| Pleocitosis | No | 30 células | No | - | No | No | - |
| Hiperproteinorraquia | Sí (1,02) | Sí (0,87) | No | - | No | Sí (0,81) | - |
| BOC | Sí | Sí | Sí | - | No | No | - |
| EEG | Normal | Actividad lenta persistente en región posterior del hemisferio derecho | PLEDS-plus en región posterior del hemisferio derecho | - | Lento difuso | Lento difuso | - |
| TAC | Hipodensidades subcorticales | Hipodensidades subcorticales | Hipodensidades subcorticales | Hipodensidades subcorticales | Normal | Hipodensidades subcorticales | Hipodensidadessubcorticales |
| RMN | |||||||
| Hiperintensidad subcortical FLAIR | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Localización lesiones | Parietooccipital/temporal | Parietooccipital/temporal | Parietooccipital/temporal | Parietooccipital | Temporal | Parietooccipital | Parietooccipital |
| Afectación bilateral | Sí | Sí | No | No | Sí | No | No |
| Efecto masa | Sí | No | No | No | No | No | No |
| Realce leptomeníngeo tras gadolinio | Sí | Sí | Sí | Sí | Sí | Sí | No |
| Siderosis superficial cortical | Sí | No | Sí | No | Sí | No | Sí |
| Microhemorragias lobares | >10 | >10 | < 10 | >10 | >10 | >10 | >10 |
| Microhemorragias profundas | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Predominio microhemorragias en zona hiperintensa | Sí | Sí | Sí | No | No | Sí | No |
| PET amiloide | Positivo | Negativo | |||||
| Biopsia | Patológica | Patológica | |||||
BOC: bandas oligoclonales; EEG: estudio electroencefalográfico; FLAIR: Fluid Attenuated Inversion Recovery; LCR: líquido cefalorraquídeo; PET: tomografía por emisión de positrones; PLEDs: descargas epileptiformes periódicas lateralizadas; RMN: resonancia magnética; TAC: tomografía axial computarizada; VSG: velocidad de sedimentación globular.
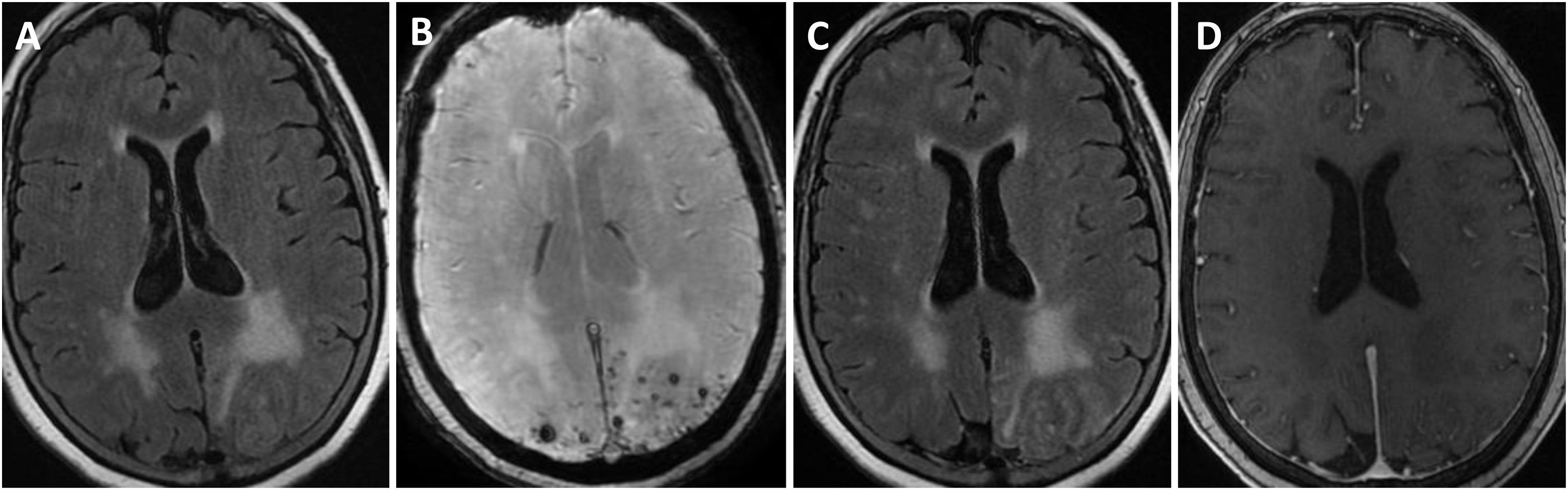
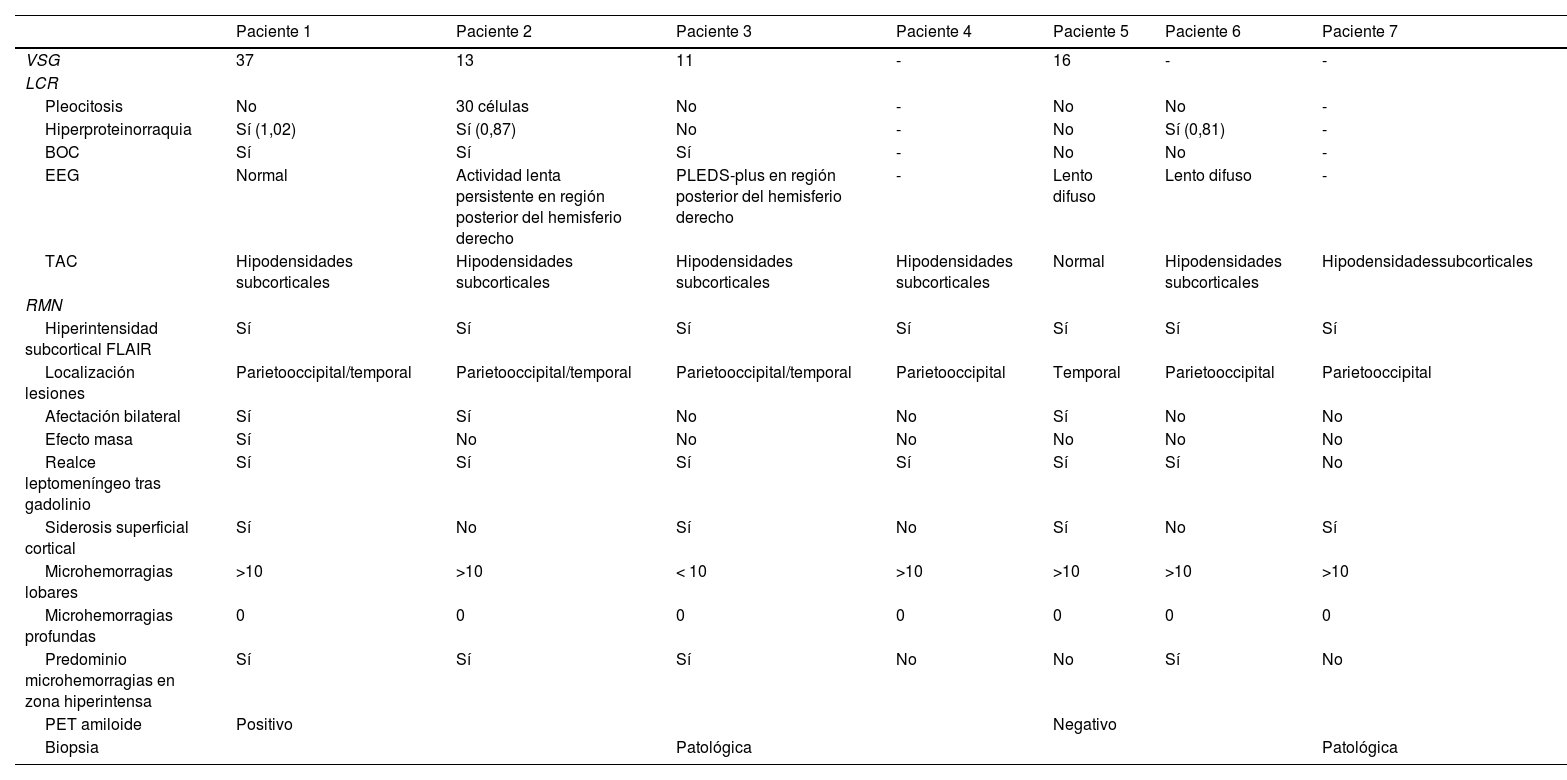
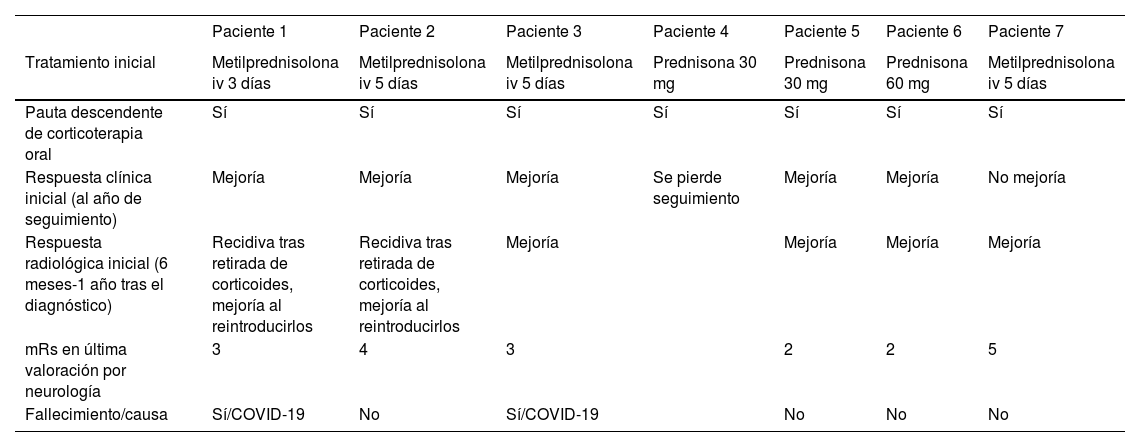
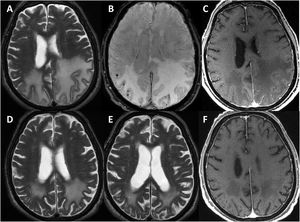
Se efectuó un TAC craneal inicialmente en todos los pacientes, observándose hipodensidades subcorticales en seis de ellos. Asimismo, a todos se les realizó RMN cerebral durante los primeros días de ingreso hospitalario, cuyas características fundamentales quedan también expuestas en la tabla 3. En todos los sujetos se observaba hiperintensidad subcortical extensa en la secuencia FLAIR, unilateral (n = 4) o bilateral asimétrica (n = 3), con claro predominio en regiones posteriores. El resto de los hallazgos principales fueron microhemorragias lobares (n = 7), siderosis superficial cortical (n = 4) y realce leptomeníngeno en la región adyacente a la hiperintensidad de señal subcortical (n = 6). Ningún paciente presentaba microhemorragias profundas. La figura 1 ilustra los principales hallazgos de neuroimagen en uno de los casos.
Hallazgos de RM craneal en la inflamación relacionada con Angiopatía amiloide (paciente 6).
Mujer de 83 años, con cuadro agudo de desorientación, confusión y crisis epiléptica. La resonancia magnética (RM) craneal muestra afectación de la sustancia blanca parietal bilateral, de predominio izquierdo (A). Asocia múltiples microhemorragias de distribución cortical en el margen posterior de ambos lóbulos parietales en susceptibilidad magnética (B) y captación leptomeníngea en el interior de los surcos que se identifica con mayor claridad en secuencias FLAIR (C) que en secuencias potenciadas en T1 con contraste (D).
Se obtuvo un electroencefalograma anormal en cuatro de los cinco pacientes en los que se llevó a cabo.
En dos de los sujetos se realizó PET de amiloide, obteniéndose resultado positivo en uno de ellos.
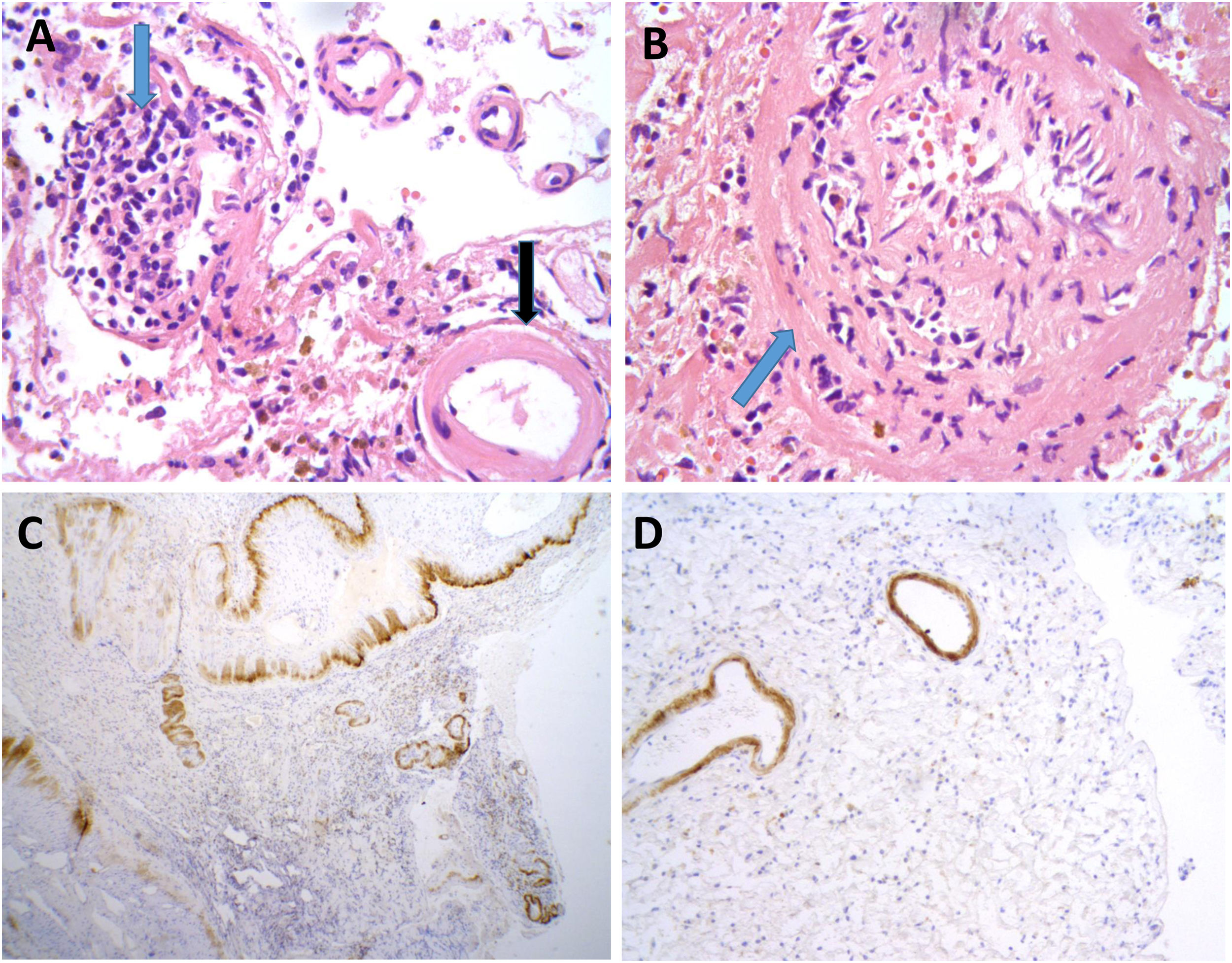
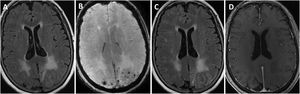
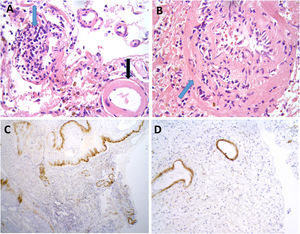
Se llevó a cabo una biopsia cerebral en dos casos, observándose en ambos, depósitos de amiloide en las paredes de los vasos de la corteza y leptomeninge, así como infiltrado inflamatorio transmural, hallazgos sugestivos de AA-ri tipo ARBA (fig. 2).
Hallazgos neuropatológicos en la biopsia cerebral de uno de los casos de inflamación relacionada con angiopatía amiloide (paciente 3).
Vasos de leptomeninge con paredes engrosadas, hialinas (A, flecha negra). Existen infiltrados inflamatorios linfocitarios que focalmente se encuentran invadiendo la pared de vasos sanguíneos con datos focales de cariorrexis (A y B, flechas azules). No se identifica necrosis fibrinoide, células gigantes ni granulomas. Las paredes de los vasos engrosados muestran positividad inmunohistoquímica para Beta amiloide (C y D).
Respecto al tratamiento, todos los pacientes recibieron glucocorticoides. En los casos que presentaban crisis epilépticas, se asoció terapia antiepiléptica según el criterio de los médicos tratantes. Las pautas de tratamiento y datos de seguimiento se especifican en la tabla 4.
Tratamiento y seguimiento en los siete pacientes analizados
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | |
|---|---|---|---|---|---|---|---|
| Tratamiento inicial | Metilprednisolona iv 3 días | Metilprednisolona iv 5 días | Metilprednisolona iv 5 días | Prednisona 30 mg | Prednisona 30 mg | Prednisona 60 mg | Metilprednisolona iv 5 días |
| Pauta descendente de corticoterapia oral | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Respuesta clínica inicial (al año de seguimiento) | Mejoría | Mejoría | Mejoría | Se pierde seguimiento | Mejoría | Mejoría | No mejoría |
| Respuesta radiológica inicial (6 meses-1 año tras el diagnóstico) | Recidiva tras retirada de corticoides, mejoría al reintroducirlos | Recidiva tras retirada de corticoides, mejoría al reintroducirlos | Mejoría | Mejoría | Mejoría | Mejoría | |
| mRs en última valoración por neurología | 3 | 4 | 3 | 2 | 2 | 5 | |
| Fallecimiento/causa | Sí/COVID-19 | No | Sí/COVID-19 | No | No | No |
iv: vía intravenosa; mRs: escala Rankin modificada.
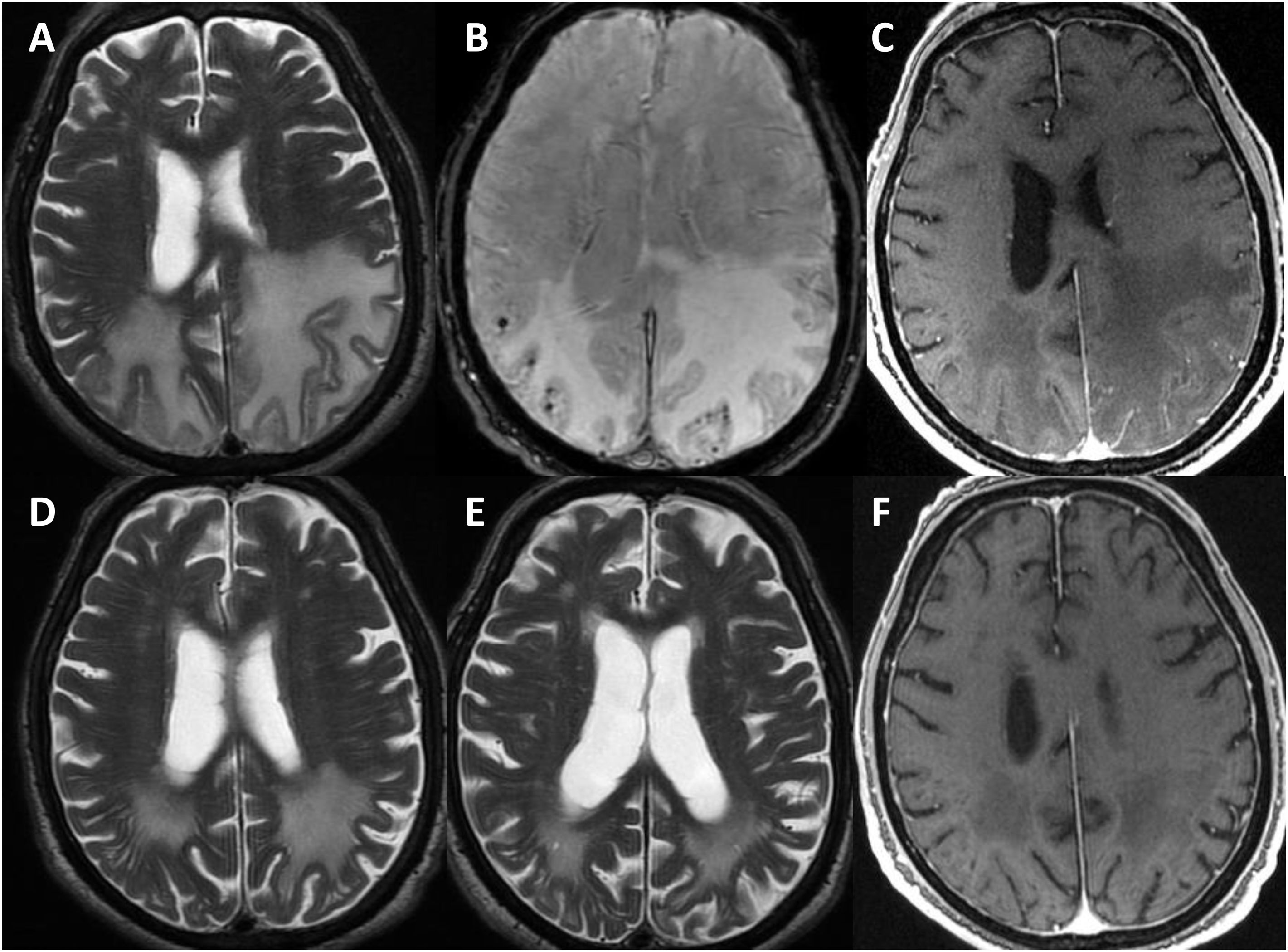
Se perdió el seguimiento de uno de los pacientes. El resto continuó durante una media de 3,25 años (rango 0,5 a 6 años). En todos los casos, se hizo al menos una RMN cerebral de control a los seis meses-un año desde el diagnóstico (fig. 3), constatándose en dos un empeoramiento radiológico tras la retirada de los corticoides, con mejoría posterior tras su reintroducción. Al final del seguimiento, dos pacientes habían fallecido en el contexto de la pandemia de COVID-19. Ambos, según los últimos informes de los que se disponía poco tiempo antes del deceso, presentaban un grado moderado de discapacidad (mRs 3). De los cuatro restantes, dos presentaron una evolución favorable, con un grado aceptable de autonomía (mRs < 3), y los otros evolucionaron de forma tórpida, con deterioro cognitivo progresivo y dependencia para las actividades básicas e instrumentales de la vida diaria (mRs > 3).
Evolución radiológica del paciente 1 (varón de 81 años).
La resonancia magnética (RM) craneal muestra extensa afectación de la sustancia blanca de ambos lóbulos parietales en secuencias potenciadas en T2, asimétrica y con importante efecto de masa en el hemisferio izquierdo (A). Coincidiendo con la afectación de sustancia blanca, existen múltiples microhemorragias de distribución cortical en susceptibilidad magnética (B) y una captación leptomeníngea de predominio izquierdo (C). La RM de control realizada un mes (D) y tres meses tras tratamiento con corticoides muestra importante disminución de la afectación de sustancia blanca (E), resolución del efecto de masa y de la captación meníngea (F).
La AA-ri constituye un problema clínico creciente y probablemente continúe aumentando en el futuro dado el envejecimiento de la población. Presentamos una serie de siete pacientes de nuestro centro con dicho diagnóstico, con el objetivo de describir sus características demográficas, clínicas, de laboratorio y de neuroimagen, así como el manejo realizado y su evolución posterior, comparando nuestros hallazgos con lo previamente descrito en la literatura.
En nuestra serie, la edad media al diagnóstico (79 años) es superior a los datos de revisiones previas, que sitúan la edad media en torno a 67 años, lo cual encaja con la estrecha relación que existe entre la edad avanzada y la patología cerebral relacionada con el amiloide. El predominio masculino (71%) es mayor que el encontrado en otros trabajos, que situaban la frecuencia masculina en torno al 55%3,8.
La AA-ri puede cursar con una amplia variedad de síntomas, siendo los más comúnmente descritos tanto en la literatura como en nuestro trabajo, el deterioro cognitivo, las crisis epilépticas y la cefalea9. En nuestra serie, es llamativo el hallazgo de alteraciones de la conducta en la mayoría de los pacientes. A diferencia de la AAC clásica, en la AA-ri la hemorragia intracerebral es infrecuente como forma de presentación inicial. El comienzo de la clínica en nuestra serie fue agudo o subagudo en la mayoría de los casos, a diferencia de la evolución crónica o insidiosa inicial descrita en series previas3.
En ocasiones, el diagnóstico de la AA-ri puede constituir un verdadero desafío. El diagnóstico definitivo requiere confirmación histológica. Dado que la biopsia cerebral es un procedimiento invasivo no exento de riesgos10,11, en los últimos años se han propuesto nuevos criterios12. Chung et al. propusieron unos lineamientos clínico-radiológicos para el diagnóstico de AA-ri13, validados posteriormente por Auriel et al. en una cohorte de 17 pacientes con diagnóstico confirmado mediante biopsia. Informaron de una sensibilidad de 82% y una especificidad de 97% para sus criterios7. Aunque sus conclusiones están limitadas por el bajo número de sujetos, los lineamientos propuestos están en consonancia con los hallazgos encontrados en nuestra serie y en algunas revisiones sistemáticas3. De hecho, cabe señalar, que en los dos pacientes de nuestro trabajo en los que se llevó a cabo una biopsia cerebral, se podría haber llegado al diagnóstico de AA-ri posible o probable, empleando dichos criterios clínico-radiológicos, que fueron propuestos años después de la presentación clínica de los pacientes.
Las pruebas de imagen desempeñan un papel muy importante en la identificación de esta entidad. Las lesiones más comunes consisten en hipodensidades subcorticales en el TAC craneal, e hiperintensidades en RMN ponderada en T2-FLAIR, encontrando este hallazgo en la totalidad de nuestros pacientes. El realce leptomeníngeo tras la administración de contraste es más habitual en la AA-ri que en la AAC clásica, estando descrito en el 70% de personas con inflamación perivascular (frente a un 86% en nuestro trabajo), pero solo en el 7% de aquellas con AAC no inflamatoria. No es infrecuente que, en ocasiones, la imagen produzca efecto de masa, como ocurre en el caso del paciente 1 de nuestra serie, simulando una neoplasia del sistema nervioso central5. La secuencia SWAN o eco de gradiente tiene gran relevancia en esta entidad para la detección de microhemorragias, que según revisiones previas se encuentran en más del 80% de casos, habiéndose detectado en el 100% de nuestros pacientes. En la AA-ri aún está por determinarse si las microhemorragias constituyen una manifestación de la angiopatía amiloide subyacente, o si, por el contrario, guardan relación con los mecanismos vinculados con la inflamación14. Llama la atención en nuestro trabajo que la totalidad de microhemorragias detectadas han sido superficiales, ninguna profunda, en un número superior a 10 en la mayoría de casos y coincidiendo, sobre todo, en la zona hiperintensa. Las lesiones que hemos identificado tienen un predominio por regiones parietooccipitales, lo cual se ajusta a la localización dominante descrita en estudios previos3,15. La AA-ri se manifiesta frecuentemente en neuroimagen como lesiones multifocales y bilaterales.
Es habitual detectar un LCR anormal en los pacientes con AA-ri, siendo la hiperproteinorraquia y la pleocitosis los hallazgos más frecuentes, como ocurre en la mayoría de nuestros sujetos a los que se les realizó punción lumbar. Además, esta enfermedad está asociada con un perfil de biomarcadores en LCR similar al observado en AAC, incluyendo niveles bajos de Aβ 1-40 (Aβ40) y 1-42 (Aβ42). La disminución de Aβ40 en LCR se ha relacionado con un mayor recuento de microhemorragias y con la presencia de siderosis en la superficie cortical, lo que sugiere que Aβ40 podría considerarse un biomarcador potencial de riesgo de hemorragia en trastornos relacionados con AAC14,16,17. En algunos trabajos, se han identificado anticuerpos específicos anti-Aβ en el LCR de pacientes con AA-ri18,19. Este hallazgo se apoya en que los cambios en neuroimagen y algunas características clínicas de esta entidad, se habían detectado previamente en algunas personas con enfermedad de Alzheimer tratadas con anticuerpos monoclonales anti-amiloide (ARIA), lo que sugiere un posible papel de estos anticuerpos en la patogenia del padecimiento. Además, dicho marcador podría constituir no solo una herramienta diagnóstica sino también de actividad, ya que se demostraron títulos elevados de autoanticuerpos anti-Aβ durante las fases más activas de la enfermedad, con un retorno a niveles basales en fases de remisión20.
Aunque todavía no se incluyen de forma rutinaria en la práctica clínica, la validación de los valores de corte experimentales está siendo investigada activamente21 y podría plantearse como una herramienta futura para el diagnóstico de la AA-ri y su respuesta al tratamiento22,23.
Las imágenes de PET con ligandos de amiloide (como el efectuado en dos de nuestros pacientes), también pueden ser útiles para sospechar la AA-ri, si bien es cierto que no discriminan bien entre depósitos vasculares y parenquimatosos5,15,22 y los artículos publicados hasta ahora reconocen que los resultados deben interpretarse con precaución14. Los análisis cualitativos del PET de amiloide, basados en la visualización por parte del médico nuclear de dos o más áreas corticales positivas, hacen que la sensibilidad de la prueba no sea del 100%. Por tanto, un resultado negativo del PET amiloide no excluye el diagnóstico de AAC en ciertos contextos. De hecho, existen casos documentados de ciertas angiopatías amiloides con mutaciones de APP confirmatorias, que presentan negatividad en el PET amiloide24,25.
Como tratamiento de la AA-ri se han propuesto diversos agentes inmunosupresores26–30, sin que, hasta la fecha, se hayan identificado los regímenes óptimos de tratamiento, e incluso se han descrito mejorías espontáneas en ausencia de inmunosupresores28. Regenhardt et al.23 han llevado a cabo recientemente una investigación en la que se concluyó que los individuos que recibieron terapia inmunosupresora mostraron mejoría clínica y radiológica, así como menos recurrencias durante el período de seguimiento.
Los efectos beneficiosos del tratamiento parecen demostrarse incluso en pacientes que tan solo reciben un ciclo corto de corticoesteroides, y no solo en aquellos en los que se emplean otras terapias inmunosupresoras como la ciclofosfamida. De hecho, en nuestro trabajo, todos recibieron únicamente tratamiento corticoideo, observándose una mejoría clínica y/o radiológica inicial en casi la totalidad de los casos.
Las principales limitaciones de nuestro estudio son su diseño retrospectivo (por lo que la información sobre algunas variables podría estar incompleta, si bien se intentaron revisar cuidadosamente todas las notas clínicas en la historia electrónica) y el pequeño tamaño de la muestra (n = 7), aunque constituye una de las series más grandes elaboradas en nuestro medio.
ConclusionesLa AA-ri es una entidad infrecuente, pero con un número de descripciones creciente en los últimos años. Su diagnóstico precoz resulta imprescindible, ya que es una entidad tratable, en la que el tratamiento en fases tempranas ha demostrado mejorar el pronóstico tanto en términos de supervivencia como de funcionalidad y recurrencias. Si bien el diagnóstico de certeza es histopatológico, los criterios clínicos-radiológicos propuestos tienen buena sensibilidad y excelente especificidad, lo que nos permite llegar al diagnóstico sin necesidad de recurrir a una biopsia cerebral.
FinanciaciónSara Llamas Velasco se encuentra realizando un contrato de investigación «Juan Rodés» financiado por el Instituto de Salud Carlos III.
Víctor Blanco Palmero se encuentra realizando un contrato de investigación «Rio Hortega» financiado por el Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.