El síndrome de encefalopatía posterior reversible (PRES) se caracteriza por hallazgos clínicos y radiológicos, generalmente recuperables, debidos a edema vasogénico. Sin criterios diagnósticos establecidos, es una patología infradiagnosticada sobre la que debemos estar alerta ante un contexto propicio1.
Puede tener un inicio agudo o subagudo y mayoritariamente progresivo, siendo lo más habitual la afectación del nivel de conciencia, las alteraciones visuales y las crisis epilépticas. Su asociación con hipertensión arterial aguda es muy frecuente y guarda relación con su fisiopatología. El pronóstico viene marcado principalmente por sus posibles causas, como cuadros autoinmunes, sepsis, eclampsia y diversas sustancias citotóxicas1.
La inmunoterapia, cada vez más usada en diferentes tipos de cáncer, es uno de los factores predisponentes. Estos inhibidores de puntos de control inmunitario (ICI) se han asociado a distintos efectos adversos neurológicos secundarios a la regulación de las células T2.
Presentamos un caso de PRES tras tratamiento con pembrolizumab, evidenciado por cefalea, disminución de conciencia y ceguera cortical, con síndrome de Anton asociado.
Se trata de una mujer de 56 años con adenocarcinoma de pulmón estadio IV diagnosticado hace tres meses. Exfumadora y con tromboembolismo pulmonar reciente. Inicia primera línea terapéutica con esquema carboplatino, pemetrexed y pembrolizumab, con aparente buena tolerancia. Tres semanas después de esa primera dosis, comienza con mal control de la tensión arterial (TA), dolor torácico y cefalea holocraneal opresiva de alta intensidad, sin otros datos de afectación neurológica. Se decide continuar con el tratamiento oncológico, administrando al día siguiente el segundo ciclo terapéutico con el mismo esquema, pero persiste la cefalea, junto a náuseas y una TA sistólica mantenida en torno a 180 mmHg. Ese mismo día, comienza a aquejar déficit visual en su hemicampo derecho que va progresando a todo el campo en 24 horas. La familia observa cierta fabulación en la percepción visual de la paciente e indiferencia en cuanto a sus déficits y situación clínica. Al mismo tiempo, continúa con hipertensión arterial refractaria a tratamiento, aunque lábil, con al menos un episodio de hipotensión reactiva a antihipertensivos, con TA sistólica de 80 mmHg y empeoramiento del nivel de conciencia asociado.
Al quinto día de inicio de la clínica neurológica, se encuentra alerta, atenta y colaboradora, aunque desorientada en tiempo, espacio y persona. Es capaz de fijar la mirada a la voz, pero al examen visual no puede contar dedos a 30 cm en todo el campo, ni reconocer imágenes básicas. Ella niega estos déficits y fabula sobre su contenido. Presenta unas pupilas isocóricas y normorreactivas, con oculomotricidad conservada. No se evidencia nistagmo en ninguna de las posiciones. No hay otro compromiso de pares craneales. Al examen motor se objetiva una debilidad distal en la mano derecha de 4/5 en la escala MRC. Los reflejos de estiramiento muscular son evocables de forma simétrica, y sin aumento del área reflexógena. Reflejos cutáneo-plantares flexores. No refiere quejas sensitivas. No hay meningismo. No se explora la marcha, ni las dismetrías apendiculares, por ceguera.
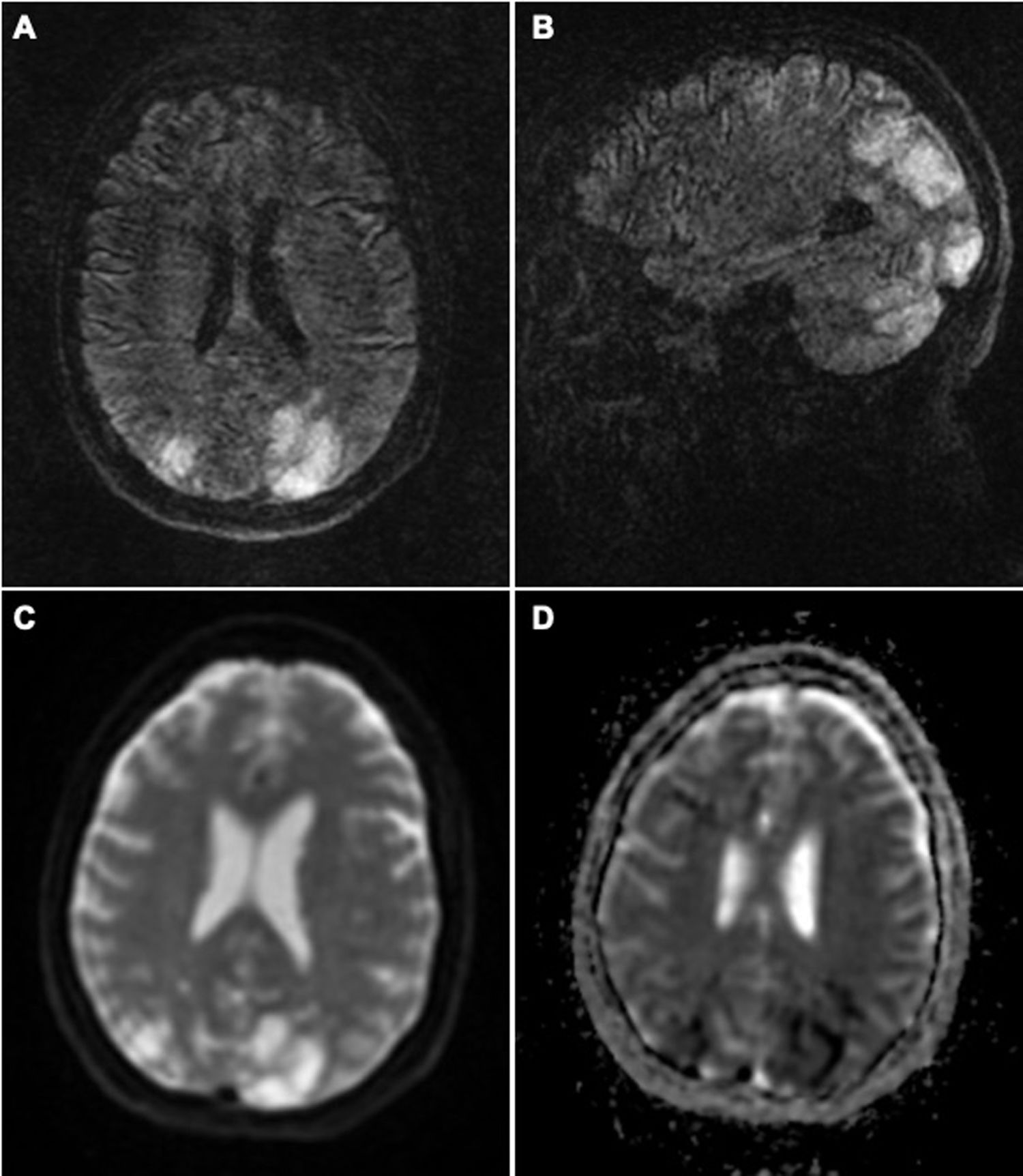
La RM cerebral evidencia en secuencia T2-FLAIR hiperintensidades en ambos hemisferios cerebelosos, tálamos y lóbulos parieto-occipitales, junto a otras en territorios frontera. Algunas lesiones presentan restricción a la difusión (fig. 1). Los análisis sanguíneos muestran una glucemia e ionograma en rango, sin otras alteraciones significativas.
Resonancia magnética (RM) cerebral: en la secuencia T2-FLAIR en su corte axial (A) y coronal (B) podemos ver lesiones hiperintensas en ambos hemisferios cerebelosos y lóbulos parieto-occipitales, de predominio izquierdo, sin corresponderse al territorio de un gran vaso. En secuencias DWI (C) observamos que alguna de estas lesiones restringe a la difusión, con atenuación en los valores de ADC (D). Todo ello sugestivo de un PRES con datos de gravedad por infarto establecido.
Al sexto día de inicio de la clínica, la paciente fallece en el contexto de una insuficiencia respiratoria aguda asociada a linfangitis carcinomatosa.
Sobre el esquema terapéutico que recibió nuestra paciente, cabe resaltar que el pembrolizumab es un ICI que actúa frente al antígeno de muerte programada 1 (PD-1), al igual que el nivolumab. Otros inhibidores actúan sobre el CTL-4, como el ipilimumab, o el PD-L1, como el durvalumab3. Destacan como efectos adversos neurológicos, por su gravedad, los cuadros neuromusculares4. Sin embargo, el PRES es otro daño secundario a tener en cuenta y que hasta ahora se ha asociado a alguno de los ICI2.
La clínica de nuestra paciente es compatible, clínica y radiológicamente, con un PRES de mal pronóstico, dado el edema citotóxico evidenciado en la neuroimagen1. Las lesiones en territorios frontera, no típicas de este síndrome, podrían estar en el contexto de los episodios de hipotensión sintomática, derivados del tratamiento de las crisis hipertensivas, unido al compromiso de la autorregulación vascular cerebral relacionada con el propio síndrome de vasoconstricción.
En cuanto a la fisiopatología del PRES, existen dos hipótesis principales y no necesariamente excluyentes. La primera sugiere que la elevación de la tensión arterial por encima de los límites de autorregulación cerebral lleva a una hiperperfusión tisular, causando edema vasogénico. La hiperperfusión cerebral contribuiría a la disfunción de la barrera hematoencefálica, provocando extravasación de plasma y macromoléculas. Esta «teoría de la hiperperfusión» se ve respaldada por el hallazgo de cifras tensionales altas, o fluctuaciones de la TA en la mayoría de los pacientes. El territorio posterior es especialmente sensible debido a su menor inervación simpática. Sin embargo, hasta el 30% de los pacientes con PRES tienen tensiones normales o escasamente elevadas. La segunda teoría propone que el síndrome se desencadena por una disfunción endotelial causada por toxinas circulantes endógenas (como en la eclampsia o la sepsis) y exógenas (como la quimioterapia o inmunosupresores). Una variante de esta «teoría tóxica» sería la «tóxica-inmunogénica», en la que el desencadenante es la liberación excesiva de citoquinas proinflamatorias, provocando una activación endotelial, liberación de sustancias vasoactivas y edema1. Este mecanismo explicaría los PRES asociados a enfermedades autoinmunes, y sería el que mejor explicaría nuestro caso.
Algunos cánceres son capaces de expresar proteínas que se unen al PD-1 de las células T, inhibiendo la capacidad del sistema inmunitario para atacar las células tumorales. El bloqueo del PD-1 por parte de pembrolizumab, un anticuerpo humanizado, permite reactivar las células T y enfrentarse a dichas células cancerígenas. Sin embargo, también favorece el aumento de las repuestas autoinmunes. En el caso del PRES, como resultado de la cascada inmunitaria, se produciría un daño endotelial con la disrupción definitiva de la integridad vascular y el consiguiente edema cerebral4,5.
El único paciente descrito hasta ahora con PRES asociado a pembrolizumab había estado los meses anteriores con ipilimumab, con el que hay varios casos reportados5. En nuestro caso, si bien hay reportes previos de PRES con platinos y pemetrexed, estos suelen tener un menor desfase con la última administración del fármaco6. La vinculación con los ICIs en monoterapia y tras una sola dosis está más documentada, viéndose generalmente en las semanas posteriores al tratamiento7, aunque sin poder descartar en nuestra paciente la implicación de los quimioterápicos como posible efecto acumulativo.
Por el fallecimiento no fue posible realizar una neuroimagen de control para observar el margen de resolución. No obstante, dada su asociación con el esquema terapéutico combinado con pembrolizumab, iniciado tres semanas antes, el caso se ha notificado a farmacovigilancia.
Con esta nota queremos poner en evidencia otros efectos neurológicos adversos menos frecuentes asociados a la inmunoterapia, que pueden ser más habituales si se usan de forma concomitante a otros quimioterápicos. Dado su uso cada vez más extendido en diferentes tipos de cáncer, es fundamental su conocimiento, tanto por oncólogos, como por los propios neurólogos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.