Reducir la presión arterial es la clave tanto en la prevención primaria de la enfermedad como en la secundaria para evitar su recidiva. Sin embargo, el efecto beneficioso que tiene la reducción de la presión arterial no está demostrado durante la fase aguda del ictus, situación en la que los objetivos de presión arterial que se deben alcanzar no están todavía claramente definidos. Los cambios en la autorregulación del flujo sanguíneo cerebral durante la fase aguda del ictus hacen que sea recomendable una actitud cauta a la hora de administrar tratamiento antihipertensivo durante este período del accidente vascular, aconsejándose sólo cuando los valores de la presión arterial sistólica y diastólica son iguales o superiores a 220/120 mmHg, excepto para los pacientes que reciben tratamiento trombolítico, en cuyo caso se reduce el umbral de tratamiento a 180/115 mmHg o cuando el ictus es debido a una hemorragia, en cuyo caso es aconsejable el tratamiento cuando la presión arterial sistólica es superior a 180 mmHg.
En cuanto al tratamiento en la fase crónica, se ha de destacar que, según los datos disponibles actualmente, el beneficio sobre la recidiva del ictus parece depender más de los valores de presión arterial alcanzados que del tipo de fármaco utilizado para conseguirlo.
INTRODUCCIÓN
El objetivo de este trabajo es revisar la forma de abordar los cambios de la presión arterial (PA) en la fase aguda del ictus. Se ha basado principalmente en las pautas de actuación que se siguen en la unidad de ictus de nuestro hospital y en las recomendaciones consensuadas por la Guía de la Sociedad Española de Neurología y el documento de consenso de las Sociedades Catalanas de Neurología e Hipertensión Arterial1,2. Una vez superada la fase aguda, se plantea también la incógnita de cuál es el esquema terapéutico más aconsejable para evitar la recidiva del accidente vascular, por lo que también hemos revisado brevemente los resultados de los últimos estudios publicados. El ictus es la principal causa de incapacidad en personas adultas en todo el mundo y la segunda causa de mortalidad en los países desarrollados3. Según los datos publicados en la guía de práctica clínica del ictus, en un registro de datos de altas hospitalarias de 65 hospitales generales de Cataluña, bajo el epígrafe definido como enfermedad cerebrovascular aguda, se declararon 12.335 casos en el año 2002, y 2.292 dentro del grupo de ataque isquémico transitorio (AIT), sin incluir a los enfermos que no fueron ingresados, cifras que dan idea de la frecuencia de estos procesos. Según la misma fuente, la enfermedad cerebrovascular (ECV) ocasionó el 9,2% de la mortalidad global en Cataluña; el 7,5% en hombres y el 11,1% en mujeres1,4. La prevalencia de ECV, según la Encuesta de Salud de Cataluña (ESCA) de 2002, es del 1,8% en varones y del 1,4% en mujeres, de todas las edades. La aparición del ictus guarda una estrecha relación con los valores de la PA, siendo la complicación car- diovascular más directamente relacionada con ésta. Se calcula que cada 7,5 mmHg de aumento de la presión arterial diastólica (PAD) se dobla el riesgo de que aparezca esta complicación, siendo incluso mayor para la hipertensión sistólica aislada, especialmente en los varones de mediana edad, en los que el riesgo se quintuplica5. Parece interesante señalar que la aplicación de un sistema de atención urgente del ictus (Código Ictus), basado en una asistencia protocolizada y especializada e integral en unidades de ictus ha supuesto una importante mejora en la supervivencia y un menor número de secuelas en los pacientes con ictus6. La implantación de estas unidades está extendiéndose progresivamente y en ellas se lleva a cabo no sólo el manejo de las alteraciones de la PA, sino también los tratamientos de revascularización y la atención de las numerosas complicaciones que estos pacientes pueden presentar debido a su frecuente patología asociada a las directamente derivadas del daño neurológico7.
Manejo de la presión arterial en la fase aguda del ictus
Reducir la PA es la clave, tanto en la prevención primaria de la enfermedad como en la secundaria para evitar su recidiva. Sin embargo, el efecto beneficioso que tiene la reducción de la PA no está demostrado durante la fase aguda del ictus, situación en la que los objetivos de PA que se deben alcanzar no están todavía claramente definidos. En el UK-TIA Aspirine Trial8, se pudo observar una relación entre el riesgo de ictus y la presión arterial sistólica (PAS) y presión arterial diastólica (PAD) y cómo una reducción de 5 mmHg de la PAD y de 10 mmHg de la PAS se asociaba a una significativa disminución del riesgo de padecer un nuevo ictus del 34 y 28%, respectivamente. Por el contrario, el tratamiento de la hipertensión en la fase aguda continúa siendo un tema controvertido, ya que las evidencias existentes sobre cómo se debe actuar son muy escasas9. Por este motivo, las recomendaciones publicadas en las diversas guías clínicas de manejo de la enfermedad se basan hasta ahora principalmente en los resultados de observaciones clínicas limitadas y opiniones de expertos, siendo muy escasos los ensayos clínicos aleatorizados que se han llevado a cabo para aclarar esta importante cuestión. Por ello persisten las dudas en relación con el manejo de la PA en el ictus y que plantean los principales puntos de debate, que son: a) ¿cómo se debe manejar la elevación de la PA durante la fase aguda del ictus? y justamente el punto opuesto: b) ¿cuándo es necesario aumentar la PA para mejorar la perfusión de las áreas isquémicas del cerebro?, sin que por ello aumente el riesgo de edema o de sangrado. Como se expone a continuación, existen diferencias importantes a tener en cuenta en el manejo de la PA cuando el accidente vascular es isquémico o cuando es hemorrágico, por lo que antes de abordar el tratamiento en un paciente que acaba de padecer un ictus se debe proceder a las pruebas correspondientes para determinar el diagnóstico etiológico. Conviene recordar brevemente algunos aspectos generales básicos del manejo de un paciente con sospecha de ictus (figura 1), entre los que se encuentran los datos básicos que deberán recogerse en la historia clínica (tabla 1) y también que existen situaciones que pueden simular un ictus, las más frecuentes son: trastornos conversivos, encefalopatía hipertensiva, hipoglucemia, migraña complicada y convulsiones. Un aspecto importante y que tiene influencia a la hora de decidir la actitud terapéutica es la presencia de una respuesta hipertensiva aguda y generalmente transitoria que tiene lugar en más del 50% de los pacientes durante la fase aguda del ictus. También, que en más del 80% de los casos se produce en las primeras 12 horas de la evolución6. Esta elevación de la PA se puede añadir a cifras inicialmente altas en pacientes hipertensos o sobre valores normales y tiene lugar en cualquier tipo de ictus, aunque es especialmente llamativo en los hemorrágicos. La causa de esta elevación de la PA puede ser el daño cerebral sobre regiones específicas que regulan la actividad del sistema nervioso simpático. En la tabla 2 se recogen las principales causas que pueden exacerbar el aumento de la PA. Esta elevación tiende a regresar de forma espontánea en días o semanas sin tratamiento farmacológico alguno. La aparición de este fenómeno es tan frecuente que valores normales o bajos después del ictus agudo son indicativos de daño cerebral extenso o de coincidencia con enfermedad coronaria. Los cambios de la PA tras el ataque agudo del ictus se asocian con la gravedad del daño neurológico. En conjunto, la relación entre la evolución y la presión arterial tiene una forma de curva en J o en U, con un mejor pronóstico para los niveles de PAS entre 140 y 180 mmHg. En relación con la necesidad de elevar los valores de PA en algún tipo de ictus con el fin de mejorar la perfusión de sangre a la zona isquémica, no existe evidencia de que sea necesario, salvo en aquellos pacientes en los que existe un componente hemodinámico evidente asociado con estenosis en una arteria principal10.
Cambios hemodinámicos en la circulación cerebral en la fase aguda del ictus y su importancia en el tratamiento de la HTA
La fisiopatología del comportamiento de la circulación cerebral durante la fase aguda es de una gran importancia para entender las consecuencias que puede tener la administración de fármacos que pueden modificar la PA. Los principales cambios hemodinámicos en la fase aguda se producen sobre la autorregulación del flujo sanguíneo cerebral. La autorregulación consiste en la capacidad que tienen las arterias cerebrales para mantener un flujo de sangre relativamente constante (de aproximadamente 55-60 ml por 100 g de tejido cerebral) de forma independiente de las variaciones que pueda tener la PA sistémica, dentro de unos márgenes de PA media comprendidos entre 60 y 120 mmHg. Estos valores varían según diversos factores, entre ellos la edad y la presencia de hipertensión arterial crónica. La importancia de este fenómeno radica en que más allá de los valores de PA del intervalo de la autorregulación, el flujo sanguíneo cerebral depende directamente de la PA sistémica, es decir que disminuye si la PA media es inferior a 60 mmHg o aumenta si es superior a 120 mmHg de PA media y dichas alteraciones están asociadas con complicaciones potenciales. Durante la fase aguda del ictus la autorregulación del flujo sanguíneo cerebral se ve alterada como consecuencia de diversos factores; por ejemplo, los cambios en la presión parcial de oxígeno arterial y de dióxido de carbono11 y la reorganización de la vascularización cerebral tras la isquemia12. La regulación del flujo sanguíneo cerebral es crítica para el mantenimiento de la función neuronal, que necesita un aporte constante de oxígeno y glucosa. Por ello, el sistema vascular del cerebro adulto es extremadamente estable y en situaciones fisiológicas no sufre grandes modificaciones, pero cuando en un área del cerebro se interrumpe el flujo sanguíneo, el tejido circundante parcialmente afectado, que se conoce como área de penumbra isquémica, es viable fundamentalmente gracias al flujo sanguíneo colateral y a la liberación de factores angiogénicos que inducen la proliferación de células endoteliales y la migración de células progenitoras endoteliales para formar nuevos vasos. Por todo ello, la angiogénesis podría ser una opción terapéutica en el tratamiento del ictus isquémico. Sin embargo, determinados factores angiogénicos, como el factor de crecimiento del endotelio vascular, el factor de crecimiento derivado de las plaquetas o la angiopoyetina incrementan la permeabilidad vascular y pueden generar complicaciones como la transformación hemorrágica.
Manejo de la presión arterial en el ictus isquémico
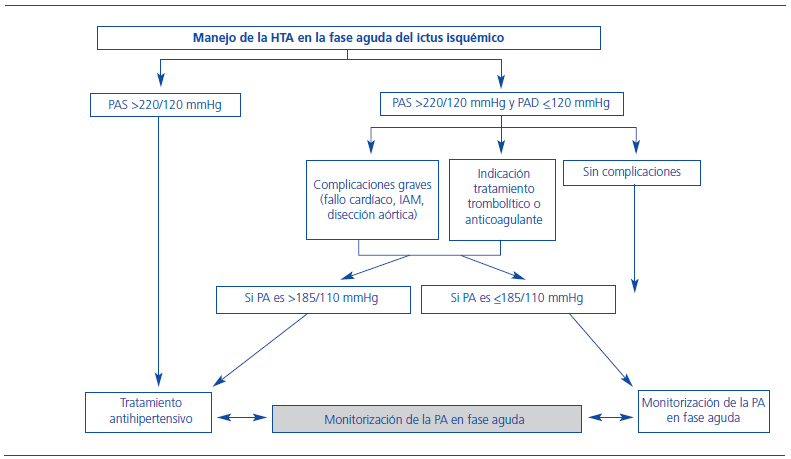
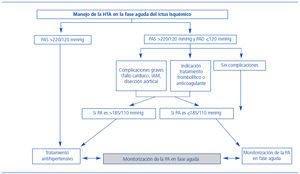
Como se ha descrito anteriormente, la PA está elevada en la gran mayoría de los pacientes en la fase aguda del ictus y desciende espontáneamente de forma habitual13. Los datos acerca del significado pronóstico de la elevación de la PA en el ictus son discordantes. Así, algunos trabajos han mostrado que cifras de PAS y PAD por debajo de ciertos límites (menos de 155 mmHg y menos de 90 mmHg, respectivamente), se asociaban a mayores tasas de mortalidad a los 90 días14. Sin embargo, otros estudios, como el de Leonardi-Bee et al.13, observaron que tanto cifras altas como bajas de PA en el momento basal se asociaban con mal pronóstico, probablemente debido a un aumento de la recurrencia precoz y de la muerte por el edema cerebral. Por otra parte, otros estudios han mostrado beneficio con los descensos moderados de la PA durante la primera semana tras el ictus isquémico15, aunque sin duda, cualquier descenso, si se produce de forma súbita, podría comprometer la presión de perfusión cerebral en las áreas de penumbra isquémica y asociarse con mal pronóstico16. Recientemente, un estudio multicéntrico ha demostrado que el efecto de los descensos absolutos de más de 27 mmHg sobre el pronóstico se ve influido por la edad, con un aumento progresivo de la probabilidad de presentar un mal pronóstico para los pacientes con edades superiores a 70 años17. Por todo ello, en los últimos años, las guías de tratamiento de la presión en la fase aguda del ictus isquémico no han cambiado notablemente, recomendándose precaución y tratamiento antihipertensivo en casos de cifras iguales o superiores de PAS de 220 mmHg y/o de PAD de 120 mmHg, excepto para los pacientes que reciben tratamiento trombolítico18 (figura 2). Para los pacientes que reciben tratamiento trombolítico, la relación entre la PA y la respuesta al tratamiento trombolítico ha sido analizada en diferentes tiempos. Por un lado, cifras elevadas de PA previamente a la administración del tratamiento trombolítico se asocian con peores tasas de recanalización arterial precoz (2 horas) y, aunque no de forma independiente, con un mal pronóstico al tercer mes19. Estos autores formularon una hipótesis en que la PA elevada tendría efectos perjudiciales sobre el sistema fibrinolítico endógeno, tal y como sucede en pacientes hipertensos, dificultando así la recanalización arterial. Por otra parte, una vez se ha administrado el tratamiento trombolítico, tanto las cifras elevadas de PA como una mayor variabilidad de ésta se han relacionado con el riesgo de presentar transformaciones hemorrágicas y mayor crecimiento del infarto, respectivamente20,21, condicionando así un peor pronóstico. En la actualidad, las guías de práctica clínica recomiendan, en los pacientes con ictus isquémico que reciben tratamiento trombolítico, no superar los umbrales máximos de 185 mmHg para la PAS y de 105 mmHg para la PAD18. En caso de que se precise disminuir la PA, no existen datos que soporten indicaciones específicas en cuanto al tipo de fármaco que se debe usar. Además, el tipo de fármaco más indicado podría verse influido por otras patologías concomitantes. En las guías de la Sociedad Española de Neurología1 se recomienda que, si se precisa la vía intravenosa, debe usarse un fármaco de acción previsible y fácilmente reversible como labetalol o urapidilo, entre otros. No deben administrarse antagonistas del calcio por vía sublingual por la hipotensión brusca que producen. La utilización del nitroprusiato sódico para casos de HTA extrema se sigue contemplando en algunas guías terapéuticas, a pesar del riesgo que conlleva de aumentar el edema cerebral como consecuencia de la vasodilatación.
Manejo de la presión arterial en el ictus hemorrágico
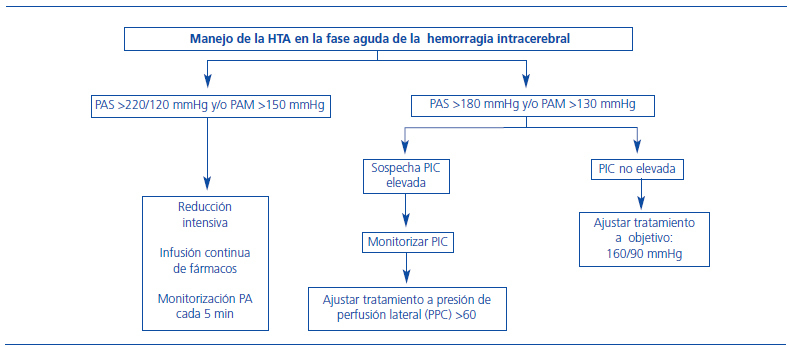
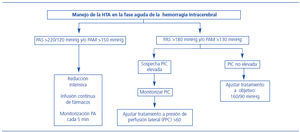
Los ictus hemorrágicos constituyen alrededor de un 15% de todos los ictus, y de ellos, aproximadamente un 85% son hemorragias intracerebrales (HIC). Desde hace algunos años, se sabe que la hemorragia cerebral es un proceso dinámico y que los hematomas crecen de forma evidente, sobre todo durante las primeras 3 horas, pero incluso días después, aunque en menor proporción22. Además, el crecimiento precoz de la hemorragia es uno de los principales determinantes de mal pronóstico a corto y largo plazo, motivo por el cual, en los últimos años, muchos estudios se han dirigido a identificar precozmente el crecimiento de la HIC y a limitar dicho aumento. Existen muy pocos factores clínicos que permitan predecir el crecimiento de la hemorragia, como son el tiempo que transcurre entre el inicio de los síntomas y el diagnóstico (a menor tiempo, mayor crecimiento) y el volumen basal de la hemorragia (a mayor volumen, mayor crecimiento). La extravasación de contraste en los estudios con angio-TC también se ha propuesto como un predictor importante de crecimiento23. A pesar del mal pronóstico asociado con la HIC, hasta la fecha no existe un tratamiento médico o quirúrgico satisfactorio en la hemorragia cerebral, aunque se han hecho algunos avances significativos en los últimos años. El tratamiento hemostático ha demostrado que limita el crecimiento del hematoma en dos estudios realizados con factor VII de la coagulación recombinante activado, cuando se administra en las primeras 4 horas desde el inicio de los síntomas24,25. Sin embargo, los resultados en cuanto al pronóstico fueron discordantes entre ambos estudios, y no fue posible confirmar en el segundo trabajo, de mayor tamaño, los resultados positivos obtenidos en el primero24,25. Pese a todo, es posible que en algunos casos (pacientes más jóvenes, con hemorragias inicialmente más pequeñas y escasa extensión intraventricular que sean tratados de forma muy precoz, dentro de las primeras 2,5 horas) se puedan obtener mejorías más importantes en el pronóstico26. En cuanto al tratamiento quirúrgico, por el momento los estudios realizados con distintas técnicas quirúrgicas (craneotomía y evacuación, cirugía mínimamente invasiva, etc.) no han puesto de manifiesto mejorías respecto al tratamiento médico convencional para el conjunto de todas la HIC, aunque están en marcha estudios con subgrupos (hemorragias lobulares que se encuentran dentro de 1 centímetro de la superficie cortical y limitadas al parénquima cerebral, sin extensión ventricular [STICH trial-II]), que aportarán más información en el futuro27. Respecto a la PA, a menudo se encuentra muy elevada en la fase aguda de la HIC, de tal manera que en un estudio realizado en 45.330 pacientes, un 75% tenían una PA superior a 140 mmHg y un 20% superior a 180 mmHg en el momento de presentar la HIC28. Dicha elevación inicial se ha asociado con el crecimiento de la hemorragia, con un aumento de la mortalidad y con la formación de edema perihematoma, aunque no se ha establecido una relación clara de causa y efecto entre ellos29. Sin embargo, no se ha demostrado de forma concluyente que la reducción de la PA pueda de reducir el aumento de la hemorragia, por lo que las guías americanas y europeas actualmente son conservadoras30,31 en cuanto al umbral de reducción de la PA (figura 3). En espera de los resultados de los ensayos clínicos, en la actualidad se recomienda mantener la PAS por debajo de 180 mmHg en la fase aguda de la HIC con fármacos administrados por vía intravenosa de vida media corta, aunque podría considerarse una reducción más agresiva en los casos en que no existen hipertensión intracraneal o antecedentes de hipertensión crónica. Desde que se presentaron las últimas guías, se han publicado los resultados de dos ensayos clínicos, con manejo más agresivo de las cifras de PA en fase aguda que las que figuran en las guías, el ATACH (Antihypertensive Treatment of Acute Cerebral Hemorrhage)29 y el INTERACT (INTEnsive Blood Pressure Reduction in Acute Cerebral Hemorrhage)32. Ambos mostraron que la reducción más agresiva de la PA se asocia con una disminución del crecimiento del hema- toma, sin efectos adversos. Además, en un análisis por subgrupos del estudio INTERACT, los pacientes tratados de forma más precoz (dentro de las primeras 3 horas) y con PAS superior a 181 mmHg fueron los que más se beneficiaron. El estudio ATACH se diseñó para demostrar la eficacia y la seguridad de alcanzar y mantener la PA a distintos niveles, inferiores a los publicados en las guías actuales (entre 200 y 170 mmHg, entre 170 y 140 mmHg y entre 140 y 110 mmHg) mediante el uso de nicardipino intravenoso. Los pacientes fueron incluidos dentro de las primeras 6 horas desde el inicio de los síntomas y en total se estudiaron a 18, 20 y 22 pacientes, respectivamente, en cada grupo. Los resultados mostraron unas cifras de deterioro neurológico y mortalidad inferiores a las esperadas. El descenso más agresivo de la PA fue bien tolerado, sin producirse un aumento de los efectos adversos. Sin embargo, la interpretación de los resultados de este estudio ha de ser cauta debido, principalmente, al pequeño tamaño muestral y a que en el tercer grupo (de 140 a 110 mmHg), el número de pacientes con deterioro neurológico, efectos adversos graves y retiradas del tratamiento fueron superiores a los otros grupos. El estudio INTERACT incluyó a un mayor número de pacientes (n = 404), con cifras de PA entre 150 y 220 mmHg en las primeras 6 horas. Los pacientes fueron aleatorizados a tratamiento antihipertensivo «intensivo» (objetivo por debajo de los 140 mmHg) frente a tratamiento según las guías actuales (objetivo igual o inferior a 180 mmHg). El objetivo principal fue el cambio proporcional en el volumen del hematoma en las primeras 24 horas y los resultados fueron positivos, encontrándose el crecimiento del hematoma disminuido en los pacientes que habían recibido tratamiento intensivo. En cuanto a la repercusión clínica, la proporción de eventos adversos o mal pronóstico al tercer mes fue similar en ambos grupos, aunque el estudio no estaba lo suficientemente potenciado para mostrar diferencias a nivel clínico. Los principales tratamientos administrados fueron furosemida y urapidilo. El diseño del futuro estudio ATACH II y el estado actual del estudio INTERACT II, en curso actualmente, puede consultarse en la página web http://www.strokecenter.org/trials/.
Tratamiento antihipertensivo en prevención secundaria del ictus
En conjunto, el tratamiento antihipertensivo se asocia con una reducción en la incidencia de ictus entre un 35 y un 44%33. Además, el riesgo absoluto de ictus está aumentado en los pacientes que ya han presentado un primer episodio34. Todas las guías publicadas dirigidas a la prevención secundaria de ictus o cualquier otro episodio vascular, en personas que han tenido un ictus o un AIT, recomiendan el uso de fármacos antihipertensivos, una vez ha pasado la fase hiperaguda35-37. El tratamiento antihipertensivo debe ir acompañado de una serie de modificaciones del estilo de vida (control del peso, ejercicio aeróbico, dieta saludable, etc.), como se refleja en las principales guías de manejo de la HTA38. Sin embargo, el momento óptimo para comenzar el tratamiento antihipertensivo se desconoce, aunque en general se recomienda esperar 7 días después del ictus y evitar el tratamiento hipotensor en la fase inicial de mayor inestabilidad hemodinámica (días 1 a 3 después del ictus). Por otra parte, como el beneficio al disminuir la PA se extiende a todas las personas, esta recomendación debería extenderse a todos los pacientes que hayan presentado un ictus isquémico o un AIT, independientemente de que tengan o no antecedentes de hipertensión arterial, salvo para los que sufran hipotensión sintomática. Sin embargo, se desconoce la cifra objetiva óptima a la que se debe llegar, aunque en distintos estudios la mejoría se ha objetivado con disminuciones de 10/5 mmHg y la mayoría de las guías recomiendan alcanzar unos valores de PAS y de PAD inferiores a 130 y 85 mmHg, respectivamente. En cuanto al régimen de fármacos más apropiados, este aspecto también es desconocido. Así, de las cinco familias de fármacos más importantes que existen (diuréticos tiazídicos, beta-bloqueantes, inhibidores de la enzima conversiva de la angiotensina o IECA, bloqueantes de los receptores de angiotensina o ARA-II, y antagonistas del calcio), en el momento actual no hay evidencias claras de cuál o cuáles de ellos en combinación serían los más apropiados. En los últimos años se han publicado varios estudios, tanto en prevención primaria como en prevención secundaria del ictus, con resultados dispares que favorecen a cualquiera de las clases farmacológicas que existen respecto a otras. Por otra parte, también se han descrito para todos, por separado, efectos pleiotrópicos, que irían más allá de los que se obtienen por la simple reducción en las cifras de PA. En la práctica clínica habitual, no obstante, la indicación del tipo de fármaco se ajusta más a una elección personalizada teniendo en cuenta su perfil de seguridad y efectos adversos. Recientemente, se ha publicado un amplio metaanálisis que intenta contestar a las siguientes preguntas relacionadas con la ECV: ¿difiere el efecto preventivo de los fármacos antihipertensivos en prevención primaria o secundaria?, ¿existen efectos pleiotrópicos o independientes de la reducción de la PA?, ¿hay diferencias entre los distintos tipos de fármacos?, ¿cuál sería el régimen de tratamiento más apropiado, combinaciones o monoterapia? En busca de la respuesta, se realizó un metaanálisis de 147 ensayos clínicos realizados con fármacos antihipertensivos (108 fármacos controlados con placebo y 46 comparando diversos fármacos entre sí) cuyo objetivo fue evaluar la presencia de cualquier evento vascular o ictus durante el seguimiento39. En primer lugar, este estudio intentó dar respuesta a si el efecto de los fármacos difería en función de la presencia o no de enfermedad vascular previa, es decir, si era igual en prevención primaria o secundaria. Los resultados obtenidos fueron que, teniendo en cuenta una reducción en la PAS de 10 mmHg y de la PAD de 5 mmHg, ambos grupos eran comparables, pese a que el riesgo absoluto fuese superior en pacientes con ictus/enfermedad vascular previa. Por lo tanto, estos resultados indicarían que no hay razón para no usar estos fármacos antihipertensivos tanto en prevención primaria como en prevención secundaria del ictus. Un resumen de dichos resultados puede verse en la tabla 3. En segundo lugar, para averiguar si el menor riesgo se debía sólo a la reducción de la PA o a efectos independientes de ésta (pleiotrópicos), los autores compararon sus resultados de estudios con otro metaanálisis previo, que agrupaba datos obtenidos de estudios de cohortes (Prospective Studies Collaboration Analysis)40. Ajustado por la reducción obtenida en la PA, se descartaba la existencia de efectos pleiotrópicos para cualquier tipo de fármaco. Lo importante de este análisis es que el beneficio se obtenía precozmente, a partir del primer año de tratamiento, y que considerando los diferentes tipos de fármacos, la reducción en el riesgo de ictus y en el de episodios coronarios fue de la misma magnitud. Debe remarcarse, no obstante, que los resultados obtenidos con los ARA-II se basan únicamente en 4 estudios, con lo que no se disponía de suficiente poder estadístico como para observar diferencias significativas. En el año 2008 se han publicado nuevos resultados con este tipo de fármacos, que se revisarán más adelante. Respecto a la pregunta de si alguno de los fármacos era superior a otro, para el ictus, las únicas diferencias venían de un muy discreto mayor efecto preventivo de los antagonistas del calcio respecto a todos los demás fármacos (riesgo relativo [RR] 0,91, intervalo de confianza [IC] 95% 0,84- 0,98, p = 0,01). Una explicación, aunque poco convincente, podría ser que los antagonistas del calcio son capaces de reducir la presión aórtica en mayor grado que otros fármacos, por lo que su efecto preventivo sería mayor. En cuanto a la pregunta acerca de si es mejor la combinación de varios fármacos o la administración de monoterapia en dosis óptimas, los autores analizaron un escenario en el que, para personas de edades comprendidas entre 60 y 69 años, con una PAD de 90 mmHg antes del tratamiento, 3 fármacos a la mitad de la dosis estándar en combinación reducirían el riesgo de episodios coronarios en un 46% y de ictus en un 62%. Sin embargo, el tratamiento con un único fármaco en dosis estándar tendría la mitad de ese efecto. A partir de la publicación del estudio LIFE, en el que se demostró la superioridad del fármaco losartán sobre el atenolol en la prevención de las complicaciones cardiovasculares, se han realizado diversos ensayos clínicos con diferentes agentes farmacológicos del grupo de los bloqueadores de los receptores de la angiotensina (ARA-II). Recientemente, se ha publicado una revisión de los tres últimos estudios con este tipo de fármacos en prevención primaria y secundaria del ictus41: el estudio PRoFESS (PReventiOn regimen For Effectively avoiding Second Strokes trial)42, que incluyó a pacientes con ictus previos, y los estudios ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial)43 y TRANSCEND (Telmisartan Randomized AssessmeNt Study in ACE-iNtolerant subjects with cardiovascular Disease)44 que incluyeron a pacientes con riesgo elevado de presentar un ictus. En el estudio PRoFESS, los pacientes fueron aleatorizados a recibir telmisartán (80 mg/día) o placebo, además de dos regímenes de antiagregantes plaquetarios (a escoger entre aspirina más dipiridamol de liberación sostenida o clopidogrel), además del tratamiento habitual en prevención secundaria de ictus y, por tanto, incluyendo otros fármacos antihipertensivos. En total, 20.332 pacientes, tanto hipertensos como normotensos, fueron distribuidos aleatoriamente, con un tiempo medio corto entre el ictus y la aleatorización de sólo 15 días. Entre sus particularidades, cabe destacar que, debido a los efectos secundarios de los fármacos antiagregantes, se retiró el tratamiento en un elevado número de casos (aproximadamente un 25% en cada uno de los grupos de tratamiento). También, como el uso de otros fármacos antihipertensivos estaba permitido, al final del estudio, el porcentaje de pacientes que tomaban otros tratamientos (diuréticos, IECA, antagonistas del calcio o beta-bloqueantes) fue superior en el grupo placebo que en el de telmisartán. En cuanto al objetivo primario del estudio, que fue la presencia de ictus recurrente, globalmente y tras 36 meses de seguimiento, los resultados del telmisartán no fueron diferentes del placebo. Sin embargo, en un análisis posterior, a partir de los 6 meses, los resultados eran favorables al telmisartán, mientras que durante los primeros 6 meses la tendencia era inversa (probablemente debido al diseño del estudio y a la alta tasa de ictus recurrente precoz). También, un seguimiento más prolongado sería preferible para este tipo de estudios. El estudio TRASCEND investigó el efecto de telmisartán comparado con el placebo en el objetivo compuesto por muerte vascular, infarto de miocardio, ictus u hospitalización por fallo cardíaco en pacientes de alto riesgo vascular o diabéticos tipo II con intolerancia a los IECA. La duración media fue más prolongada que para el estudio anterior, de 56 meses, y los resultados obtenidos mostraron una reducción significativa de episodios a favor del telmisartán (13 fente al 14,8%, hazard ratio [HR] 0,87, IC 95% 0,76-1). Teniendo en cuenta únicamente el ictus como objetivo, éste ocurrió en el 3,8% del grupo de telmisartán y en el 4,6% del grupo tratado con ictus (HR 0,83, IC 95% 0,64-1,06, p = 0,13). Un metaanálisis de los estudios PRoFESS y TRANSCEND demostró un efecto significativo del telmisartán en el objetivo combinado de muerte cardiovascular, infarto de miocardio e ictus (12,8 frente al 18,8%, OR 0,91, IC 95% 0,85-0,98, p = 0,013), aunque sólo había un claro beneficio a partir de los 6 meses de tratamiento41. Por último, y con la hipótesis de que un bloqueo a varios niveles del sistema renina-angiotensina podría dar beneficios adicionales, el estudio ONTARGET investigó los beneficios de telmisartán, ramipril o la combinación de los dos, en la prevención de la combinación de ictus, infarto agudo de miocardio (IAM), fallo cardíaco o muerte vascular en pacientes de alto riesgo o diabéticos tipo 2. En conjunto, los resultados fueron negativos, ya que se encontraron similar número de pacientes con el objetivo positivo en el grupo de ramipril, telmisartán y en el de la combinación de ambos (16,7% frente al 16,5% y al 16,3%, respectivamente), aunque en el grupo de pacientes con ictus el telmisartán mostró una tendencia no significativa a la reducción de ictus recurrente respecto a ramipril (0,93, IC 95% 0,81-1,07). En resumen, el estudio PRoFESS mostró una reducción no significativa del objetivo combinado de ictus, IAM o muerte vascular, aunque con un potencial beneficio a partir de, aproximadamente, 6 meses, que se confirmó en un metaanálisis conjunto del PRoFESS y del TRASCEND. En el subgrupo con ictus del estudio ONTARGET el telmisartán también mostró mayor beneficio en la reducción de ictus recurrente.
Para finalizar, algunos de los estudios descritos han mostrado beneficios en la reducción del riesgo, pese a que las variaciones absolutas en la PA durante el seguimiento eran muy pequeñas. Como ejemplo, el estudio HOPE (Heart Outcomes Prevention Evaluation)45, que comparó ramipril y vitamina E con placebo en un diseño 2 x 2, mostró una reducción del riesgo relativo de ictus del 32% en el grupo tratado con ramipril respecto al placebo. Estas diferencias se identificaron pese a que las reducciones en la PA fueron muy modestas.
Los autores de este estudio atribuyeron estos resultados a que la medicación se administraba en una única dosis nocturna, con lo cual la medida en la consulta (office blood pressure) podría haber infraestimado la reducción real46 y, de hecho, en un subgrupo de 38 pacientes con arteriopatía periférica a los que se practicó monitorización ambulatoria de la PA (MAPA) durante 24 horas, las diferencias observadas entre grupos para la PA de 24 horas fueron muy superiores entre los grupos de tratamiento (10/4 mmHg) debido a un descenso importante durante la noche.
Éstos y otros aspectos, como el momento de la inclusión de los pacientes (precoz/tardía) tras el ictus, el tiempo total de seguimiento, la metodología en la medida de la PA, etc., deberán ser tenidos muy en cuenta en el diseño de futuros estudios.
Puntos clave
1. Más de la mitad de los pacientes con ictus agudo presentan una crisis hipertensiva que se asocia con peor pronóstico.
2. La relación entre las cifras de PA en la fase aguda del ictus y la evolución parece seguir una curva en U, presentando mejor evolución los pacientes con unos valores de PAS entre 140 y 180 mmHg.
3. Los beneficios de la disminución de las cifras de PA en la fase aguda del ictus no se han podido demostrar todavía en los pacientes con ictus isquémico ni tampoco con ictus hemorrágico.
4. Mientras no se disponga de nuevos resultados, se aconseja ser prudentes en el descenso de las cifras de PA en la fase aguda del ictus, no debiendo ser tratados valores inferiores a 220 mmHg de PAS o de 120 mmHg de PAD en el ictus isquémico o inferiores a 180 mmHg de PAS en el ictus hemorrágico.
5. En el tratamiento de la hipertensión arterial en la fase aguda del ictus se deben preferir los fármacos con respuesta controlable y evitar los que producen descensos rápidos o facilitan el edema cerebral.
6. El control de la hipertensión arterial es fundamental para disminuir el riesgo de ictus en personas con esta enfermedad y en los pacientes con antecedentes de enfermedad vascular.
7. El efecto beneficioso del tratamiento con fármacos antihipertensivos en la prevención del ictus depende, fundamentalmente, de la disminución de las cifras de PA, sin que se hayan demostrado diferencias atribuibles a la clase de fármaco.
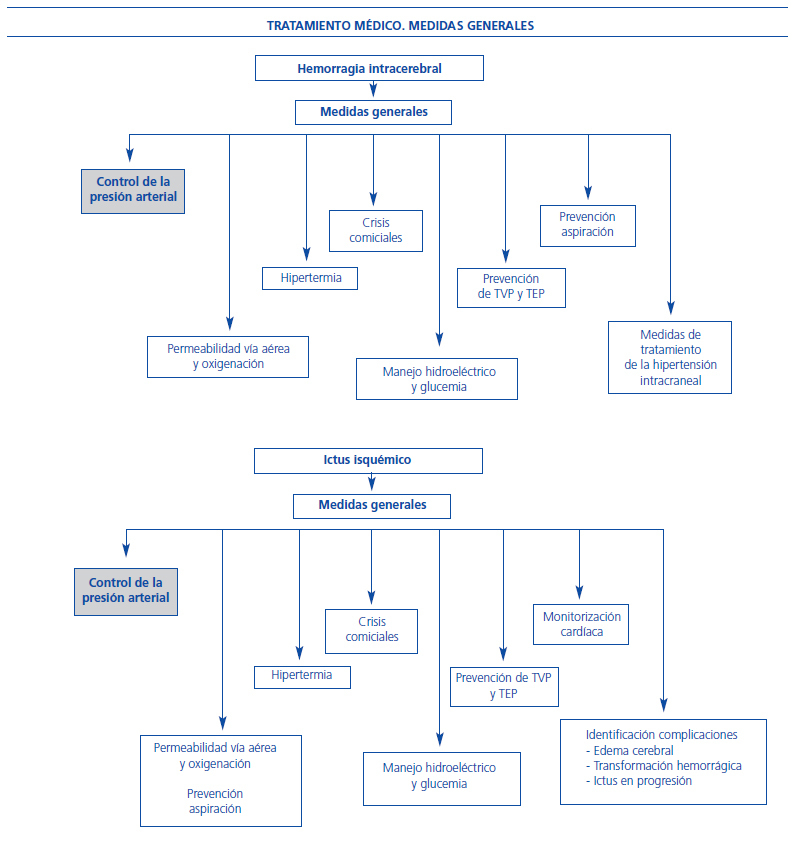
Figura 1. Medidas generales en el tratamiento del ictus isquémico y hemorrágico.
Tabla 1. Datos básicos que se deben recoger ante la sospecha de ictus
Tabla 2. Principales causas que contribuyen al aumento de la presión arterial en la fase aguda del ictus
Figura 2. Control de la presión en la fase aguda del ictus isquémico.
Figura 3. Control de la presión arterial en la fase aguda del ictus hemorrágico.
Tabla 3. Efectividad de los fármacos antihipertensivos en ictus. Riesgo relativo observado y estandarizado en relación con la historia previa de enfermedad vascular