El virus del herpes humano-8 (VHH-8), también conocido comúnmente como “virus asociado a sarcoma de Kaposi”, es un ADN virus perteneciente a la subfamilia de los virus herpes-gamma, y es el único miembro de los Rhadinovirus con la capacidad de infectar al ser humano.
La relación de este patógeno en el desarrollo de enfermedades en pacientes inmunosuprimidos es ya bien reconocida, y con respecto al grupo de los trasplantados, se ha asociado a patologías de tipo tanto neoplásico como no neoplásico. Dentro del grupo de las neoplásicas encontramos el sarcoma de Kaposi, la enfermedad de Castleman multicéntrica (ECD), el linfoma primario de cavidades y el linfoma plasmablástico; y en el grupo de patologías no neoplásicas el síndrome hemofagocítico, citopenias y fallo agudo de médula ósea.
Describimos el caso de un paciente trasplantado renal desde hace 20 años que consulta por síndrome febril, adenopatías generalizadas y fracaso renal agudo, al que se le diagnostica un síndrome linfoproliferativo postrasplante.
Discutimos la importancia de sospechar como agente etiológico en neoplasias postrasplante al VHH-8, mencionamos las diferentes neoplasias asociadas a este virus, las distintas técnicas diagnósticas, tratamiento y manejo de la inmunosupresión.
CASO CLÍNICO
Varón de 65 años de edad, con patología nefrológica que debuta con hipertensión maligna a los 26 años de edad, biopsia renal realizada en 1975 que evidencia nefroangioesclerosis maligna. El paciente inicia terapia renal sustitutiva en hemodiálisis en 1985, y recibe un primer trasplante renal de donante cadáver en 1989. Compartiendo 1 HLA-DR con el donante, se realiza inducción con anticuerpo monoclonal anti-CD3 (OKT3), ciclosporina y prednisona, con adecuada evolución sin rechazo agudo ni otras complicaciones. Creatinina al alta de 85 μmol/l. En 2001 se cambia la ciclosporina a tacrolimus por hipertrofia gingival. Desde entonces, el paciente sigue en biterapia con tacrolimus retard 5 mg/24 h (niveles medios: 6-8 μg/l) y prednisona 5 mg/24 h. Última creatinina 120 μmol/l, filtrado glomerular 53 ml/min, sin proteinuria ni microhematuria.
En febrero de 2013, el paciente consulta a urgencias de atención primaria por clínica de disfagia alta y fiebre de predominio vespertino. Se orienta como faringoamigdalitis aguda y recibe tratamiento con amoxicilina-ácido clavulánico durante 2 semanas, aunque sin presentar mejoría. Por tanto, reconsulta a nuestro centro, donde se constata que continúa con fiebre vespertina, anorexia y disfagia alta persistente; además, se objetiva oliguria y edema de las extremidades inferiores con aumento de 3 kg de peso en la última semana. No presenta disnea.
A la exploración física destaca tendencia a la hipotensión, febrícula, edemas pretibiales con fóvea grado III. A nivel bucofaríngeo, se objetiva hipertrofia amigdalar tipo IV, sin exudados. Presenta adenopatías generalizadas cervicales e inguinales. La exploración abdominal es normal, sin masas palpables ni visceromegalias.
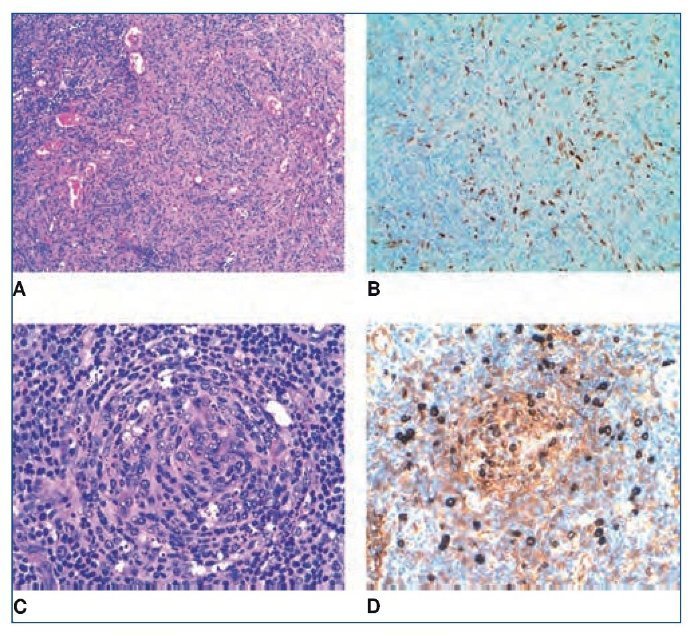
La analítica realizada al ingreso se describe en la tabla 1. Se objetiva un empeoramiento de la función renal con creatinina 222 μmol/l, urea 19,5 μmol/l e hipoalbuminemia grave (20 g/l). Hemograma sin leucocitosis ni leucopenia. El ionograma en orina denota un patrón funcional. En el sedimento urinario no se observan microhematuria, leucocituria ni proteinuria (0,04 g/ día). Se realizan pruebas microbiológicas, hemocultivos y urocultivo, que dan resultado negativo. El coprocultivo evidencia flora mixta intestinal. Asimismo, se realizan pruebas de cultivo para Clostridium difficile (negativo); toxina (negativo); β2-microglobulina, que resulta elevada –10,6 mg/l (N 0-2,2), y lactato deshidrogenasa normal con 1,6 μkat/l (N 0-3,4).
Se realiza una ecografía para la valoración del trasplante renal, la cual muestra injerto renal en la fosa ilíaca derecha, de morfología normal, con grosor cortical conservado y correctamente diferenciado del seno, sin ectasia de vías excretoras y con ausencia de colecciones o de líquido perirrenal. Finalmente, se realiza diagnóstico de fracaso renal agudo de origen prerrenal secundario a tercer espacio (volumen efectivo intravascular disminuido) por anasarca en el contexto de desnutrición proteica.
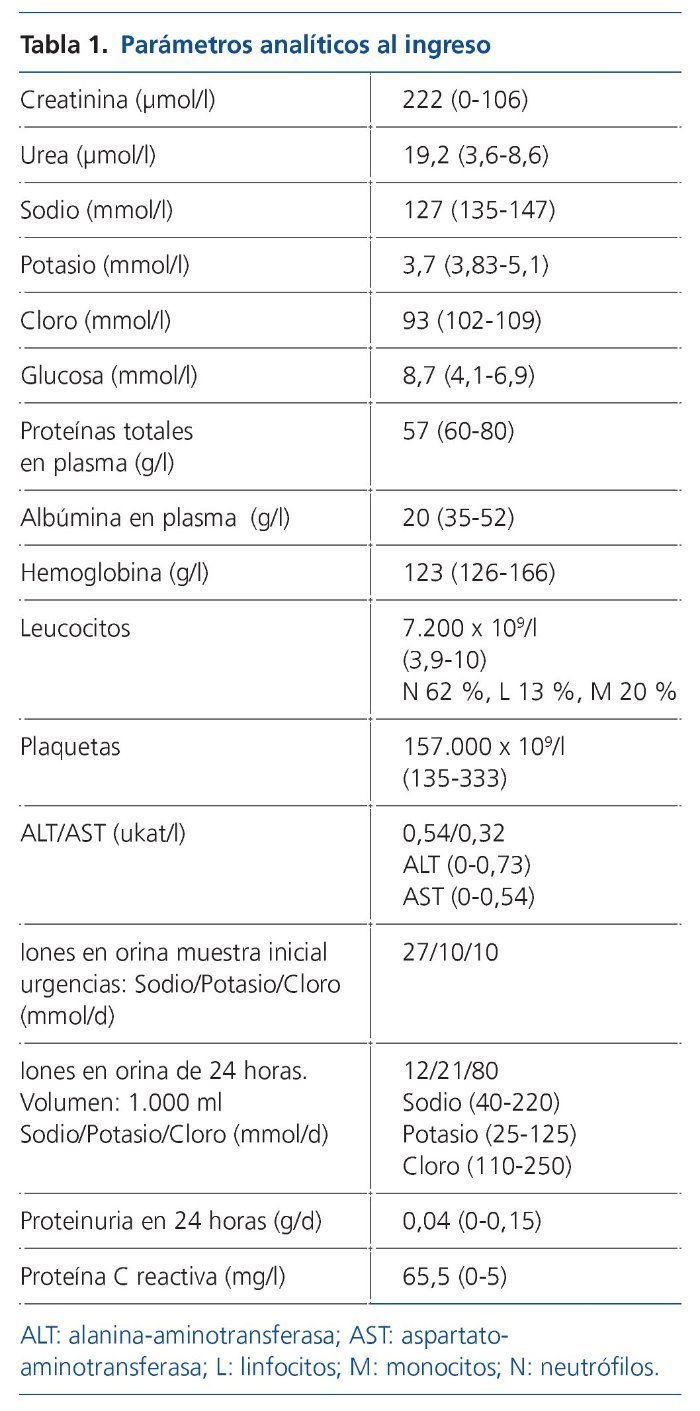
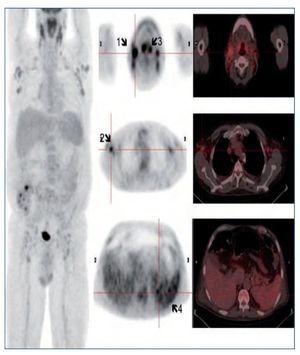
Se instaura tratamiento con sueroterapia, reposición de seroalbúmina y suplementos nutricionales. Por la presencia de síndrome tóxico y adenopatías generalizadas, y con la sospecha diagnóstica de síndrome linfoproliferativo, se decide solicitar como prueba diagnóstica una PET/TC con 18F-FDG (figura 1).
Figura 1. Flechas 1 y 2: Adenopatías hipermetabólicas laterocervicales y axilares, respectivamente. Flecha 3: Engrosamiento amigdalar hipermetabólico. Flecha 4: Hipermetabolismo difuso esplénico.
La PET/TC con 18F-FDG muestra imágenes de cuerpo entero que identifican múltiples adenopatías discretamente hipermetabólicas laterocervicales (la de mayor tamaño de 23 mm y SUVmáx 5,5 g/ml), axilares (18 mm, SUVmáx 4 g/ml) (figura 1, flechas 1 y 2), cadenas ilíacas externas e inguinales (16 mm, SUVmáx 3 g/ml). Se observa también un marcado engrosamiento hipermetabólico amigdalar bilateral y simétrico (figura 1, flecha 3) y aumento difuso de la captación de la FDG a nivel esplénico (sin alteraciones morfológicas) con respecto a la captación hepática (figura 1, flecha 4). A estos hallazgos se asocia un discreto derrame pleural bilateral sin captación patológica que condiciona un colapso pasivo de lóbulos inferiores sin clara evidencia de lesiones pleurales o pulmonares. El tamaño amigdalar, las numerosas adenopatías de características discretamente hipermetabólicas y el aumento difuso de la captación esplénica plantean el diagnóstico diferencial entre un proceso inflamatorio-reactivo/infeccioso-sistémico (infecciones por herpes virus, virus de Epstein-Barr [VEB], citomegalovirus, virus de la inmunodeficiencia humana, micobacterias, enfermedades granulomatosas, entre otras) frente a un proceso linfoproliferativo. Ante dichos hallazgos se solicitan pruebas dirigidas a la identificación de virus del herpes, VEB, citomegalovirus, virus de la inmunodeficiencia humana, micobacterias y antígenos tumorales. Entre ellas destacamos VEB IgG: 25,1 UI/ml, IgM negativo. Reacción en cadena de la polimerasa (PCR) para VEB: 4.974 copias. El resto de pruebas fueron negativas. Se realiza biopsia ganglionar cervical derecha y amidgalectomía por parte del servicio de otorrinolaringología (figura 2).
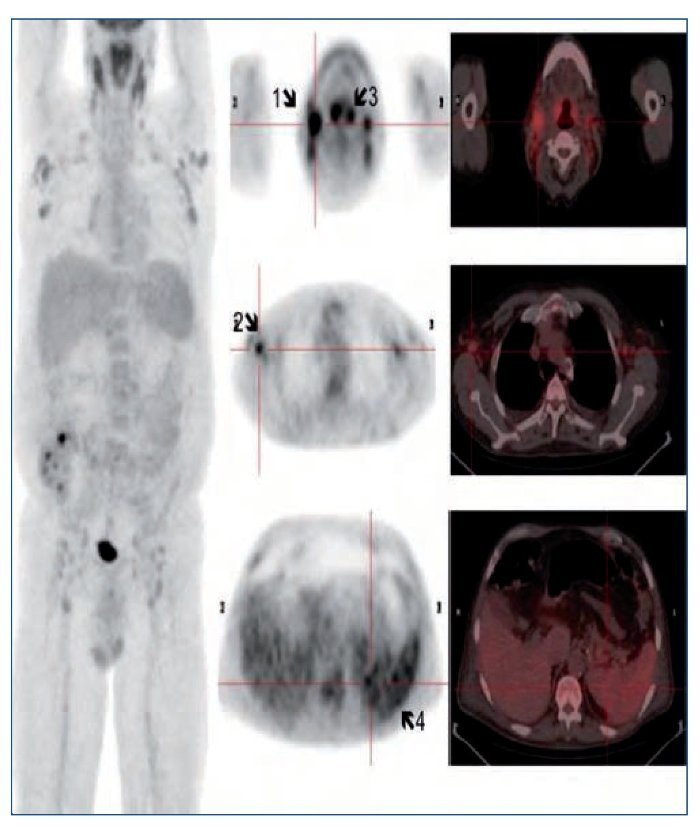
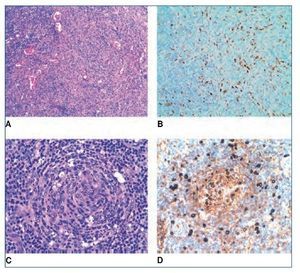
Figura 2. A) Imagen histológica con tinción de hematoxilinaeosina de una proliferación vascular atípica x10. B) Marcador inmunohistoquímico para HHV-8 x20. C) Imagen histológica con tinción de hematoxilina-eosina donde se observa un centro germinal x20. D) Marcador inmunohistoquímico para IgM x20.
El informe de la anatomía patológica describe un ganglio cervical derecho de 3 x 1,8 cm y amígdalas de 3 x 2 cm, sin alteraciones macroscópicas significativas. En el estudio histopatológico el ganglio cervical y las amígdalas muestran una arquitectura conservada, observándose en el ganglio, a nivel capsular y subcapsular, una proliferación de células fusiformes atípicas, formando estructuras vasculares (figura 2A). El estudio inmunohistoquímico es positivo para marcadores vasculares (CD31) y para el VHH-8 (figura 2B). Con estos hallazgos, se establece el diagnóstico de sarcoma de Kaposi. Además, los centros germinales tienen un aspecto depletivo (figura 2C), y en la zona del manto destacan células aisladas de aspecto blástico, que inmunohistoquímicamente son positivas para IgM (figura 2D), lambda y VHH-8. Estos hallazgos son compatibles con una enfermedad de Castleman multicéntrica. El estudio molecular (IgH FR3) es compatible con un patrón policlonal. Ante los hallazgos histológicos se realiza PCR de VHH-8 en sangre periférica, que resulta positiva (test cualitativo).
Frente a dicho diagnóstico se decide conversión con iMtor (sirolimus con un nivel entre 8 y 10 μg/l) y, posteriormente, tras una revisión de la bibliografía, se opta por añadir tratamiento con anticuerpo monoclonal anti-CD-20 (rituximab 375 mg/m2/semanal, 4 dosis en total). Tras el tratamiento instaurado el paciente evoluciona favorablemente, mejoran el síndrome febril y tóxico, y desaparecen las adenopatías a la palpación y en las imágenes. Al alta el paciente presenta recuperación completa de la función renal (creatinina 90 μmol/l) y normalización de la hipoalbuminemia (albúmina 35 g/l).
Tras casi 2 años de seguimiento (20 meses) el paciente se mantiene en remisión completa, con carga vírica VHH-8 y PET-TC negativas.
DISCUSIÓN
El virus del herpes humano tipo 8 es un virus herpes gamma que infecta linfocitos y células epiteliales/endoteliales. La relación de este patógeno en el desarrollo de enfermedades en pacientes inmunosuprimidos es ya bien conocida, con amplia bibliografía en casos de pacientes VIH1; en lo que respecta al grupo de los trasplantados, se han planteado una serie de mecanismos de transmisión según se halle en una zona endémica o no2. La adquisición de una nueva infección puede proceder del donante, de la reactivación de una infección latente, o bien ser secundaria a una infección primaria después de un contacto sexual o no sexual (transfusión).
En cuanto a la patogénesis del VHH-8, se sabe que tanto la expresión latente del gen como la lítica están presentes en el desarrollo de todas las enfermedades del tipo neoplásico, pero se ha visto que la expresión lítica del gen es más común en la ECD, menos en el sarcoma de Kaposi e infrecuente en el linfoma primario de cavidades3. La interleucina 6 tiene un papel central en la fisiopatología de la ECD, ya que el VHH-8 contiene en su ADN un homólogo de la interleucina 6 que explica la mayoría de las manifestaciones clínicas sistémicas de la enfermedad4. En cuanto al diagnóstico de la infección por VHH-8 y de las neoplasias relacionadas en pacientes postrasplantados, se utilizan varios métodos diagnósticos como la serología, el análisis inmunohistoquímico, la histología, la hibridación in situ y la PCR, ya que algunos métodos son limitados en infecciones agudas y otros tienen sensibilidad y/o especificidad relativas, siendo para algunos autores la histopatología el modelo de referencia.
El conocimiento del efecto de este virus sobre la apoptosis, la progresión del ciclo celular, la angiogénesis, la producción de citocinas y la proliferación de células B ha sido muy útil en cuanto al desarrollo de dianas de tratamientos eficaces y efectivos contra dicho patógeno. En el tratamiento contra la infección y patologías subsecuentes por VHH-8 encontramos diferentes líneas: reducción de los inmunosupresores5, cambio del régimen de inmunosupresión, quimioterapia6, antivirales7 y tratamiento con anticuerpos monoclonales8,9.
Actualmente, lo que se encuentra en mayor discusión es la técnica de detección y prevención, ya que el factor endémico del virus tiene una gran relevancia. En zonas no endémicas (< 20 %), el screening a todos los donantes y receptores puede llegar a tener una relación coste-beneficio no viable según en qué grupo poblacional nos encontremos. Independientemente de la detección pretrasplante de la carga vírica del VHH-8, no cabe ninguna duda de la importancia de la monitorización de la carga vírica VHH-8 en pacientes ya diagnosticados de patología tumoral relacionada (sea sarcoma de Kaposi o ECD o linfoma primario de cavidades) con el fin de confirmar la respuesta al tratamiento a través de la negativización de la viremia10. Como método alternativo y más preciso señalamos la monitorización inmunológica con el uso de la técnica de Elispot-T contra distintos antígenos del VHH-8. Con esta técnica se ha demostrado cómo el aumento de las clonas de células T específicas contra los antígenos del VVH-8, que se obtiene a través de la disminución de la inmunosupresión, produce una remisión de la enfermedad11.
Nuestro paciente presentaba dos de las neoplasias relacionadas con VHH-8, esto es, el sarcoma de Kaposi y la ECD. En la literatura médica, la presencia contemporánea de estas dos enfermedades en el trasplante renal solo se ha descrito en otro caso. El caso descrito, a diferencia del nuestro, ha tenido mala evolución, ya que ha sido diagnosticado post mortem de sarcoma de Kaposi pulmonar, mientras que la ECD sí se había detectado pre mortem12. El diagnóstico rápido de la enfermedad gracias a un enfoque multidisciplinar y a la reducción de la inmunosupresión a través de la conversión a iMtor ha sido la clave de la evolución favorable de nuestro paciente. Debido al elevado riesgo de recaída y al mal pronóstico relacionado con la ECD, en nuestra opinión es conveniente añadir también rituximab. La remisión completa casi a los dos años en nuestro caso, tratado con la administración combinada de iMtor más rituximab, respalda nuestra actitud terapéutica, aunque se debería confirmar con una casuística más amplia de casos.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia: Ángela Casas Parra
Servicio de Nefrología. Hospital Universitario de Bellvitge.
C/ Feixa Llarga, s/n. 08907 L’Hospitalet de Llobregat, Barcelona.
angelita_2121@hotmail.com; angela.casas@bellvitgehospital.cat