Describir la experiencia tras el primer año de funcionamiento de una consulta integrativa de cuidados paliativos en pacientes con mieloma múltiple.
Materiales y métodosSe revisaron las historias clínicas de los pacientes visitados por primera vez en la consulta de cuidados paliativos en pacientes con mieloma múltiple. Durante la primera y las 3 siguientes visitas se evaluaron: dolor, anorexia, estreñimiento, insomnio, náuseas y vómitos, disnea, ansiedad y tristeza; mediante una escala visual numérica [0-10]. Se calculó la carga sintomática de los síntomas físicos y emocionales mediante el sumatorio de las puntuaciones de sus escalas visuales numéricas. La intensidad del dolor y su interferencia se evaluó mediante la versión española del Brief Pain Inventory modificada ad hoc.
ResultadosDe febrero a diciembre 2013, se visitaron 67 pacientes (mediana desde el diagnóstico 355 días), y tras 3 visitas de seguimiento (mediana 60 días) la proporción de pacientes con dolor moderado-severo (escala visual numérica≥5) se redujo para el «dolor máximo» (57 vs. 18%; p<0,0001) y el «dolor promedio» (24 vs. 2%; p<0,0001). La proporción de pacientes sin interferencia por el dolor mejoró: actividad general (52 vs. 82%; p=0,0001), sueño (73 vs. 91%; p=0,01), estado de ánimo (52 vs. 87,5%; p=0,0001). La carga sintomática física y emocional, y la proporción de pacientes deprimidos (13 vs. 5%; p=0,001) mejoraron.
ConclusionesLa integración de los cuidados paliativos en la atención de los pacientes con mieloma múltiple no solo es posible, sino que mejora de forma significativa los síntomas emocionales y físicos.
To describe the experience after the first year of operation of an integrative palliative care clinic for patients with multiple myeloma.
Materials and methodsThe medical records were reviewed of patients seen for the first time in the integrative palliative care clinic for patients with multiple myeloma. During the first, and the next 3 visits, pain, anorexia, constipation, insomnia, nausea and vomiting, dyspnoea, anxiety, and sadness were evaluated using a visual numeric scale [0-10]. The symptomatic burden of physical and emotional symptoms was calculated by summing the scores of their visual numeric scale. The pain intensity and its interference were assessed using the Spanish version of the Brief Pain Inventory modified ad hoc.
ResultsFrom February to December 2013, 67 patients (median 355 days from diagnosis) were seen, and after 3 follow up visits (median 60 days from the first visit) the proportion of patients with moderate-severe pain (visual numeric scale≥5) was reduced for “worst pain” (57% vs. 18%; P<.0001) and “average pain” (24% vs. 2%; P<.0001). The proportion of patients without interference from pain improved in, general activity (52% vs. 82%; P=.0001), sleep (73% vs. 91%; P=.01), and mood (52% vs. 87.5%; P=.0001). There was also improvement in the physical and emotional symptom burden, and the proportion of depressed patients (13% vs. 5%; P=.001).
ConclusionsThe integration of palliative care in the care of patients with multiple myeloma is not only possible, but also significantly improves the emotional and physical symptoms.
Desde los inicios los cuidados paliativos (CP) se han centrado en la atención de los pacientes con cáncer avanzado, y particularmente con tumores sólidos1 y en menor proporción en enfermos con otras enfermedades, como la esclerosis lateral amiotrófica2 y el síndrome de inmunodeficiencia adquirida, especialmente durante los años iniciales tras su identificación como enfermedad específica3. En los últimos años se han acumulado pruebas a favor de una mayor intervención de los CP en pacientes con enfermedad no oncológica4, así como de los beneficios de la intervención precoz de los CP en pacientes con neoplasias de pulmón no célula pequeña5 y de otras neoplasias sólidas6,7.
A pesar de los avances antes mencionados, los pacientes con tumores hematológicos difícilmente acceden a los CP; la información disponible al respecto hace énfasis en resaltar las dificultades en identificar el momento adecuado en la transferencia de los pacientes con neoplasias hematológicas (NH) a los equipos de CP debido a la dificultad de identificar las fases avanzadas8,9. Recientemente, diversos autores9–11 enfatizan la idoneidad de la intervención de los equipos de CP en el manejo de los pacientes con NH.
En nuestra institución hace años que los CP están integrados en la atención de pacientes hematológicos en la unidad de hospitalización, basándose en un sólido modelo multidisciplinar centrado en el paciente12. Apoyándose en la exitosa experiencia de hospitalización, se consideró apropiado iniciar una consulta externa integrativa de CP con el Servicio de Hematología Clínica centrada en la atención de pacientes con mieloma múltiple y sus familias (MM-PAL). Apoyados en datos epidemiológicos de nuestro entorno 13 y teniendo en cuenta las características clínicas del MM, se consideró que esta NH era buen modelo para explorar el beneficio de la intervención de CP en pacientes hematológicos ambulatorios. Así pues, el MM aunque solo representa el 10% de todas las NH14 es una enfermedad incurable desde el diagnóstico, aunque afortunadamente su supervivencia ha mejorado notablemente con la aparición de nuevos tratamientos15,16. Por otra parte, los pacientes pueden estar prolongados periodos paucisintomáticos o asintomáticos, pero la carga sintomática suele ser elevada, especialmente debido al dolor, cuya prevalencia es del 80%, y su incidencia del 100%17,18. En febrero de 2013 se puso en marcha la MM-PAL, basada en consultas contiguas, agenda flexible, junto con la evaluación, apoyo y seguimiento telefónico proactivo de enfermería de CP. Todo ello con una comunicación fluida entre los diferentes profesionales involucrados.
El objetivo de este trabajo es describir la experiencia, especialmente en el control sintomático, del primer año tras la puesta en funcionamiento de la MM-PAL.
Materiales y métodosSe revisaron las historias clínicas de los pacientes que fueron visitados por primera vez en MM-PAL desde el 1 de febrero hasta el 31 de diciembre de 2013. Se incluyeron aquellos pacientes diagnosticados de MM y plasmocitoma, seguidos por Hematología y que fueron consultados a MM-PAL.
Los pacientes se programaban en MM-PAL según la prioridad clínica acorde al screening telefónico realizado por la enfermera de CP que evaluaba la presencia e intensidad de síntomas físicos y emocionales, dificultades en el apoyo familiar y para el desplazamiento al hospital, siguiendo el protocolo del servicio19. Las primeras visitas tenían una duración programada de 60min y las sucesivas de 30min.
Durante la primera visita se realizó una evaluación multidimensional integral20, que incluía una batería de síntomas físicos y emocionales, el estado funcional, la estructura y la disponibilidad familiar para el apoyo emocional y práctico, así como los aspectos espirituales. Tras la primera visita en MM-PAL, las visitas de seguimiento se programaron de acuerdo a las necesidades y deseos de los pacientes, y cuando estaba indicado, se realizaron seguimientos telefónicos por parte de enfermería, ya fuese para la reevaluación de los síntomas, apoyo emocional y familiar, como para la supervisión del tratamiento. Asimismo, todos los pacientes y familias disponían de acceso fácil a psiconcología, trabajo social, clínica del dolor u otros profesionales, cuando estaba indicado.
En MM-PAL se realizó de forma rutinaria, a todos los pacientes, una evaluación del dolor, anorexia, estreñimiento, insomnio, náuseas y vómitos, disnea, ansiedad y tristeza. Asimismo, si los pacientes referían otros síntomas, estos se añadían al listado para proceder a su ulterior seguimiento.
La intensidad del dolor se evaluó a través de una versión clínica adaptada ad hoc del Brief Pain Inventory-versión española21, midiendo el «dolor actual», y en las últimas 24h el «dolor máximo», «dolor mínimo» y «dolor promedio», mediante una escala visual numérica (EVN) de 11 puntos (0=sin dolor, 10=el peor dolor posible). También se valoró la interferencia del dolor (sí/no) en la «actividad general», «sueño» y en el «estado de ánimo». Los otros síntomas también fueron evaluados utilizando una EVN de 11 puntos. El pronóstico del dolor se evaluó con el Edmonton Classification System-Cancer Pain22. La presencia de un episodio depresivo se determinó usando los criterios de Endicott23. El estado funcional se evaluó mediante el Palliative Performance Status24 y la dependencia física utilizando el índice de Barthel25. Los mismos datos evaluados en la primera visita lo fueron también en las visitas sucesivas para monitorizar su evolución.
Con el fin de valorar la evolución, se decidió evaluar los cambios en las puntuaciones de las diferentes variables en 3 visitas de seguimiento consecutivas en MM-PAL, para minimizar la interferencia de potenciales variables de confusión debidas a la progresión de la enfermedad o por los efectos del tratamiento. Adicionalmente, se calculó la carga sintomática tanto física como emocional. La carga sintomática física es el sumatorio de la puntuación de: anorexia, astenia, insomnio, estreñimiento, náuseas/vómitos y disnea (puntuación: 0-60); y la carga sintomática emocional la suma de la puntuación de la tristeza y la ansiedad (puntuación: de 0-20).
Análisis estadísticoLas variables categóricas se muestran como porcentajes con su intervalo de confianza del 95%. Las variables continuas se presentan como medias y desviaciones estándar o como mediana y rango intercuartílico (IQR, del inglés Inter Quartil Range) (IQR: Q1 y Q3). Los datos categóricos se compararon mediante χ2 de Pearson y la prueba exacta de Fisher. Las variables continuas se compararon mediante la prueba t de Student o Mann-Whitney o de Wilcoxon Signed Ranks en función de la distribución (normal o no normal). Un valor de p<0,05 fue considerado estadísticamente significativo. Todos los análisis se realizaron con el paquete SPSS (v. 20 para Windows).
ResultadosDurante el periodo de estudio se han visitado 67 pacientes, cuyas principales características se muestran en la tabla 1. La mayoría de los pacientes (63 [94%]] fueron diagnosticados de MM y el resto, de plasmocitoma solitario. Las principales razones aducidas para la consulta fueron: dolor en 37 (55%) pacientes, seguimiento compartido en 28 (42%), fragilidad en uno (1,5%), y sin especificar uno (1,5%). La frecuencia de los síntomas en la primera visita se muestra en la tabla 1. En la primera visita 9 (13%) pacientes presentaban un episodio depresivo, de acuerdo a los criterios de Endicott.
Características demográficas de los pacientes, frecuencia de síntomas y su intensidad media en la primera visita
| Sexo: mujer/hombre (n [%]) | 33 [49,3]/34 [50,7] | |
| Edad (media; DE [rango]) | 68,6; DE 11años [39-88] | |
| PPS (mediana [IQR]) | 80% [Q1:70%; Q3:90%] | |
| Índice Barthel (mediana [IQR]) | 100 [Q1:90; Q3:100] | |
| Tiempo desde el diagnóstico hasta la consulta a CP (mediana [IQR]) | 355 días [Q1:76; Q3:1027] | |
| MM estadio: ISS (n [%])a | ||
| I | 29 [44] | |
| II | 17 [26] | |
| III | 20 [30] | |
| Estado tratamiento antitumoral del MM en la primera visita (n [%]) | ||
| Sí | 55 [82] | |
| No | 12 [18] | |
| Síntomas: frecuencia n[%] e intensidad (0-10)/media; DE | ||
| Dolor | 56 [5,8] | |
| Máximo | 4,5; DE 3 | |
| Promedio | 2,9; DE 2,3 | |
| Ansiedad | 30 [44,7] | 1,2; DE 1,6 |
| Tristeza | 29 [43,3] | 1,2; DE 1,6 |
| Insomnio | 23 [3,34] | 1,3; DE 2,2 |
| Anorexia | 20 [8,29] | 1,2; DE 1,9 |
| Estreñimiento | 20 [8,29] | 1,1; DE 2,1 |
| Astenia | 13 [7,19] | 0,8; DE 1,9 |
| Disnea | 10 [9,14] | 0,3; DE 0,8 |
| N/V | 7 [4,10] | 0,2; DE 0,4 |
DE: desviación estándar; IQR: Inter Quartil Range (rango intercuartílico) Q1-Q3; MM: mieloma múltiple; PPS: Palliative Performance Status.
Respecto al dolor, 56 (83,5%) pacientes refirieron padecer algún tipo de dolor, de los que 49 (87,5%) tenían alguno de los factores de mal pronóstico de la Edmonton Classification System-Cancer Pain tal y como se muestra en la tabla 2. El 46% de los pacientes informaron de interferencia en la «actividad general» y «estado de ánimo» y un 27% en el «sueño».
Pacientes que refirieron dolor (n=56) en cada una de las categorías del Edmonton Classification System-Cancer Pain
| Ítem | Descripción | na | % |
|---|---|---|---|
| Mecanismo de dolor (N) | No (no dolor)a | - | - |
| Nc (Cualquier combinación de dolor visceral y/u óseo o partes blandas) | 42 | 75 | |
| Ne (Dolor neuropático con o sin combinación de dolor nociceptivo) | 14 | 25 | |
| Nx (Información insuficiente para clasificar) | 0 | 0 | |
| Dolor incidental (I) | Io (Sin dolor irruptivo) | 15 | 26,8 |
| Ii (Dolor irruptivo presente) | 41 | 73,2 | |
| Ix (Información insuficiente para clasificar) | 0 | 0 | |
| Distrés psicológico (P) | Po (Sin distrés psicológico) | 33 | 58,9 |
| Pp (Distrés psicológico presente) | 23 | 41,1 | |
| Px (Información insuficiente para clasificar) | 0 | 0 | |
| Conducta adictiva (A) | Ao (Sin conducta adictiva) | 51 | 91,1 |
| Aa (Conducta adictiva presente) | 4 | 7,1 | |
| Ax (Información insuficiente para clasificar) | 1 | 1,8 | |
| Fallo cognitivo | Co (Sin deterioro cognitivo) | 49 | 87,5 |
| Ci (Deterioro parcial, suficiente para afectar a la capacidad del paciente para proporcionar una historia detallada de su dolor actual y pasado) | 7 | 12,5 | |
| Cu (Deterioro completo. No responde, delirium o demencia hasta el punto de no poder proporcionar una historia detallada de su dolor actual y pasado) | 0 | 0 | |
| Cx (Información insuficiente para clasificar) | 0 | 0 |
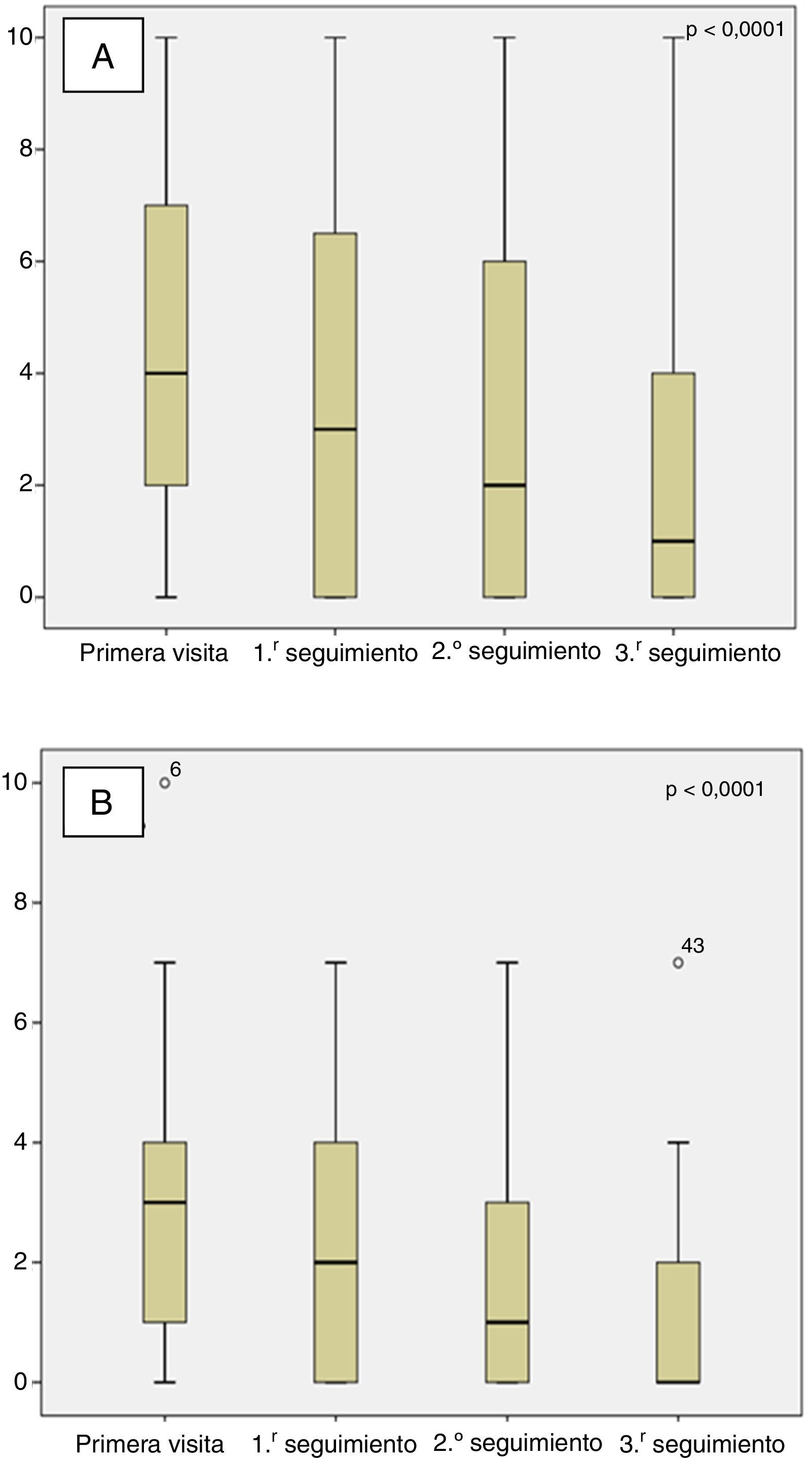
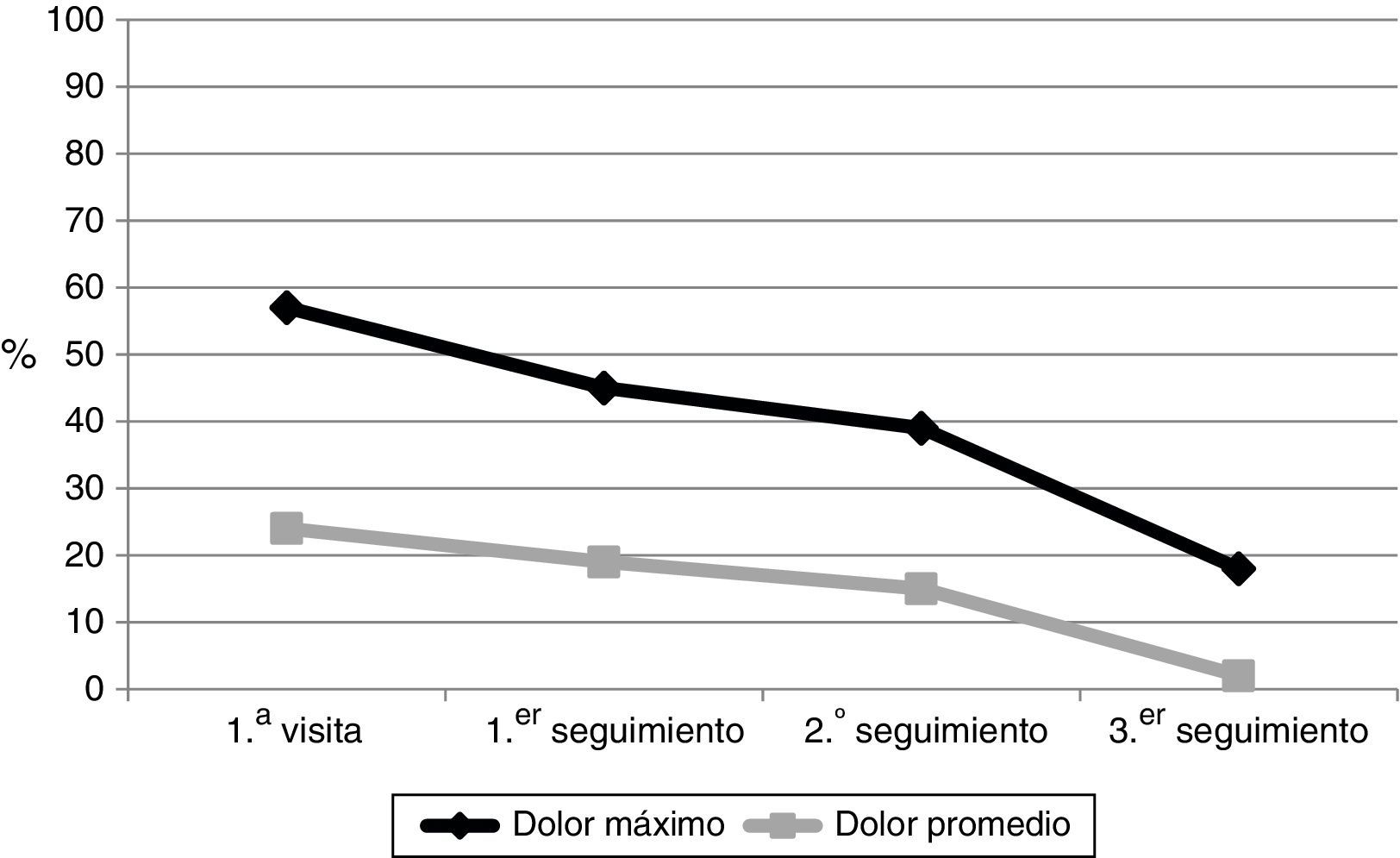
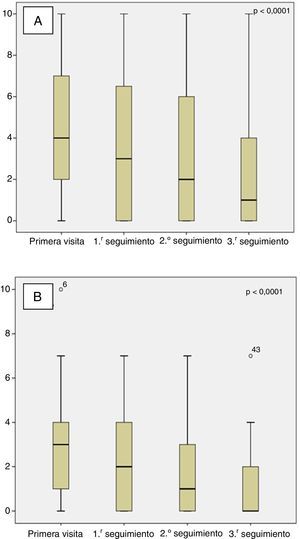
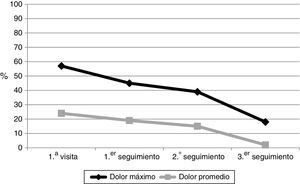
La mediana de tiempo entre la primera visita en MM-PAL y la primera, segunda y tercera visitas de seguimiento fueron: 14 días (IQR: Q1: 7; Q3: 14), 21 días (IQR: Q1:21; Q3: 28), y 60 días (IQR: Q1:45; Q3: 63), respectivamente. Durante el tiempo de seguimiento hubo una mejora significativa (p<0,0001) en la mediana del «dolor máximo» y «dolor promedio» (fig. 1). En la primera visita, el 57% de los pacientes referían un «dolor máximo» moderado-intenso (EVN≥5), mientras que en la tercera visita fue del 18% (p<0,0001), siendo moderado (EVN: 5-6) en el 23 vs. 18%, y severo (EVN≥7) en el 34 vs. 7%, en la primera y tercera visita, respectivamente. Respecto al «dolor promedio» moderado-intenso, fue del 24 y del 2% (p<0,0001) en la primera y tercera visita de seguimiento, respectivamente (fig. 2); considerando el dolor moderado, este lo presentaban el 18 y 0%, y el dolor severo el 11 y 2%, en las primeras y terceras visitas, respectivamente.
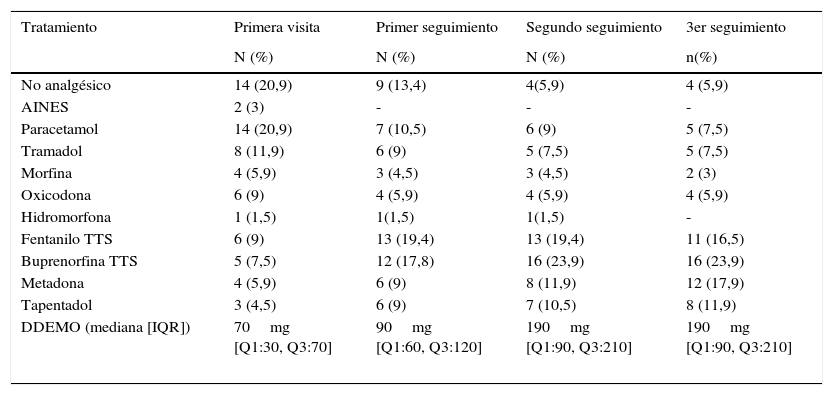
La proporción de pacientes que informaron de interferencia debido al dolor en la primera vs. la tercera visita de seguimiento disminuyó: «actividad general» (46 vs. 18%; p=0,0001), «sueño» (27 vs. 9%; p=0,01) y «estado de ánimo» (46 vs. 12,5%; p=0,0001). Durante el periodo de seguimiento el porcentaje de pacientes tratados con opioides mayores se incrementó del 43,3% en la primera visita al 79,1% en la tercera visita de seguimiento (p<0,0001). El tratamiento analgésico se resume en la tabla 3.
Tratamiento analgésico y su evolución durante el seguimiento
| Tratamiento | Primera visita | Primer seguimiento | Segundo seguimiento | 3er seguimiento |
|---|---|---|---|---|
| N (%) | N (%) | N (%) | n(%) | |
| No analgésico | 14 (20,9) | 9 (13,4) | 4(5,9) | 4 (5,9) |
| AINES | 2 (3) | - | - | - |
| Paracetamol | 14 (20,9) | 7 (10,5) | 6 (9) | 5 (7,5) |
| Tramadol | 8 (11,9) | 6 (9) | 5 (7,5) | 5 (7,5) |
| Morfina | 4 (5,9) | 3 (4,5) | 3 (4,5) | 2 (3) |
| Oxicodona | 6 (9) | 4 (5,9) | 4 (5,9) | 4 (5,9) |
| Hidromorfona | 1 (1,5) | 1(1,5) | 1(1,5) | - |
| Fentanilo TTS | 6 (9) | 13 (19,4) | 13 (19,4) | 11 (16,5) |
| Buprenorfina TTS | 5 (7,5) | 12 (17,8) | 16 (23,9) | 16 (23,9) |
| Metadona | 4 (5,9) | 6 (9) | 8 (11,9) | 12 (17,9) |
| Tapentadol | 3 (4,5) | 6 (9) | 7 (10,5) | 8 (11,9) |
| DDEMO (mediana [IQR]) | 70mg [Q1:30, Q3:70] | 90mg [Q1:60, Q3:120] | 190mg [Q1:90, Q3:210] | 190mg [Q1:90, Q3:210] |
AINE: antiinflamatorios no esteroideos; DDEMO: dosis diaria equivalente de morfina oral; IQR: Inter Quartil Range (rango intercuartílico) Q1-Q3; TTS: transdérmico.
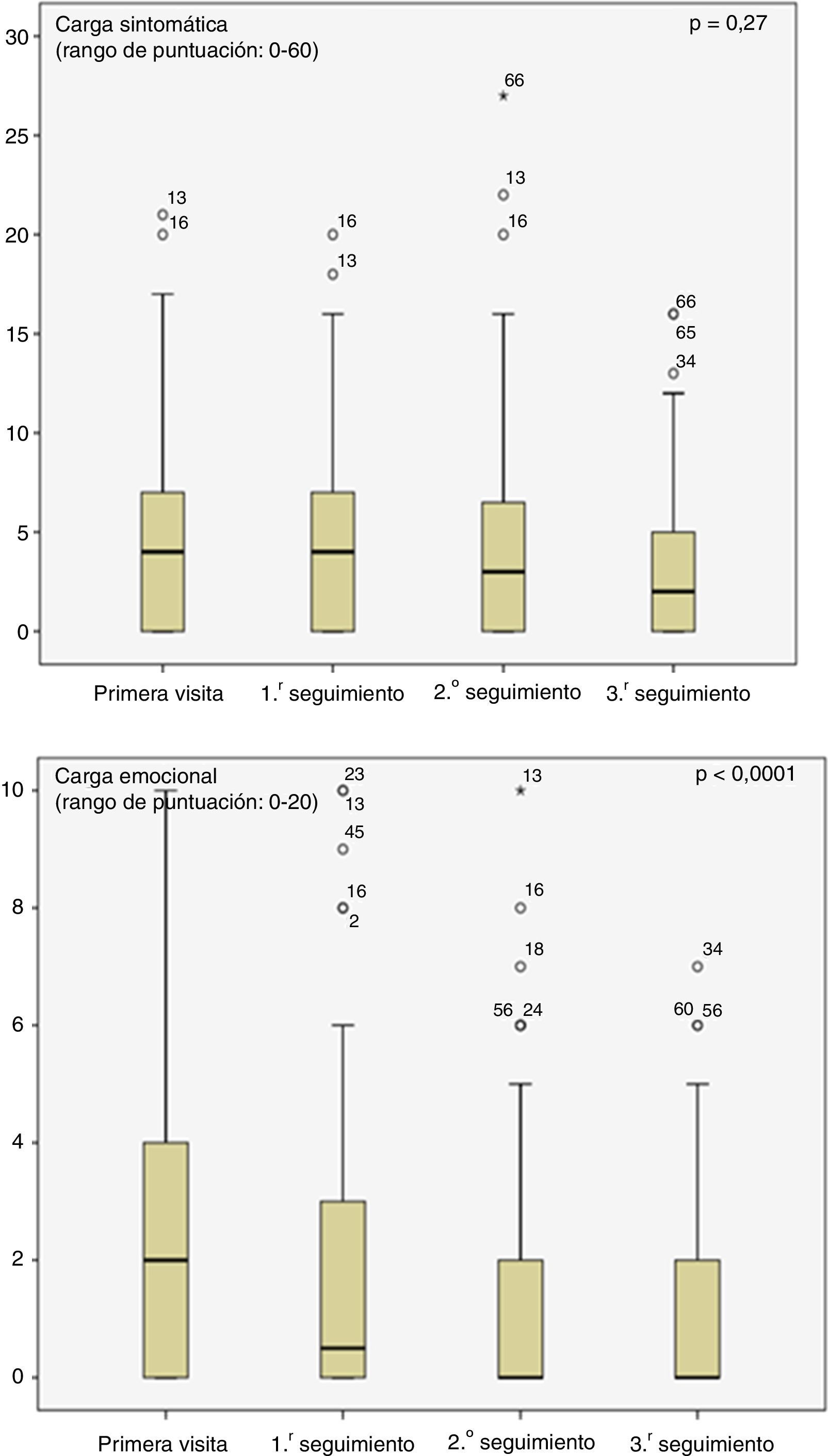
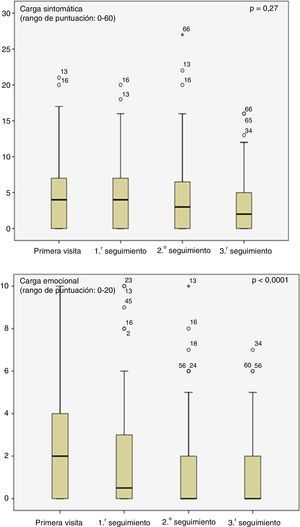
Las medias de intensidad de los diferentes síntomas durante la primera visita fueron leves (tabla 1) a pesar de ello, la carga de los síntomas físicos, así como de los síntomas emocionales disminuyeron significativamente durante el seguimiento (fig. 3). La proporción de pacientes con un episodio depresivo disminuyó también significativamente tras la primera visita (13%), siendo en la tercera visita de seguimiento del 5% (p=0,001).
DiscusiónHasta donde sabemos, este es el primer trabajo que describe los resultados de la integración en la práctica clínica habitual de los CP en las consultas externas de Hematología.
Al inicio de los CP, en los años 70, estos habían sido restringidos a los pacientes incurables, cuando se habían desechado todos los tratamientos antitumorales26. Progresivamente, con el avance del tratamiento del cáncer y el consiguiente aumento de la supervivencia, el concepto de intervención de los CP fue evolucionado, permitiendo una integración más pronta de estos en el curso de las enfermedades oncológicas. Hoy en día, el beneficio de la intervención de los CP ha sido reconocida por las principales sociedades de oncología como un aspecto clave en la calidad de la atención oncológica27,28, existiendo evidencia de la mejoría del dolor y de la carga sintomática, así como de los síntomas emocionales, junto con la reducción de los ingresos hospitalarios y del coste sanitario29,30.
Respecto a los pacientes con NH, los trabajos pioneros de McGrath et al.31,32 evidenciaron las dificultades de interrelación entre los equipos de CP y hematología, describiendo cómo los pacientes recibían tratamientos agresivos hasta el final de la vida (FdV) e incluso estos fallecían durante el tratamiento antitumoral con las dificultades añadidas de lidiar con un final prolongado y/o con las necesidades emocionales y espirituales no abordadas. A pesar del reconocimiento de los CP como un aspecto esencial de la atención oncológica, la intervención de los equipos de CP en las NH continúa retrasándose en comparación con los tumores sólidos33. Las características de la evolución clínica de las NH (las cuales pueden cambiar el enfoque terapéutico de curación a una situación de FdV en poco tiempo), la expectativa poco realista de los tratamientos antitumorales, la dificultad de atención a domicilio de estos pacientes y el fuerte vínculo que se establece entre el hematólogo y los pacientes, son factores descritos que pueden influir en la consulta tardía a CP10–12,32.
En otro orden de cosas, la escasa formación del onco-hematólogo en CP ha sido referida como otro agente limitante para las derivaciones a CP31,34. Recientemente Thomas et al.34 describen en una encuesta a residentes de oncología y hematología que a pesar de que el 99% tratan con pacientes con enfermedad avanzada y al FdV, solo un 44,9% reciben formación específica para ello. En una encuesta realizada por Hui et al.8 se ponen de manifiesto las diferencias entre oncólogos y hematólogos respecto al enfoque al FdV, mostrando cómo los hematólogos prescriben más tratamiento antitumoral en pacientes con Eastern Cooperative Oncology Group (ECOG) 4, un 13% frente el 7% de los oncólogos. Asimismo, el 46% de los hematólogos manifiestan una sensación de fracaso si no pueden alterar el curso de la enfermedad, frente a un 31% de los oncólogos. Paradójicamente, la encuesta destaca que el 80% de los hematólogos se sienten cómodos tratando asuntos como el control de síntomas, apoyo emocional, discusiones sobre pronóstico y/o planificación avanzada de cuidados, y en cambio se sienten menos confortables que los oncólogos discutiendo temas de FdV (72 vs. 88%) y consultando a equipos de CP (81 vs. 93%).
En 2007, McGrath y Holewa35, en un estudio cualitativo mediante entrevistas en profundidad a enfermeras de hospitalización de agudos y de CP, cuyo objetivo era presentar un modelo para el cuidado de FdV en pacientes hematológicos, describieron una trilogía de patrones de funcionamiento entre los equipos de CP y hematología. El primer patrón, de tipo funcional, promueve una experiencia de FdV satisfactoria para pacientes y familias, basado en la comunicación abierta respecto a la muerte y en el proceso de morir, cuidados liderados por CP y delegación de los asuntos específicos de la enfermedad a hematología, y con una organización basada en la colaboración de ambos equipos. El segundo patrón se denomina refractario, donde existe una resistencia a los CP y se basa en la negación del proceso de morir y de la implicación de CP, hecho que hace que las derivaciones sean tardías, con falta de positividad y esperanza hacia los cuidados y asuntos de FdV, y con una organización hierática y paternalista. El tercer patrón llamado envolvente se define como fluctuante y puede oscilar entre el funcional o el refractario. Estos patrones pueden solaparse e indican la complejidad de interrelación entre CP y hematología, frecuentemente asociada a la cultura hospitalaria. Finalmente, estos autores concluyen que lo deseable sería la integración de los CP en estos pacientes.
Asimismo, al igual que se han identificado los obstáculos, también se han hecho más evidentes las áreas de mejora para optimizar la accesibilidad a los CP en todos los estadios de las NH, como serían la mejora de circuitos y recursos, así como promover una intervención precoz para una integración temprana de los CP, sin entrar en conflicto con los objetivos del tratamiento antitumoral tal y, como apunta McGrath en el patrón funcional35; la optimización de la formación en CP, el incidir en la importancia del equipo interdisciplinar y promover una atención anticipada al duelo también forman parte de esas áreas de mejora31,32,35.
En nuestro estudio, los pacientes con MM fueron referidos a la MM-PAL después de una mediana de tiempo desde el diagnóstico de 355 días, pudiéndose considerar un tiempo corto en el contexto de una enfermedad cuya mediana de supervivencia es de 7 años36, y casi la mitad de ellos para intervención compartida y no solo para el control del dolor. Esto nos permite considerar una cohorte de pacientes diagnosticados de MM derivados de forma temprana. Es destacable que tras el dolor, los síntomas emocionales (tristeza y ansiedad) fueron los más prevalentes. En un estudio37 en el que se que incluyeron 154 pacientes con MM, con un tiempo medio tras del diagnóstico más tardío que en nuestro estudio (de 3,7 años), los síntomas más frecuentes fueron fatiga (59%), dolor de huesos (51%), somnolencia (36%), hipoestesia o parestesias (33%) y calambres musculares (31%), siendo el 51% de intensidad moderada a severa. En contraste, en nuestro estudio, a excepción del dolor, la intensidad de los síntomas en la primera visita podría ser considerada leve, pudiendo ser esto reflejo de una consulta temprana. Boland et al.38, en un estudio de cohortes prospectivo utilizando el Sheffield Profile for Assessment and Referral for Care como herramienta de evaluación integral, valoraron las necesidades de 32 pacientes con MM y enfermedad estable tras el primer tratamiento tras recaída para un trasplante autógeno; y encontraron que el 50% de los pacientes presentaban cansancio, el 44% dolor, el 33% insomnio, el 33% somnolencia, el 33% estaban preocupados por los efectos secundarios del tratamiento, el 31% tenían afectada su vida sexual y el 40% estaban preocupados por sus familias. En resumen, a pesar de que la prevalencia de los síntomas puede variar de acuerdo con el momento y la etapa del MM, diferentes estudios demuestran la necesidad de abordar la gran variedad de necesidades de estos pacientes y sus familias, la individualización del tratamiento según los síntomas y la introducción de la planificación avanzada de cuidados12,38–40. La mejoría de los síntomas físicos y emocionales en nuestro estudio podría ser el resultado de muchas razones concurrentes: la pronta evaluación de los síntomas y su tratamiento, el seguimiento telefónico por parte de enfermería y mejor toma de decisiones durante el tratamiento antitumoral.
Nuestros resultados muestran no solo que es posible una integración de CP en hematología, sino que además una intervención precoz en pacientes con MM mejora de forma significativa los síntomas emocionales y físicos; y ello puede realizarse independientemente de si los pacientes reciben tratamiento antitumoral o no. Adicionalmente, es relevante destacar el alto grado de adherencia ya que el 86,6% de los pacientes continuaban seguimiento en la MM-PAL, durante el tiempo del estudio.
En definitiva este estudio muestra que, a pesar de las dificultades descritas en la literatura, no solo es posible, sino que es beneficiosa, la colaboración precoz entre la hematología clínica y los CP. En cualquier caso son necesarios más estudios para identificar mejor las necesidades en los pacientes afectos, no solo de MM sino también de otras NH.
LimitacionesEn primer lugar, vale la pena destacar que la consistencia de los datos podría considerarse afectada por ser un estudio retrospectivo y por el tiempo variable de recogida de los datos. Consideramos que este problema se minimiza debido al hecho de que solo 2 investigadores participaron en la evaluación y recogida de los datos (JPS, MGT). En segundo lugar, los resultados solo reflejan los cambios en el dolor y otros síntomas físicos y emocionales, así que otros aspectos relevantes en CP, como los sociales y espirituales no son comunicados, por lo que solo se ha podido informar de la intervención de CP de una forma parcial; a pesar de que consideramos que la información dada es válida y refleja el beneficio obtenido por los pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores no declaran ningún conflicto de intereses.
Damos las gracias a todo el personal de los Servicios de Hematología y CP, sin los cuales la mayor parte de este trabajo no podría haberse realizado. También nuestro agradecimiento a la Dra. Cristina Monforte y al Prof. Albert Balaguer de la Cátedra WeCare: Atención al final de la vida, de la Universitat Internacional de Catalunya (Barcelona) por su apoyo durante este proyecto.