Analizar las características de los pacientes con demencia atendidos por un equipo de soporte de atención domiciliaria y establecer si existen diferencias en cuanto a la actuación en pacientes con otras enfermedades.
Material y métodosEstudio analítico prospectivo, comparativo de 2 cohortes de pacientes atendidos en sus domicilios (una afecta de demencia y la segunda sin dicho antecedente), comparando edad, sexo, cuidador principal, número de visitas y tiempo de seguimiento, motivo de alta, antecedentes médicos, índices de Barthel previo a intervención y en la primera visita del equipo de soporte de atención domiciliaria, cuestionario de Pfeiffer, tipo de demencia y escala Global Deterioration Scale de Reisberg, número de fármacos previos, presencia de síntomas (dolor, disnea, náuseas, ansiedad, depresión, insomnio, agitación) tratamiento de síntomas o modificación de tratamiento previo, necesidad de sedación. Análisis de datos con programa SPSS 15.0.
ResultadosDel total de pacientes atendidos (N=638), 195 constituyeron la cohorte de pacientes con demencia (30,7%). La causa más frecuente fue demencia vascular 40,4% (N=74). El Global Deterioration Scale medio resultó 6±1,05, con una puntuación media de 8,87 errores en el test de Pfeiffer y con un índice de Barthel medio de 11,9±23. En pacientes sin demencia, se obtienen diferencias significativas en cuanto a la situación funcional y cognitiva (índice de Barthel de 52,34±38 y test de Pfeiffer con una puntuación media de 1,48±3,2 (p<0,001)). El paciente con demencia, más frecuentemente institucionalizado (el 37,9% frente a 11,8% en no dementes), presenta en mayor cuantía síndrome de inmovilidad (70,3 frente al 24%) y presencia de úlceras por presión (el 19,6 frente al 3,9%), menor presencia de clínica salvo agitación y menor necesidad de sedación paliativa (el 8,2 frente al 20,4%). Son pacientes con una menor mortalidad el 31,8 frente al 53,1%) y una menor necesidad de hospitalización (el 6,7 frente al 17,5%), sin evidenciarse diferencias en la actividad asistencial.
ConclusionesNuestros resultados muestran que estos pacientes presentan un perfil sintomático y funcional lentamente progresivo que requerirá una atención centrada en los momentos de crisis, pudiendo disminuir ingresos hospitalarios mediante un adecuado control de síntomas.
to Analyze the characteristics of patients with dementia attended by a home care support team and to establish whether there are differences from patients with other diseases.
Material and methodsA prospective, comparative analytical study of 2 cohorts of patients attended at home, one with dementia and one without, comparing age, sex, principal caregiver, number of visits and time of follow-up, reason for discharge, medical comorbidity, Barthel index prior to intervention and on the first home care support team visit, Pfeiffer questionnaire, type of dementia and Global Deterioration Scale of Reisberg, amount of previous medication, presence of symptoms (pain, dyspnoea, nausea, anxiety, depression, insomnia, agitation) treatment of symptoms or modification of previous treatment, need for sedation. Data analysis with SPSS 15.0 software.
ResultsOf all patients attended (N=638), 195 comprised the cohort of patients with dementia (30.7%). The most common cause was vascular dementia 40.4% (N=74). The average Global Deterioration Scale was 6±1.05, with an average score of 8.87 errors in the Pfeiffer test and average Barthel index of 11.9± 23. In the patients without dementia, significant differences were obtained in terms of functional and cognitive status (Barthel index of 52.34±38 and Pfeiffer test with an average score of 1.48 ±3.2 (P<.001)). The patients with dementia, most commonly institutionalised (37.9% versus 11.8% in non-demented), presented a greater amount of immobility syndrome (70.3% versus 24%) and pressure ulcers (19.6% compared to 3.9%), fewer symptoms other than agitation and less need for palliative sedation (8.2% versus 20.4%). These are patients with lower mortality 31.8% versus 53.1%) and a reduced need for hospitalisation (6.7% versus 17.5%), with no differences in clinical activity.
ConclusionsOur results suggest that these patients have a slowly progressive symptomatic and functional profile that will require attention at times of crisis, hospital admissions could be reduced by adequate control of symptoms.
Una enfermedad muy susceptible de ser subsidiaria de inclusión en programas de cuidados paliativos es la demencia, dada la ausencia de tratamiento curativo. Hay más de 35 millones de personas en todo el mundo que viven con demencia, y según la Organización Mundial de la Salud, se prevé que esta cifra se duplique para el año 20301. La mediana de supervivencia después del diagnóstico es de 2 a 4 años2, pero es una enfermedad poco reconocida como terminal3, salvo en fases muy avanzadas4. La demencia es la enfermedad crónica que provoca la mayor dependencia a los 12, 24 y 36 meses después del diagnóstico, delante de otras enfermedades como el ictus, la enfermedad de Parkinson y la enfermedad cardiovascular5. Existen cada vez más trabajos relativos a cuidados paliativos en enfermedades crónicas degenerativas, como la enfermedad de Alzheimer6, dado el aumento de prevalencia de estas enfermedades7, aunque generalmente realizados en unidades hospitalarias8, donde frecuentemente no se lleva a cabo un adecuado control de síntomas en enfermedades terminales, tal como se puede constatar en un estudio9. Respecto a esto, incluso síntomas como estertores respiratorios y agitación no reciben tratamiento específico en pacientes no oncológicos en hospitales de agudos en los 5 días previos a su fallecimiento. Lo mismo se constata en el trabajo de Martínez-Sellés et al.10, en el que se relata un bajo uso de medidas paliativas en pacientes fallecidos en una unidad de Cardiología, con un alto uso de medidas agresivas previas a haberse dado la orden de no reanimación cardiopulmonar.
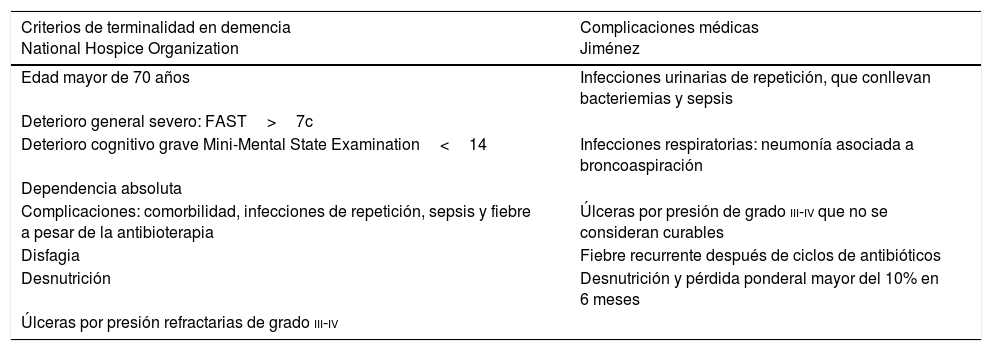
La tabla 1 recoge los criterios de terminalidad en demencia11 propuestos por la National Hospice Organization y las complicaciones que condicionan un mayor deterioro según Jiménez12.
Criterios de terminalidad en demencia y complicaciones médicas
| Criterios de terminalidad en demencia National Hospice Organization | Complicaciones médicas Jiménez |
|---|---|
| Edad mayor de 70 años | Infecciones urinarias de repetición, que conllevan bacteriemias y sepsis |
| Deterioro general severo: FAST>7c | |
| Deterioro cognitivo grave Mini-Mental State Examination<14 | Infecciones respiratorias: neumonía asociada a broncoaspiración |
| Dependencia absoluta | |
| Complicaciones: comorbilidad, infecciones de repetición, sepsis y fiebre a pesar de la antibioterapia | Úlceras por presión de grado iii-iv que no se consideran curables |
| Disfagia | Fiebre recurrente después de ciclos de antibióticos |
| Desnutrición | Desnutrición y pérdida ponderal mayor del 10% en 6 meses |
| Úlceras por presión refractarias de grado iii-iv |
FAST: Functional Assessment Staging.
El domicilio es el lugar donde los pacientes en fase terminal pasan una mayor parte del tiempo, y allí los familiares prestan hasta el 80-90% de los cuidados. Probablemente por este motivo, los cuidadores presentan mayor morbimortalidad, y deben ser tanto dadores como receptores de cuidados13. Entre el 2 y el 5% de personas mayores de 65 años viven en residencias para ancianos y enfermos crónicos, precisando cuidados paliativos14.
La atención domiciliaria presta cuidados a pacientes crónicos, terminales e inmovilizados, dependiendo su organización frecuentemente de gerencias de atención primaria, con recursos propios. La atención a pacientes que precisan cuidados paliativos se realiza en este ámbito a través de los equipos de atención primaria y equipos específicos de soporte (equipo de soporte de atención domiciliaria [ESAD]) cuando la complejidad de la atención, o el propio equipo de primaria, lo requiere15. Tanto a nivel domiciliario como hospitalario existen evidencias de los beneficios de la coordinación con equipos de cuidados paliativos en los pacientes con necesidades de atención más complejas16. En este contexto, nos planteamos como objetivo conocer las diferencias entre los pacientes con y sin demencia avanzada atendidos por un ESAD.
Material y métodosRealizamos un estudio analítico prospectivo comparativo de 2 cohortes de pacientes atendidos por el ESAD en sus domicilios (una afecta de demencia y la segunda sin dicho antecedente), en el sector sanitario de Barbastro (Huesca) desde el 19 de septiembre del año 2007 hasta febrero del año 2011. La población a estudio fueron todos los pacientes derivados al ESAD de Barbastro, llevando a cabo una primera visita y posterior seguimiento. Los pacientes susceptibles de seguimiento y tratamiento por un ESAD son el paciente crónico o con gran dependencia terminal o no terminal, oncológico o no oncológico. Fueron excluidos del trabajo aquellos pacientes sin dichas características.
Las variables estudiadas fueron edad, sexo, cuidador principal (ninguno, cónyuge, hijos, residencia, contratado, otros), número de visitas y tiempo de seguimiento, motivo de alta (mejoría o estabilización, fallecimiento, hospitalización, cambio de sector sanitario), antecedentes médicos, índices de Barthel previo y en la primera visita para dependencia de actividades básicas, cuestionario de Pfeiffer para cribado de deterioro cognitivo, tipo de demencia y escala Global Deterioration Scale de Reisberg para estadificar el grado de demencia, número de fármacos previos, presencia de síntomas (dolor, disnea, náuseas, ansiedad, depresión, insomnio, agitación y fiebre), cuantificación del dolor mediante escala EVA y de la disnea mediante escala de la NYHA, tratamiento de síntomas o modificación de tratamiento previo y necesidad de sedación al final del proceso.
Inicialmente realizamos un análisis estadístico descriptivo de las variables recogidas, analizando la distribución normal o no de cada una de ellas. Posteriormente, las variables continuas, de tendencia normal, se expresaron como media y desviación estándar y se compararon mediante el test de la t de Student para datos pareados y no pareados. Las comparaciones entre más de 2 grupos se realizaron con análisis de la varianza. La distribución de las variables continuas se llevó a cabo mediante el test de Kolmogorov-Smirnov. En los casos de distribución no normal se expresaron como mediana (rango intercuartílico) y se emplearon test no paramétricos en las comparaciones. Las variables categóricas se expresan como porcentajes de la población a estudio y se compararon mediante el test de la χ2, aplicando la corrección de Fisher en los casos apropiados. En las pruebas no paramétricas para 2 muestras independientes se utilizó el estadístico de U de Mann-Whitney, se estudiaron variables categóricas codificadas numéricamente o variables de escala como variables de contraste y una única variable categórica codificada numéricamente como la variable de agrupación. La prueba de Kruskal-Wallis contrasta si las diferencias entre las muestras indican idénticas variaciones respecto de las poblaciones de las que fueron extraídas. Se consideró diferencia significativa si la p<0,05. Los cálculos se realizaron utilizando el paquete estadístico SPSS 15.0.
ResultadosDel total de la muestra (N=638), presentaban diagnóstico de demencia 195 pacientes, el 30,7%, con una edad media de 83,88±7 años. El 42,6% fueron hombres (N=83), con edad media de 81,8±6,2 años y el resto, mujeres con edad media de 85,3±7,2 años (p<0,001). La edad media de los no dementes resultó de 77,7±11,6 años y en dementes 83,8±7 (p<0,001). La demencia vascular fue el diagnóstico etiológico más frecuente, al suponer un 40,4% (N=74), seguido por la enfermedad de Alzheimer, presente en un 31,7% (N=58) y el resto presentaron otros orígenes, como deterioro cognitivo mixto en el 12% (N=22), demencia asociada a enfermedad de Parkinson un 8,7% (N=16), un 0,5% demencia por cuerpos de Lewy (N=1) y otros orígenes un 6,6% (N=12), existiendo 12 casos de demencia no filiada.
La puntuación media en la escala Global Deterioration Scale fue de 6±1,05, con una puntuación media de 8,87 errores en el test de Pfeiffer y con un índice de Barthel medio previo de 19,73±31,8 y de 11,9±23 en la primera valoración. No se detectaron diferencias entre el Global Deterioration Scale medio de hombres y de mujeres dementes (5,85±1,1 en hombres y 6,1±0,99 en mujeres). Los pacientes sin demencia, la mayoría oncológicos, mostraron una puntuación en el índice de Barthel previo de 85±30,3 y en la primera visita de 52,34±38, y en el test de Pfeiffer una puntuación media de 1,48±3,2 (p<0,001). Presentaban úlceras por presión el 19,6% (N=38) de los pacientes con demencia, frente a un 3,9% (N=17) en pacientes sin demencia (p<0,001). Ocurre lo mismo con la presencia de síndrome de inmovilidad, observado en 137 casos con demencia (70,3%). En pacientes sin demencia se observó síndrome de inmovilidad en 106 casos (24%) (p<0,001).
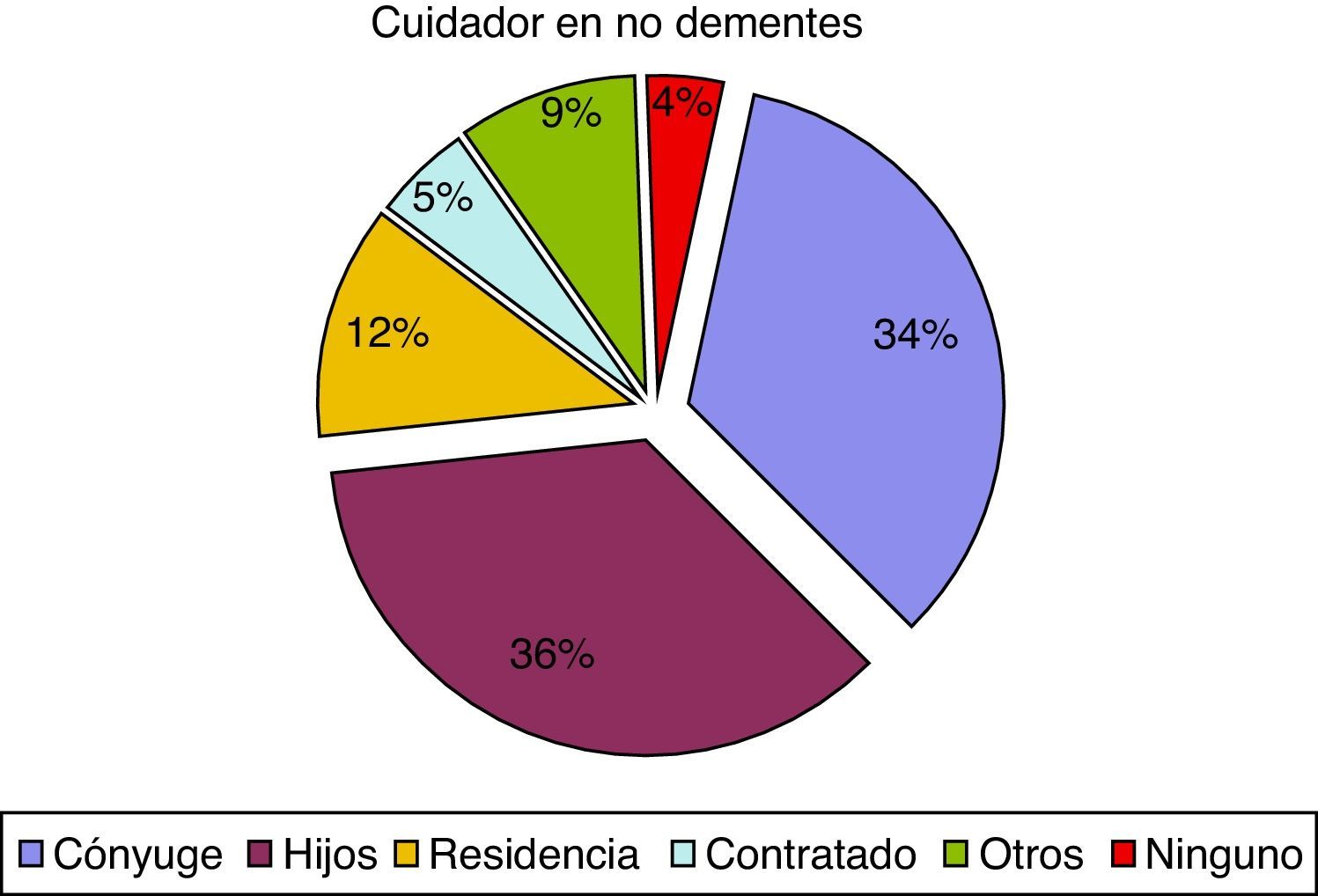
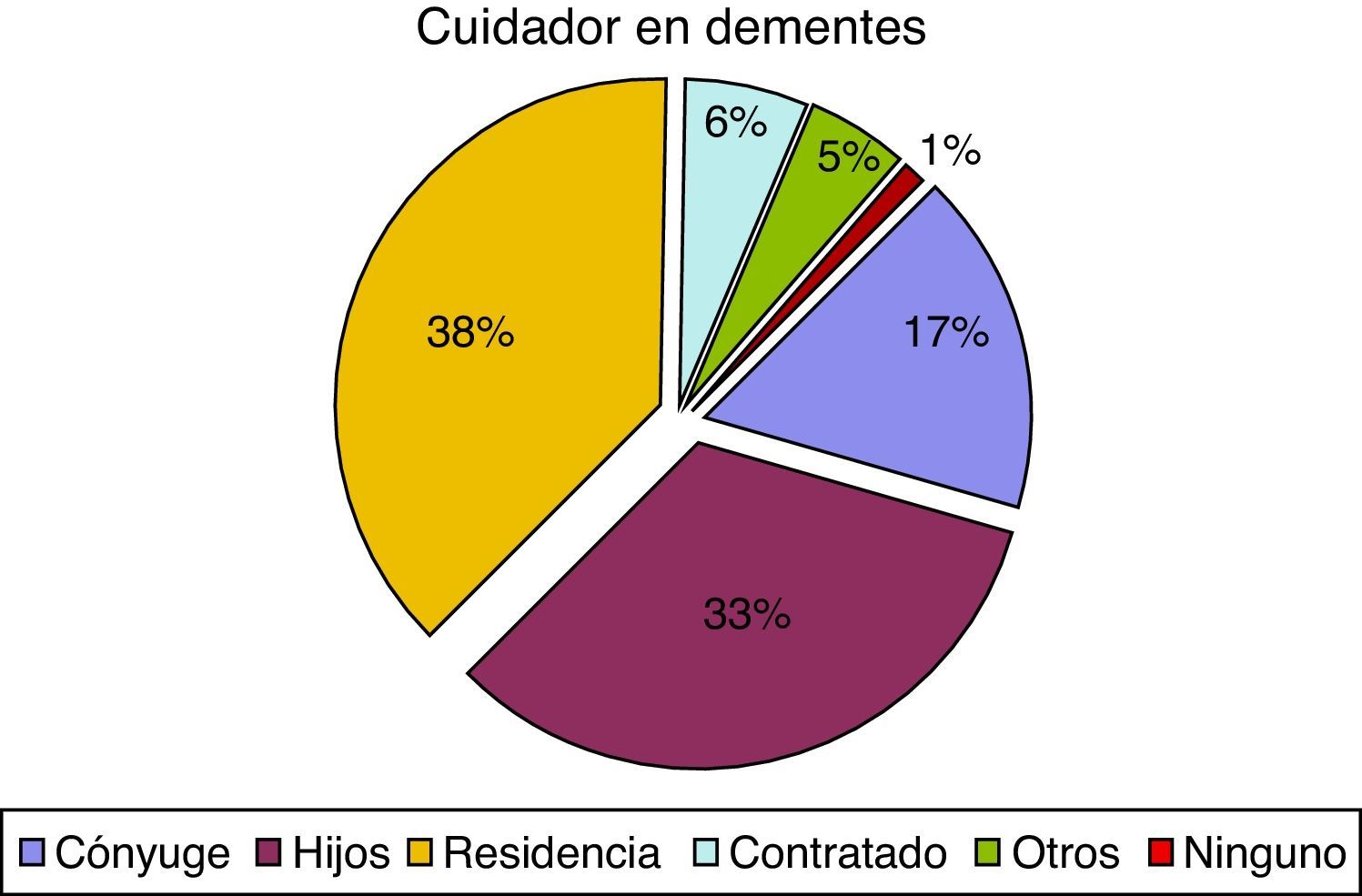
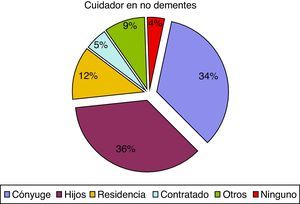
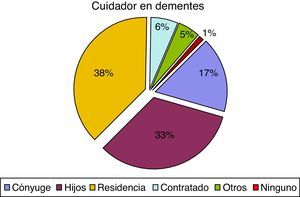
En cuanto al cuidador principal, observamos 74 casos (37,9%), de pacientes con demencia institucionalizados, en comparación con 52 pacientes sin demencia (11,8%). Estas diferencias también afectaban al parentesco del cuidador principal ya que el cónyuge representa el 16,9% en el caso de los pacientes con demencia y el 33,7% en los pacientes sin demencia. Los porcentajes tienden a igualarse cuando los cuidados son asumidos por los hijos, otros familiares o cuentan con cuidador contratado, como se puede observar en las figuras 1 y 2.
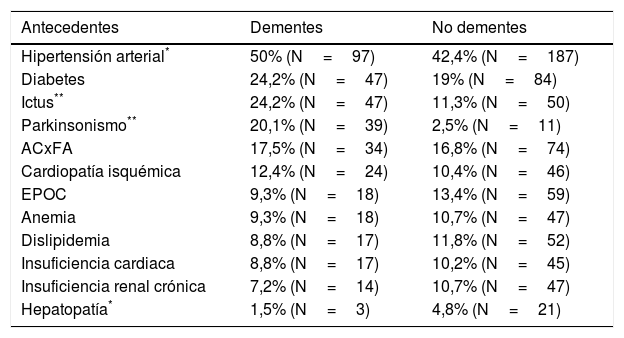
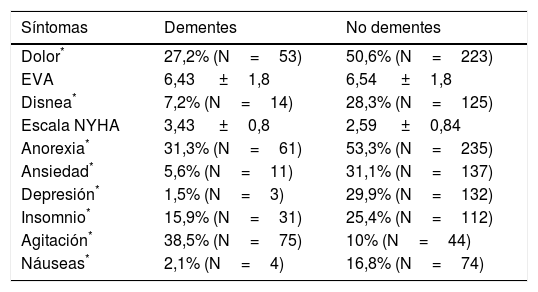
Respecto a los antecedentes médicos, representados en la tabla 2, se observaron diferencias significativas entre dementes y pacientes sin demencia en ictus, parkinsonismo, hipertensión y hepatopatía. Las diferencias observadas entre dementes y no dementes respecto a la sintomatología fueron todas muy significativas (p<0,001), pudiendo observarse las frecuencias en la tabla 3. Con relación a la actividad asistencial generada, los pacientes con demencia precisaron un número medio de 2,34±2,1 visitas en un tiempo medio de seguimiento de 54,72±53,15 días, mientras que en pacientes sin demencia se realizaron una media de 2,83±2,7 visitas en un tiempo de seguimiento medio de 56,71±58,17 días. No se encontraron diferencias significativas en estos 2 aspectos.
Antecedentes médicos en dementes y no dementes
| Antecedentes | Dementes | No dementes |
|---|---|---|
| Hipertensión arterial* | 50% (N=97) | 42,4% (N=187) |
| Diabetes | 24,2% (N=47) | 19% (N=84) |
| Ictus** | 24,2% (N=47) | 11,3% (N=50) |
| Parkinsonismo** | 20,1% (N=39) | 2,5% (N=11) |
| ACxFA | 17,5% (N=34) | 16,8% (N=74) |
| Cardiopatía isquémica | 12,4% (N=24) | 10,4% (N=46) |
| EPOC | 9,3% (N=18) | 13,4% (N=59) |
| Anemia | 9,3% (N=18) | 10,7% (N=47) |
| Dislipidemia | 8,8% (N=17) | 11,8% (N=52) |
| Insuficiencia cardiaca | 8,8% (N=17) | 10,2% (N=45) |
| Insuficiencia renal crónica | 7,2% (N=14) | 10,7% (N=47) |
| Hepatopatía* | 1,5% (N=3) | 4,8% (N=21) |
Clínica presentada en dementes y en no dementes
| Síntomas | Dementes | No dementes |
|---|---|---|
| Dolor* | 27,2% (N=53) | 50,6% (N=223) |
| EVA | 6,43 ±1,8 | 6,54 ±1,8 |
| Disnea* | 7,2% (N=14) | 28,3% (N=125) |
| Escala NYHA | 3,43 ±0,8 | 2,59 ±0,84 |
| Anorexia* | 31,3% (N=61) | 53,3% (N=235) |
| Ansiedad* | 5,6% (N=11) | 31,1% (N=137) |
| Depresión* | 1,5% (N=3) | 29,9% (N=132) |
| Insomnio* | 15,9% (N=31) | 25,4% (N=112) |
| Agitación* | 38,5% (N=75) | 10% (N=44) |
| Náuseas* | 2,1% (N=4) | 16,8% (N=74) |
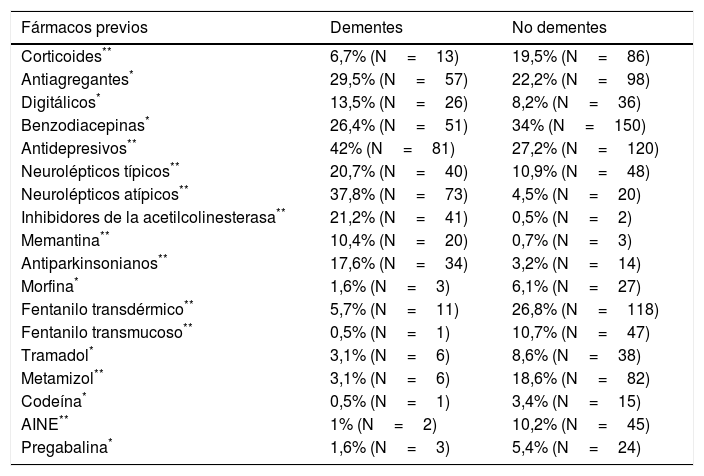
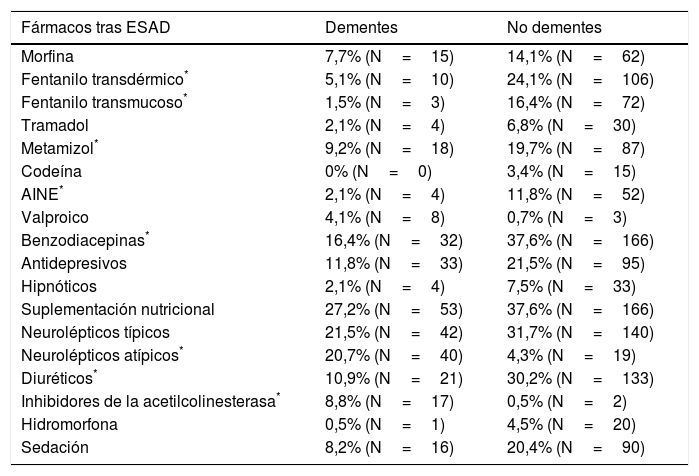
Los pacientes con demencia presentaban una menor polifarmacia, con una media de 6,3±3,1 fármacos previos; en pacientes sin demencia se detectó una media de 7,28±3,34 fármacos. Estas diferencias son estadísticamente significativas (p=0,001). De los pacientes con demencia, un 31,6% se encontraban en tratamiento antidemencia, un 21,2% con inhibidores de la acetilcolinesterasa y un 10,4% con memantina. En la tabla 4 se han representado todos los tratamientos previos a la intervención del ESAD en los que se han encontrado diferencias estadísticamente significativas entre los pacientes con y sin antecedente de demencia. Tras la intervención del ESAD, se observó modificación de diversos tratamientos, representándose en la tabla 5 los fármacos modificados o de nueva prescripción en los que se han hallado diferencias estadísticamente significativas entre dementes y no dementes. Precisaron sedación paliativa al final del proceso 16 pacientes con antecedente de demencia (8,2%) y 90 pacientes sin dicho antecedente (20,4%) (p<0,001).
Diferencias significativas en tratamientos previos entre dementes y no dementes
| Fármacos previos | Dementes | No dementes |
|---|---|---|
| Corticoides** | 6,7% (N=13) | 19,5% (N=86) |
| Antiagregantes* | 29,5% (N=57) | 22,2% (N=98) |
| Digitálicos* | 13,5% (N=26) | 8,2% (N=36) |
| Benzodiacepinas* | 26,4% (N=51) | 34% (N=150) |
| Antidepresivos** | 42% (N=81) | 27,2% (N=120) |
| Neurolépticos típicos** | 20,7% (N=40) | 10,9% (N=48) |
| Neurolépticos atípicos** | 37,8% (N=73) | 4,5% (N=20) |
| Inhibidores de la acetilcolinesterasa** | 21,2% (N=41) | 0,5% (N=2) |
| Memantina** | 10,4% (N=20) | 0,7% (N=3) |
| Antiparkinsonianos** | 17,6% (N=34) | 3,2% (N=14) |
| Morfina* | 1,6% (N=3) | 6,1% (N=27) |
| Fentanilo transdérmico** | 5,7% (N=11) | 26,8% (N=118) |
| Fentanilo transmucoso** | 0,5% (N=1) | 10,7% (N=47) |
| Tramadol* | 3,1% (N=6) | 8,6% (N=38) |
| Metamizol** | 3,1% (N=6) | 18,6% (N=82) |
| Codeína* | 0,5% (N=1) | 3,4% (N=15) |
| AINE** | 1% (N=2) | 10,2% (N=45) |
| Pregabalina* | 1,6% (N=3) | 5,4% (N=24) |
Diferencias significativas en tratamientos pautados por ESAD entre dementes y no dementes
| Fármacos tras ESAD | Dementes | No dementes |
|---|---|---|
| Morfina | 7,7% (N=15) | 14,1% (N=62) |
| Fentanilo transdérmico* | 5,1% (N=10) | 24,1% (N=106) |
| Fentanilo transmucoso* | 1,5% (N=3) | 16,4% (N=72) |
| Tramadol | 2,1% (N=4) | 6,8% (N=30) |
| Metamizol* | 9,2% (N=18) | 19,7% (N=87) |
| Codeína | 0% (N=0) | 3,4% (N=15) |
| AINE* | 2,1% (N=4) | 11,8% (N=52) |
| Valproico | 4,1% (N=8) | 0,7% (N=3) |
| Benzodiacepinas* | 16,4% (N=32) | 37,6% (N=166) |
| Antidepresivos | 11,8% (N=33) | 21,5% (N=95) |
| Hipnóticos | 2,1% (N=4) | 7,5% (N=33) |
| Suplementación nutricional | 27,2% (N=53) | 37,6% (N=166) |
| Neurolépticos típicos | 21,5% (N=42) | 31,7% (N=140) |
| Neurolépticos atípicos* | 20,7% (N=40) | 4,3% (N=19) |
| Diuréticos* | 10,9% (N=21) | 30,2% (N=133) |
| Inhibidores de la acetilcolinesterasa* | 8,8% (N=17) | 0,5% (N=2) |
| Hidromorfona | 0,5% (N=1) | 4,5% (N=20) |
| Sedación | 8,2% (N=16) | 20,4% (N=90) |
Finalmente, respecto al motivo de alta, los pacientes con demencia representaron un porcentaje menor de fallecimientos y de hospitalización que los no dementes. En nuestra serie fallecieron 62 pacientes con demencia (31,8%) frente a 234 sin demencia (53,1%) y fueron hospitalizados 13 dementes (6,7%) frente a 77 pacientes sin demencia (17,5%). Debemos destacar también el número de altas por estabilización o mejoría del cuadro que origina la intervención del ESAD en pacientes dementes (61%) frente al 28,8% en el grupo de otros diagnósticos. Las diferencias observadas en cuanto a mortalidad y hospitalización son muy significativas (p<0,001).
DiscusiónA pesar de que cada vez se investiga más en este campo, queda patente que es necesario realizar estudios prospectivos para ayudar a la creación de criterios de inclusión en programas de cuidados paliativos para pacientes con enfermedades crónicas no oncológicas17, a pesar de las dificultades que entraña la investigación en este ámbito, debido a la heterogeneidad de la población, problemas de medición, la complejidad de los cuadros clínicos y la fluctuación en el estado de salud del paciente18. Casi la mitad de los pacientes con demencia que murieron por neumonía en un amplio estudio belga19 recientemente realizado, lo hicieron en el hospital, así como un 25% de los institucionalizados, siendo más frecuente la hospitalización en estos casos si no contaban con pareja/cónyuge y si vivían en zonas más urbanizadas.
En estos pacientes el único factor que se vio relacionado con el hecho de fallecer en casa fue la convivencia con, al menos, un familiar, no con las características propias del paciente ni de su enfermedad. En nuestro trabajo obtenemos un muy bajo porcentaje de hospitalizaciones entre los pacientes atendidos con demencia, a diferencia de otros, en los que rondan entre el 82%20 y el 95%21, a pesar de que la satisfacción del cuidador frente al trato recibido suele ser mejor en el propio domicilio22. La inclusión en un programa de cuidados paliativos ha demostrado aumentar la probabilidad de muerte en casa, reduciendo las muertes hospitalarias en pacientes con demencia en los Estados Unidos23. Según otra publicación, en el Reino Unido muy pocas personas mueren hospitalizadas en unidades de cuidados paliativos con mención en su certificado de defunción de la demencia24, algo que puede estar minimizado por el hecho de no ser o no haberse considerado tan severa como para influir en el fallecimiento25, habiendo estudios26 donde en el 37% de las personas con demencia avanzada conocida esta no fue mencionada en el certificado de defunción. Los servicios de cuidados paliativos han demostrado en un metaanálisis27 aumentar las probabilidades de morir en casa en pacientes oncológicos, pero la evidencia en la demencia es escasa28, en contra de lo observado en nuestro trabajo.
En algunas series de pacientes7 se puede observar un inadecuado control de síntomas en pacientes con demencia, con un deficiente uso de analgésicos en pacientes con úlceras por presión y dolor, aunque con frecuente uso de antibioterapia y medidas agresivas, como nutrición artificial o restricciones físicas29. En otro trabajo22 se determina que los síntomas más frecuentemente sufridos por los pacientes con demencia en sus últimos días son la confusión y anorexia, seguidos por la ansiedad, disnea y dolor, además de sufrir declive funcional (en este aspecto sin diferencias respecto a pacientes sin demencia). No obstante, todos los síntomas, salvo la desorientación y confusión, fueron más frecuentes en pacientes sin demencia, algo observado también en los pacientes atendidos por el ESAD de Barbastro. En nuestro estudio, el amplio porcentaje de altas es equivalente a un adecuado control sintomático del paciente, fundamentalmente de la agitación psicomotriz. Muchas personas con demencia mueren en condiciones difíciles debido a que el sistema de atención de salud está mal equipado para hacer frente a sus necesidades30. Hay trabajos31 que demuestran la mejoría del control de síntomas y la disminución del gasto sanitario en pacientes hospitalizados con demencia y edad avanzada tras la intervención de un equipo de atención paliativa.
La situación funcional basal de estos pacientes se encuentra muy deteriorada, siendo la edad media similar a la evidenciada en otra publicación7, en la que predominan las mujeres. El porcentaje de institucionalización en residencia es mucho mayor en el subgrupo de dementes, mostrando diferencias respecto al cuidador principal, de forma que en los casos sin demencia es el cónyuge mucho más frecuentemente quien se encarga de los cuidados del paciente. Se ha demostrado que la menor capacidad cognitiva y funcional, y la presencia de sintomatología neuropsiquiátrica predispone a una mayor y más temprana institucionalización del paciente con demencia32. Según una reciente revisión33, la carga del cuidador y la institucionalización del paciente se ven influenciadas por el estado conductual y cognitivo de este, el tiempo utilizado en la atención del mismo, con el consiguiente estrés y aislamiento social, el sexo (más frecuente en mujeres), la relación con el paciente, la disponibilidad de recursos de apoyo y las características del cuidador. Este grupo de pacientes presentaba úlceras por presión en menor grado que en otras series7,34, con un 19,6% de los pacientes con demencia frente a un 3,9% en pacientes sin demencia, siendo esta un factor determinante para su aparición y condicionando una mayor mortalidad respecto a pacientes sin úlceras por presión35. Comparando con los pacientes de nuestra muestra sin presencia de demencia se observan unas marcadas diferencias respecto al hecho de presentar síndrome de inmovilidad y úlceras por presión, aunque la mortalidad del grupo de pacientes con demencia fue menor que en los no dementes, a pesar de que la situación funcional y cognitiva, medida mediante las escalas de Barthel y el test de Pfeiffer muestran diferencias significativas, siendo mucho peores en el grupo de dementes. Esto quizás sea debido a que el empeoramiento de la situación funcional previa fue mucho más marcado en el grupo de pacientes oncológicos, que a su vez presentaron una mayor mortalidad. Otro estudio más reciente36 relaciona la mortalidad intrahospitalaria con la presencia de demencia y fallo cardiaco, además de con el juicio clínico realizado por el médico, no encontrando relación con la situación funcional del paciente, determinada mediante el índice de Barthel al ingreso ni con el hecho de ser un paciente institucionalizado en residencia. En nuestro caso existe un mayor declive funcional en pacientes sin demencia, con una mayor mortalidad asociada. El porcentaje de hospitalizaciones también fue menor en pacientes afectos de demencia, a pesar de que la actividad asistencial del ESAD no mostró diferencias significativas respecto a los pacientes sin demencia, con un número de visitas y un tiempo de seguimiento similar. Una posible causa, además de la mayor institucionalización, es la menor presencia de sintomatología en pacientes con demencia, ya que el único síntoma más frecuente en estos pacientes es la agitación psicomotriz, presente en un 38,5%, porcentaje menor que el registrado en un estudio previamente nombrado22, donde alcanza casi el 87%. De ahí que los únicos fármacos prescritos por el ESAD que muestran diferencias frente a no dementes en cuanto a un mayor uso sean los antipsicóticos atípicos y los inhibidores de la acetilcolinesterasa. Antes de que interviniera el ESAD se observa un mayor uso de antidepresivos y neurolépticos tanto típicos como atípicos, así como de antiagregantes y digitálicos, siendo que la polifarmacia es significativamente menor en el grupo de dementes, algo frecuente en este tipo de enfermedades37. El hecho de padecer demencia no influyó en la necesidad de sedación al final del proceso, quizás debido al mejor control de la sintomatología presentada con dichos antipsicóticos atípicos. Un 27,2% presentaron dolor no controlado, síntoma presente con intensidad de moderada a severa 2 días antes del fallecimiento en más de la mitad de pacientes con demencia38, siendo un factor contribuyente en la presencia de la agitación psicomotriz39, aunque la prescripción de analgésicos en dementes fue menor que en pacientes sin demencia, con diferencias significativas. Siendo una población con una situación funcional muy deteriorada, se encuentran en tratamiento con fármacos antidemencia un 31,28%, justificado quizás por el intento de control de síntomas conductuales o agitación psicomotriz, pero ya no como un tratamiento destinado a frenar la progresión del declive cognitivo o funcional de los pacientes, ya que tras la retirada de los mismos se puede ver incrementada la frecuencia de alteraciones de conducta40.
Nuestro trabajo no está exento de limitaciones. La primera es que no podemos comparar 2 cohortes de pacientes con demencia para analizar en profundidad los efectos de la intervención de un equipo específico de cuidados paliativos en esta enfermedad. La segunda se deriva de los criterios de inclusión ya que el ESAD interviene a demanda de otros profesionales por lo que podemos estar valorando solo una parte de los casos susceptibles de intervención. Otra área de mejora es la medida de la satisfacción: conocer qué opinan los cuidadores de los pacientes y en qué medida la intervención de nuevos profesionales facilita el cuidado del enfermo constituyen datos complementarios que aportan más datos de cara generalizar la intervención. En cualquier caso podemos concluir que la actividad asistencial rutinaria de un ESAD es capaz de dar respuesta a las necesidades de los pacientes con demencia avanzada en el domicilio. Nuestros resultados muestran que estos pacientes presentan un perfil sintomático y funcional lentamente progresivo que requerirá una atención centrada en los momentos de crisis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.