Describir las características clínicas y respiratorias de una cohorte de 43 pacientes con COVID-19 tras 28 días de evolución.
DiseñoProspectivo, observacional en un solo centro.
ÁmbitoMedicina intensiva.
PacientesPacientes ingresados por COVID-19 e insuficiencia respiratoria.
IntervencionesNinguna.
VariablesSe obtuvieron de forma automática variables demográficas, de gravedad, de laboratorio, de asistencia ventilatoria recibida (oxigenoterapia alto flujo [OAF] y ventilación mecánica invasiva [VMI]), de oxigenación (PaO2, PaO2/FiO2) y de complicaciones. Los pacientes se dividieron en 3 grupos: supervivientes (G1), fallecidos (G2) y aquellos que continuaban ingresados (G3). Se utilizó la prueba de Chi-cuadrado o de Fisher (variables categóricas) y la U de Mann-Whitney o Wilcoxon para analizar la diferencia entre medianas. Se consideró significativo un valor de p<0,05.
ResultadosSe incluyeron 43 pacientes (G1=28 [65,1%]; G2=10 [23,3%] y G3=5 [11,6%]), edad 65 (52-72) años, 62% varones, APACHE II 18 (15-24), SOFA 6 (4-7), hipertensión arterial (30,2%) y obesidad (25,6%) fueron las comorbilidades más frecuentes. La OAF fue usada en el 62,7% de pacientes, el 85% fracasó. El 95% de los pacientes necesitó VMI y el 85% ventilación en prono. En la población general, la PaO2/FiO2 inicial mejoró a los 7 días (165 [125-210] vs. 194 [153-285]; p=0,02), al igual que en el G1 (164 [125-197] vs. 207 [160-294]; p=0,07), pero no en el G2 (163 [95-197] vs. 135 [85-177]). No se observó co-infección bacteriana. El desarrollo de neumonía asociada a la VMI fue elevado (13 episodios/1.000 días de VMI).
ConclusionesLos pacientes con COVID-19 requieren VMI precoz, elevada frecuencia de ventilación en prono y presentan alta prevalencia de fracaso a la OAF. La falta de mejoría de la PaO2/FiO2 a los 7 días podría ser un marcador de pronóstico.
To describe the clinical and respiratory characteristics of a cohort of 43 patients with COVID-19 after an evolutive period of 28 days.
DesignA prospective, single-center observational study was carried out.
Setting: Intensive care.
PatientsPatients admitted due to COVID-19 and respiratory failure.
InterventionsNone.
VariablesAutomatic recording was made of demographic variables, severity parameters, laboratory data, assisted ventilation (HFO: high-flow oxygen therapy and IMV: invasive mechanical ventilation), oxygenation (PaO2, PaO2/FiO2) and complications. The patients were divided into three groups: survivors (G1), deceased (G2) and patients remaining under admission (G3). The chi-squared test or Fisher exact test (categorical variables) was used, along with the Mann-Whitney U-test or Wilcoxon test for analyzing the differences between medians. Statistical significance was considered for p<0.05.
ResultsA total of 43 patients were included (G1=28 [65.1%]; G2=10 [23.3%] and G3=5 [11.6%]), with a mean age of 65 years (range: 52-72), 62% males, APACHE II 18 (15-24), SOFA 6 (4-7). Arterial hypertension (30.2%) and obesity (25.6%) were the most frequent comorbidities. High-flow oxygen therapy was used in 62.7% of the patients, with failure in 85%. In turn, 95% of the patients required IMV and 85% received ventilation in prone decubitus. In the general population, initial PaO2/FiO2 improved after 7 days (165 [125-210] vs.194 [153-285]; p=0.02), in the same way as in G1 (164 [125-197] vs. 207 [160-294]; p=0.07), but not in G2 (163 [95-197] vs. 135 [85-177]). No bacterial coinfection was observed. The incidence of IMV-associated pneumonia was high (13 episodes/1000 days of IMV).
ConclusionsPatients with COVID-19 require early IMV, a high frequency of ventilation in prone decubitus, and have a high incidence of failed HFO. The lack of improvement of PaO2/FiO2 at 7 days could be a prognostic marker.
.
El 11 de marzo de 2020, la Organización Mundial de la Salud (OMS) declara una nueva pandemia debido a la rápida propagación del SARS-CoV-2 fuera de China1. Los pacientes infectados por SARS-CoV-2 pueden desarrollar una neumonía viral grave denominada enfermedad COVID-19, caracterizada por un cuadro de insuficiencia respiratoria grave, que ha condicionado una elevada demanda de camas en las unidades de cuidados intensivos (UCI) en España, poniendo a prueba el sistema sanitario nacional2,3. El 20 de febrero de 2020, se diagnosticó el primer caso del síndrome de distrés respiratorio agudo (SDRA) del adulto en Italia4 y poco menos de un mes después, el primer paciente con SDRA por COVID-19 fue ingresado en nuestra UCI.
El ingreso en las UCI de los pacientes con COVID-19 varía marcadamente entre países, desde un 9% en Italia4 hasta un 32% en China5. Según los datos publicados por la Red Nacional de Vigilancia Epidemiológica del Instituto de Salud Carlos III6 con fecha 16 de abril de 2020, de los 59.094 pacientes hospitalizados, 4.390 ingresaron en las UCI, lo que se corresponde con un 7,4% de ingresos en las UCI para España. Tomando en consideración que tanto las características de los pacientes ingresados en UCI por COVID-19, así como la asistencia recibida y por ende la mortalidad cruda, pueden variar sustancialmente entre centros7 y países 3,5,7–10, nuestro objetivo es describir las características clínicas y respiratorias de una serie de casos consecutivos de pacientes con enfermedad COVID-19 grave en un hospital de tercer nivel, diferenciando los pacientes según su evolución en la UCI a los 28 días.
Material y métodosEstudio prospectivo, observacional de cohorte, que incluye a todos los pacientes admitidos de forma consecutiva en el servicio de medicina intensiva desde el 14 de marzo hasta el 16 de abril 2020, con diagnóstico confirmado de infección por SARS-CoV-2, mediante el análisis de muestra obtenida por hisopado nasofaríngeo y/o broncoaspirado a través de RT-PCR, según los criterios establecidos por la Organización Mundial de la Salud11. La técnica de RT-PCR se realizó en el laboratorio de referencia (Hospital Clínic de Barcelona) hasta el 24 de marzo de 2020, después de lo cual, la prueba se realizó en nuestro laboratorio que fue designado de referencia para la provincia de Tarragona.
El estudio fue aprobado por el Comité de Ética e Investigación Clínica del Hospital Universitario de Tarragona Joan XXIII (# CEIM: 066/2020) y el consentimiento informado para el uso secundario de los datos obtenidos de forma automática, fue solicitado de forma verbal a los pacientes o bien a sus familiares directos, dejando constancia de ello en la historia clínica electrónica.
El presente estudio se ha realizado con datos almacenados en la base de datos del sistema de información clínica (SIC) de nuestro centro Centricity Critical Care® (CCC) de General Electric. Los datos se han ido almacenando a través del SIC de forma rutinaria mediante registros manuales, captación automática a través de dispositivos, e integración automática con el laboratorio y el Sistema de Información Hospitalaria de nuestro centro (SAP). Según la fuente y la tipología de los datos, estos se almacenan en diferentes tablas dentro de la base de datos del SIC. Cada tabla contiene como mínimo un campo o atributo que la relaciona con otra tabla dentro del sistema (esquema relacional), permitiendo así la integración de todos los datos mediante procesos de extracción, transformación y carga (ETL). El proceso de ETL que ha permitido generar la cohorte a partir de las tablas crudas de la base de datos del CIS se ha implementado íntegramente con software libre (Python 3.0, Jupyter Notebook y Docker).
VariablesSe obtuvieron variables demográficas, de gravedad (APACHE II), nivel de disfunción orgánica al ingreso (SOFA score) y comorbilidades. Las variables clínicas (tensión arterial media [TAM], frecuencia cardiaca [FC] y frecuencia respiratoria [FR]), variables relacionadas con la asistencia ventilatoria y la oxigenación (necesidad de ventilación mecánica invasiva [VMI], oxigenoterapia alto flujo [OAF], presión arterial de oxígeno [PaO2], presión arterial de dióxido de carbono [PaCO2], fracción inspirada de oxígeno [FiO2], pH arterial, relación PaO2/FiO2, presión pico [Pmáx], presión meseta (PPl), presión positiva al final de la espiración [PEEP]). Además, se consideraron variables de laboratorio como nivel de hemoglobina, leucocitos, lactato, proteína C reactiva (PCR) y procalcitonina (PCT). Todas las variables se obtuvieron al ingreso y a los 7 días de evolución para realizar comparaciones.
La indicación de intubación orotraqueal (IOT), OAF o ventilación mecánica (VM), ha sido realizada por el médico a cargo del paciente, no se contaba con un protocolo específico de manejo respiratorio para COVID-19. Debido a la sugerencia de no utilizar ventilación no invasiva (VNI) ni OAF por la generación de aerosoles12, la utilización de VNI fue desaconsejada en función del consenso interno y el empleo de OAF fue indicado en el contexto de la limitada disponibilidad de respiradores o como estrategia para retrasar o evitar la VM. Todos los pacientes que fracasaron en OAF fueron intubados y recibieron VM posteriormente. Ningún paciente fue considerado con limitación del tratamiento del soporte vital. La valoración del ingreso de los pacientes a las UCI se realizó en concordancia con las recomendaciones éticas de la SEMICYUC13.
Los pacientes se diferenciaron según su evolución a los 28 días en 3 grupos: supervivientes (grupo 1); fallecidos (grupo 2) y finalmente, aquellos que aún permanecían en la UCI a los 28 días (grupo 3).
Principales definiciones- •
Neumonía grave por SARS-CoV-2: fue definida según las consideraciones del Ministerio de Sanidad de España14, como la existencia de cuadro clínico compatible con fiebre (temperartura corporal >38°C), tos, dolor de garganta, mialgias y síntomas gripales con RT-PCR positiva para SARS-CoV-2 y presencia de insuficiencia respiratoria aguda, con infiltrados pulmonares en la radiografía de tórax que requiere ingreso en UCI.
- •
Co-infección bacteriana: fue considerada en pacientes con confirmación de COVID-19 en los cuales el cultivo de muestra respiratoria baja (broncoaspirado [BAS] o lavado broncoalveolar [BAL]) obtenida dentro de las primeras 24h de ingreso, demostró aislamiento de un microorganismo patógeno, en concentraciones superiores a los puntos de corte definidos para cada técnica15.
- •
Neumonía asociada a ventilación mecánica (NAV): fue definida de acuerdo a las nuevas guías de ATS/IDSA16, en aquellos pacientes que desarrollan cuadro clínico compatible con aumento de los infiltrados radiológicos, cambio en el aspecto de las secreciones y cultivo positivo de muestra (BAS o BAL) para microorganismos patógenos en concentraciones superiores a los puntos de corte definidos para técnica, en una muestra obtenida después de 48h de inicio de la VM.
- •
Cálculo de la tasa de incidencia de NAV por cada 1.000 días ventilador: se expresa en forma de densidad (número de casos por cada día/persona/exposición) y se calculó mediante la siguiente fórmula: tasa de incidencia=número de casos de neumonía asociada al uso de ventilador mecánico durante el periodo de estudio/total de días/persona/exposición a ventilador mecánico en la población durante el periodo de estudio * 1.000.
- •
Fracaso de la OAF: se consideró fracaso de la OAF a la necesidad de intubación inmediata y ventilación mecánica posterior. El criterio de necesidad de IOT fue clínico y gasométrico y quedo a cargo del médico tratante.
- •
Shock al ingreso: se consideró presencia de shock al ingreso, a la necesidad de cualquier dosis de noradrenalina dentro de las primeras 6h de ingreso, para mantener la presión arterial media, una vez se ha realizado la resucitación de volumen necesaria guiada por parámetros dinámicos o bien por ecocardiografía.
- •
SDRA: fue clasificado según la definición de Berlín17 en 2 grupos: severo/moderado y leve.
- •
La disfunción renal aguda se determinó según la clasificación RIFLE18 en las 3 categorías definidas.
Para las comorbilidades y el resto de las definiciones se han utilizados los criterios publicados con anterioridad19
Análisis estadísticoDado las características del estudio no se realizó el cálculo del tamaño muestral, por lo cual el tamaño de la muestra es igual al número de pacientes ingresados durante el periodo de estudio. Las variables continuas se presentan como mediana y rango intercuartil (RIC), las variables categóricas se expresan como número de casos y sus porcentajes. La diferencia en la distribución de las variables consideradas entre los grupos de pacientes, se estudiaron mediante la prueba de Chi-cuadrado o el test exacto de Fisher (variables categóricas). Las diferencias entre medianas se determinaron mediante el test de Wilcoxon o la U de Mann-Whitney (no paramétricos). Dado el número limitado de casos no se ha realizado análisis multivariables para las comparaciones. Se consideró significativa una p<0,05. El análisis se realizó mediante el paquete estadístico SPSS® 25.0 (IBM).
ResultadosCaracterísticas generalesDesde el 1 de febrero hasta el 14 de abril de 2020, 380 casos de COVID-19 fueron diagnosticados en nuestro hospital, de ellos 43 (11,3%) requirieron ingreso en la UCI por la presencia de insuficiencia respiratoria aguda y son motivo del presente análisis. Diecisiete pacientes (39,5%) fueron ingresados desde el servicio de medicina interna, 15 (34,9%) derivados desde otros hospitales y 11 (25,6%) desde el departamento de urgencias de nuestro hospital. Aunque los pacientes recibieron oxigenoterapia convencional y en algunas ocasiones OAF antes del ingreso a nuestra UCI, estos datos no están disponibles para su análisis. La mediana de tiempo desde el ingreso al hospital hasta la UCI fue de un día (0,0-3,0).
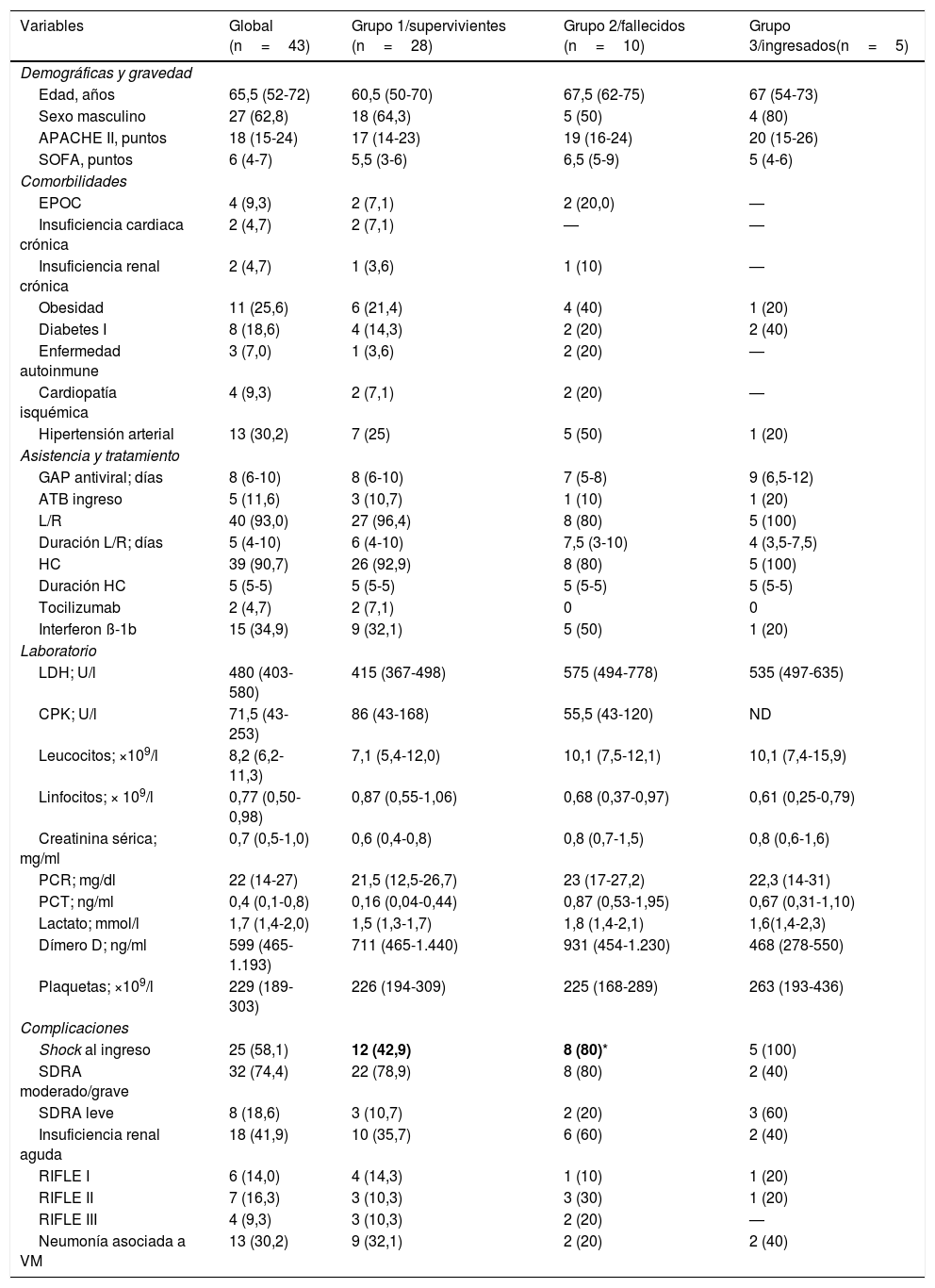
Las características basales de los pacientes se pueden observar en la tabla 1. Al momento del análisis 28 pacientes fueron dados de alta vivos (grupo 1=65,1%), 10 pacientes fallecieron (grupo 2=23,3%) y 5 (grupo 3=11,6%) permanecen ingresados. La mediana de días hasta la muerte fue de 23 (RIC: 11-40) días, y un solo paciente (2,3%) falleció dentro de las primeras 24h del ingreso. La estancia media en la UCI para pacientes del grupo 1 fue de 27 días (RIC: 13-34).
Características generales de los 43 pacientes con COVID-19 grave
| Variables | Global (n=43) | Grupo 1/supervivientes (n=28) | Grupo 2/fallecidos (n=10) | Grupo 3/ingresados(n=5) |
|---|---|---|---|---|
| Demográficas y gravedad | ||||
| Edad, años | 65,5 (52-72) | 60,5 (50-70) | 67,5 (62-75) | 67 (54-73) |
| Sexo masculino | 27 (62,8) | 18 (64,3) | 5 (50) | 4 (80) |
| APACHE II, puntos | 18 (15-24) | 17 (14-23) | 19 (16-24) | 20 (15-26) |
| SOFA, puntos | 6 (4-7) | 5,5 (3-6) | 6,5 (5-9) | 5 (4-6) |
| Comorbilidades | ||||
| EPOC | 4 (9,3) | 2 (7,1) | 2 (20,0) | — |
| Insuficiencia cardiaca crónica | 2 (4,7) | 2 (7,1) | — | — |
| Insuficiencia renal crónica | 2 (4,7) | 1 (3,6) | 1 (10) | — |
| Obesidad | 11 (25,6) | 6 (21,4) | 4 (40) | 1 (20) |
| Diabetes I | 8 (18,6) | 4 (14,3) | 2 (20) | 2 (40) |
| Enfermedad autoinmune | 3 (7,0) | 1 (3,6) | 2 (20) | — |
| Cardiopatía isquémica | 4 (9,3) | 2 (7,1) | 2 (20) | — |
| Hipertensión arterial | 13 (30,2) | 7 (25) | 5 (50) | 1 (20) |
| Asistencia y tratamiento | ||||
| GAP antiviral; días | 8 (6-10) | 8 (6-10) | 7 (5-8) | 9 (6,5-12) |
| ATB ingreso | 5 (11,6) | 3 (10,7) | 1 (10) | 1 (20) |
| L/R | 40 (93,0) | 27 (96,4) | 8 (80) | 5 (100) |
| Duración L/R; días | 5 (4-10) | 6 (4-10) | 7,5 (3-10) | 4 (3,5-7,5) |
| HC | 39 (90,7) | 26 (92,9) | 8 (80) | 5 (100) |
| Duración HC | 5 (5-5) | 5 (5-5) | 5 (5-5) | 5 (5-5) |
| Tocilizumab | 2 (4,7) | 2 (7,1) | 0 | 0 |
| Interferon ß-1b | 15 (34,9) | 9 (32,1) | 5 (50) | 1 (20) |
| Laboratorio | ||||
| LDH; U/l | 480 (403-580) | 415 (367-498) | 575 (494-778) | 535 (497-635) |
| CPK; U/l | 71,5 (43-253) | 86 (43-168) | 55,5 (43-120) | ND |
| Leucocitos; ×109/l | 8,2 (6,2-11,3) | 7,1 (5,4-12,0) | 10,1 (7,5-12,1) | 10,1 (7,4-15,9) |
| Linfocitos; × 109/l | 0,77 (0,50-0,98) | 0,87 (0,55-1,06) | 0,68 (0,37-0,97) | 0,61 (0,25-0,79) |
| Creatinina sérica; mg/ml | 0,7 (0,5-1,0) | 0,6 (0,4-0,8) | 0,8 (0,7-1,5) | 0,8 (0,6-1,6) |
| PCR; mg/dl | 22 (14-27) | 21,5 (12,5-26,7) | 23 (17-27,2) | 22,3 (14-31) |
| PCT; ng/ml | 0,4 (0,1-0,8) | 0,16 (0,04-0,44) | 0,87 (0,53-1,95) | 0,67 (0,31-1,10) |
| Lactato; mmol/l | 1,7 (1,4-2,0) | 1,5 (1,3-1,7) | 1,8 (1,4-2,1) | 1,6(1,4-2,3) |
| Dímero D; ng/ml | 599 (465-1.193) | 711 (465-1.440) | 931 (454-1.230) | 468 (278-550) |
| Plaquetas; ×109/l | 229 (189-303) | 226 (194-309) | 225 (168-289) | 263 (193-436) |
| Complicaciones | ||||
| Shock al ingreso | 25 (58,1) | 12 (42,9) | 8 (80)* | 5 (100) |
| SDRA moderado/grave | 32 (74,4) | 22 (78,9) | 8 (80) | 2 (40) |
| SDRA leve | 8 (18,6) | 3 (10,7) | 2 (20) | 3 (60) |
| Insuficiencia renal aguda | 18 (41,9) | 10 (35,7) | 6 (60) | 2 (40) |
| RIFLE I | 6 (14,0) | 4 (14,3) | 1 (10) | 1 (20) |
| RIFLE II | 7 (16,3) | 3 (10,3) | 3 (30) | 1 (20) |
| RIFLE III | 4 (9,3) | 3 (10,3) | 2 (20) | — |
| Neumonía asociada a VM | 13 (30,2) | 9 (32,1) | 2 (20) | 2 (40) |
APACHE II: Acute Physiology And Chronic Health Evaluation; ATB: antibiótico; EPOC: enfermedad pulmonar obstructiva crónica; GAP antiviral: días desde comienzo de los síntomas hasta recibir la primera dosis de antiviral; HC: hidroxicloroquina; L/R: lopinavir/ritonavir; RIFLE: escala de disfunción renal; SDRA: síndrome de distrés respiratorio agudo; SOFA: Sequential Organ Failure Assessment; VM: ventilación mecánica.
Todas las comparaciones considerando el grupo 1 como referencia.
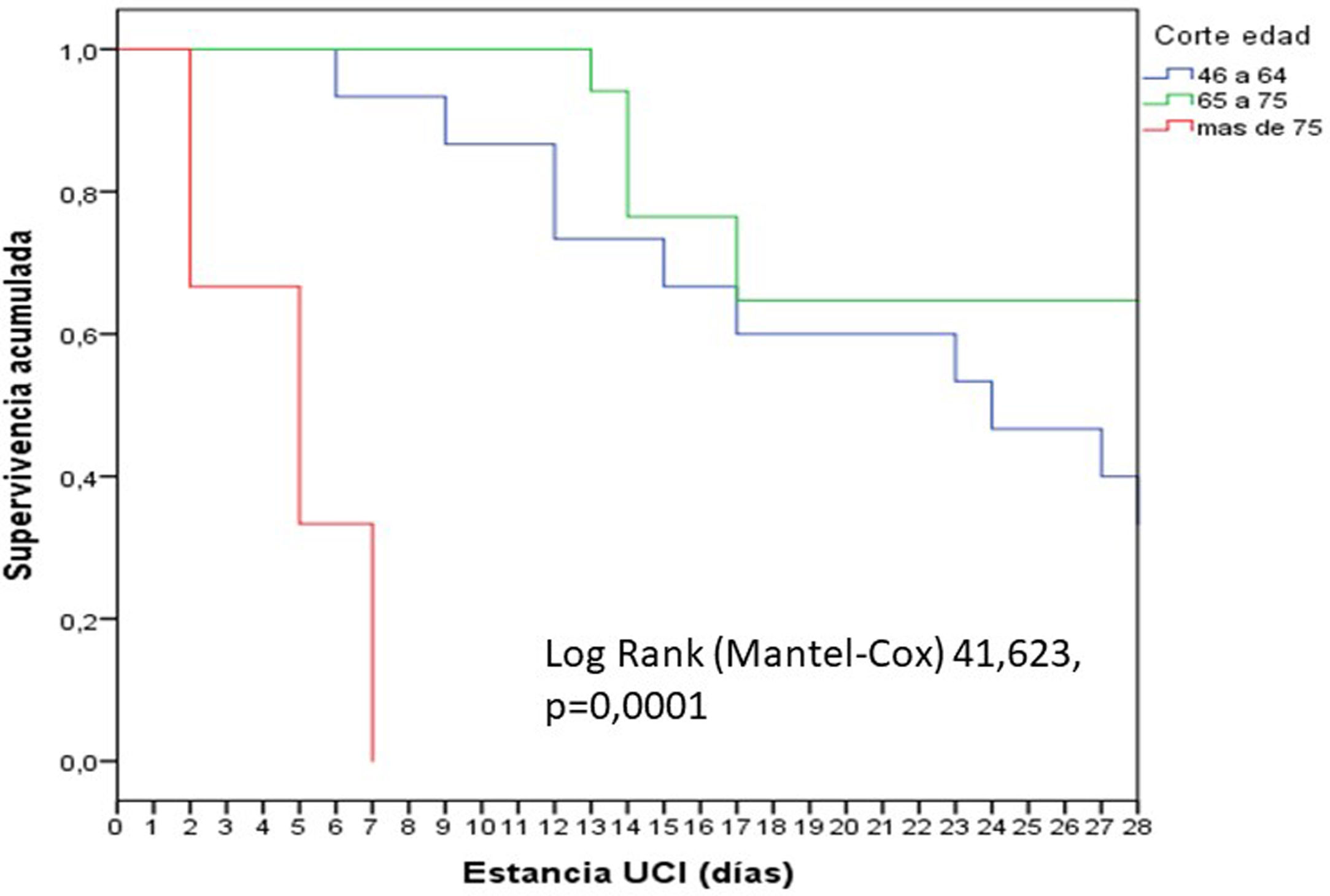
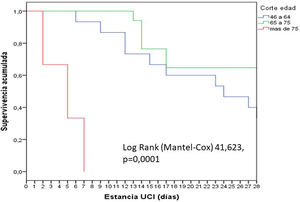
En general, los pacientes fueron jóvenes (65 años), predominantemente varones, con un nivel de gravedad elevado, como lo expresan los valores medianos de APACHE (18) y SOFA (6). Se observó un incremento significativo (p=0,02) de la mortalidad según los cortes de edad establecidos: 18 a 45 años (0%); 46-64 años (13,3%), 65-75 años (35,3%) y mayor de 75 años (66,7%). La mortalidad de los pacientes mayores de 75 años fue precoz, en la primera semana (fig. 1).
En el 44% de los pacientes no se registraron comorbilidades. Ningún trabajador de la salud de nuestro hospital fue ingresado en la UCI afectado por COVID-19 dentro del periodo de observación. Las principales comorbilidades fueron la HTA (30,2%) y la obesidad (25,6%), seguida de la diabetes mellitus (18,6%), enfermedad pulmonar obstructiva crónica (EPOC: 9,3%) y cardiopatía isquémica (9,3%). Dentro de los 13 pacientes con HTA, 7 pacientes (53,8%) tenían antecedentes de medicación relacionada con inhibidores de la enzima convertidora de angiotensina (IECA; n=2) o de antagonistas del receptor de angiotensina (ARA, n=5). Solamente la presencia de shock al ingreso fue más frecuente en pacientes fallecidos (80%) respecto del grupo superviviente (grupo 1=42,9%) (tabla 1). Las otras variables consideradas no lograron diferencias con significación estadística entre los grupos.
TratamientoEl tiempo desde el inicio de los síntomas hasta la primera dosis de antiviral fue prolongado, con una mediana de 8 días (RIC: 6-10), sin observarse diferencias entre los grupos. Lopinavir/ritonavir fue administrado en 40 (93%) pacientes, con una duración mediana de solo 5 días (RIC: 3,5-10) debido a complicaciones relacionadas con la elevación marcada de las transaminasas, lo cual condicionó la retirada del tratamiento. Hidroxicloroquina se administró a 39 (90,7%) pacientes con una duración mediana de 5 días. Interferón ß-1b solo se administró en 15 pacientes (34,9%) por problemas de disponibilidad del fármaco y solo 2 pacientes (4,7%) recibieron tocilizumab en otros centros, antes de su derivación a nuestra UCI (tabla 1). No se consideró la administración de corticosteroides dentro del tratamiento para la COVID-19. Su administración se realizó al ingreso en la UCI en un solo (2,3%) paciente para continuar su tratamiento crónico. Cinco pacientes (11,6%) recibieron metilprednisolona como tratamiento de rescate por infiltrados pulmonares persistentes después de la segunda semana de estancia, y 4 (9,3%) recibieron la medicación por otras causas como trombocitopenia (n=1), anemia hemolítica (n=1) y rash cutáneo (n=2).
Asistencia ventilatoriaTodos los pacientes necesitaron algún tipo de asistencia ventilatoria durante las primeras horas de ingreso en la UCI. La OAF fue utilizado como tratamiento inicial de la insuficiencia respiratoria por COVID-19 en 27 pacientes (62,7%). Sin embargo, a las 24h solo 4 de los pacientes respondieron favorablemente, lo cual equivale a una frecuencia de fracaso del 85,2% (4/27). Al día 7, solo 2 pacientes mantenían OAF y estos fueron dados de alta como supervivientes, sin requerir otro tipo de soporte respiratorio. La mediana de tiempo hasta el fracaso de la OAF fue de 8h (RIC: 6-20h). Todos los pacientes que fracasaron fueron posteriormente intubados y ventilados. La VMI fue empleada como primera opción de tratamiento de la insuficiencia respiratoria aguda en 16 pacientes (37,2%). Sin embargo, durante las primeras 24h, 37 (86%) de los 43 pacientes estaban ventilados, y finalmente, a los 7 días, 41 (95%) necesitaron VMI. De los pacientes en VMI, 34 (82%) requirieron al menos un episodio de ventilación en prono, con una mediana de 3 (1-5) maniobras por paciente, aunque algunos recibieron más de 10 periodos de ventilación en prono. Solo un paciente (2,3%) fue derivado al hospital de referencia para realizar ECMO, el cual finalmente falleció. La mediana de días de la VMI fue de 27 días (RIC: 15-38), y similar en sobrevivientes (23 días [RIC: 12-30]) y fallecidos (27 días [RIC: 13-38; p=0,37]. De los 37 pacientes que requirieron VMI, 32 (86,5%) han completado la evolución en la UCI al momento del análisis, con una mortalidad cruda del 28,1% (9/32), similar respecto de aquellos pacientes que no requirieron VMI en las primeras 24h (16,6%; p=0,55).
El 93% (40/43) de los pacientes cumplieron criterios de SDRA, siendo en 32 (74,4%) moderado/severo y en 8 (18,6%) leve. De los 32 pacientes con SDRA moderado/severo, 27 (72,9%) recibieron VMI a las 24h, pero 4 (14,8%) se mantuvieron con OAF, y un paciente con máscara facial con reservorio. La totalidad de los pacientes con SDRA leve necesitaron VMI a las 24h.
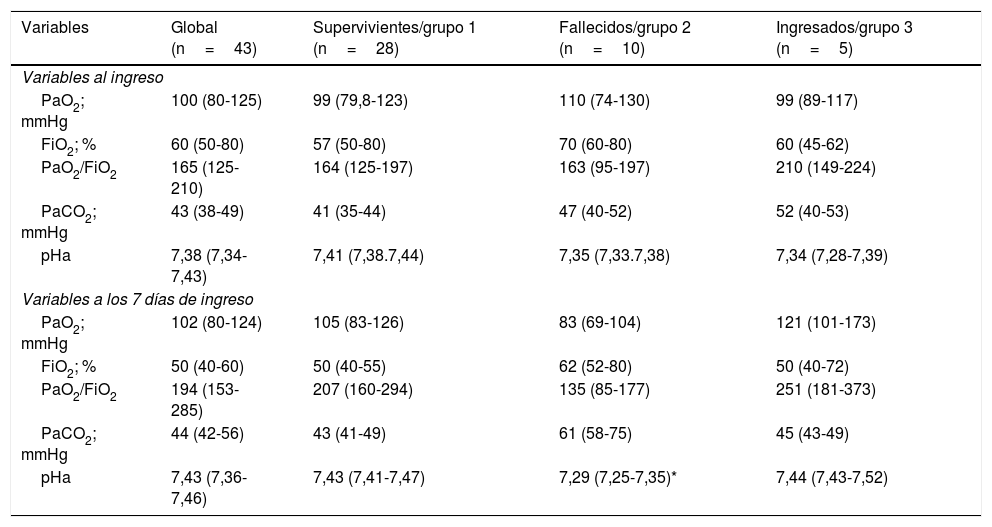
Independiente del soporte respiratorio recibido, la PaO2/FiO2 mediana al ingreso de los pacientes fue de 165 (RIC: 125-210), la cual se incrementó significativamente hasta el día 7.° llegando a 194 (153-285; p=0,05). Un comportamiento similar de la PaO2/FiO2 se observó en los supervivientes, aunque sin lograr significación (p=0,07), mientras que en los fallecidos la PaO2/FiO2 se redujo discretamente después de 7 días a pesar del tratamiento (tabla 2).
Variables relacionadas con la oxigenación de los 43 pacientes diferenciados por su evolución
| Variables | Global (n=43) | Supervivientes/grupo 1 (n=28) | Fallecidos/grupo 2 (n=10) | Ingresados/grupo 3 (n=5) |
|---|---|---|---|---|
| Variables al ingreso | ||||
| PaO2; mmHg | 100 (80-125) | 99 (79,8-123) | 110 (74-130) | 99 (89-117) |
| FiO2; % | 60 (50-80) | 57 (50-80) | 70 (60-80) | 60 (45-62) |
| PaO2/FiO2 | 165 (125-210) | 164 (125-197) | 163 (95-197) | 210 (149-224) |
| PaCO2; mmHg | 43 (38-49) | 41 (35-44) | 47 (40-52) | 52 (40-53) |
| pHa | 7,38 (7,34-7,43) | 7,41 (7,38.7,44) | 7,35 (7,33.7,38) | 7,34 (7,28-7,39) |
| Variables a los 7 días de ingreso | ||||
| PaO2; mmHg | 102 (80-124) | 105 (83-126) | 83 (69-104) | 121 (101-173) |
| FiO2; % | 50 (40-60) | 50 (40-55) | 62 (52-80) | 50 (40-72) |
| PaO2/FiO2 | 194 (153-285) | 207 (160-294) | 135 (85-177) | 251 (181-373) |
| PaCO2; mmHg | 44 (42-56) | 43 (41-49) | 61 (58-75) | 45 (43-49) |
| pHa | 7,43 (7,36-7,46) | 7,43 (7,41-7,47) | 7,29 (7,25-7,35)* | 7,44 (7,43-7,52) |
FiO2: fracción inspirada de oxígeno; PaCO2: presión parcial de dióxido de carbono arterial; PaO2: presión parcial de oxígeno arterial.
Todas las comparaciones considerando el grupo 1 como referencia.
El 11,6% (n=5) de los pacientes recibieron tratamiento antimicrobiano (ATB) al ingreso en la UCI por sospecha clínica de co-infección bacteriana. Cuatro pacientes recibieron ceftriaxona más macrólido y un paciente piperacilina /tazobactam más macrólido. No se obtuvo aislamiento de microorganismos patógenos en muestras respiratorias profundas (BAS=5) de esos pacientes. En todos los pacientes el antígeno urinario para S. pneumoniae y Legionella spp. fue negativo, así como el broncoaspirado y los hemocultivos realizados al ingreso en la UCI. No se observó presencia de co-infección bacteriana en nuestra serie. La mediana de PCT al ingreso fue de 0,45ng/ml (RIC: 0,04-2,45), mientras que la mediana de PCR fue de 23mg/dl (RIC: 10-28). Por el contrario, 13 de los 43 pacientes (30,2%) desarrollaron NAV, lo cual equivale a una incidencia de 13,3 casos/1.000 días de VMI. Los microorganismos aislados fueron S. anginosus (n=3), P. aeruginosa (n=3), S. aureus sensible a la meticilina (n=2), E. coli (n=1), S. oralis (n=1), K. pneumoniae (n=1), E. faecalis (n=1) y Corynebacterium spp (n=1). No se observó aislamiento de Aspergillus spp. en ninguna de las muestras respiratorias procesadas.
DiscusiónNuestro estudio describe la evolución de 43 pacientes graves con COVID-19 durante las primeras 4 semanas en una UCI de un hospital de tercer nivel. A pesar del reducido número de pacientes, nuestros resultados son de gran interés, dado la falta de conocimiento en la evolución de esta nueva enfermedad y las diferencias en las características de los pacientes. Una de los principales hallazgos de nuestro estudio fue que, uno de cada 2 pacientes ingresados no presentaron comorbilidades mayores. Este hallazgo es similar a los observados en otros estudios8–11, los cuales informan de la ausencia de comorbilidades en más del 60% de los pacientes. De forma similar a lo observado en la pandemia por la gripe A (H1N1)pdm0920, la obesidad fue una comorbilidad muy frecuente en nuestros pacientes. Por el contrario, la obesidad no se menciona en los estudios realizados en China9 ni Italia3, pero sí en la experiencia de Vitoria7 y en una reciente publicación de EE. UU.21, con un nivel aún superior de obesos en sus pacientes (41,7%). Esto podría dificultar la extrapolación directa de los resultados internacionales3,8–11,21,22 al tratarse de poblaciones diferentes.
Otro de los hallazgos relevantes fue que la mortalidad observada (23,2%) en nuestra serie, fue inferior a observada en el estudio de Vitoria7 (31%), a pesar de una edad y gravedad semejante de los pacientes y similar frecuencia de VMI (94%). Diferentes publicaciones también informan de una mortalidad más elevada. En el estudio de Yang X et al.9, la mortalidad global fue del 61,5%, pero al considerar los pacientes en VMI, la misma ascendió hasta el 81% (30/37), considerablemente mayor que la observada en nuestro estudio (28,1%). Hay que resaltar que, en dicho estudio, de los 52 pacientes críticos, solo 22 (42%) recibieron VMI. Aunque los autores no informan del tiempo desde el fracaso otras técnicas de oxigenación hasta la implementación de la VMI, la elevada mortalidad de los pacientes en VMI, hace suponer un importante retraso en la intubación orotraqueal. Por su parte, Wu C et al.10, comunican una mortalidad global del 21,9%. En este estudio, de los 210 pacientes incluidos, 165 (78,5%) recibieron algún tipo de soporte respiratorio, pero también es notoria la baja frecuencia de utilización de VMI (3%) en los pacientes, mientras que casi la mitad (48,8%) recibieron cánulas nasales y el 30% VNI. Asimismo, el estudio de Grasselli G et al.4 realizado en Italia, comunica una mortalidad del 26%. Este estudio, aunque no menciona escalas de gravedad, parece incluir una población más similar a nuestra serie, ya que, de los 1.591 pacientes, 1.287 (80%) ingresaron en las UCI, y de ellos, el 89% requirieron VMI. Aunque los autores asocian la mortalidad con la edad, la mediana de edad no fue diferente a la de nuestra población (63 vs. 65 años). En Nueva York21, de los 5.700 pacientes con COVID-19, solo el 6,5% (n=373) fueron ingresados en las UCI y 320 de estos (85,8%) requirieron VMI. La mortalidad en este subgrupo fue muy elevada (88,1%). Mortalidad similar a la observada por Arentz M et al.22 en una pequeña población de 21 pacientes. La elevada mortalidad en esta serie podría relacionarse con una mediana de edad sensiblemente mayor que en la mayoría de las comunicaciones (70 años, RIC: 40-92). Contrariamente a estos hallazgos, nuestra mortalidad fue marcadamente superior a la observada en el estudio de Guan W et al.8 de solo el 1,4%. En este estudio, la mayoría de los 1.099 pacientes fueron considerados como no graves (ninguno requirió ventilación). En aquellos considerados graves (15,7%; 173/1.099) la mortalidad fue del 8,1%, a pesar que, dentro de estos pacientes solo 25 (2,2%) recibieron VMI. Resulta evidente que los estudios internacionales, incluyen otro tipo de población y especialmente otro tipo de asistencia ventilatoria, lo cual hace muy difícil trasladar esa experiencia a nuestro medio, y sus datos deben ser interpretados cuidadosamente.
Otro hallazgo de interés fue observar que, a pesar de las recomendaciones en contra de su uso12, la OAF fue iniciada en más del 60% de los pacientes como primera línea de tratamiento. Sin embargo, en más del 85% de los casos se observó fracaso. Aunque con los datos disponibles, no podemos evaluar el impacto del retraso en la intubación en relación con la evolución, es posible que un gap de 8h desde el fracaso de la OAF hasta la intubación, no haya afectado considerablemente la evolución, considerando la mortalidad observada.
Un dato preocupante fue observar una elevada tasa de NAV (30% o 13 casos/1.000 días de VMI), la cual duplica ampliamente la tasa habitual de nuestra UCI. Esta frecuencia es superior a la comunicada por Xang X et al,9 (13,5%), aunque los autores no indican días de exposición al riesgo por lo cual es difícil realizar comparaciones. La urgencia del trabajo durante la pandemia, la utilización de equipos de protección individual, la rotación de personal poco entrenado, así como una disminución en las medidas de prevención de la NAV, pueden ser las razones que justifiquen este incremento. Sin embargo, esta elevada incidencia deberá ser confirmada con otros estudios.
Finalmente, nuestros datos muestran que en los pacientes fallecidos la PaO2/FiO2 de ingreso no tubo mejoría a los 7 días a pesar del tratamiento. En supervivientes, la PaO2/FiO2 se incrementó a los 7 días, por lo cual podemos hipotetizar que, la falta de mejoría de la PaO2/FiO2 a la semana de tratamiento podría ser un factor pronóstico a considerar en nuevos estudios.
Es evidente que nuestro estudio tiene importantes limitaciones que deben ser remarcadas. La primera de ellas y posiblemente la más importante, es el bajo número de pacientes incluidos. Debido a ello, es posible que no puedan evidenciarse diferencias entre grupos por un error de tipo I. Sin embargo, dado las características novedosas de esta pandemia, nuestros datos aportan valor al conocimiento, aunque los hallazgos deberán ser confirmados por estudios con mayor número de pacientes. Segundo, nuestros resultados describen la evolución en un tipo especial de UCI y posiblemente no pueda ser generalizado a otras áreas u otras UCI. Es evidente que tanto la indicación de ingreso en UCI, así como la complejidad de la asistencia brindada a los pacientes, es muy variable entre centros y países por lo cual, esta información deberá ser analizada cuidadosamente en cada estudio.
En conclusión, nuestros datos sugieren que a pesar de describir la evolución de una población con edad no muy avanzada y con bajo nivel de comorbilidades, la COVID-19 requiere con elevada frecuencia de VMI por SDRA, presenta una alta incidencia de fracaso de la OAF y una elevada mortalidad. La falta de mejoría de la PaO2/FiO2 después de una semana de tratamiento activo, podría considerarse como una variable asociada a la mortalidad precoz, aunque estos datos deberán ser confirmados en futuros estudios.
AutoríasConcepción y diseño del estudio: AR, MB, LC, GM, RC y ST.
Adquisición de los datos y análisis: AR, MB, JG, GM, RC, EPP, ST, CBB, RSP, LC y XT.
Interpretación de los datos: AR, MB, LC, GM, RC, ESP, LC, ESP y EPP.
Importante aportación intelectual al contenido: AR, MB, GM, RC, ESP, LC y LC.
Borrador del manuscrito: AR, MB, GM y RC.
Revisión crítica del contenido: JG, EPP, CBB, RSP, ST y XT.
Todos los autores aprobaron el manuscrito final enviado para su evaluación y posible publicación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
AR ha recibido una beca de investigación de Gilead Science para el estudio de antibióticos nebulizados. Además, ha recibido honorarios por conferencias docentes para Biomerieux, Astellas, Pfizer, Thermo Fisher, MSD, Gilead, Shionogi y BRHAMS. Sin embargo, no tiene conflictos de interés con el presente manuscrito. El resto de los autores no tienen conflictos de interés que declarar.
AgradecimientoEl grupo de trabajo HJ23-COVD-19 quiere agradecer a todos los trabajadores de la salud del HJ23 relacionados con la asistencia de los pacientes COVID-19 por su abnegada dedicación y esfuerzo durante este periodo de estudio. Sin ellos, este manuscrito no podría haberse escrito.
Los hallazgos y las conclusiones del presente manuscrito son responsabilidad de los autores y no representan necesariamente la posición oficial del Instituto Catalán de la Salud.
Laboratorio clínico
Natalia Bastón Paz, Carolina Sarvisé Buil, Frederic Gómez Bertomeu, Gemma Recio Comi, Carla Martin Grau, Silvia Montolio Breva, Victoria Rivera Moreno, Modest Sabaté Piñol, Carmen Molina Clavero, Nuria Serrat Orús, Maria Teresa Sans Mateu y Cristina Gutiérrez Fornes.
Epidemiología y prevención de la infección nosocomial
M. Montserrat Olona Cabases
Departamento de enfermería UCI
Xavier Teixidó, Diana Gil Castillejos y Nuria Burló Arévalo.
Farmacia clínica
Laura Canadell y Erika Esteve Pitarch.
Médicos UCI
María Bodi, Alejandro Rodríguez, Gerard Moreno, Christian Villavicencio, Mari Carmen Gilavert, Sara Rosich, Ángel Pobo, Mónica Magret, Gonzalo Sirgo, Vanessa Blázquez, Federico Esteban, Iulen Leache, Paula Perello, Iban Oliva, Manuel Samper, Oriol Plans, Marc Cartanyá, Sandra Canelles, Raquel Carbonell, Neus Guasch, Cristina Ferré, Sara Manrique, Xavier Daniel, Silvia Urgeles, Ivan David, Marina Roure, Natalia Murillo, Marina Sánchez y Melina Salgado.
UCI Data-Analitics
Josep Gómez, Manuel Ruiz-Botella, Jordi Albiol y Eduard Mayol.