El trasplante pulmonar es un procedimiento terapéutico, médico-quirúrgico, indicado en enfermedades pulmonares terminales e irreversibles con los tratamientos médicos actuales, excepto el carcinoma pulmonar. En España se llevan realizados más de 3.500 trasplantes, con una tasa superior a 6 pacientes por millón de habitantes y en expansión.
En esta revisión se analizan los tipos de trasplantes, sus indicaciones y contraindicaciones, la estrategia del trasplante, el tratamiento inmunosupresor con sus efectos secundarios e interacciones medicamentosas, la profilaxis habitual. Se incluyen unas referencias bibliográficas, la mayoría de autores nacionales, de fácil acceso para facilitar una profundización en temas seleccionados.
Lung transplant is a therapeutic, medical-surgical procedure indicated for pulmonary diseases (except lung cancer), that are terminal and irreversible with current medical treatment. More than 3,500 lung transplants have been performed in Spain, with a rate of over 6 per million and increasing.
In this review, an analysis is made of the types of transplants, their indications and contraindications, the procedures, immunosuppressive treatments, their side effects and medical interactions, current prophylaxis. A list of easily accessible literature references is also include, the majority being by national authors.
El trasplante pulmonar (TP) consiste en la sustitución del pulmón, dañado irreversiblemente, por un órgano nuevo proveniente de un donante. En España es un procedimiento terapéutico plenamente desarrollado, 294 trasplantes en 2015 y aún en expansión, con tasas anuales de 6-6,3 pacientes trasplantados por millón de habitantes; hasta diciembre de 2015 se llevan trasplantados 3.781 pacientes, según el informe 2015 de la ONT, lo que justifica una puesta al día en el ámbito de la asistencia extrahospitalaria.
Hay 3 tipos de TP: unipulmonar, bipulmonar y cardiopulmonar.
Trasplante unipulmonarEs el trasplante de un único pulmón, derecho o izquierdo. Consiste en extraer un pulmón del receptor, el más gravemente lesionado, e implantar el del mismo lado del donante, mediante una sutura del bronquio principal, de la rama correspondiente de la arteria pulmonar y de un parche de la aurícula que contenga las 2 ramas correspondientes de las venas pulmonares. Es la técnica más sencilla y dura unas 2-4h, dependiendo de la dificultad en la extracción del órgano del receptor.
En general no requiere circulación extracorpórea (CEC), ya que el mantenimiento de la oxigenación del paciente se realiza a través de su otro pulmón.
Está indicado en las enfermedades intersticiales, la fibrosis pulmonar, en algunos casos de enfisema, sobre todo en pacientes de mayor edad que toleran mejor intervenciones de corta duración.
Se realiza a través de una toracotomía lateral y se recupera el 60-80% de la función pulmonar.
Trasplante bipulmonarConsiste en la realización de un doble TP a través de una toracotomía bilateral.
Se implanta primero el pulmón que se encuentra más gravemente afectado, manteniendo al paciente con el pulmón que se encuentra mejor, realizando una intervención como si fuese un trasplante unipulmonar, y posteriormente se realiza el implante del segundo pulmón.
La intervención es mucho más prolongada (alrededor de 2h más). En ocasiones, al clampar la arteria pulmonar del primer pulmón o la del segundo pulmón, colocado ya el primero, el corazón no es capaz de mantener un flujo adecuado por la resistencia del único pulmón que utiliza, lo que origina un fallo de bomba y se precisa la utilización de CEC o de un oxigenador de membrana extracorpórea. La CEC puede ser causa de graves complicaciones postoperatorias por la anticoagulación que necesita, favoreciendo el sangrado, lo que aumenta la mortalidad postoperatoria, por lo que se intenta evitar en lo posible.
La recuperación de la función pulmonar del trasplante exitoso es del 100%.
Está indicado en cualquier enfermedad con indicación de trasplante (ver más adelante), pero es obligatorio en las enfermedades supurativas como son las bronquiectasias, la fibrosis quística y la hipertensión arterial pulmonar.
Trasplante cardiopulmonarConsiste en el implante del bloque corazón-pulmones mediante la sutura de tráquea, aorta y venas cavas. Es técnicamente más sencillo que los anteriores, aunque requiere siempre CEC.
Está indicado en pacientes en los que no es posible realizar el TP por problemas cardiacos asociados.
Se utiliza menos que los anteriores porque los resultados son estadísticamente peores.
Indicaciones del trasplanteLas enfermedades pulmonares en las que está indicado el trasplante son en principio todas las que cursan con insuficiencia respiratoria progresiva y son irreversibles, que no han respondido al tratamiento adecuado, excepto el cáncer de pulmón1.
Las agrupamos en procesos:
Enfermedades intersticiales como la fibrosis pulmonar idiopática y otras fibrosis.
Enfermedades obstructivas como el enfisema, idiopático y por déficit de alfa 1-antitripsina.
Enfermedades supurativas como la fibrosis quística y bronquiectasias.
Enfermedades vasculares como la hipertensión arterial pulmonar idiopática y secundaria.
Contraindicaciones del trasplanteSon situaciones en las que un paciente no puede ser trasplantado a pesar de tener una enfermedad con indicación. Pueden ser situaciones permanentes o temporales y están en constante revisión con base en la mayor experiencia de los equipos trasplantadores2,3. Algunos ejemplos:
Insuficiencia de otro órgano vital (riñón, hígado, etc.). Puede no ser una contraindicación si se puede realizar un trasplante combinado.
Estado inestable del paciente o enfermedad en fase aguda. Es preferible estabilizar al paciente, aunque en los jóvenes se puede realizar un trasplante de urgencia (alarma cero)4.
Infección pulmonar o extrapulmonar no controlada.
Enfermedad coronaria o vascular no solucionable antes del trasplante.
Hábitos tóxicos (fumador activo, bebedor, etc.).
Neoplasia de cualquier órgano no curada.
Enfermedad psiquiátrica, inestabilidad psicológica o falta de colaboración en los controles.
Edad. Se recomienda no sobrepasar los 55 años para el trasplante cardiopulmonar, los 60 para el bipulmonar y los 65 para el unipulmonar, aunque se realizan trasplantes a pacientes de mayor edad que están en buena situación general, valorados individualmente5,6.
La presencia de infección por VIH y hepatitis está en revisión, dado que estas infecciones pueden ser controladas en la actualidad.
Situaciones como osteoporosis marcada, obesidad o caquexia se desaconsejan.
Cirugía torácica previa o previsibles dificultades en la disección u otros problemas técnicos. Dependen de cada equipo quirúrgico.
Algunos detalles sobre la estrategia del trasplanteEl estudio del candidato a trasplante incluye una valoración general de su estado, ausencia de contraindicaciones, estimación de la función individual de cada pulmón y valoración de las posibilidades de tratamiento médico, fisioterapéutico y rehabilitador, para mejorar su estado y, por tanto, el curso postoperatorio.
Estos estudios nos permiten calcular, estadísticamente, la probabilidad de que un porcentaje más elevado de pacientes vivan con el trasplante en comparación con el porcentaje que vivirían con tratamiento médico3,7,8. Un sencillo ejemplo: para un paciente con enfisema cuyo flujo espiratorio en el primer segundo sea inferior al 35% del teórico, recorra menos de 200m en el Test de la marcha de 6 minutos y su grado de disnea sea 3, la probabilidad de estar vivo a los 50 meses es del 20%; si se trasplantase en ese momento las probabilidades de estar vivo serían del 56%, por tanto, en esa situación es mejor el trasplante que el tratamiento médico. Sin embargo, un paciente con enfisema cuyo flujo espiratorio en el primer segundo sea el 45% del teórico, recorra 300m en 6min y su grado de disnea sea 2, la probabilidad de estar vivo a los 50 meses es del 70%; si se trasplantase en ese momento la probabilidad de estar vivo a los 50 meses sería del 56%, por tanto, es mejor continuar el tratamiento médico y, si progresa la enfermedad, llegará un momento en que su pronóstico empeore y sea mejor trasplantarlo.
Cuando los parámetros clínicos y funcionales nos indican que tiene mejor pronóstico el trasplante que el tratamiento médico, incluimos a los pacientes en «lista de espera».
DonantesLos pulmones para trasplante se obtienen, previo consentimiento de la familia, de personas que han fallecido de muerte cerebral, por traumatismo o ACVA; que fueran relativamente jóvenes9, con escaso tabaquismo o mejor no fumadores, con Rx de tórax y función pulmonar normales y sin signos de infección. También se utilizan como donantes los fallecidos de parada cardiaca (asistolia), siempre que las maniobras de reanimación se hayan instaurado en un periodo corto de tiempo y no hayan sido eficaces.
El emparejamiento donante-receptor se realiza por grupo sanguíneo y similitud de la capacidad pulmonar total (pulmones de igual tamaño).
El donante puede ser del propio hospital o de otra ciudad y el pulmón debe ser trasportado, tras irrigarlo con una solución de preservación, en un contenedor hermético a 4°C, hasta el hospital donde se ha ingresado al receptor y se realizará el trasplante; en la actualidad, los hospitales que trasplantan son: Barcelona (Vall d’Hebron), Córdoba (Reina Sofía), La Coruña (Complejo Hospitalario), Madrid (Puerta de Hierro y Doce de Octubre), Santander (Marqués de Valdecilla) y Valencia (La Fe).
Se denomina tiempo de isquemia al periodo que trascurre entre el momento en que se pinza la arteria pulmonar y deja de irrigarse el pulmón en el donante hasta que se libera una vez injertado y se inicia la irrigación pulmonar, e incluye la extracción, el trasporte y la cirugía de implante hasta que se irriga de nuevo. Oscila entre 3 y 7h y debe ser lo más corto posible.
Tratamiento inmunosupresorDurante el implante se inicia el tratamiento inmunosupresor. Su finalidad es evitar que el sistema inmune del receptor reconozca el órgano donante como extraño y lo rechace. Para ello se utiliza la triple terapia inmunosupresora, que consiste en la administración de 3 fármacos que frenen la respuesta de la inmunidad celular10,11.
Uno debe ser del grupo de los inhibidores de la calcineurina: ciclosporina (Sandimmun Neoral®) o tacrolimus (Prograf®, Advagraf®); otro, del grupo de los antimetabolitos: azatioprina (Imurel®), micofenolato mofetilo (CellCept®) o micofenolato sódico (Myfortic®); y esteroides.
Ciclosporina (Sandimmun Neoral®)Es el primer fármaco descubierto de esta familia y el que permitió poner en marcha el TP. Inhibe la activación de los linfocitos T, impidiendo de esta forma el rechazo del injerto y actuando como un potente inmunosupresor.
Se administra cada 12h por vía oral y se dosifica monitorizando los niveles en sangre, bien la concentración mínima –C0–, realizando el análisis justo antes de la toma de la mañana, bien la concentración máxima –C2–, realizando el análisis a las 2h de la toma matinal. Según sea la concentración se procede a mantener la dosis, aumentarla o disminuirla. Si se modifica la dosis es conveniente realizar un control a los 7-10 días para comprobar el nuevo nivel obtenido.
El nivel objetivo es de alrededor de 300ng/ml los primeros meses, y posteriormente niveles de 250ng/ml durante el resto del primer año. Los niveles posteriores dependerán de la evolución, más bajos si hay toxicidad, más altos si no hay toxicidad y ha habido rechazos.
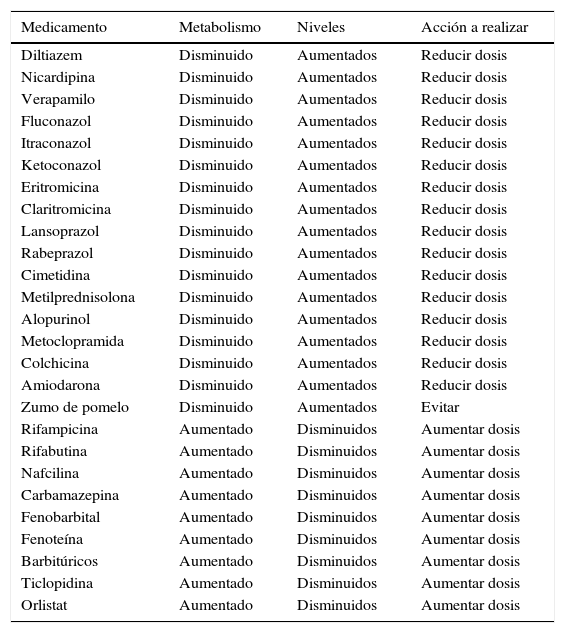
Interacciona con múltiples fármacos, por lo que su concentración puede aumentar a niveles tóxicos o disminuir a niveles ineficaces y precipitar un rechazo agudo (tabla 1).
Interacciones medicamentosas de los inhibidores de la calcineurina
| Medicamento | Metabolismo | Niveles | Acción a realizar |
|---|---|---|---|
| Diltiazem | Disminuido | Aumentados | Reducir dosis |
| Nicardipina | Disminuido | Aumentados | Reducir dosis |
| Verapamilo | Disminuido | Aumentados | Reducir dosis |
| Fluconazol | Disminuido | Aumentados | Reducir dosis |
| Itraconazol | Disminuido | Aumentados | Reducir dosis |
| Ketoconazol | Disminuido | Aumentados | Reducir dosis |
| Eritromicina | Disminuido | Aumentados | Reducir dosis |
| Claritromicina | Disminuido | Aumentados | Reducir dosis |
| Lansoprazol | Disminuido | Aumentados | Reducir dosis |
| Rabeprazol | Disminuido | Aumentados | Reducir dosis |
| Cimetidina | Disminuido | Aumentados | Reducir dosis |
| Metilprednisolona | Disminuido | Aumentados | Reducir dosis |
| Alopurinol | Disminuido | Aumentados | Reducir dosis |
| Metoclopramida | Disminuido | Aumentados | Reducir dosis |
| Colchicina | Disminuido | Aumentados | Reducir dosis |
| Amiodarona | Disminuido | Aumentados | Reducir dosis |
| Zumo de pomelo | Disminuido | Aumentados | Evitar |
| Rifampicina | Aumentado | Disminuidos | Aumentar dosis |
| Rifabutina | Aumentado | Disminuidos | Aumentar dosis |
| Nafcilina | Aumentado | Disminuidos | Aumentar dosis |
| Carbamazepina | Aumentado | Disminuidos | Aumentar dosis |
| Fenobarbital | Aumentado | Disminuidos | Aumentar dosis |
| Fenoteína | Aumentado | Disminuidos | Aumentar dosis |
| Barbitúricos | Aumentado | Disminuidos | Aumentar dosis |
| Ticlopidina | Aumentado | Disminuidos | Aumentar dosis |
| Orlistat | Aumentado | Disminuidos | Aumentar dosis |
Reacciones adversas: HTA 8-53%, hirsutismo 21-45%, hipertricosis 5-19%, cefalea 2-25%, hipertrigliceridemia 15%, temblor 7-55%, insuficiencia renal 10-38%. Con menor frecuencia: insomnio, convulsiones, alteraciones psiquiátricas, hipertrofia gingival, náuseas, vómitos, ginecomastia, hiperbilirrubinemia y un largo etcétera (ver la información del producto para más detalle).
Se presenta en cápsulas de 25, 50 y 100mg.
Tacrolimus (Prograf®, Advagraf®)Es un potente inmunosupresor, unas 100 veces más potente que la ciclosporina, farmacológicamente diferente, aunque con el mismo o muy parecido mecanismo de acción. Es un inhibidor de la calcineurina y, por tanto, inhibe la activación de los linfocitos T.
Ambos preparados, Prograf® y Advagraf®, contienen tacrolimus en distinta forma farmacéutica; el primero se administra cada 12h y el segundo cada 24h, la dosis diaria es la misma en ambos preparados.
Se dosifican según los niveles en sangre que se obtienen antes de la dosis de la mañana. Interaccionan con múltiples fármacos que modifican su concentración (tabla 1).
Las reacciones adversas son similares a las de ciclosporina, es menos nefrotóxico, no produce hirsutismo, hiperplasia gingival ni ginecomastia, pero es más diabetógeno.
Se presentan en cápsulas de 0,5, 1 y 5mg.
Nivel objetivo alrededor de 12 los primeros meses, posteriormente alrededor de 8ng/ml.
Azatioprina (Imurel®)Análogo a la 6-mercaptopurina. Es un inhibidor de la síntesis de purinas, que afecta a todas las células de crecimiento rápido, entre ellas las células de la médula ósea, pudiendo producir anemia, leucopenia y trombocitopenia; por esta vía es un potente inmunosupresor.
Se presenta en comprimidos de 50mg, administrándose por vía oral a una dosis de 50mg cada 12h. El ajuste de la dosis se realiza por el recuento de leucocitos en sangre periférica, que nunca debe ser inferior a 4.000 leucocitos/ml. Si en algún momento es inferior, se debe reducir la dosis a la mitad.
Las reacciones adversas no son muy frecuentes y, en general, revierten al reducir la dosis o suspender la medicación; puede producir hepatotoxicidad, detectable por analítica, los efectos hematológicos comentados, estomatitis, náuseas, vómitos, diarrea y pancreatitis.
Hay una importante interacción con alopurinol que inhibe la enzima que metaboliza e inactiva el Imurel®, por lo que su concentración puede aumentar exageradamente. Se recomienda no utilizarlos conjuntamente; si fuese imprescindible se recomienda reducir la dosis de Imurel® en un 75% (dar un cuarto de dosis).
Micofenolato mofetilo (CellCept®)Es un profármaco del ácido micofenólico (principio activo) que actúa inhibiendo la síntesis de novo de las purinas. Los linfocitos dependen más de esta vía de síntesis de purinas que otras células de nuestro organismo; es, por tanto, un poco más específico de los linfocitos que azatioprina. Inhibe la proliferación de linfocitos T y B y, por ello, actúa sobre la inmunidad celular y humoral. Tiene un efecto inmunosupresor aditivo con ciclosporina y tacrolimus. Es menos hepatotóxico que azatioprina.
Sus principales efectos adversos son náuseas, vómitos, diarrea e íleo.
Se administra por vía oral a dosis de 1-2g/día, repartido en 2 dosis. El ajuste de dosis se realiza por la aparición de efectos adversos. Se absorbe bien por vía oral y se originan 2 picos de nivel elevado, uno a la hora de su administración y otro a las 6h por la gran circulación enterohepática (se metaboliza en el hígado; una parte se inactiva y elimina y otra se excreta por la bilis y es reabsorbida).
Se presenta en cápsulas de 250 y 500mg.
Micofenolato sódico (Myfortic®)Comprimidos gastrorresistentes de micofenolato sódico.
Se presenta en comprimidos de 180 y 360mg, que son equivalentes a la presentación de 250 y 500mg de micofenolato mofetilo.
Tiene la misma actividad y efectos secundarios que la forma mofetilo, aunque la tolerancia gastrointestinal es mejor y la aparición de diarrea, menor.
Se administra oralmente a dosis de 720-1.440mg/día en 2 dosis.
EsteroidesMedicamento de sobra conocido y utilizado. Imprescindible en los primeros meses del trasplante, en los que la dosificación se va reduciendo a lo largo de meses o años, y puede llegar a suspenderse en ciertos pacientes seleccionados y bajo estricto control por el equipo de trasplante12.
Nota importante: la medicación inmunosupresora nunca debe suspenderse. Se puede tomar en ayunas o con el estómago lleno, pero siempre de igual forma.
Otros inmunosupresoresSirolimus (rapamicina, Rapamune®)Es un inmunosupresor con estructura química muy parecida a tacrolimus, aunque con un mecanismo de acción totalmente diferente. Inhibe la activación de una cinasa, la diana de rapamicina en células de mamífero, y origina una inhibición de la proliferación de linfocitos T y B, deteniendo el ciclo celular en la fase G1.
Se utiliza en pacientes que han presentado toxicidad exagerada a los anticalcineurínicos, como en el síndrome hemolítico urémico o la púrpura trombótica-trombocitopénica.
Se presenta en jarabe o comprimidos de 1-2mg.
Se administra por vía oral, aunque se absorbe mal, por lo que los niveles pueden tardar en estar estables hasta 7 días. El ajuste de dosis se realiza por niveles.
Los efectos secundarios más frecuentes son: úlceras orales, edema generalizado, proteinuria, hipercolesterolemia, hipertrigliceridemia y neumonitis intersticial. En las fases iniciales del TP está contraindicado por el riesgo de producir dehiscencia de la sutura bronquial, con riesgo de mediastinitis y muerte.
Everolimus (Certican®)Derivado del sirolimus, con el mismo mecanismo de acción y efectos secundarios.
Se presenta en comprimidos de 0,25, 0,50, 0,75 y 1mg.
Se absorbe mejor por vía oral, por lo que los niveles estables se consiguen más rápidamente y es más fácil monitorizarlo13.
Otros tratamientos habituales en trasplante pulmonarBien por el efecto inmunosupresor de la medicación, bien por sus efectos tóxicos, la mayoría de los pacientes con TP requiere cierta medicación complementaria para minimizar estos riesgos.
CotrimoxazolSe administra de forma oral en dosis de un comprimido al día o 2 comprimidos en días alternos.
Su indicación es la prevención de la aparición de infecciones pulmonares por Pneumocystis jirovecii, complicación muy frecuente si no se utiliza profilaxis, nula cuando se utiliza.
ItraconazolAntifúngico empleado ocasionalmente para la prevención de infecciones micóticas. Se administra en dosis de 100mg cada 12h.
AnfotericinaSe utiliza para profilaxis de infección micótica.
Las diversas formas disponibles se administran por vía inhalada según diversos protocolos, muchos de ellos en estudio. La duración de la profilaxis es variable según los diversos protocolos y oscila entre 3 y 6 meses.
Valganciclovir (Valcyte®)Derivado del ganciclovir para administración oral.
Es un virostático contra el citomegalovirus y otros virus del grupo herpes, utilizado para la prevención de infección/neumonía por citomegalovirus en todos los pacientes trasplantados en los que el donante, receptor o ambos sean portadores del virus en estado latente.
Se presenta en comprimidos de 450mg. Se administra a dosis de 900mg al día en una toma.
La duración de la profilaxis oscila entre los 36 primeros meses14–16. Se tolera bien y no presenta efectos secundarios importantes, salvo algún caso aislado de leucopenia.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.