A finales de diciembre del 2019 se reportaron una serie de casos de neumonía atípica, en ese momento de origen desconocido, en Wuhan, China. Días más tarde se identificó al agente etiológico como un nuevo coronavirus. A este nuevo coronavirus se le llamó SARS-CoV-2, y a la enfermedad que produce se la denominó COVID-19. El origen de este nuevo virus se presume zoonótico, siendo los murciélagos su probable vector. Debido al acelerado número de contagios y muertes que se produjeron primero en China y posteriormente alrededor del mundo, la infección de este virus pasó rápidamente de ser un brote aislado en una región china a convertirse en una emergencia sanitaria de preocupación internacional, y posteriormente en una pandemia. El propósito de esta revisión es estudiar la información más relevante y actual del patógeno, así como la epidemiología, la patología, las características clínicas, la transmisión, la prevención y el tratamiento de la enfermedad.
In late December 2019, some cases of atypical pneumonia, at that time of unknown origin, were reported in Wuhan, China. Days later, the etiologic agent was identified as a new coronavirus. This new coronavirus was called SARS-CoV-2 and the disease it produces was named COVID-19. The origin of this new virus is presumed zoonotic, with bats being its probable vector. Due to the rapid number of infections and deaths that occurred first in China and later around the world, the infection of this virus quickly went from being an isolated outbreak in a Chinese region to becoming a health emergency of international concern and later, a pandemic. The purpose of this review is to study the most relevant and current information on the pathogen, as well as epidemiology, pathology, clinical features, transmission, prevention, and treatment of the disease.
A finales de diciembre del 2019 una serie de casos de neumonía, hasta ese momento de origen desconocido, fueron identificados en la ciudad de Wuhan, China. La presentación clínica de estos casos era parecida a la de una neumonía de tipo viral, con fiebre, tos seca e imágenes radiológicas incompatibles con las de una neumonía causada por las bacterias y virus más comunes1-3. El surgimiento de estos casos levantó sospechas, sobre todo después de que varios de los pacientes que presentaban este cuadro clínico refirieran tener de antecedente trabajar como distribuidores o vendedores en el mercado de mariscos y vida animal silvestre de Huanan. Debido al surgimiento de este brote, la autoridad sanitaria en China alertó a la Organización Mundial de la Salud (OMS) el día 31 de diciembre del 2019 sobre la aparición de casos de neumonía atípica de origen desconocido con la sospecha de una posible zoonosis2,3.
A 59 pacientes originalmente identificados que padecían de esta neumonía se les tomaron múltiples muestras del tracto respiratorio, sangre y heces, que fueron analizadas a través de la reacción en cadena de la polimerasa en tiempo real (real time PCR [RT-PCR]) en la cual se identificó un nuevo coronavirus que fue aislado en el fluido resultante del lavado broncoalveolar de las muestras del tracto respiratorio inferior de 41 pacientes. En ese momento, a este nuevo coronavirus se le llamó 2019-nCoV (del inglés: 2019-novel coronavirus) y fue identificado por las autoridades sanitarias chinas como el agente causal de estos casos de neumonía atípica1,3,4.
Los coronavirus son un grupo amplio de virus envueltos de material genético tipo ARN, y deben su nombre a la apariencia de una corona, que es observada en su superficie a través de la microscopia electrónica5,6. Existen diferentes tipos de coronavirus, los cuales pueden llegar a causar múltiples afecciones respiratorias, gastrointestinales o incluso la muerte. Entre los síntomas respiratorios, pueden causar desde un resfriado común hasta una neumonía, aunque en la mayoría de los casos los síntomas suelen ser menores y mitigables con facilidad6,7. No obstante, a lo largo de la historia se han documentado cepas que pueden causar afecciones y enfermedades severas6,8. Tal es el caso del SARS-CoV (del inglés severe acute respiratory syndrome coronavirus), identificado por primera vez en China en 2003, y del MERS-CoV (del inglés Middle East respiratory syndrome-related coronavirus), aislado en Arabia Saudita en 20121,4,6,8.
Emergencia sanitaria de preocupación internacionalLas infecciones por el nuevo coronavirus comenzaron a tomar progresivamente protagonismo a nivel internacional cuando el día 13 de enero de 2020 la OMS reportó el primer caso de infección fuera de China, ocurrido en Tailandia9. A partir de este punto, y previniendo que el virus se propagara a escala internacional, la OMS ofreció su asesoramiento y guía para el manejo de esta nueva infección3. No obstante, y a pesar de estos esfuerzos durante el mes de enero, el número de infectados aumentó rápidamente y se reportaron las primeras muertes10. Hacia final de mes, el día 30 de enero la OMS declaró la enfermedad causada por el nuevo coronavirus como una emergencia de salud pública de preocupación internacional, ya que para aquel momento se habían reportado casos en todas las regiones de la OMS en solo un mes9,11.
A poco más de un mes del inicio del brote, la OMS anunció que la enfermedad causada por el nuevo coronavirus aislado en Wuhan, China, sería llamada COVID-19, que responde a la forma corta del nombre «coronavirus disease 2019», mientras que el agente causal fue denominado SARS-CoV-2 por el Comité Internacional de Taxonomía de Virus8. A partir de este punto la línea cronológica de eventos, así como la de infectados, se tornó muy precipitada (fig. 1). Conforme el paso de los días, el SARS-CoV-2 se fue propagando en todas las regiones del mundo y progresivamente el número de infectados y muertos se aceleró bruscamente por los meses subsiguientes. Hasta el punto de que la OMS caracterizó esta enfermedad como pandemia el día 11 de marzo9.
Cronología de eventos COVID-19. Eventos relevantes ocurridos durante la pandemia de COVID-19 en el mundo.
Fuente: Elaboración propia de los autores de acuerdo con la información recopilada de la OMS9.
Los coronavirus son un grupo grande de virus que están envueltos de ARN en sentido positivo no segmentado; pertenecen a la familia Coronaviridae, del orden de los Nidovirales. A su vez, los coronavirus son clasificados en cuatro géneros: alfa, beta, gamma y delta5,6. De estos géneros, se sabe que el género alfa y beta infectan a los seres humanos ocasionando generalmente afecciones y síntomas tanto respiratorios como gastrointestinales, aunque raramente también pueden ocasionar alteraciones hepáticas y neurológicas5,6,8,13,14.
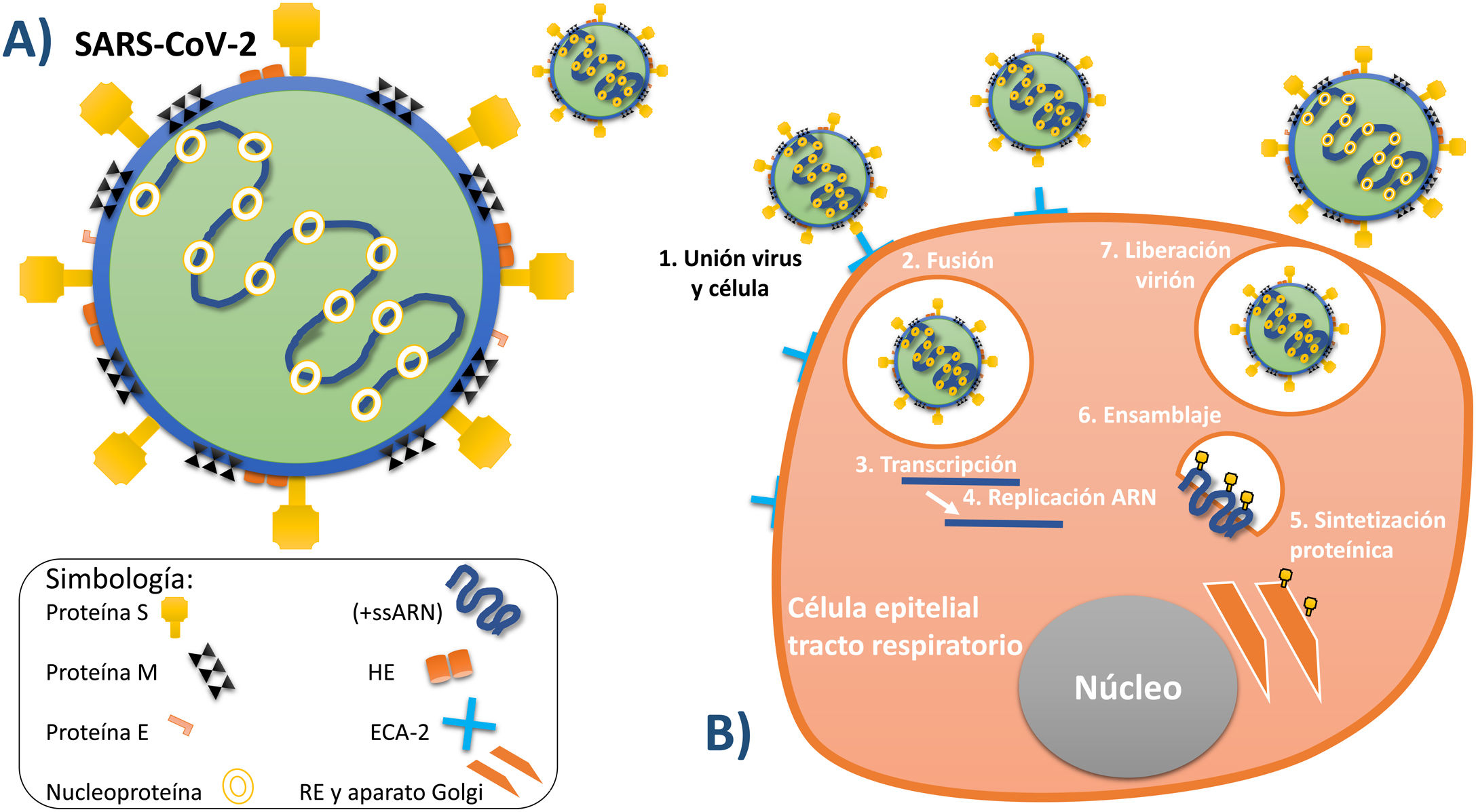
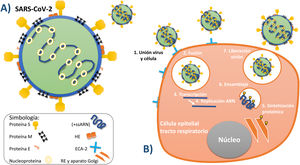
En cuanto a su morfología y estructura, son reportados por la literatura microbiológica como virus de forma aproximadamente esférica de una capacidad moderada al pleomorfismo. En cuanto a sus dimensiones, se reporta que el diámetro de este tipo de virus varía de entre 80-120nanómetros5,15. Mediante el estudio de la superficie de estos virus a través de microscopia electrónica se ha descubierto la existencia de estructuras sobre la superficie del virión, las cuales están dispuestas de manera de proyecciones largas, separadas las unas de las otras. Estas estructuras están constituidas por complejos triméricos de la glicoproteína viralS (Spike)5,14,15. Adicionalmente se han identificado sobre la superficie del virión otro tipo de proyecciones, las cuales, en contraste con las anteriores, son cortas y están formadas por complejos diméricos de las proteínas hemaglutina-esterasa (HE). En lo referente a la envoltura viral, se sabe que está reforzada por la proteína más abundante de la superficie del virión, la cual es llamada glicoproteína de membrana (M), y que además se encuentra ensimismada en la membrana por tres dominios transmembranales14-16. Además de los componentes ya mencionados de la estructura del virus, existe la proteína de envoltura (E), que se encuentra en menor proporción que las demás, ya que es de menor tamaño y tiene como característica principal ser altamente hidrofóbica17. Internamente el virión está conformado por una proteína llamada nucleoproteína (N), la cual se une al ARN viral en una estructura helicoidal para, de esta forma, proteger al material genético5,14,15.
El material genético es de tipo ARN y su genoma está constituido por una hebra sencilla no segmentada y de polaridad positiva (+ssARN) que cuenta con un tamaño de entre 27-32kilobases, por lo cual los coronavirus son el grupo de virus ARN más largo conocido hasta el momento (fig. 2A)15,16.
A)Principales estructuras que conforman al virus SARS-CoV-2. B)Serie de procesos por los cuales el virus entra en la célula, la contagia y posteriormente utiliza sus organelos para replicarse y liberar más viriones.
Fuente: Elaboración propia de los autores de acuerdo con su conceptualización según la información recabada5,13-17.
Hasta este momento, se plantea que el origen de este coronavirus es debido a una zoonosis2,4,6. Es sabido que los diferentes géneros de coronavirus están presentes y circulan entre un amplio espectro de seres vivos, entre ellos los mamíferos y, consecuentemente, los seres humanos. Según se ha observado, la mayor variedad de coronavirus está presente en los murciélagos, por lo que se infiere que ellos son el principal reservorio de estos virus5,6,8,14. Una investigación previa al brote SARS-CoV-2 identificó a más de 500 coronavirus en murciélagos de China, y estudios serológicos realizados en poblaciones rurales cercanas al hábitat natural de estos animales mostraron una seroprevalencia del 2,9% de los coronavirus de murciélagos, lo cual demuestra que la exposición a coronavirus propios de los murciélagos es quizás algo común18. Otra investigación estableció la relación y el factor de riesgo que implica la interacción estrecha y constante entre poblaciones humanas con la vida animal silvestre o su consumo bajo estándares higiénicos bajos, con la aparición de enfermedades infecciosas zoonóticas19.
Investigaciones realizadas posteriormente al surgimiento del brote demostraron un vínculo entre el SARS-CoV-2 y otros coronavirus similares previamente conocidos, los cuales estaban presentes en la subespecie de murciélagos Rhinolophus affinis, la cual está ampliamente distribuida en el sureste chino20. En una investigación se descubrió que este nuevo coronavirus es a nivel genómico idéntico en el 96,2% a un coronavirus (BatCoVRaTG13) procedente de un murciélago de la subespecie antes mencionada de una provincia cercana al lugar donde emergió el nuevo coronavirus. Esta investigación además señaló que este virus pertenece a la especie SARS-CoV, con el que comparte el 79,6% de su secuencia genómica21. Debido a las similitudes que comparten, se infiere que el SARS-CoV-2 es producto de una zoonosis, ya que el brote de SARS-CoV en 2003 surgió de la transmisión del virus a los humanos a través de animales exóticos en mercados de China, mientras que el brote MERS-CoV del 2012 en Arabia Saudita surgió de la transmisión del virus de los camellos a los humanos. Dichas enfermedades, además de ser zoonóticas, resultaron también ser pandemias15,16,22,23.
Según los reportes iniciales, no todos los pacientes originales con la sintomatología de COVID-19 tenían relación con el mercado de Huanan, ya que de estos 59 pacientes solo 27 de ellos tenían alguna implicación directa con el mercado. Esto, aunado al hecho de la rápida propagación de la infección, sugirió una probable transmisión comunitaria1,24,25, suposición que posteriormente fue afirmada por múltiples investigaciones al respecto y observada a medida que el brote no solo se concentró en China, sino que se fueron produciendo brotes consecutivos en el continente asiático y después en todo el mundo9,11,24,25.
TransmisiónEn general, la transmisión de esta enfermedad se basa principalmente en la exposición de un individuo sano a objetos contaminados o a individuos infectados que se pueden encontrar sintomáticos, presintomáticos o incluso asintomáticos26-28.
En cuanto a la trasmisión sintomática, la OMS la define como aquella que ocurre cuando un individuo sano es infectado por un individuo que analíticamente es positivo al SARS-CoV-2 y que ha desarrollado los síntomas y/o signos de la enfermedad26.
Investigaciones al respecto demuestran evidencia de que el virus SARS-CoV-2 es transmitido primordialmente mediante dos mecanismos. Uno por el cual las personas infectadas sintomáticas contagian personas sanas a través del contacto cercano o directo de gotitas respiratorias, también llamadas gotitas de Flügge o de Flush, que son expelidas al hablar, toser, estornudar o respirar y que contienen al virus26-28. El otro mecanismo descrito sigue el mismo principio del primero, y en este se postula que los restos de estas secreciones respiratorias quedan inertes en objetos o superficies que finalmente tendrán la función de fómites, y que posteriormente el virus presente en estos restos de secreciones ingresará al aparato respiratorio del sujeto sano a través de las mucosas de ojos, nariz o boca, lo que ocasiona el comienzo de su patogenicidad28,29. El motivo por el que se piensa que la transmisión sintomática es la que mayor número de contagios ocasiona es debido a que estudios han demostrado que durante los primeros 3días de la infección esta se encuentra mayormente localizada en las vías respiratorias superiores (nariz y garganta), lo que genera que las gotitas de Flügge, portadoras del virus, sean más fáciles de expeler30.
El periodo de incubación del SARS-CoV-2 es de 5días, pudiendo incluso llegar a extenderse hasta 14días según se asevera en distintas fuentes13,31,32. A este periodo de tiempo también se le conoce como periodo presintomático. La transmisión presintomática ocurre cuando un persona ya infectada es capaz de contagiar a otras personas aun cuando esta no haya presentado hasta ese momento síntomas de la infección26,33-35. En cuanto a la transmisión asintomática, se refiere a la ocurrida cuando una persona sana es contagiada por alguien que analíticamente resulta positivo al virus pero que en ningún momento del curso de la infección manifiesta síntomas26. Hasta este momento se cuenta con información muy limitada en cuanto a este tipo de transmisión. Sin embargo, la literatura médica actual ha demostrado la contagiosidad de esta infección a partir de individuos asintomáticos, y la proporción de enfermos que este tipo de transmisión aporta a la pandemia aún está sujeta a estudio35-37.
Cabe además destacar el tipo de transmisión intrahospitalaria que se ha reportado en todo el mundo, donde personal médico y personal asociado a la atención sanitaria se ha contagiado por el estrecho e inevitable contacto con los pacientes infectados y su espacio vital, pese a las medidas de prevención y el uso de equipo sanitario desechable de protección individual a base de batas, guantes, mascarillas y gafas12,38-41.
Ante una pandemia de las características de la COVID-19 es importante conocer el índice de contagio, es decir, la capacidad de transmisión que tiene un patógeno. Para tal efecto se utiliza internacionalmente el número reproductor básico (R0), un parámetro teórico que proporciona información sobre la velocidad con la que una enfermedad infecciosa puede propagarse en una población determinada, y que además es utilizado para medir la dinámica promedio de casos secundarios que se producen a partir de un caso inicial42,43. En el caso del SARS-CoV-2 algunos autores señalan que el R0 a nivel mundial está ubicado entre 1,4 y 2,5, similar al R0 del SARS-CoV de 2003 al inicio de la pandemia (ubicado entre 2,2 y 3,7), valor que se redujo a 0,67-1,23 hacia el final de esta43,44. Otras fuentes señalan que el R0 del SARS-CoV-2 es de entre 2,2 y 3,545. Dicho en otras palabras, que una persona infectada por este virus puede, en teoría, infectar de 2 a 4 personas.
A diferencia del R0, que es un cálculo promediado y teórico del comportamiento dinámico de una epidemia, el número reproductivo efectivo (Re) es, por su parte, la estimación de cuántas personas en promedio se han contagiado cada día a partir de la notificación de los casos ya existentes y observados durante la epidemia46. El Re se obtiene del valor estimado del R0 multiplicado por el número de individuos susceptibles a la enfermedad (S/N), de modo que Re=R0×S/N42. Si el Re es mayor a 1, quiere decir que la enfermedad se seguirá propagando. Mientras mayor sea el Re, mayor y más exponencial será el número de contagios secundarios originados de un caso inicial. En contraparte, conforme el Re disminuye significa que el número de contagios diarios disminuye, ya sea por la menor exposición de la población susceptible a contraer el virus o porque la proporción de la población susceptible disminuye por la llamada inmunidad rebaño, también conocida como inmunidad colectiva42.
En España, el Centro Nacional de Epidemiología (CNE) es el encargado de calcular diariamente el Re. Hacia finales de febrero y con las medidas de contención empleadas por el Gobierno de España, el Re estaba situado en 6. Conforme se declaró el día 14 de marzo el estado de alarma y se impusieron las medidas de distanciamiento social y cuarentena, se observó que el Re disminuyó hasta 4 y progresivamente fue disminuyendo hasta que, hacia finales de abril, el Re se situó cercano a 0,846,47.
La importancia del R0 y del Re radica en que estos indicadores ofrecen un panorama general del comportamiento de la epidemia y sirven de apoyo para determinar la necesidad de emplear medidas de salud pública, más o menos estrictas, para la mitigación, contención y control de los brotes epidémicos42,44,46.
PatogeniaUna vez que el virus entra al organismo a través de las mucosas, ya sea oral, nasal o conjuntival, la proteína viralS comienza a tomar su protagonismo, ya que con la ayuda de los picos de su superficie formados por las subunidades S1 y S2 es capaz de mediar la unión con el receptor y fusionarse con la membrana celular de las células del huésped13,16,30. Análisis comparativos entre la proteínaS del SARS-CoV y del SARS-CoV-2 muestran que el genoma de estas proteínas es idéntico en el 75%, lo cual sugiere que el SARS-CoV-2 utiliza el mismo receptor que el SARS-CoV para entrar en la célula y poder replicarse21,48. El receptor utilizado es la enzima convertidora de angiotensina2 (ECA-2)13,49. Estudios también indican que la proteínaS del SARS-CoV-2 tiene una afinidad hacia este receptor de 10 a 20 veces mayor que la proteínaS del SARS-CoV, lo cual facilita una tasa aumentada y exponencial de contagio entre las poblaciones humanas, específicamente entre los pacientes hipertensos, ya que se ha observado que la expresión de la ECA-2 aumenta en pacientes hipertensos que son medicados con antihipertensivos, especialmente los inhibidores de la enzima convertidora de angiotensina2 (IECA), los antagonistas de los receptores de la angiotensinaII (ARA-II) y algunos antiinflamatorios. Esto postula la hipótesis de que al existir una mayor expresión de la ECA-2, existe en consecuencia una mayor unión del virus con estos receptores, lo que facilita la rápida progresión de la infección entre estos individuos46,49. Sin embargo, cabe señalar que esta es solo una teoría y no está inequívocamente consensuada por la comunidad científica. Es por esto que la Agencia Europea de Medicamentos (EMA), así como otras organizaciones internacionales de salud y múltiples autores, no recomiendan la suspensión de estos medicamentos en pacientes hipertensos, los cuales, al dejar de consumir sus medicamentos, podrían descompensarse y aumentar su probabilidad de complicarse en caso de presentar la infección por el nuevo coronavirus49,50.
Una vez que ocurre la unión entre la superficie del virus y la membrana celular de la célula huésped, comienza un proceso de fusión entre la membrana vírica y plasmática. Posteriormente, el ARN del virus se comienza a transcribir y a replicar, procesos que ocurren principalmente dentro de las células epiteliales del tracto respiratorio superior e inferior13,29,51. Una vez terminado el proceso de sintetización proteínica y de replicación genómica del ARN viral, estos elementos pasan a ser ensamblados en el retículo endoplásmico y el aparato de Golgi de la célula infectada, seguido por su liberación al citoplasma celular, para que finalmente los nuevos viriones sean liberados a través de vesículas (fig. 2B)5,13,15,16.
Desde el punto de vista fisiopatológico, el origen de los síntomas que presentan los pacientes enfermos de COVID-19 se explica por la activación del sistema inmunitario innato, en la que, como suele suceder en otro tipo de infecciones respiratorias, se observa una importante liberación de citoquinas y mediadores proinflamatorios. Estas sustancias causan la activación del centro termorregulador en el hipotálamo produciendo la fiebre, así como la irritación del tracto respiratorio, lo cual se traduce como la activación del reflejo tusígeno en el bulbo raquídeo ocasionando la tos28.
En el caso de los pacientes enfermos de COVID-19 que cursan una evolución severa, la respuesta inmune no es capaz de controlar adecuadamente la infección del virus, por lo que este logra proliferar y propagarse con mayor eficacia produciendo mayor daño tisular pulmonar, lo cual propicia la activación de macrófagos y granulocitos, que generan a su vez la liberación masiva de citocinas y mediadores proinflamatorios, particularmente interleucina6 (IL-6) y factor estimulante de las colonias de granulocitos-macrófagos (GM-CSF)1,13,28,46.
Esta hiperactivación, que no logra contener la infección, conduce a que ocurra una depleción linfocitaria que por sí misma se asocia a un incremento en el daño tisular ya existente y que analíticamente es observada en pacientes graves que presentan linfopenia e hiperferritinemia. A esta hiperactivación y liberación masiva de citocinas y mediadores proinflamatorios se la ha denominado síndrome de liberación de citocinas (SLC), que se produce cuando una gran cantidad de leucocitos son reclutados y liberan grandes cantidades de citocinas proinflamatorias, entre ellas GM-CSF, IL-6, IL-10, el interferón (IFN), la proteína quimiotáctica de monocitos1 (MCP-1), el factor de necrosis tumoral (TNF), IL-1, IL-2, IL-2 receptor e IL-813,46.
La propia tormenta de citocinas que genera el SLC causa daño en el sistema microvascular, lo cual activa el sistema de coagulación e inhibición de la fibrinólisis. Esta alteración del sistema microvascular conduce a la aparición de la coagulación intravascular diseminada (CID), la cual es señalada como una de las principales causantes de falla orgánica en pacientes graves y que analíticamente es observada a través del aumento progresivo del dímeroD y del fibrinógeno13.
Características y manifestaciones clínicasSegún los primeros informes epidemiológicos generados en China, la edad media de los pacientes que contrajeron la infección se ubicó entre los 47 y los 59años, con una ligera predominancia entre individuos del género masculino. Se observaron casos en individuos menores de 18años, pero fueron reportados como casos aislados. Entre las comorbilidades o condiciones médicas coexistentes más prevalentes entre estos pacientes se reportó: hipertensión, diabetes, enfermedades cardiovasculares, consumo de tabaco, enfisema pulmonar y obesidad1,7,13. A partir de estas comorbilidades se determinó que los pacientes de mayor riesgo para presentar un cuadro clínico severo son los que padezcan alguna de las condiciones médicas anteriores, así como adultos mayores de 60años, personas inmunocomprometidas, mujeres embarazadas y asmáticos1,7,28,43.
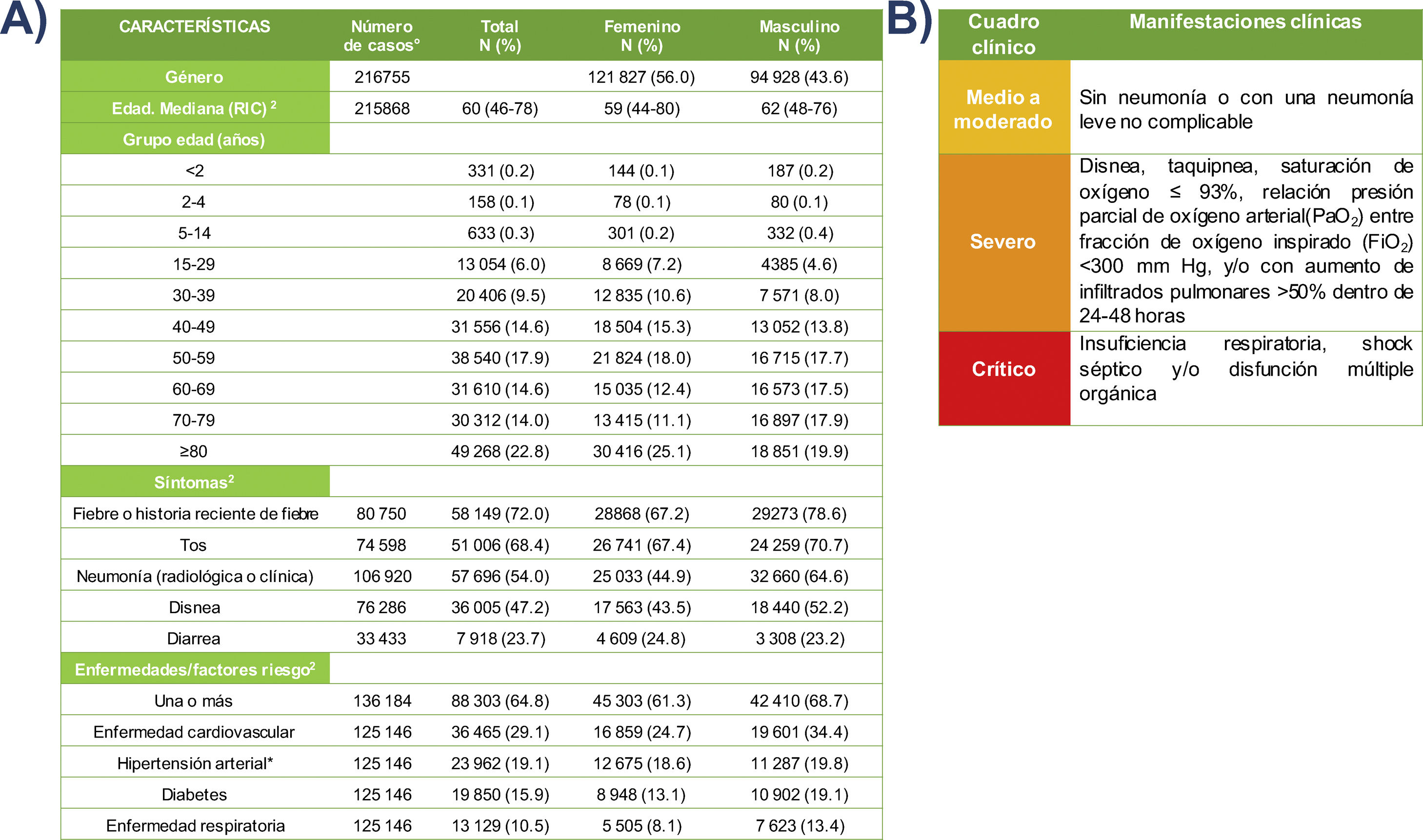
En España, mediante la Red Nacional de Vigilancia Epidemiológica (RNVE) se ha comprobado que los primeros informes sobre las características demográficas, clínicas y epidemiológicas, originados en los países asiáticos, no difieren mucho de lo que se ha observado en el país durante la pandemia, por lo que en muchos aspectos los datos son superponibles (tabla 1A)46.
A) Principales características demográficas, clínicas y antecedentes epidemiológicos de riesgo en España. En base a la información recabada por la RNVE a partir de una muestra total de 217.543 pacientes. Se enumera por frecuencia y porcentaje las manifestaciones clínicas y los factores de riesgo de los pacientes con COVID-19 hasta el hasta el día 7 de mayo 2020.
1 Los porcentajes se calculan sobre los casos de COVID-19 de los que se dispone de información de cada variable.
2 RIC: rango intercuartil. ̊: número de casos con información sobre la variable.
* La información sobre hipertensión arterial se recoge a partir del 18 marzo 2020.
Fuente: Adaptación de los autores a partir de la información pública difundida por el Centro Nacional de Epidemiología. Red Nacional de Vigilancia Epidemiológica. Informe sobre la situación de COVID-19 en España. Informe COVID-19 n.° 29. Publicado 7 mayo 2020. Disponible en: https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Documents/INFORMES/Informes%20COVID-19/Informe%20n%C2%BA%2029.%20Situaci%C3%B3n%20de%20COVID-19%20en%20Espa%C3%B1a%20a%2007%20de%20mayo%20de%202020.pdf
B) Feng He et al. proponen esta clasificación de pacientes con COVID-19 según el cuadro clínico. Se clasifican en 3 cuadros clínicos: medio a moderado, severo y crítico, en función del grado de gravedad de las manifestaciones clínicas13.
Fuente: Extraída del artículo de revisión de Feng He et al.13. Adaptado al español por los autores de la presente revisión bajo el uso legítimo de la licencia: Attribution 4.0 International (CC BY 4.0).
Los síntomas producidos por la COVID-19 son inespecíficos. No obstante, el espectro clínico puede ir desde un cuadro clínico asintomático hasta una neumonía severa que produzca insuficiencia respiratoria a causa del síndrome de distrés respiratorio del adulto (SDRA). La presencia del SDRA está asociada al SLC y a la CID, que han sido descritos por la literatura médica actual como las principales causas del daño multiorgánico que presentan estos pacientes y que consecuentemente originan la alta mortalidad de COVID-19 en pacientes de alto riesgo1,13,28,46.
La neumonía es la manifestación clínica más severa que comúnmente se ha presentado durante el transcurso de la enfermedad en pacientes graves. Esta se caracteriza principalmente por presentar fiebre, tos, disnea e infiltrados en las imágenes de tórax. Sin embargo, así como sucede con otras infecciones respiratorias virales, no existen síntomas que sean específicos para poder diferenciar una neumonía ocasionada por otros virus de la ocasionada por SARS-CoV-21,7,13,28.
Los principales síntomas inespecíficos de la COVID-19 que han sido reportados en China, Europa y en muchas otras partes del mundo son: fiebre, tos seca, astenia, mialgias, artralgias, escalofríos, cefalea, odinofagia y disnea (presente en casos graves). Menos frecuente es la presentación de anosmia, ageusia, diarrea, vómitos, congestión nasal y hemoptisis1,3,13,28,46,52.
En cuanto a la presentación de los síntomas de la COVID-19 en España, los datos son nuevamente equiparables con los reportados en la literatura médica y los informes de la OMS. Concretamente la RNVE en su informe n.° 29 del día 7 de mayo enumera los principales síntomas presentados por el conjunto de la población española, hasta la fecha y a base de una muestra de 217.543 casos, de la siguiente manera: fiebre (72%), tos (68,4%), neumonía radiológica o clínica (54%), disnea (47,2%), diarrea (23,7%) (tabla 1A)52.
Los hallazgos de laboratorio que se presentan en esta enfermedad pueden ser desestimados y pasar inadvertidamente como hallazgos que se suelen presentar en cualquier otra infección respiratoria. Sin embargo, en la COVID-19 es importante hacer hincapié en que se pueden presentar hallazgos analíticos que han demostrado asociación significativa por su utilidad como posibles marcadores de gravedad y/o de mortalidad13,46.
Entre estos hallazgos es común observar la leucopenia y la linfopenia, siendo esta última característica de la COVID-19, ya que el SLC propicia la detección de IL-6, hiperferritinemia y la depleción linfocitaria. Se ha reportado elevación de la enzima lactato deshidrogenasa (LDH) y creatinquinasa (CK) en respuesta al estado de sepsis que desarrollan los casos severos de la enfermedad. La mitad de los pacientes llegan a padecer algún grado de función hepática anormal manifestada con la elevación de las enzimas aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT). Puede coexistir además la elevación en suero de la proteínaC reactiva, pero sin elevación de la procalcitonina, y hasta un tercio de los pacientes, sobre todo los que se encuentran en estado crítico, pueden presentar elevación del dímeroD, en respuesta de la activación de la coagulación y sus mediadores procoagulantes, los cuales causan fenómenos trombóticos observados analíticamente a través del aumento del tiempo de protrombina (Tp) y la trombocitopenia1,13,46.
Los hallazgos imagenológicos han demostrado una alta eficiencia cuando estos hallazgos son adecuadamente integrados con la clínica del paciente. No obstante, hay que tener en cuenta que las manifestaciones radiológicas son diversas y que estas progresan rápidamente1,13. Entre los estudios de imagen que se han utilizado destacan las radiografías de tórax (Rx-Tx), así como las tomografías computarizadas de tórax con ventana pulmón (TC-Tx). Como es sabido, las Rx-Tx tienen una sensibilidad menor a las TC-Tx. Sin embargo, las primeras logran ser útiles en los casos donde no se dispone de tomógrafo, como sucede en sistemas sanitarios en países menos desarrollados.
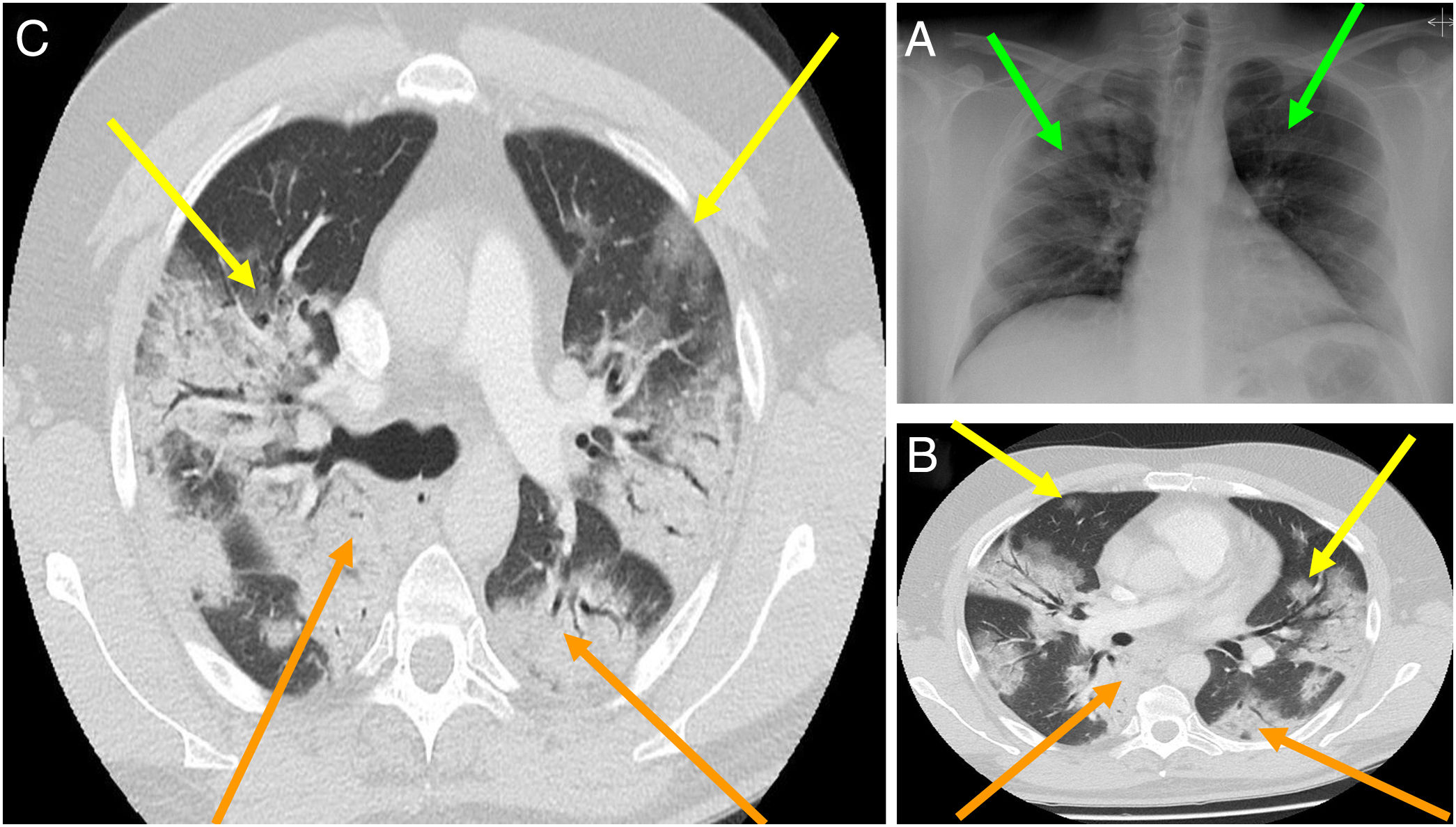
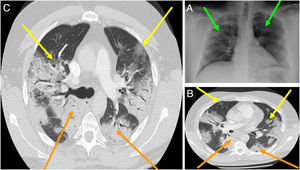
En general, el hallazgo imagenológico principal tanto en las Rx-Tx y las TC-Tx es el de una neumonía atípica u organizada (fig. 3A). En las Rx-Tx se suelen observar opacidades asimétricas irregulares como en vidrio esmerilado, datos de consolidación, con distribuciones bilaterales, periféricas y de los campos pulmonares inferiores. La afección pulmonar tiende a progresar en el trascurso de la infección, por lo que estos hallazgos pueden variar según el momento de evolución en que el cuadro clínico se encuentre; con todo, según la literatura médica, hasta un 20% de los casos no presentan ni presentarán estos hallazgos radiológicos en ningún momento de la enfermedad (fig. 3B)1,53.
A) Radiografía de tórax de un paciente con COVID-19. Las flechas verdes marcan opacidades asimétricas irregulares en ambos campos pulmonares. B)Tomografía de tórax de un paciente con COVID-19, etapa inicial. Las flechas amarillas marcan consolidaciones, las flechas naranjas marcan consolidaciones en vidrio esmerilado. C)Tomografía de tórax de un paciente con COVID-19, etapa tardía. Las flechas amarillas marcan consolidaciones, las flechas naranjas marcan consolidaciones en vidrio esmerilado con patrón reticular e importante distorsión anatómica.
Fuente: Imágenes obtenidas mediante consentimiento de paciente salvaguardando su identidad.
En cuanto a lo referente a las TC-Tx, los hallazgos predominantes son las opacidades en vidrio esmerilado y las consolidaciones distribuidas irregularmente, como si fueran parches, principalmente en la zona medial y externa de los campos pulmonares. Entre los hallazgos tomográficos menos comunes se han reportado: derrame pleural, cavitaciones, adenopatías y neumotórax1,13,54. Según un estudio, las anormalidades tomográficas alcanzan su punto máximo en la mayoría de los pacientes hacia el día10 de la infección, cuando además de los hallazgos ya mencionados se puede observar un patrón reticular con una importante distorsión anatómica y, en fases tardías, bronquiectasias por tracción (fig. 3C)54.
Como se menciona en los informes de la OMS y la experiencia adquirida desde el inicio del brote hasta este momento, aproximadamente el 80% de los pacientes enfermos de COVID-19 cursarán con un cuadro clínico medio a moderado sin neumonía o con una neumonía leve no complicable, mientras que aproximadamente el 20% restante cursarán con un cuadro severo de la enfermedad y un 3,6% del total de los enfermos morirán13,28,55,56. Por esta situación, los pacientes pueden ser clasificados en grupos clínicos en función de la severidad de su estado (tabla 1B). Esta clasificación ayuda a establecer quiénes son los pacientes que mayor soporte médico requieren, y contribuye a que la atención médica sea priorizada a quienes más la necesiten sin que se saturen los servicios médicos existentes13,28.
Métodos diagnósticosLa sospecha de encontrarnos ante un caso de COVID-19 debe basarse primordialmente en la historia clínica del paciente y en la evolución de su cuadro clínico. Un paciente que presente los síntomas asociados de COVID-19 o que refiera datos de alguna enfermedad de vías respiratorias sin que se haya identificado una causa concreta debe ser estudiado como caso sospechoso. Más aún si al interrogatorio el paciente refiere haber tenido contacto cercano con un caso confirmado o sospechoso de COVID-19 en los últimos 14días o si manifiesta residir o haber viajado en los últimos 14días a cualquier lugar del mundo donde se conozca que existe la transmisión comunitaria del virus12.
Como se ha evidenciado en la literatura revisada, la TC-Tx ha demostrado ser una herramienta muy útil de apoyo para establecer el diagnóstico. Estudios han puesto a prueba la capacidad de utilizar la TC-Tx a la par de la RT-PCR, y se ha reportado que la TC-Tx tiene una sensibilidad diagnóstica del 97%, con un valor predictivo positivo del 65% y negativo del 83%. En un estudio comparativo similar, con una muestra menor, se obtuvieron resultados parecidos, donde la TC-Tx tuvo una sensibilidad del 98%57.
Para el diagnóstico definitivo de COVID-19 es indispensable la realización de una RT-PCR. Este es el método diagnóstico que ha sido ampliamente utilizado alrededor del mundo por su capacidad de detectar al SARS-CoV-2 en las secreciones respiratorias1,7,13. La toma de la muestra en pacientes ambulatorios se realiza a través de exudado nasofaríngeo u orofaríngeo, mientras que en pacientes intubados se prefiere la toma a través del lavado broncoalveolar30. Una vez que se obtienen las muestras, el material genético del virus es extraído de las células infectadas y es procesado por la RT-PCR, cuyo principio básico es leer o detectar el genoma del virus, principalmente de las secuencias correspondientes a las proteínasN, E yS43,58.
Además de la detección del virus, es importante determinar la carga viral que los infectados poseen en sus células, por lo que, valiéndose del llamado valor umbral de ciclo (Ct-value [cycle threshold value]), se puede determinar el número de copias del virus presentes en las células. El Ct-value es el número de veces que la RT-PCR tiene que leer el genoma del virus para considerar que está presente y determinar la carga viral celular43,58,59. En algunos estudios el Ct-value umbral fue establecido de 40-37. Cuando se realizaba la detección del SARS-CoV-2 y la muestra procesada por RT-PCR reportaba un valor umbral menor a 37 ciclos, la prueba era positiva. En cambio, si era mayor de 40 ciclos la prueba era negativa. En los casos en que el Ct-value se encontraba entre 37 y 40 ciclos se requería una confirmación, por lo que se repetía la prueba43. En otras palabras, mientras menos ciclos realice la RT-PCR, mayor es la carga viral, y viceversa.
Otras pruebas diagnósticas que se han utilizado son las pruebas rápidas basadas en la detección antígeno-anticuerpo. Estas pruebas son cualitativas y solo expresan un resultado, ya sea positivo o negativo. La técnica más utilizada en estas es el ensayo por inmunoabsorción ligado a enzimas (ELISA), en la cual se toma una muestra de exudado nasofaríngeo u orofaríngeo. En el ELISA un anticuerpo ligado a una enzima busca intencionadamente la detección de antígenos, que en este caso son proteínas específicas del SARS-CoV-2 (proteínaN y las subunidadesS1,S2 de la proteínaS), para después generar una señal o producto detectable que se pueda identificar en caso de encontrar a un antígeno del virus, para así determinar la positividad de la prueba60-62.
En el caso de las pruebas rápidas por determinación de anticuerpos, estas surgen desde la idea de que el sistema inmunitario desarrolla inmunoglobulinas (Ig) frente al virus, dependiendo de la fase de la infección en la que el individuo se encuentre. La IgM es la inmunoglobulina de fase aguda, mientras que la IgG es la de fase crónica, de memoria o de recuperación60.
Aunque hasta la fecha no existe consenso entre la comunidad médica sobre el tiempo en el que los títulos de IgM e IgG aumentan para ser detectables, se ha postulado que la IgM comienza a elevarse entre 5-7días tras el momento del contagio (siendo su pico detectable entre 8-14días), mientras que la IgG se vuelve detectable a partir del día 15 al 2161,62.
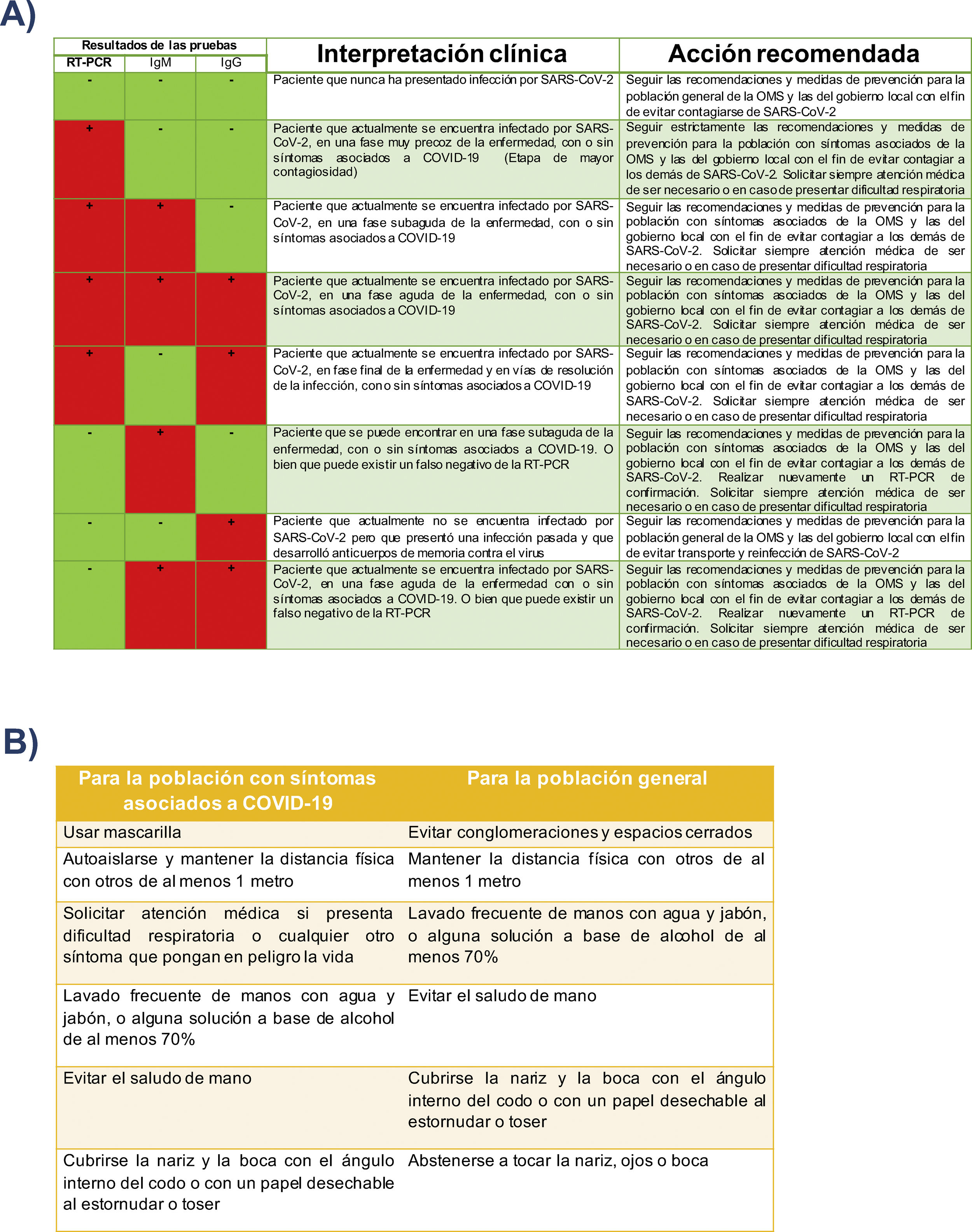
Las pruebas rápidas adquieren su mayor utilidad cuando son empleadas para detectar oportunamente la infección por SARS-CoV-2, sobre todo cuando la RT-PCR no se encuentra disponible o no se puede realizar de forma masiva. Sin embargo, es imprescindible que estas sean valoradas junto con la situación epidemiológica y clínica del paciente (tabla 2A).
A) Interpretación combinada del resultado de RT-PCR y prueba rápida de detección de anticuerpos. B) Recomendaciones y medidas de prevención de la OMS para la población general y población con síntomas asociados a COVID-19 para evitar la propagación del SARS-CoV-2
A) Propuesta de interpretación clínica combinada del resultado de RT-PCR y prueba rápida de detección de anticuerpos con las medidas de prevención de la OMS.
B) La OMS recomienda tanto a la población general como a la población con síntomas asociados a COVID-19 seguir estas medidas de prevención tanto para evitar contagiar al virus como para evitar contagiarse.
Fuente: Elaboración propia de los autores en base al conocimiento adquirido sobre el uso y la interpretación de la pruebas. Recomendaciones fundadas en los documentos técnicos de la OMS67.
Hasta este momento no se dispone de un tratamiento específico contra la COVID-19, ni de una vacuna capaz de prevenir la infección por SARS-CoV-2, motivo por el cual las medidas masivas de salud pública, optadas por gran parte de la comunidad internacional, han sido y han demostrado ser las únicas formas efectivas para la contención de la propagación de la enfermedad y su mitigación. Tales medidas masivas de salud pública se han basado principalmente en el distanciamiento social y la cuarentena63.
Entre las recomendaciones generales de la OMS para la prevención de la enfermedad (tabla 2B) es importante hacer énfasis en dos de estas medidas: el lavado de manos y el uso de mascarilla.
El lavado de manos se tiene que realizar de forma adecuada según la técnica de la OMS, donde las manos se tienen que frotar durante 20-30s, y de 40-60s si las manos se notan sucias. Además, es importante que estas sean lavadas con agua y con jabón, o con una solución a base de alcohol al 70%, ya que se demostró que el SARS-CoV-2 puede estar presente en superficies inanimadas hasta durante 9días, y que una solución de alcohol al 62-71% disminuye su infectividad en las superficies después de su exposición de al menos 1min64,65, por lo que es importante también lavarse las manos frecuentemente, sobre todo después de que estas hayan estado en contacto con alguna superficie. En el caso específico del personal de salud, el lavado de manos además se tiene que realizar después de estar en contacto con el paciente o con su medio, ya sea directa o indirectamente, así como después de realizar cualquier procedimiento médico65.
El uso de mascarillas por parte de la población general ha sido un tema ampliamente discutido como medida efectiva de prevención, ya que hasta la fecha no existe evidencia científica concluyente que demuestre que el uso de mascarillas en el ámbito comunitario reduzca el contagio de SARS-CoV-2 o alguna otra infección respiratoria aguda viral66. Ante esto, la OMS ha recomendado el uso de mascarillas solo a la población infectada y no recomienda su uso generalizado. Entre otras cosas, porque optar únicamente por esta medida no es suficiente para evitar el contagio, ya que esta medida por sí sola no confiere el adecuado nivel de protección. Por lo tanto, deberían adoptarse también otras medidas67.
El uso de mascarillas quirúrgicas entre el personal sanitario que atiende pacientes con COVID-19 no es efectivo, debido a que las partículas virales son capaces de penetrar a través del material del que están hechas. La OMS recomienda el uso de respiradores de alta eficiencia, que cuentan con un filtro de partículas de entre 3 a 5μm de diámetro. Entre los ejemplos más conocidos de respiradores de alta eficiencia a nivel mundial se encuentran los FFP2 y FFP3, que poseen una eficiencia del 95 y del 99,95%, respectivamente, están avalados por la Unión Europea y por tanto son los utilizados en los países europeos. En contraparte, existen los respiradores N95, N99 y N100, con una eficiencia del 95, del 99 y del 99,7%, que están certificados ante el U.S. National Institute for Occupational Safety and Health, y su uso está difundido mayoritariamente entre los países americanos68,69.
Al no existir hasta el momento un tratamiento farmacológico eficaz contra la infección, la comunidad médica internacional ha utilizado empíricamente medicamentos ya conocidos y ampliamente utilizados en otras enfermedades, principalmente en las causadas por el SARS-CoV y MERS-CoV, debido a su similitud y parentesco con el nuevo coronavirus70. Entre los medicamentos que se han empleado hasta el momento destacan:
- •
Cloroquina/hidroxicloroquina: utilizados para el tratamiento de la malaria, el lupus eritematoso sistémico y la artritis reumatoide.
- •
Lopinavir/ritonavir y otros antirretrovirales: utilizados para el tratamiento de la infección por VIH.
- •
Ribavirina: antiviral utilizado para el tratamiento de la hepatitisC.
- •
Otros fármacos antivirales: oseltamivir, umifenovir.
- •
Otros agentes: interferón-α/β utilizados junto con otros de los fármacos anteriores.
- •
Otras terapias coadyuvantes: anticuerpos monoclonales contra citocinas proinflamatorias como IL-6 (tocilizumab) y terapia de inmunoglobulinas con inmunoglobulinas extraídas del plasma de pacientes recuperados de la infección.
Tratamientos bajo investigación para su uso estándar en COVID-19:
- •
Favipiravir: con experiencia clínica limitada en COVID-19. Sin embargo, con resultados alentadores en otros coronavirus.
- •
Remdesivir: utilizado por primera vez en la pandemia de Ébola70, es el medicamento que hasta la fecha tiene mayor expectativa de ser utilizado como de uso estándar. Protocolos de ensayos aleatorizados, doble ciego controlado con placebo se han realizado sobre este medicamento, y uno de ellos demostró un ligero acortamiento en el tiempo de estancia intrahospitalaria de los pacientes que fueron tratados oportunamente con este medicamento, aunque no se pudo asociar en este estudio ningún otro beneficio clínico71. A raíz de una serie de ensayos aleatorizados realizados por la farmacéutica GILEAD y el National Institute of Allergy and Infectious Diseases (NIAID), el día 1 de mayo la Food and Drug Administration (FDA) emitió una autorización de uso urgente de este medicamento en presentaciones graves de la enfermedad. Aunque se aclara que esta autorización es temporal y que el medicamento tendrá que transitar por el procedimiento normal para la aprobación de medicamentos de la FDA72.
Desde el comienzo del brote y su progresión pandémica, la expectativa mundial está concentrada en el desarrollo de una vacuna. Sin embargo, el desarrollo de vacunas no es un proceso corto, ya que se tiene que contar con una base teórica fuerte, tecnología necesaria y su prueba en animales pequeños y en humanos, para lo cual se necesita contar con ciertas regulaciones73. No obstante, es posible que a principios de 2021 la vacuna se encuentre disponible y en uso de emergencia, ya que a escala mundial se están uniendo esfuerzos entre gobiernos nacionales, farmacéuticas e instituciones de investigación74.
El panorama hasta el día 5 de mayo sobre el avance del desarrollo de una vacuna contra el SARS-CoV-2 es el siguiente: 108 modelos de posibles vacunas, 100 de ellos que actualmente se encuentran en una etapa preclínica (experimental en animales) y 8 en fase clínica (experimental en humanos)75.
ConclusiónActualmente el mundo se encuentra luchando arduamente en contra de la que quizás es la pandemia más severa a la que se haya enfrentado la humanidad. Esta lucha se encuentra liderada por la OMS en apoyo de los gobiernos del mundo y respaldada por miles de científicos y médicos, quienes invaluablemente han ofrecido sus conocimientos y experiencia para el control de la pandemia y para evitar más muertes. Las medidas de distanciamiento social y la cuarentena han sido claves para mitigar la pandemia, ya que hasta la fecha no se dispone de un tratamiento médico eficaz o de alguna vacuna. La contribución de la población aislándose ha representado un importante sacrificio, pero conforme pasan las semanas ha demostrado un impacto significativo en el desarrollo positivo de la pandemia. Es importante que el médico de familia conozca las generalidades de la enfermedad con el fin de que se pueda lograr un diagnóstico certero y precoz para que la enfermedad no ponga en riesgo la salud de la población.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.
Los autores desean agradecer a todo el personal sanitario alrededor del mundo que ha luchado valientemente contra el virus durante la pandemia de COVID-19.