La aféresis es un procedimiento médico consistente en el procesamiento de sangre periférica de los pacientes o donantes mediante un instrumento capaz de separar la sangre en sus distintos componentes. De esta manera, unos componentes serán separados y extraídos del sujeto, y otros retornarán al torrente circulatorio. Los distintos componentes sanguíneos se separarán por su tamaño, o por diferentes gradientes de densidad, o por adsorción a distintas sustancias. Los modernos instrumentos de aféresis son equipos totalmente automatizados, pero la experiencia del operador es crucial, especialmente en el ámbito pediátrico.
En los niños más pequeños, los accesos vasculares, la anticoagulación o el volumen extracorpóreo (sangre que pasará al separador celular) constituyen retos técnicos que debemos superar.
Puntos clave
- •
El uso de aféresis terapéuticas en Pediatría es aún poco frecuente, a pesar de que su número de indicaciones de acuerdo a las guías de la Sociedad Americana de Aféresis ha aumentando en los últimos años.
- •
Las aféresis en niños presentan mayor incidencia de complicaciones que en adultos, pero aún así son procedimientos seguros. La hipovolemia secundaria al paso de sangre al separador celular, el uso de anticoagulantes y la dificultad de un acceso vascular adecuado son los principales inconvenientes a resolver.
- •
El recambio plasmático terapéutico es un tratamiento de primera línea en el síndrome de Guillain-Barré o la enfermedad neuropsiquiátrica autoinmune pediátrica asociada a infección estreptocócica. Solo una adecuada valoración de riesgos y beneficios debería justificar la elección del tratamiento de primera línea.
- •
La adsorción de proteínas de baja densidad con columnas es un tratamiento de primera línea de la hipercolesterolemia familiar grave.
El acceso venoso se realiza con frecuencia en la edad pediátrica con catéteres clásicos de diálisis o aféresis. Catéteres rígidos, no colapsables por la presión negativa que presentarán, con múltiples orificios para aumentar el flujo y con la luz de cada una de las vías a distinta distancia del punto de inserción para disminuir la recirculación. En adultos, habitualmente se usan catéteres venosos centrales tunelizados subcutáneos de doble luz tipo Hickman o accesos periféricos. Estos catéteres tunelizados se han empleado en algunas series pediátricas. Sin embargo, en nuestra experiencia es preferible la realización de los procedimientos de aféresis con catéteres no tunelizados, ya que estos no precisan anestesia general ni quirófano para ser colocados, son más rígidos, y pueden ser retirados fácilmente1,2.
Es obvio que el tamaño del catéter es de vital importancia en la edad pediátrica. Este debe guardar relación con el peso del paciente. Gorlin et al3 propusieron una guía para la selección del catéter a emplear. Estos autores sugerían el empleo de catéteres de 8 Fr en los pacientes con peso entre 20 y 40kg, y de 10 Fr Hickman de doble luz, o 7–9 Fr en la vía de acceso y 7 Fr en la de retorno, en los pacientes de menos de 20kg. Para todos los demás pacientes, sugieren el empleo de catéteres de 12.5 Fr. En nuestra experiencia, los procedimientos pueden llevarse a cabo incluso con catéteres de 5Fr, requiriéndose en estos casos flujos muy bajos4. Otros autores han llegado a utilizar accesos arteriales, creando una fístula en el antebrazo, aunque esto no es estrictamente necesario. Algunos autores emplean de modo rutinario como acceso vascular vías periféricas, pero esta medida es mucho menos frecuente que en la edad adulta.
AnticoagulaciónLos procedimientos de aféresis requieren anticoagulación para prevenir la trombosis y oclusión del sistema. Habitualmente se realiza con ácido cítrico anhidro, citrato trisódico dihidrato y dextrosa monohidrato (ACD-A), que previene la activación de la coagulación quelando el calcio del plasma cuando se encuentra en concentraciones superiores a 1:7. Esta quelación del calcio es la que puede provocar hipocalcemia, su principal efecto secundario. La hipocalcemia en adultos es responsable de parestesias peribucales, escalofríos y náuseas. En niños, sin embargo, se observa más frecuentemente dolor abdominal (con o sin náuseas y vómitos), agitación, sudación, taquicardia e hipotensión. Las complicaciones son más frecuentes en los niños por un menor metabolismo del citrato y una mayor concentración del ACD-A en el organismo al ser menor el volumen sanguíneo en el que se distribuirá. Esto condiciona que los ritmos de infusión en las aféresis pediátricas deban ser muy bajos. Gorlin et al realizaron una modificación en la anticoagulación introduciendo heparina como anticoagulante en un intento de disminuir los efectos adversos metabólicos atribuidos al citrato. Con esta modificación, la ratio de ACD se disminuyó hasta 25–30:1. El flujo osciló entre 20 y 50ml/min, con una menor infusión de citrato, lo que permitió que no aparecieran efectos adversos3. Esta modificación ha sido empleada en nuestra experiencia con buenos resultados, reduciendo las complicaciones por hipocalcemia sin realizar infusión simultánea de calcio y sin aumentar los episodios hemorrágicos2,4–6. En los casos en que no se puede incluir heparina en la solución anticoagulante, se realiza profilaxis de la hipocalcemia mediante administración simultánea de una infusión con suplementos de calcio.
Volumen extracorpóreoLos procedimientos de aféresis implican un desequilibrio en el volumen sanguíneo circulante al pasar parte de este volumen al separador celular. Este hecho puede ser de vital importancia en Pediatría, ya que puede representar una proporción excesiva del volumen sanguíneo. El purgado del sistema del separador celular con soluciones capaces de reemplazar la función del volumen sanguíneo perdido puede evitar este desequilibrio. A lo largo del tiempo, se han modificado las indicaciones para el purgado del sistema y las soluciones empleadas para el mismo. Inicialmente, se aconsejó purgar en todos los menores de 20kg. En los últimos tiempos, se aconseja hacerlo en los pacientes de menos de 15kg si no existe anemia. Se han empleado como soluciones de purgado concentrados de hematíes, diluidos o no con soluciones de seroalbúmina al 5%. También se ha descrito el uso de soluciones de seroalbúmina al 4%, restringiendo de este modo la transfusión de hemoderivados.
DefinicionesPodemos diferenciar 2 tipos de procesos de aféresis. Aquellos encaminados a retirar sustancias tóxicas del organismo, o recambiar elementos celulares existentes, a los que denominaremos aféresis terapéuticas, y aquellos procedimientos encaminados a la extracción de diversos componentes de la sangre para su posterior uso. A estos últimos no solo pertenecerían los procesos de donación de plaquetas, plasma o hematíes (inexistentes en el ámbito pediátrico), sino también los procedimientos de donación de progenitores hematopoyéticos para trasplante u otros subtipos celulares para terapia celular (linfocitos, por ejemplo). Estos últimos sí que son empleados en menores de edad.
Podríamos agrupar las aféresis terapéuticas según el tipo de procedimiento a realizar en varios grupos, siendo los más frecuentes en pediatría:
- 1.
Recambios plasmáticos terapéuticos. La sangre del paciente pasa al separador celular. Se separa el plasma del componente celular y se reinfunde solo el componente celular, siendo el plasma sustituido por una solución de reposición, que puede ser plasma de un donante sano u otras soluciones, como coloides o mezclas de cristaloides y coloides.
- 2.
Recambio eritroide. Se sustituyen los hematíes del paciente por hematíes de donante sano mezclado con coloides.
- 3.
LDL aféresis. Extracción selectiva de lipoproteínas de baja densidad (LDL) con devolución del resto de componentes sanguíneos. Se puede hacer la selección en base a su carga, tamaño, precipitación en medio ácido o inmunoadsorción en columnas.
El uso de separadores celulares para la colecta de progenitores hematopoyéticos para trasplante alogénico, o como rescate tras altas dosis de quimioterapia (trasplante autólogo), es un procedimiento consolidado y muy extendido. La experiencia en su uso en donantes pediátricos sanos ha sido revisada recientemente7. Por otro lado, las variables que condicionan el resultado de la colecta en los pacientes que precisan tratamiento con altas dosis de quimioterapia también están ampliamente descritas. La radioterapia y la quimioterapia previas, y la edad de los pacientes, influyen en los resultados de la colecta y deben tenerse en cuenta a la hora de programar estos procedimientos2,6,8. En cualquier caso, las aféresis tanto en pacientes como en donantes pediátricos pueden considerarse procedimientos con pocos efectos adversos cuando son realizados por equipos con experiencia. En los últimos tiempos ha resultado más interesante el definir a que niños debe realizarse la aféresis o no sobre la base de los recuentos de progenitores en sangre periférica antes de iniciarse el procedimiento. Recuentos de menos de 10 células CD34+ en sangre periférica antes de la aféresis deberían disuadirnos de iniciar la colecta8.
Aféresis terapéuticasDe manera regular, la Sociedad Americana de Aféresis (ASFA) revisa las evidencias clínicas y científicas que apoyarían el uso de aféresis como parte del tratamiento de distintas patologías. Su última revisión se publicó en 2013 y en este caso asignó a cada enfermedad una categoría del I al IV, siendo la I para aquellas enfermedades en las que la aféresis se considera el procedimiento terapéutico de primera línea, hasta el IV, en que se considera no efectiva o incluso perjudicial9.
Aunque mucha de esta patología es muy poco frecuente en pediatría, esta clasificación se usa también en pacientes pediátricos, si bien se cree que el uso en Pediatría es mucho menos frecuente. En este sentido, existe un reciente estudio americano que demuestra que, aunque el recambio plasmático terapéutico es cada vez más usado en Pediatría, su uso es aún raro, incluso en enfermedades catalogadas por la ASFA como I (su uso debería ser en primera línea)10. Algunas revisiones recientes permiten tener una interesante visión de este campo en pediatría11,12.
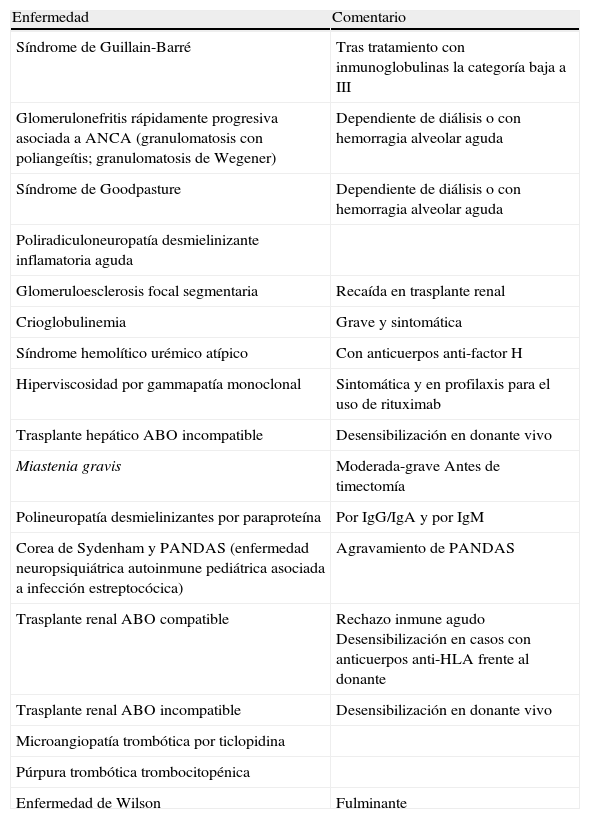
En las tablas 1–3 se recogen las indicaciones establecidas en las guías ASFA para estos procedimientos con categoría I.
Enfermedades con indicación de recambio plasmático terapéutico en categoría I
| Enfermedad | Comentario |
| Síndrome de Guillain-Barré | Tras tratamiento con inmunoglobulinas la categoría baja a III |
| Glomerulonefritis rápidamente progresiva asociada a ANCA (granulomatosis con poliangeítis; granulomatosis de Wegener) | Dependiente de diálisis o con hemorragia alveolar aguda |
| Síndrome de Goodpasture | Dependiente de diálisis o con hemorragia alveolar aguda |
| Poliradiculoneuropatía desmielinizante inflamatoria aguda | |
| Glomeruloesclerosis focal segmentaria | Recaída en trasplante renal |
| Crioglobulinemia | Grave y sintomática |
| Síndrome hemolítico urémico atípico | Con anticuerpos anti-factor H |
| Hiperviscosidad por gammapatía monoclonal | Sintomática y en profilaxis para el uso de rituximab |
| Trasplante hepático ABO incompatible | Desensibilización en donante vivo |
| Miastenia gravis | Moderada-grave Antes de timectomía |
| Polineuropatía desmielinizantes por paraproteína | Por IgG/IgA y por IgM |
| Corea de Sydenham y PANDAS (enfermedad neuropsiquiátrica autoinmune pediátrica asociada a infección estreptocócica) | Agravamiento de PANDAS |
| Trasplante renal ABO compatible | Rechazo inmune agudo Desensibilización en casos con anticuerpos anti-HLA frente al donante |
| Trasplante renal ABO incompatible | Desensibilización en donante vivo |
| Microangiopatía trombótica por ticlopidina | |
| Púrpura trombótica trombocitopénica | |
| Enfermedad de Wilson | Fulminante |
ANCA: anticuerpos contra el citoplasma de los neutrófilos; IgA: inmnoglobulina A; IgG: inmnoglobulina G; IgM: inmnoglobulina M.
Las patologías con indicación de categoría II son también varias. Debe tenerse en cuenta que la categoría II indicaría patologías en las que las aféresis están aceptadas como tratamiento de segunda línea. En estos casos, el tratamiento puede ser aislado con aféresis, o en combinación con otras aproximaciones terapéuticas. Estas patologías son muchas, de entre las que queremos señalar las siguientes: profilaxis del rechazo cardiaco, síndrome antifosfolípido catastrófico, hipercolesterolemia familiar heterocigota, enfermedad injerto contra huésped cutánea (aguda o crónica) tras trasplante hematopoyético, síndrome de Eaton-Lambert, esclerosis múltiple aguda de localización en sistema nervioso central, envenenamiento por setas, enfermedad de Refsum, síndrome torácico agudo en pacientes con anemia falciforme o lupus eritematoso agudo grave.
Para más información, como por ejemplo otras indicaciones en categoría II, III o IV, se debe revisa las propias guías9.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.