Se define como hemorragia digestiva alta la que se origina en una lesión situada por encima del ángulo de Treitz. Clínicamente se manifiesta en forma de hematemesis de sangre fresca o en «poso de café», de melenas o, con menor frecuencia, como hematoquecia. La úlcera péptica gastroduodenal es la etiología más frecuente de la hemorragia digestiva alta no varicosa, y es la causa de alrededor del 40-70% de los casos1-6. Esta complicación representa una urgencia médica frecuente, con una incidencia anual que oscila entre los 50 y 150 casos por 100.000 habitantes, lo que se traduce en un elevado número de ingresos anuales y un consumo muy alto de recursos sanitarios1,3,7.
Base racional del tratamiento farmacológico en la hemorragia digestiva
La hemorragia que ocurre como complicación de una úlcera péptica se produce cuando ésta alcanza una estructura vascular. Ello pone en marcha una serie de mecanismos hemostáticos destinados a detener la hemorragia de forma inmediata y permanente1,3,8,9. El ácido gástrico y la pepsina alteran el mecanismo normal de formación del coágulo en la lesión sangrante y aceleran el proceso de fibrinólisis8,10-14. Un valor de pH gástrico de 6 prolonga el tiempo de formación del agregado plaquetario y del coágulo de fibrina, mientras que a un pH inferior o igual a 5 estos procesos hemostáticos están completamente abolidos10-13. El empleo de fármacos antisecretores se basa en su capacidad de aumentar el pH intragástrico de forma ideal a un valor de pH superior a 6 de forma sostenida para optimizar los mecanismos hemostáticos en la lesión ulcerosa1,3,8,9. La necesidad de alcanzar este objetivo se basa no sólo en observaciones realizadas in vitro, sino también en que algunos estudios han demostrado que la tasa de recidiva hemorrágica en pacientes con hemorragia digestiva por úlcera péptica tratados con antisecretores es mayor en los que el valor medio de pH intragástrico es inferior a 615.
Por tanto, con intención de alcalinizar el pH intragástrico y controlar el episodio hemorrágico, se ha administrado diversos fármacos antisecretores, entre los que destacan los antagonistas H2 y los inhibidores de la bomba de protones (IBP). Aunque los antagonistas H2 se han empleado clásicamente en el tratamiento de la hemorragia digestiva alta, realmente no hay evidencia científica sólida que demuestre que tengan un efecto beneficioso en el control o la recidiva hemorrágica, la necesidad de cirugía o la mortalidad16-19, lo que podría deberse a que la administración intravenosa de estos fármacos causa un aumento que es sólo discreto y además fluctuante del pH intragástrico20-23. Los IBP, sin embargo, tienen una mayor potencia antisecretora, por lo que, como a continuación se revisará, podrían desempeñar un papel más relevante en el tratamiento de la hemorragia digestiva por úlcera péptica.
Potencia antisecretora de los inhibidores de la bomba de protones
Como se ha comentado previamente, el ácido gástrico es capaz tanto de deteriorar los mecanismos de formación del coágulo como de favorecer su destrucción, y los antagonistas H2 no son capaces de incrementar el pH intragástrico lo suficiente como para no interferir con esos procesos hemostáticos. Por el contrario, la capacidad alcalinizante de los IBP es considerablemente superior a la de los antagonistas H2, lo que les permite reducir la acidez intragástrica hasta cifras de pH superiores a 6 y optimizar los mecanismos hemostáticos en la lesión ulcerosa8,24-31. La ventaja terapéutica de los IBP frente a los antagonistas H2, en cuanto al incremento del pH intragástrico, se ha demostrado no sólo en sujetos sanos, sino también, específicamente, en pacientes con hemorragia digestiva32. Además, se ha descrito que el omeprazol cicatriza el 96% de las úlceras resistentes a ranitidina23 y se han publicado varios casos clínicos en los que la administración de este fármaco por vía intravenosa ha sido capaz de controlar la hemorragia digestiva secundaria a lesiones pépticas que no habían respondido previamente al tratamiento con ranitidina33-37.
Eficacia clínica de los inhibidores de la bomba de protones
A continuación se revisan los estudios que evalúan el efecto de los IBP en el episodio agudo de hemorragia digestiva, la prevención de su recurrencia, la necesidad de cirugía y la mortalidad. Puesto que la demostración de un pequeño beneficio en una entidad clínica tan frecuente e importante como la hemorragia digestiva puede ser relevante, los metaanálisis, que combinan los diferentes estudios e incrementan por tanto la potencia estadística de éstos, tienen aquí un interés especial. Debido a que la mayoría de los ensayos clínicos que comparan IBP con placebo o antagonistas H2 tiene un tamaño muestral relativamente pequeño por lo que carecen de la potencia necesaria para demostrar diferencias estadísticamente significativas entre las comparaciones efectuadas, la aglutinación de los resultados de todos los estudios en un metaanálisis nos puede proporcionar una estimación más precisa sobre el efecto terapéutico de estos antisecretores.
Inhibidores de la bomba de protones frente a placebo
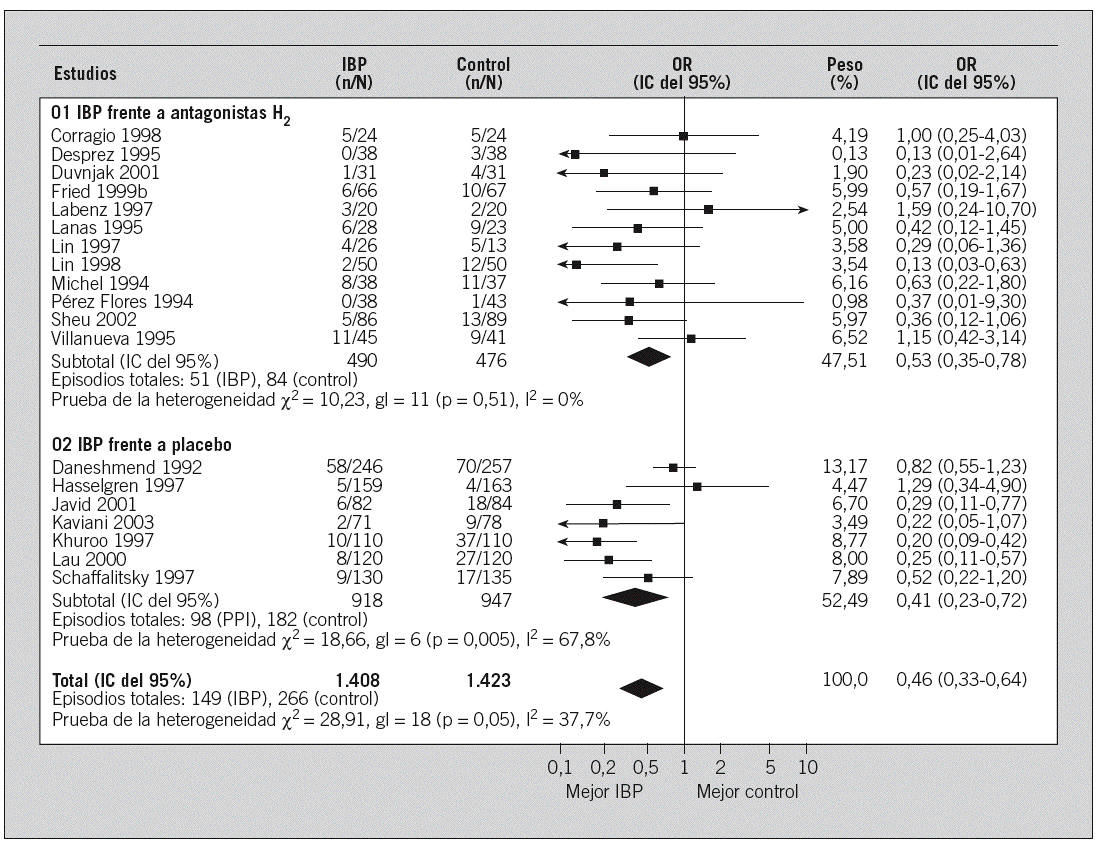
Recientemente se ha publicado una revisión sistemática y un metaanálisis llevado a cabo por la Colaboración Cochrane38,39 en que se han incluido todos los ensayos clínicos aleatorizados en los que se comparaba el tratamiento con IBP frente a placebo. Se incluyó 7 estudios que cumplieron estrictamente los prerrequisitos establecidos, con un total de 1.865 pacientes evaluados40-46. En resumen, como se representa gráficamente en la figura 1 (panel inferior), el tratamiento con IBP se asoció con una reducción de la tasa de recidiva hemorrágica (el 1,7 frente al 19,2% con placebo; odds ratio [OR] = 0,41; intervalo de confianza [IC] del 95%, 0,23-0,72). De igual modo, también se demostró una menor necesidad de cirugía (el 8,7 con IBP frente al 13,5% con placebo; OR = 0,52; IC del 95%, 0,32-0,84). Sin embargo, no se pudo demostrar efecto alguno en la mortalidad. Otros metaanálisis18,47, uno de ellos publicado en el año 2005, han confirmado la superioridad de los IBP frente al placebo en cuanto a la reducción de la recidiva hemorrágica y la necesidad de tratamiento quirúrgico48.
Fig. 1. Metaanálisis de los estudios que comparan inhibidores de la bomba de protones (IBP) con antagonistas H2 (panel superior) o con placebo (panel inferior) en la prevención de la recidiva hemorrágica por úlcera péptica. OR: odds ratio; IC: intervalo de confianza.
Inhibidores de la bomba de protones frente a antagonistas H2
Se han publicado diversos estudios aleatorizados en los que se ha comparado el tratamiento con IBP y con antagonistas H2, con resultados contradictorios. Hasta época muy reciente, no se había llevado a cabo un metaanálisis que valorara conjuntamente estos estudios. Así, Gisbert et al49 realizaron en 2001 una revisión sistemática y un metaanálisis de los ensayos clínicos aleatorizados que comparaban IBP con antagonistas H2. Al analizar conjuntamente los 11 estudios incluidos25-27,31,33,50-55 se constató la persistencia o la recurrencia de la hemorragia en el 13% de los pacientes tratados con antagonistas H2 y tan sólo en el 6,7% de los que recibieron IBP (OR = 0,4; IC del 95%, 0,27-0,59). El empleo de IBP se asoció igualmente con una disminución en la necesidad de cirugía y en la mortalidad, aunque en estos casos las diferencias no alcanzaron significación estadística.
Más recientemente, el metaanálisis publicado en la Librería Cochrane previamente mencionado38,39 ha actualizado estos resultados, incluido un total de 1.050 pacientes, en los que se comparó IBP y antagonistas H225-27,31,33,50,53-60. De nuevo, no se pudo demostrar diferencias significativas entre los dos grupos al evaluar la mortalidad y la necesidad de cirugía, pero el empleo de IBP sí que se asoció con una menor tasa de hemorragia (el 10 frente al 18% con antagonistas H2; OR = 0,53; IC del 95%, 0,35-0,78), como se representa gráficamente en la figura 1 (panel superior). Otros metaanálisis47, el último de ellos publicado en 200548, han confirmado estos resultados.
A pesar de su indudable utilidad, es conveniente señalar que todos los metaanálisis previamente mencionados presentan importantes limitaciones metodológicas. En primer lugar, la notable variabilidad existente entre los estudios incluidos hace que la combinación de sus resultados no sea sencilla. Por ejemplo, hay una importante heterogeneidad en diversas variables clínicamente relevantes, como la definición de recidiva hemorrágica, la comparación con placebo o con antagonistas H2, la localización de la úlcera (gástrica o duodenal), la dosis y el esquema de administración de los IBP (bolos o perfusión continua), la clasificación endoscópica de la úlcera sangrante o el empleo de tratamiento endoscópico adyuvante. En segundo lugar, el número de estudios relativamente reducido (y de pacientes en cada estudio) incluido en los metaanálisis impide la realización fiable de subanálisis en función de algunas variables. Por último, la deficiente calidad metodológica de algunos estudios incluidos en los metaanálisis hace que las conclusiones finales de éstos deban tomarse con cautela.
En resumen, a partir de los estudios previamente revisados se puede concluir que los IBP son más eficaces que el placebo y que los antagonistas H2 para prevenir la recidiva hemorrágica de la úlcera péptica o para evitar la cirugía. Sin embargo, cabe destacar que los IBP no hayan demostrado una reducción de la mortalidad8,18,38,39,47-49,61. En este sentido, una reciente revisión cualitativa sobre los estudios aleatorizados que han comparado la eficacia de los IBP con diversos tratamientos (antagonistas H2, somatostatina y otros) o placebo en pacientes con hemorragia digestiva debida a úlcera péptica evidenció que 4 de los 16 estudios incluidos demostraban una reducción significativa en la tasa de recidiva hemorrágica, 4 estudios constataron también una reducción en la necesidad de cirugía, pero ninguno de ellos pudo demostrar una disminución significativa en la mortalidad62. La ausencia de efecto en la mortalidad de los pacientes con hemorragia digestiva puede deberse sencillamente a la escasa potencia estadística (y el consiguiente error tipo beta), consecuencia del reducido tamaño muestral de los estudios. Así, debido en parte al limitado número de pacientes incluidos en cada estudio y a la reducida incidencia del episodio mortalidad, es posible que diferencias pequeñas pero clínicamente relevantes en esta variable no alcancen significación estadística. De este modo, se ha estimado que un estudio debería incluir al menos 1.000 pacientes de alto riesgo (en el grupo de tratamiento y en el grupo control) para poder demostrar diferencias estadísticamente significativas en la mortalidad63. Apoyando esta hipótesis, Barkun et al64 han revisado el registro canadiense de pacientes con hemorragia digestiva alta y el de endoscopia, con un total de 1.869 pacientes incluidos, y han demostrado que el consumo de IBP y el tratamiento endoscópico hemostático se asocian de forma independiente con un descenso en la mortalidad; este último estudio es especialmente interesante porque tiene la particularidad de evaluar en la práctica en el mundo real la utilización y los beneficios de los IBP64.
Por último, es posible que la mortalidad dependa fundamentalmente de la edad y de la comorbilidad del paciente, como se ha demostrado en múltiples estudios3,65,66. Así, se ha estimado que más de dos tercios de las muertes de los pacientes con hemorragia digestiva se deben a las enfermedades asociadas, mientras que tan sólo un tercio sería consecuencia de la recurrencia hemorrágica per se48. De este modo, algunos autores han demostrado que el tratamiento con IBP se asocia con una disminución de la mortalidad debida específicamente a las complicaciones hemorrágicas de la úlcera péptica, aunque este efecto no es suficiente para modificar la mortalidad global de los pacientes48.
Clasificación endoscópica de la lesión y eficacia de los inhibidores de la bomba de protones
El factor pronóstico más importante para predecir el resangrado de una úlcera péptica es su aspecto endoscópico en el momento del diagnóstico67. La clasificación endoscópica de la úlcera péptica basada en los estigmas de hemorragia generalmente evaluados mediante la clasificación de Forrest68 podría ser útil para seleccionar qué pacientes se beneficiarían más del tratamiento con IBP. Así, los pacientes con lesiones de bajo riesgo (úlceras con fondo fibrinoso o con coágulo negro «embebido», es decir, Forrest IIc o III) suelen evolucionar favorablemente aun sin tratamiento específico y tienen, por tanto, un riesgo de resangrado muy bajo que no es probable que ningún tratamiento pueda reducir todavía más. Es en las lesiones de alto riesgo de resangrado en las que es más probable que el tratamiento antisecretor potente desempeñe un papel más relevante. En este sentido, en uno de los metaanálisis previamente mencionados49 se observó que el beneficio de los IBP frente a los antagonistas H2 era mayor cuando únicamente se consideraban las lesiones endoscópicas de alto riesgo, es decir, las clasificadas como Forrest Ia, Ib y IIa (hemorragia activa o vaso visible no sangrante). De modo similar, en otro metaanálisis se comprobó el beneficio de los IBP únicamente en las lesiones ulcerosas clasificadas como de alto riesgo de resangrando48. No obstante, un metaanálisis adicional ha demostrado que la ventaja terapéutica de los IBP (frente al placebo o a los antagonistas H2) parece mantenerse incluso en las lesiones con un menor riesgo de recidiva hemorrágica38,39.
En resumen, las úlceras clasificadas endoscópicamente como de alto riesgo de resangrado son las que con más probabilidad se beneficiarán del tratamiento con IBP, mientras que la ventaja terapéutica de estos fármacos en las lesiones de bajo riesgo (que suelen evolucionar favorablemente de forma espontánea) es más controvertido.
Asociación de tratamiento endoscópico e inhibidores de la bomba de protones
Al plantearse la existencia de una sinergia entre el tratamiento endoscópico y los IBP es importante tener en cuenta el efecto de confusión que puede existir si no se valora separadamente la influencia de la gravedad de la lesión endoscópica y la del tratamiento endoscópico hemostático; aunque actualmente este último se emplea rutinariamente en los casos de alto riesgo, esto no era así hace relativamente poco tiempo5,69,70. A modo de ejemplo, en el estudio de Villanueva et al53 se realizó el tratamiento endoscópico en las lesiones de alto riesgo (Forrest Ia, Ib y IIa) y no se logró demostrar un beneficio del omeprazol frente a los antagonistas H2, lo que contrasta con los hallazgos descritos por otros autores (en los que no se había realizado un tratamiento endoscópico adyuvante). Así, algún otro estudio ha puesto de manifiesto que la adición del tratamiento farmacológico con IBP a la esclerosis endoscópica no se asocia con beneficio alguno71. Más aún, la ventaja terapéutica de los IBP frente a los antagonistas H2 demostrada en uno de los metaanálisis previamente mencionados se observó fundamentalmente en ausencia de esclerosis endoscópica concomitante, por lo que se ha llegado a sugerir que cuando se realiza tratamiento endoscópico la eficacia de éste es tan alta que deja poco margen de mejora adicional al tratamiento antisecretor49.
Sin embargo, otros autores han evaluado el efecto de los IBP frente a los antagonistas H2 o del placebo en pacientes con hemorragia digestiva por úlcera péptica tras conseguir la hemostasia con el tratamiento endoscópico y han demostrado una disminución significativa en la incidencia de recidiva hemorrágica26,45,46 y en la necesidad de cirugía45,46. De este modo, al efectuar un subanálisis a partir de la revisión sistemática de la Colaboración Cochrane38,39,48, y considerar únicamente los estudios en los que se había aplicado algún tipo de tratamiento endoscópico, se pudo demostrar igualmente una reducción significativa en la tasa de resangrado y de intervenciones quirúrgicas. En este sentido, como se ha mencionado previamente, algunos autores han revisado el registro canadiense de pacientes con hemorragia digestiva alta y han demostrado que el consumo de IBP y el tratamiento endoscópico hemostático se asocian de forma independiente con un mejor pronóstico del episodio hemorrágico64.
Una de las pruebas más sólidas de la eficacia del tratamiento complementario con IBP, tras el tratamiento endoscópico de la hemorragia por úlcera gastroduodenal, es el estudio publicado recientemente por Lau et al45. En él se incluyó a 240 pacientes con hemorragia activa o vaso visible no sangrante que, tras conseguir la hemostasia mediante inyección de adrenalina asociada a termocoagulación, se los aleatorizó a recibir omeprazol (bolo inicial de 80 mg seguido de infusión intravenosa continua de 8 mg/h durante 3 días) o placebo a doble ciego. Se observó una menor incidencia de recidiva hemorrágica en el grupo tratado con omeprazol (el 4,2 frente al 20%), lo que se asoció a una menor necesidad de transfusión y de cirugía, así como a una menor mortalidad (aunque esta última diferencia no alcanzó significación estadística). Por su parte, Sung et al72 aleatorizaron a un grupo de pacientes con hemorragia digestiva por úlcera péptica con estigmas endoscópicos de alto riesgo de recidiva (vaso visible no sangrante o coágulo adherido «protruyente») a recibir omeprazol por vía intravenosa a altas dosis o este mismo tratamiento asociado a hemostasia endoscópica, y demostraron que esta última estrategia se seguía de una menor tasa de recidiva hemorrágica.
En resumen, los datos previamente mencionados indican que los IBP reducen la incidencia de recidiva hemorrágica tanto en los pacientes a los que no se realiza tratamiento endoscópico adyuvante como en los que precisan hemostasia endoscópica por tener una úlcera péptica con alto riesgo de recidiva.
Administración oral frente a intravenosa de los inhibidores de la bomba de protones
En el metaanálisis publicado en la Librería Cochrane previamente mencionado38,39, se realizó un subanálisis en función de la vía de administración de los IBP, y se demostró que el tratamiento oral y no sólo el intravenoso se asociaba también con una reducción significativa en la tasa de resangrado y de intervenciones quirúrgicas, observación que se ha confirmado en otros dos metaanálisis48,73. Por ello, se ha sugerido que en las áreas geográficas donde no esté disponible la presentación intravenosa de los IBP, su administración oral podría representar una alternativa válida38,39. También se ha propuesto que podría ser apropiado el uso oral de los IBP en los pacientes en los que la endoscopia demuestre la presencia de signos endoscópicos de bajo riesgo de recidiva y que, por tanto, no requieran tratamiento endoscópico hemostático38,39. En resumen, la recomendación de administrar IBP por vía intravenosa en todos los casos parece excesiva, pero, puesto que aún no hay estudios publicados en forma completa que comparen directamente ambas vías de administración, no conocemos todavía con precisión cuándo puede ser suficiente el empleo de estos fármacos por vía oral.
Bolos frente a perfusión continua de inhibidores de la bomba de protones
Tras su administración oral o intravenosa, los IBP se unen de forma irreversible a las bombas de protones que están activas en ese momento en las células parietales gástricas. Teniendo en cuenta que estas bombas de protones se activan continuamente y que la vida media plasmática de estos fármacos es corta, teóricamente sería necesario mantener una administración continuada del fármaco para conseguir un aumento marcado y sostenido del pH intragástrico1,8. Así, diversos estudios farmacológicos llevados a cabo en individuos sanos y en pacientes con enfermedad ulcerosa han evidenciado que, en lo que se refiere a la capacidad antisecretora, la infusión continua de IBP es superior a su administración en forma de bolos30,74-76, si bien algún estudio ha indicado que se puede obtener cifras similares de pH intragástrico con ambas pautas de omeprazol28.
Como se ha comentado previamente, si tenemos en cuenta la base racional para el tratamiento farmacológico de la hemorragia digestiva, nuestra meta debe ser conseguir un aumento rápido y mantenido del pH gástrico hasta valores superiores a 6. Diversos estudios han confirmado que el omeprazol pautado en forma de un bolo intravenoso seguido de una infusión continua consigue un pH superior a 6 durante más del 90% del tiempo de administración23,29,31,77-80. Sin embargo, la pauta intravenosa de bolos repetidos de omeprazol ocasiona un aumento variable y oscilante del pH que difícilmente alcanza valores superiores a 4 durante 24 h79,81-86.
Además, la administración de IBP en forma de bolos pautados se ha asociado con marcadas variaciones individuales en la respuesta del pH intragástrico81,83,87,88. Por el contrario, la perfusión continua parece compensar la variación interindividual en la masa de células parietales y la oscilación circadiana de estas células por el efecto de la acetilcolina, lo que permite asegurar, prácticamente en todos los individuos, un pH superior a 4 en cerca del 90% del día2,8. En un estudio dosis-respuesta que comparaba diversos regímenes de omeprazol intravenoso, se observó que la mejor pauta, entre las ensayadas, para reducir la secreción ácida gástrica era la que incluía un bolo inicial de 80 mg seguido de una perfusión continua a 8 mg/h, con la que se logró aumentar el pH gástrico a más de 6 en 20 min y mantenerlo así durante más del 80% del día24. Otros autores han demostrado que la administración de un bolo de omeprazol o pantoprazol seguido de su infusión continua es más eficaz que la prescripción de estos fármacos en bolos repetidos para mantener el pH gástrico por encima de 6 más allá de las primeras 12 h79,89. En consonancia con lo anterior, un metaanálisis que comparaba IBP con antagonistas H2 para el tratamiento de la hemorragia digestiva demostró, en uno de sus subanálisis, que cuando ambos fármacos se prescribían en forma de bolos seguía observándose una cierta ventaja de los primeros fármacos frente a los segundos en cuanto a la prevención de la recidiva hemorrágica, aunque esta diferencia ya no alcanzaba significación estadística49.
Por otra parte, sin embargo, algún ensayo clínico aleatorizado ha comparado directamente la administración de IBP mediante perfusión continua y en forma de bolos y ha constatado resultados comparables con ambas estrategias90, aunque es preciso destacar que en este estudio el 25% de los pacientes incluidos tenía estigmas endoscópicos de bajo riesgo (lo que podría dificultar la demostración de diferencias estadísticamente significativas). En este sentido, un reciente metaanálisis ha demostrado que el efecto beneficioso sobre el resangrado, la necesidad de cirugía o la mortalidad era semejante independientemente de la forma de administración (perfusión continua o bolos)91.
Estos resultados contradictorios probablemente indican que la administración de IBP en perfusión continua no es siempre necesaria. Más bien, esta forma de administración podría reservarse para los casos en que fuera crítico conseguir un efecto antisecretor potente, como en los pacientes de alto riesgo de resangrado; éste sería el caso, por ejemplo, de los pacientes con hemorragia activa o un vaso visible no sangrante visualizado durante la gastroscopia, o con una puntuación elevada en el sistema de clasificación predictivo que se haya empleado (p. ej., el de Rockall65,66). De este modo, la pauta de perfusión continua de IBP se utilizaría en tan sólo aproximadamente un tercio de los pacientes con hemorragia digestiva por úlcera péptica.
En resumen, aunque múltiples estudios farmacológicos han demostrado una mayor potencia antisecretora con la infusión continua de IBP en comparación con su administración en forma de bolos, el beneficio clínico en cuanto a la prevención de la recidiva hemorrágica de la primera pauta con respecto a la segunda no se ha establecido claramente. Por el momento, una opción razonable consistiría en reservar la administración en perfusión continua para los pacientes con alto riesgo de resangrado.
Dosis recomendada de inhibidores de la bomba de protones
Como se ha comentado previamente, la pauta de IBP más eficaz para reducir la secreción ácida gástrica consiste en un bolo inicial de 80 mg de omeprazol seguido de una perfusión continua a 8 mg/h24. Sin embargo, no está bien establecido que el empleo de estas dosis tan elevadas suponga un beneficio desde el punto de vista clínico. Así, por ejemplo, en el metaanálisis de la Colaboración Cochrane38,39 se demostró que tanto las dosis elevadas referidas como otras más bajas se asociaban con una reducción de la recidiva hemorrágica, si bien el beneficio en la necesidad de cirugía sólo se observó con las dosis más altas de IBP. Por tanto, se podría concluir que, aunque la ventaja de emplear dosis altas de IBP típicamente en perfusión continua a 8 mg/h tras un bolo inicial de 80 mg no está definitivamente aclarada, la evidencia proveniente de los estudios farmacodinámicos y el posible beneficio en alguna de las variables evolutivas (como la necesidad de cirugía) constituyen argumentos a favor de su empleo, al menos en los pacientes con un mayor riesgo de recidiva hemorrágica.
Duración del tratamiento con infusión continua de inhibidores de la bomba de protones
Puesto que la mayoría entre el 80 y el 97% de las recidivas hemorrágicas tienen lugar durante los primeros 3 días tras el episodio de hemorragia inicial45,92, y que pasadas las primeras 96 h el riesgcasos en que la lesión causante de la hemorragia sea de alto riesgo, la perfusión continua de IBP durante 3 días.
Efecto de la etnia en la eficacia antisecretora de los inhibidores de la bomba de protones
La realización de subanálisis en función del origen étnico de los pacientes ha permitido demostrar que los estudios llevados a cabo en países asiáticos evidencian un mayor beneficio de los IBP que los realizados en Europa, e incluso se ha llegado a observar una reducción de la mortalidad en los primeros, a diferencia de los segundos38,39,94. Esta observación se ha pretendido explicar por la menor masa de células parietales gástricas de los pacientes asiáticos95, lo que permitiría una inhibición ácida (con los IBP) más profunda que la observada en los europeos32,95-97. Por otra parte, la prevalencia de infección por Helicobacter pylori es más elevada en Asia que en Europa y, como se sabe, los IBP inducen un mayor efecto antisecretor en presencia de este microorganismo98,99. Por último, ciertos polimorfismos del citocromo P450 que caracterizan a los metabolizadores lentos de los IBP se han descrito con más frecuencia entre la población asiática100.
Experiencia con otros inhibidores de la bomba de protones, diferentes de omeprazol, administrados por vía intravenosa
Hasta hace relativamente poco tiempo, el único IBP disponible para su administración por vía intravenosa era el omeprazol, pero más recientemente se han publicado diversos estudios que confirman la potencia antisecretora y los buenos resultados con otros IBP administrados por esta vía, como lansoprazol86,101,102, pantoprazol79,103-110 o esomeprazol111,112. A modo de ejemplo, y en pacientes con hemorragia digestiva en concreto, algunos autores han empleado pantoprazol con una pauta de administración en perfusión continua similar a la evaluada previamente con el omeprazol107. Por su parte, Hsu et al110 incluyeron en su estudio a pacientes con hemorragia digestiva (y hemorragia activa o signos endoscópicos de alto riesgo) y, tras lograr la hemostasia endoscópica, administraron aleatoriamente pantoprazol o ranitidina y demostraron una mayor reducción de la tasa de recidiva hemorrágica con el primero.
Coste-beneficio de la administración de inhibidores de la bomba de protones en la hemorragia digestiva
Diversos estudios han demostrado que la administración de IBP por vía intravenosa y a dosis elevadas es una estrategia coste-efectiva para reducir la recurrencia de hemorragia y la necesidad de cirugía en pacientes con hemorragia digestiva por úlcera péptica, tras haber obtenido la hemostasia inicialmente por métodos endoscópicos113-116. En otro estudio en el que se comparó diversas estrategias terapéuticas en la hemorragia digestiva se demostró, a partir de un modelo de análisis de decisión, que la administración de tratamiento intravenoso con IBP (tras conseguir la hemostasia con métodos endoscópicos) era una estrategia coste-efectiva, a condición de que la tasa de recidiva hemorrágica con estos fármacos fuera menor del 9% y el coste del tratamiento no sobrepasara los 10 dólares al día117.
Por último, diversos estudios han evaluado la relación coste-beneficio de administrar sistemáticamente IBP (por vía intravenosa) ante un episodio de hemorragia digestiva, antes incluso de realizar una gastroscopia y confirmar con ella que la causa de la hemorragia es una úlcera péptica118. Es ésta una práctica frecuente entre los médicos que atienden las urgencias hospitalarias, entre otros motivos porque la exploración endoscópica no está siempre disponible en el momento inmediato, por lo que en no pocos casos debe diferirse unas cuantas horas119,120. Parecería que, al menos teóricamente, esta actitud no estaría claramente justificada, ya que la úlcera péptica es la causa aproximadamente de sólo el 50% de los episodios de hemorragia digestiva y, de éstos, sólo un tercio tendrá estigmas endoscópicos de alto riesgo3. Por tanto, a priori, menos de la mitad de los pacientes que experimentan una hemorragia digestiva se beneficiarían del tratamiento intravenoso con IBP. A pesar de ello, diversos estudios han demostrado que esta estrategia de prescripción temprana de IBP es coste-eficaz118,121, lo que apoya la recomendación de administrar empíricamente estos fármacos por vía intravenosa a todo paciente con hemorragia digestiva, especialmente cuando la gastroscopia no pueda realizarse tempranamente o el paciente sea de alto riesgo (por la edad, la comorbilidad o la cantidad de la hemorragia)3,5,8,122,123. Más adelante, una vez practicada la exploración endoscópica, y en función de sus hallazgos, se decidirá si debe mantenerse la vía intravenosa, se puede emplear ya la vía oral o si incluso es adecuado suspender los IBP por no estar indicados. En este sentido, es importante recalcar que el mantenimiento de los IBP, cuando tras la realización de la gastroscopia se demuestra que no están claramente indicados, es una de las causas fundamentales del uso inapropiado de estos fármacos, por lo que debe evitarse119,120.
Somatostatina y octreótido
La somatostatina se ha utilizado en el tratamiento de la hemorragia digestiva por úlcera péptica por sus potenciales efectos beneficiosos desde el punto de vista fisiopatológico. Así, la somatostatina es un péptido endógeno con acción antisecretora y vasoconstrictora de la circulación esplácnica, es capaz de inhibir la secreción ácida y la motilidad gástrica, y tiene un efecto citoprotector124-128. El octreótido, un análogo sintético de larga duración de la somatostatina, posee un perfil terapéutico similar129-132. Algunos estudios publicados hace ya unos años han demostrado un efecto beneficioso de la somatostatina, ya sea por conseguir el control de la hemorragia133-139 o por reducir la necesidad de cirugía136,140 y transfusión134,137,139. No obstante, la mayoría de ellos se caracterizan por incluir un número reducido de pacientes y por presentar importantes limitaciones metodológicas, lo que dificulta la obtención de conclusiones válidas. Otros estudios, con un número adecuado de pacientes o publicados más recientemente, no han mostrado diferencias entre la somatostatina y el placebo o los antagonistas H2141-143. En este sentido, Somerville et al141 publicaron en 1985 el estudio que ha incluido un mayor número de pacientes evaluables, de los que se trató a 265 con somatostatina y 269 recibieron placebo. Los autores no pudieron demostrar diferencias significativas en la incidencia de recidiva hemorrágica entre ambos grupos (el 23 frente al 30%).
En el año 1997 se publicó un metaanálisis de los 14 estudios controlados y aleatorizados133-146, que incluían un total de 1.829 pacientes, que comparaban la somatostatina o el octreótido, por una parte, con el placebo o los antagonistas H2, por otra, en el tratamiento de la hemorragia digestiva por úlcera péptica gastroduodenal147. Este metaanálisis demostró un efecto beneficioso de la somatostatina, pues ésta disminuyó la persistencia o recurrencia de la hemorragia, con un riesgo relativo de 0,53 (IC del 95%, 0,43-0,63) en comparación con el tratamiento de control. Por otra parte, el análisis de subgrupos puso de manifiesto que la eficacia de la somatostatina quedaba limitada a la hemorragia debida a úlcera péptica (en cuyo caso el riesgo relativo era de 0,48, con un IC del 95%, 0,39-0,59)147. Es preciso destacar, no obstante, que los resultados del mencionado metaanálisis fueron heterogéneos y que la calidad metodológica de muchos de los estudios incluidos fue deficiente. A modo de ejemplo, la duración de la infusión de somatostatina osciló entre las 48 y las 120 h, según los diferentes protocolos. Por otra parte, al realizar un subanálisis en función de la calidad metodológica, se observó que, cuando únicamente se incluían los estudios con un diseño doble ciego, la eficacia de la somatostatina para prevenir la recidiva hemorrágica era menor (aunque todavía era estadísticamente significativa) y el efecto en la necesidad de cirugía no era ya demostrable. Finalmente, algunos estudios publicados muy recientemente, después de que el mencionado metaanálisis viera la luz, no han sido capaces de demostrar beneficio alguno del octreótido como tratamiento adyuvante tras la obtención de la hemostasia por métodos endoscópicos en pacientes con hemorragia activa o con estigmas de alto riesgo de recidiva hemorrágica148. En otro estudio se concluyó que la somatostatina era más efectiva que la ranitidina para controlar el episodio de hemorragia en los pacientes con hemorragia activa, pero no se asociaba con efectos beneficiosos en aquellos con lesiones clasificadas como Forrest II149.
En resumen, la utilidad de la somatostatina en el tratamiento de la hemorragia por úlcera péptica gastroduodenal es controvertido150, por lo que antes de poder recomendar su utilización de forma sistemática deberíamos disponer de más estudios controlados y aleatorizados que incluyan un número suficiente de pacientes y nos permitan obtener conclusiones válidas.
Agentes antifibrinolíticos
El ácido tranexámico es un inhibidor del plasminógeno, y se ha descrito la presencia de activadores del plasminógeno en la mucosa gástrica y duodenal151. Por otra parte, el ácido tranexámico tiene la capacidad de inhibir la acción fibrinolítica de la pepsina152. Un metaanálisis153 publicado hace ya más de 15 años evaluó seis estudios aleatorizados en los que el ácido tranexámico se comparaba a placebo en el tratamiento de la hemorragia digestiva alta154-159. La mayoría de los pacientes incluidos en este metaanálisis tenía una úlcera gástrica o duodenal como causa de la hemorragia. Este tratamiento se asoció con un 20-30% de reducción en la tasa de recidiva hemorrágica, un 30-40% de disminución en la necesidad de cirugía y un 40% de reducción en la mortalidad153. No obstante, los estudios incluidos en el mencionado metaanálisis fueron bastante heterogéneos, lo que limita considerablemente sus conclusiones. Por ejemplo, el ácido tranexámico se administró, dependiendo de cada estudio, a una dosis que oscilaba entre 3 y 6 g/día por vía intravenosa durante 2-3 días, seguido de su prescripción por vía oral durante 3-5 días más153. Además, es posible que los resultados de este metaanálisis estén sesgados (a favor del ácido tranexámico) por la inclusión de un estudio con un elevado número de pacientes en el que la mortalidad en el grupo control fue sorprendentemente alta, lo que plantea la posibilidad de que las diferencias encontradas pudieran deberse meramente al azar158. En este último estudio, el empleo de ácido tranexámico se asoció con una disminución en la mortalidad del 50%, pero, curiosamente, no se demostró una reducción paralela en la tasa de recidiva hemorrágica ni en la necesidad de tratamiento quirúrgico158.
Un inconveniente del ácido tranexámico es su ausencia de efecto en la cicatrización ulcerosa, de modo que requeriría la administración concomitante de un fármaco antisecretor con este fin. Por otra parte, su perfil de seguridad no está bien establecido, y se ha indicado que podría facilitar la aparición de fenómenos tromboembólicos (en pacientes con hemorragia subaracnoidea se ha asociado a la aparición de infarto cerebral160).
En resumen, es evidente que se precisan más estudios y que se diseñen mejor antes de poder recomendar el empleo del ácido tranexámico como tratamiento sistemático de la hemorragia digestiva por úlcera péptica.
Resumen y recomendaciones prácticas
El empleo de fármacos antisecretores se basa en su capacidad de aumentar el pH intragástrico para optimizar los mecanismos hemostáticos en la lesión ulcerosa. Los antagonistas H2 no parecen ser suficientemente eficaces en el control de la acidez intragástrica y, por tanto, en el tratamiento de la hemorragia digestiva secundaria a úlcera péptica. Sin embargo, la capacidad alcalinizante de los IBP es considerablemente superior a la de los antagonistas H2, lo que establece la base racional para que estos fármacos sí puedan ser eficaces en el tratamiento de la hemorragia digestiva. Así, diversos metaanálisis han confirmado la superioridad de los IBP frente al placebo y a los antagonistas H2 en cuanto a la reducción de la recidiva hemorrágica y la necesidad de tratamiento quirúrgico. Aunque los IBP no han demostrado, en general, una reducción de la mortalidad en los pacientes con hemorragia digestiva, esto puede deberse al reducido tamaño muestral de los estudios realizados o a que la mortalidad dependa fundamentalmente de la edad y de la comorbilidad del paciente.
Los pacientes con úlceras clasificadas endoscópicamente como de alto riesgo de resangrado son los que con más probabilidad se beneficiarán del tratamiento con IBP, mientras que la ventaja terapéutica de estos fármacos en las lesiones de bajo riesgo no está tan clara. Los IBP parecen ser eficaces para reducir la recidiva hemorrágica no sólo en los pacientes a los que no se realiza tratamiento endoscópico, sino también en los que precisan hemostasia endoscópica. La administración de IBP por vía intravenosa en todos los pacientes con hemorragia digestiva parece excesiva y es probable que en algunos casos sea suficiente el empleo de estos fármacos por vía oral. En caso de que se decida emplear la vía intravenosa, podría reservarse la administración en perfusión continua para los pacientes con alto riesgo de resangrado, ya que esta estrategia ha demostrado una mayor potencia antisecretora en estudios farmacológicos, si bien su beneficio clínico no está claramente establecido. La pauta de IBP más eficaz para reducir la secreción ácida gástrica consiste en un bolo inicial de 80 mg de omeprazol (o equivalente de otro IBP) seguido de una perfusión continua a 8 mg/h, aunque, una vez más, no está definitivamente aclarada la ventaja terapéutica de este régimen, que podría reservarse para pacientes con un mayor riesgo de recidiva hemorrágica. Puesto que la mayoría de las recidivas hemorrágicas tienen lugar durante los primeros 3 días tras el episodio de sangrado inicial, parece lógico mantener, en los casos en que la lesión causante de la hemorragia sea de alto riesgo, la perfusión continua de IBP durante este período. Otros IBP diferentes de omeprazol, como lansoprazol, pantoprazol o esomeprazol, se han empleado también por vía intravenosa y han demostrado una potencia antisecretora similar.
La administración de IBP (por vía intravenosa y a dosis elevadas) es una estrategia coste-efectiva para reducir la recurrencia de hemorragia y la necesidad de cirugía en pacientes con hemorragia digestiva por úlcera péptica, tras haber obtenido la hemostasia inicialmente por métodos endoscópicos. La administración empírica de IBP (por vía intravenosa) ante un episodio de hemorragia digestiva, antes incluso de realizar una gastroscopia y confirmar que la causa de la hemorragia es una úlcera péptica, es también una estrategia coste-efectiva, lo que apoya la prescripción sistemática de IBP en todo paciente con hemorragia digestiva, especialmente cuando la gastroscopia no pueda realizarse precozmente o el paciente sea de alto riesgo.
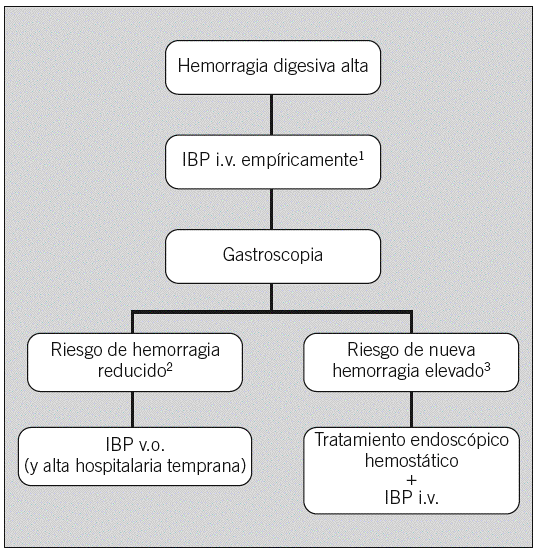
En la figura 2 se resume la estrategia de tratamiento farmacológico ante una hemorragia digestiva. Tras la prescripción empírica de IBP se debería realizar una gastroscopia lo antes posible, para así poder establecer con precisión el origen de la hemorragia y el riesgo de recidiva hemorrágica. Si en la endoscopia se identifica una úlcera péptica y se establece que el riesgo de resangrado es muy bajo, tanto por criterios endoscópicos (al tener estigmas de bajo riesgo, como un fondo ulceroso con fibrina o con coágulo negro «embebido») como clínicos (según el método de puntuación predictivo empleado), podría ser suficiente la administración oral de IBP y el alta hospitalaria temprana o incluso inmediata. Puesto que los estudios que han empleado IBP orales han utilizado estos fármacos a dosis más elevadas que las habitualmente prescritas en la enfermedad ulcerosa no complicada, se recomienda que en caso de emplear la vía oral se prescriban los IBP a dosis doble. Por otra parte, en el subgrupo de pacientes con elevado riesgo de resangrado (úlcera con hemorragia activa, vaso visible no sangrante o coágulo adherido «protruyente»), tras el tratamiento endoscópico hemostático parece adecuado administrar IBP por vía intravenosa, inicialmente en bolo (80 mg de omeprazol o equivalente de otro IBP) y posteriormente en perfusión continua (8 mg/h) durante 3 días aproximadamente.
Fig. 2. Estrategia de tratamiento farmacológico ante una hemorragia digestiva no varicosa. IBP: inhibidores de la bomba de protones.