Muchos de los que estuvimos en la “primera línea” contra la COVID-19 experimentamos una gran frustración al ver muchos pacientes fallecer sin poderles ofrecer un tratamiento de eficacia demostrada. Posiblemente, este sentimiento explique en gran parte la “segunda pandemia” que hemos vivido, la exponencial irrupción de intervenciones aplicadas como “uso compasivo”. El tocilizumab, un anticuerpo monoclonal capaz de bloquear el efecto de la interleucina (IL) 6 al unirse a sus receptores solubles y de membrana, fue una de las intervenciones “de uso compasivo” más extendidas en España y el resto del mundo. El fundamento para su prescripción es que los niveles elevados de IL6 se correlacionan con la gravedad de la enfermedad1,2; por ende su bloqueo podría ser un eficaz tratamiento para la COVID-193–5. Adicionalmente, dado que su semivida (según su ficha técnica) es de 7-10 días, a pesar de darse precozmente podría tener efecto durante la fase evolucionada de la enfermedad.
Uno de los primeros estudios de tocilizumab en la COVID-19 fue publicado por Xu et al.6 e incluyó 21 pacientes. Los resultados reportados tras la administración del fármaco fueron impresionantes: descenso en la concentración de proteína C reactiva, de la temperatura y de los requerimientos de oxígeno, incremento en la saturación de oxígeno, desaparición de las lesiones tomográficas pulmonares en el 90% de los pacientes y sobrevida del 100%. Posteriormente, series de casos7, estudios observacionales8,9 y hasta algunos metaanálisis10,11 parecieron ratificar los buenos resultados. Adicionalmente, la positiva percepción de muchos clínicos y pacientes expresada en webinares y grupos de WhatsApp incrementó exponencialmente la confianza en esta intervención. Sin embargo, el 17 de junio del 2020 aparece la primera alerta en una nota de prensa; un EAC italiano reporta que el tocilizumab administrado precozmente es incapaz de evitar la agravación clínica de la enfermedad12. El 29 de junio sucede lo no deseado, otro comunicado de prensa afirma que el primer EAC mundial, fase III, con más de 400 pacientes, no encuentra diferencias significativas entre la intervención y el placebo en términos de curación y mortalidad13. Posteriormente, tres EAC reportaron efectos neutros de la intevención14-16. Sin embargo, a principios de 2021 otros dos EAC (REMAP-CAP y RECOVERY) han demostrado resultados muy positivos con la mencionada intervención17,18.
La vertiginosa historia del tocilizumab en pacientes con la COVID-19, cuyo final no está próximo y es difícil de imaginar al momento de escribir estar revisión narrativa, nos lleva a plantearnos tres preguntas: 1) si el tocilizumab en teoría puede modular eficazmente la respuesta inmune, ¿por qué algunos EAC han tenido resultados negativos?; 2) ¿cómo se explica que múltiples estudios observacionales demuestren resultados positivos y algunos EAC no? y 3) dado los disímiles resultados reportados por los EAC, qué deberemos hacer?
Modulación eficaz de la respuesta inmuneSi el tocilizumab en teoría puede modular eficazmente la respuesta inmune, ¿por qué algunos EAC han tenido resultados negativos?La fisiopatología de las infecciones graves es compleja y en ella intervienen redes de interacciones que muchas veces son resistentes a una única intervención ultraespecífica. El bloqueo específico de un único mediador o receptor podría no ser suficiente en enfermedades complejas como la COVID-19 dado que los seres vivos, para poder resistir los cambios ambientales a los cuales están continuamente expuestos, tienen vías fisiopatológicas redundantes y altamente interconectadas. Por ejemplo, entre las propiedades generales de las citoquinas se encuentran: pleiotropía (múltiples efectos al actuar sobre diferentes células), redundancia (varias citoquinas pueden ejercer el mismo efecto), sinergia (dos o más citoquinas producen un efecto que se potencia mutuamente) y antagonismo (inhibición o bloqueo mutuo de sus efectos). Estas características pueden explicar por qué el bloqueo de una vía o estructura específica, raramente es capaz de desestructurar toda la red (existen vías capaces de compensar o sustituir la pérdida de una vía)19. En otras enfermedades críticas, como la sepsis, ya se ha intentado bloquear determinadas moléculas o estructura y los resultados han sido desalentadores20-23.
Diana terapéutica. Para que un medicamento tenga efecto, el paciente debe tener la diana terapéutica. Recientemente se demostró que el término “tormenta de citoquinas” es inexacto dado que las concentraciones en sangre de IL6, IL8 y TNFα en pacientes con síndrome de distrés respiratorio agudo (SDRA) asociado al SARS-CoV-2 es menor o igual que en SDRA de otras etiologías, en sepsis sin SDRA, en trauma o en paradas cardiaca extrahospitalarias24. Más aún, Han et al.25 compararon 102 pacientes con la COVID-19 con 45 controles sanos. Si bien reportaron que la concentración de IL6 entre ambos grupos es diferente, los intervalos de confianza de cada grupo se superponen lo cual permite concluir que hay una proporción de pacientes con COVID-19 que no tienen la diana del tratamiento (se asume que la concentración normal de una variable no es una diana terapéutica). Llamativamente, ninguno de los EAC analizados previamente han requerido tener niveles de IL6 elevados antes de prescribir el medicamento12–16. Es más, en España algunas veces se utiliza la concentración en sangre de IL6 para prescribir tocilizumab. Sin embargo, un reciente sub-estudio del EAC COVACTA demostró que la IL6 no predice la respuesta a tocilizumab; por ende, no debería ser considerada al momento de decir si prescribir o no el mencionado bloqueador26. Finalmente, en tres EAC12,14,15 se subrogó la inflamación mediante algunos marcadores (tabla 1); sin embargo, no es clara la relación entre estado inflamatorio, las variables requeridas para su definición y la respuesta al tocilizumab.
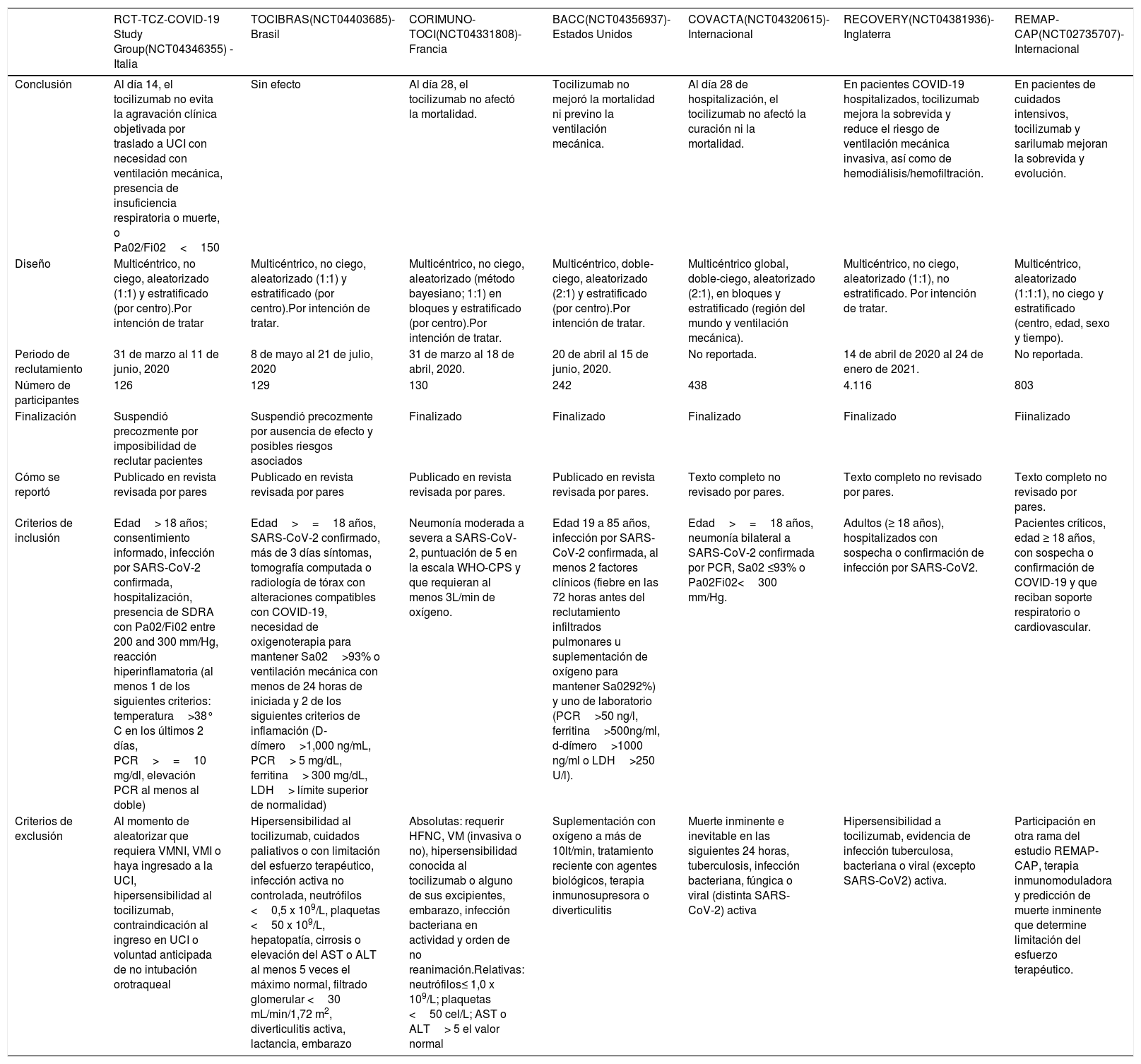
Estudios aleatorizados y controlados que compararon tocilizumab frente a placebo
| RCT-TCZ-COVID-19 Study Group(NCT04346355) - Italia | TOCIBRAS(NCT04403685)- Brasil | CORIMUNO-TOCI(NCT04331808)- Francia | BACC(NCT04356937)- Estados Unidos | COVACTA(NCT04320615)- Internacional | RECOVERY(NCT04381936)- Inglaterra | REMAP-CAP(NCT02735707)- Internacional | |
|---|---|---|---|---|---|---|---|
| Conclusión | Al día 14, el tocilizumab no evita la agravación clínica objetivada por traslado a UCI con necesidad con ventilación mecánica, presencia de insuficiencia respiratoria o muerte, o Pa02/Fi02<150 | Sin efecto | Al día 28, el tocilizumab no afectó la mortalidad. | Tocilizumab no mejoró la mortalidad ni previno la ventilación mecánica. | Al día 28 de hospitalización, el tocilizumab no afectó la curación ni la mortalidad. | En pacientes COVID-19 hospitalizados, tocilizumab mejora la sobrevida y reduce el riesgo de ventilación mecánica invasiva, así como de hemodiálisis/hemofiltración. | En pacientes de cuidados intensivos, tocilizumab y sarilumab mejoran la sobrevida y evolución. |
| Diseño | Multicéntrico, no ciego, aleatorizado (1:1) y estratificado (por centro).Por intención de tratar | Multicéntrico, no ciego, aleatorizado (1:1) y estratificado (por centro).Por intención de tratar. | Multicéntrico, no ciego, aleatorizado (método bayesiano; 1:1) en bloques y estratificado (por centro).Por intención de tratar. | Multicéntrico, doble-ciego, aleatorizado (2:1) y estratificado (por centro).Por intención de tratar. | Multicéntrico global, doble-ciego, aleatorizado (2:1), en bloques y estratificado (región del mundo y ventilación mecánica). | Multicéntrico, no ciego, aleatorizado (1:1), no estratificado. Por intención de tratar. | Multicéntrico, aleatorizado (1:1:1), no ciego y estratificado (centro, edad, sexo y tiempo). |
| Periodo de reclutamiento | 31 de marzo al 11 de junio, 2020 | 8 de mayo al 21 de julio, 2020 | 31 de marzo al 18 de abril, 2020. | 20 de abril al 15 de junio, 2020. | No reportada. | 14 de abril de 2020 al 24 de enero de 2021. | No reportada. |
| Número de participantes | 126 | 129 | 130 | 242 | 438 | 4.116 | 803 |
| Finalización | Suspendió precozmente por imposibilidad de reclutar pacientes | Suspendió precozmente por ausencia de efecto y posibles riesgos asociados | Finalizado | Finalizado | Finalizado | Finalizado | Fiinalizado |
| Cómo se reportó | Publicado en revista revisada por pares | Publicado en revista revisada por pares | Publicado en revista revisada por pares. | Publicado en revista revisada por pares. | Texto completo no revisado por pares. | Texto completo no revisado por pares. | Texto completo no revisado por pares. |
| Criterios de inclusión | Edad> 18 años; consentimiento informado, infección por SARS-CoV-2 confirmada, hospitalización, presencia de SDRA con Pa02/Fi02 entre 200 and 300 mm/Hg, reacción hiperinflamatoria (al menos 1 de los siguientes criterios: temperatura>38° C en los últimos 2 días, PCR>=10 mg/dl, elevación PCR al menos al doble) | Edad>=18 años, SARS-CoV-2 confirmado, más de 3 días síntomas, tomografía computada o radiología de tórax con alteraciones compatibles con COVID-19, necesidad de oxigenoterapia para mantener Sa02>93% o ventilación mecánica con menos de 24 horas de iniciada y 2 de los siguientes criterios de inflamación (D-dímero>1,000 ng/mL, PCR> 5 mg/dL, ferritina> 300 mg/dL, LDH> límite superior de normalidad) | Neumonía moderada a severa a SARS-CoV-2, puntuación de 5 en la escala WHO-CPS y que requieran al menos 3L/min de oxígeno. | Edad 19 a 85 años, infección por SARS-CoV-2 confirmada, al menos 2 factores clínicos (fiebre en las 72 horas antes del reclutamiento infiltrados pulmonares u suplementación de oxígeno para mantener Sa0292%) y uno de laboratorio (PCR>50 ng/l, ferritina>500ng/ml, d-dímero>1000 ng/ml o LDH>250 U/l). | Edad>=18 años, neumonía bilateral a SARS-CoV-2 confirmada por PCR, Sa02 ≤93% o Pa02Fi02<300 mm/Hg. | Adultos (≥ 18 años), hospitalizados con sospecha o confirmación de infección por SARS-CoV2. | Pacientes críticos, edad ≥ 18 años, con sospecha o confirmación de COVID-19 y que reciban soporte respiratorio o cardiovascular. |
| Criterios de exclusión | Al momento de aleatorizar que requiera VMNI, VMI o haya ingresado a la UCI, hipersensibilidad al tocilizumab, contraindicación al ingreso en UCI o voluntad anticipada de no intubación orotraqueal | Hipersensibilidad al tocilizumab, cuidados paliativos o con limitación del esfuerzo terapéutico, infección activa no controlada, neutrófilos <0,5 x 109/L, plaquetas <50 x 109/L, hepatopatía, cirrosis o elevación del AST o ALT al menos 5 veces el máximo normal, filtrado glomerular <30 mL/min/1,72 m2, diverticulitis activa, lactancia, embarazo | Absolutas: requerir HFNC, VM (invasiva o no), hipersensibilidad conocida al tocilizumab o alguno de sus excipientes, embarazo, infección bacteriana en actividad y orden de no reanimación.Relativas: neutrófilos≤ 1,0 x 109/L; plaquetas <50 cel/L; AST o ALT> 5 el valor normal | Suplementación con oxígeno a más de 10lt/min, tratamiento reciente con agentes biológicos, terapia inmunosupresora o diverticulitis | Muerte inminente e inevitable en las siguientes 24 horas, tuberculosis, infección bacteriana, fúngica o viral (distinta SARS-CoV-2) activa | Hipersensibilidad a tocilizumab, evidencia de infección tuberculosa, bacteriana o viral (excepto SARS-CoV2) activa. | Participación en otra rama del estudio REMAP-CAP, terapia inmunomoduladora y predicción de muerte inminente que determine limitación del esfuerzo terapéutico. |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BACC: Boston Area COVID-19 Consortium (BACC) Bay tocilizumab Trial; CORIMUNO-TOCI: Cohort Multiple Randomized Controlled Trials Open-label of Immune Modulatory Drugs and Other Treatments in COVID-19 Patients –tocilizumab Trial–; COVACTA: a study to evaluate the safety and efficacy of tocilizumab in patients with severe COVID-19 pneumonia; LDH: lactato deshidrogenasa; NCT: number clinical trial; Pa02/Fi02: relación entre presión parcial de oxígeno y fracción inspiratoria de oxígeno; PCR: proteína C reactiva; Sa02: saturación arterial de oxígeno; TOCIBRAS: Safety and efficacy of tocilizumab in moderate to severe COVID-19 with inflammatory markers; UCI: Unidad de Cuidados Intensivos.
Momento de la intervención. La administración de tocilizumab es una intervención pretendidamente inmumoduladora, es decir que influiría en la respuesta del huésped, pero no necesariamente en la actividad viral. Teóricamente, los pacientes deberían tener una respuesta inflamatoria suficientemente intensa para que su pronóstico esté influido por ella; pero no haber traspasado el punto “de no retorno” en el cual el episodio adverso (ej. muerte) es inevitable. Estas dos características son las que cumplían los pacientes del EAC REMAP-CAP (xx% de ventilación mecánica invasiva o no, media XX días desde inicio síntomas y media 2 días desde hospitalización) y del RECOVERY (54% de ventilación mecánica invasiva o no, media 9 días desde inicio síntomas y media 2 días desde hospitalización), en los cuales se demostró que tocilizumab se asoció a mejoría en el pronóstico31,32. Los pacientes con clínica muy leve o muy breve tiempo de evolución podrían no beneficiarse de esta intervención, pues su pronóstico podría estar influido principalmente por la acción viral. A día de hoy, el momento ideal para aplicar esta intervención se desconoce.
Dosis de la intervención. La dosis actualmente recomendada es de 8mg/kg de peso corporal administrada de forma intravenosa durante una hora. Sin embargo, esta dosis es una extrapolación de la dosis recomendada para pacientes con artritis reumatoide27. En paciente COVID-19, especialmente en los más graves, que presentan shock séptico, existen sustanciales cambios farmacodinámicos y farmacocinéticos que podrían modificar la posología recomendada.
Expectativas mayores que las reales. A pesar de que algunos EAC no demuestran efecto en la mortalidad o tasa de curación, sí reportan efectos beneficioso de tocilizumab en otros eventos más “débiles”. Por ejemplo, el COVACTA demostró efectos positivos en algunos episodios secundarios como días de hospitalización o de estancia en la unidad de cuidados intensivos13. Es importante resaltar que estos últimos dos episodios son subjetivos pues dependen de la decisión del médico que trata al paciente. Si bien el estudio fue doble-ciego, es relativamente sencillo reconocer clínicamente a los pacientes que reciben tocilizumab; lo que podría ocasionar un sesgo de seguimiento. También es importante resaltar que este efecto exclusivamente sobre sucesos relativamente “blandos” es lo que se observa en intervenciones ampliamente aceptadas y de uso rutinario como el oseltamivir para la neumonía por influenza o los esteroides para el shock séptico28–30.
Tamaño muestral. Una de las características obligatorias de los EAC es calcular el tamaño muestral a priori en base al error tipo I, tipo II y a la magnitud del efecto que se desea detectar. La razón de esta obligatoriedad es la optimización de los recursos y la protección de los pacientes, dado que tamaños muestrales muy pequeños podrían ser insuficientes para extraer conclusiones válidas y tamaños excesivos podrían exponer a pacientes innecesariamente al riesgo de recibir una intervención experimental. En 2 de los 7 EAC reportados12,14, el reclutamiento de pacientes se detuvo antes de llegar al tamaño muestral deseado.
Grupos no intercambiables. Una de las principales características de los EAC es la aleatorización del tratamiento y el cuidado exquisito que debe tenerse al realizarla (ocultación de la secuencia de aleatorización y estratificación, por ejemplo), ya que tiene el valioso objetivo de generar grupos que solo difieren entre sí en la intervención, posibilitando la comparación directa. La aleatorización busca distribuir, de manera equitativa entre los diferentes grupos, tanto las variables que medimos (ej. edad, comorbilidades, etc.) como las que no medimos (ej. polimorfismos genético, concentraciones de citoquinas, etc.); sin embargo, en ocasiones hay dificultades. Por ejemplo, en el estudio CORIMUNO-TOCI16 los grupos se diferenciaron en la proporción de pacientes que recibieron antivirales, tratamientos coadyuvantes (esteroides e inmunomoduladores), en la presencia de daño renal crónico y en algunas variables analíticas basales (ej. proteína C reactiva, dímero-d, etc.). En el estudio COVACTA13, los grupos se diferenciaron en la raza y los tratamientos coadyuvantes (corticoides, antivirales y plasma de convaleciente). El efecto de estas diferencias en el resultado final de los EAC es desconocido; sin embargo, es indiscutible que constituyen un sesgo y sugieren la posible existencia de diferencias en variables no observadas.
Al margen de las particularidades o carencias del diseño citadas, existe también la posibilidad de que a pesar de que exista una buena teoría fisiopatológica para apoyar la intervención y una intensa percepción de la utilidad de la misma, la intervención simplemente no funcione en algunas condiciones por razones que pueden no llegar nunca a conocerse. No debería llamar la atención esto porque, en realidad, es el núcleo de la justificación para hacer un ensayo clínico: creemos que la nueva intervención puede funcionar (¡por eso es ético hacerlo!) pero no tenemos la certeza (¡por eso es ético hacerlo!). No es la primera, ni será la última vez, que un ensayo clínico en fases avanzadas falle; de hecho, sucede de manera relativamente frecuente. Dos ejemplos muy conocidos son lidocaína para prevenir las arritmias en el infarto agudo de miocardio y el reemplazo hormonal en mujeres posmenopáusicas para reducir el riesgo de episodios isquémicos secundarios. En ambas intervenciones, la percepción inicial era muy buena y se publicaron múltiples estudios observacionales a su favor e incluso algún EAC con episodios intermedios en el caso de la terapia de reemplazo; sin embargo los EAC con episodios más duros y los metaanálisis de EAC han demostrado la futilidad o incluso el perjuicio de ambas intervenciones y hoy en día no se aplican rutinariamente31,32.
Discordancia entre estudios observacionales y ensayos aleatorizados controlados¿Como se explica que múltiples estudios observacionales demuestren resultados positivos y algunos EAC no?Como fue mencionado previamente, la disociación entre estudios observacionales y EAC no debe extrañar dado que es conocida desde hace años. Posiblemente, su principal explicación radique en el efecto de los factores de confusión. Los EAC son el mejor instrumento para valorar la eficacia de una intervención, superiores a los estudios observacionales para este fin concreto porque tienen características que les protegen de ciertos sesgos que frecuentemente afectan a los estudios observacionales. Por ejemplo, la asignación aleatoria del tratamiento tiende a producir grupos iguales en todo excepto en la intervención; es decir, en variables que sabemos que importan y también en otras que ignoramos su papel o simplemente desconocemos que existen (ej. polimorfismos genéticos). En los estudios observacionales, dependiendo de la intervención evaluada, es el médico, el entorno (disponibilidad) o incluso el propio paciente quien asigna la intervención, lo que tiende a producir grupos muy diferentes entre sí. Esta confusión se intenta reducir mediante estrategias como la restricción o semirrestricción (ej. casos y controles) o los análisis de regresión multivariados (ej. COX). Describir en detalle el proceso del análisis multivariante excede el objetivo de la presente revisión; sin embargo, vale destacar que no siempre es transparente y podría estar influido por el investigador. Además, el resultado final se puede ajustar solo por variables que se hayan observado y medido; sin embargo, siempre hay variables latentes o no registradas que podrían ser muy relevantes coadyuvantes. Recientemente han tomado notoriedad los estudios en los cuales se aplican puntuaciones de propensión (“propensity score”)9 para parear los grupos (semirrestricción) o para ajustar en el análisis. Es indudable que aportan algunas ventajas respecto a los modelos más tradicionales, pero aún permanece la incertidumbre acerca de lo completo del ajuste.
Conducta ante resultados disparesDados los disímiles resultados reportados por los EAC, ¿qué deberemos hacer?El desarrollo de conocimiento y de la ciencia se caracteriza por ser repetitivo, heterogéneo y en múltiples ocasiones contradictorio. Más allá de realizar estudios clínicos bien diseñados y de elevada calidad, es frecuente que existan resultados diferentes por simple azar, por diferencias en las poblaciones o porque se han conducido en periodos de tiempo distintos (las medicina avanza continuamente; dos estudios similares, pero realizados en periodos de tiempos diferentes, pueden diferir en el tratamiento de las complicaciones, en los métodos de diagnóstico aplicados, en los tratamientos coadyuvantes, etc.). Por todas estas razones, es el clínico o el investigador quien debe realizar un análisis crítico y considerar si tiene “sentido comparar” los diferentes estudios entre sí. Si se concluye que sí, es decir que son estudios comparables, debe tener presente que la evidencia científica, por consenso, se organiza en una pirámide estando en su vértice en lo que se refiere a máxima calidad de la información para evaluar eficacia, los ensayos clínicos de gran tamaño y los metaanálisis de EAC33. Los metaanálisis implican una metodología robusta, reproducible y aceptada internacionalmente basada en el precepto de incluir todos los estudios vinculados a la pregunta que se desea responder; además, casi más importante que el análisis estadístico en sí mismo es la calidad de la revisión sistemática que lo precedió. Por otro lado, debemos hacer notar que nos referimos a metaanálisis de EAC pues hay metaanálisis de estudios observacionales u otros que combinan estudios observacionales y EAC cuya evidencia es jerárquicamente inferior a la de un EAC (es el ejemplo de los metaanálisis de Xu et al.6 y de Soraya et al.11 que se citaron previamente). Finalmente, también los resultados de los metaanálisis deben someterse a un proceso de evaluación antes de incorporar recomendaciones a las guías de práctica clínica.
En suma, la severidad de la pandemia de la COVID-19ha determinado que la comunidad científica se movilizara como nunca antes con el objetivo de encontrar tratamientos eficaces de manera urgente. Fue tan crítica la situación y la necesidad de un tratamiento efectivo que es entendible la búsqueda de “atajos” como por ejemplo el uso de tratamientos bajo el rótulo de “compasivo”. Simultáneamente, debimos acostumbrarnos a conocer la información por vías alternativas como las notas de prensa, los artículos publicados en plataformas no revisadas por pares o los webinares. La breve, pero muy intensa historia del tocilizumab aplicado a los pacientes COVID-19 demuestra que la ciencia requiere un método científico y de tiempo para desarrollarlo. La aplicación de “atajos” en la ciencia, por más entendible que sea, no parece ser adecuada dado que implica poner en riesgo a pacientes. Tras meses de intensa investigación y resultados contradictorios entre estudios observacionales y EAC, e incluso entre EAC, parecería que tocilizumab tendría un efecto beneficioso en el subgrupo de pacientes más graves y que tienen un tiempo de evolución desde el inicio de los síntomas breve.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.