Actualmente, el manejo de la enfermedad inflamatoria intestinal (EII) se basa en la evaluación objetiva de las lesiones intestinales. Por ello, es de interés disponer de herramientas sencillas y no invasivas con las que monitorizar la actividad de la EII e identificar la presencia de lesiones. La calprotectina fecal (CF) constituye la principal proteína citosólica de los neutrófilos, es resistente a la degradación bacteriana y estable a temperatura ambiente durante días, características que la hacen adecuada para su uso en la práctica clínica. Es útil para diferenciar entre procesos inflamatorios y funcionales, se correlaciona con la actividad endoscópica, se asocia con la respuesta clínica y endoscópica al tratamiento y tiene valor pronóstico a corto plazo. El presente documento pretende ofrecer una visión actualizada sobre la información que la CF puede proporcionar al clínico en el diagnóstico, la monitorización y el manejo de la EII.
The management of inflammatory bowel disease (IBD) is currently based on the objective evaluation of intestinal lesions. It would therefore be interesting to have access to simple and non-invasive tools to monitor IBD activity and to identify the presence of lesions. Faecal calprotectin (FC) is the main cytosolic protein of neutrophils, it is resistant to bacterial degradation and it is stable at room temperature for several days, characteristics that make it suitable for use in clinical practice. It can be used to differentiate between inflammatory and functional processes, it correlates with endoscopic activity, it is associated with clinical and endoscopic response to treatment and it has short-term prognostic value. This paper offers an up-to-date perspective on the information that FC can provide clinicians to aid diagnosis, monitoring and management of IBD.
La enfermedad de Crohn (EC) y la colitis ulcerosa (CU) son enfermedades inflamatorias crónicas y progresivas que se caracterizan por la alternancia de periodos de actividad y remisión de duración impredecible. Actualmente, el manejo de la enfermedad inflamatoria intestinal (EII) se basa en la evaluación objetiva de las lesiones intestinales y, en general, no se considera adecuada la toma de decisiones guiada exclusivamente por la sintomatología clínica. Esto es así por dos razones. En primer lugar, los síntomas digestivos no reflejan con fidelidad la presencia ni la gravedad de las lesiones digestivas. Más de un tercio de los pacientes en remisión clínica presentan lesiones endoscópicas y en más del 10% de los pacientes sintomáticos la endoscopia es normal1,2. Es fácil entender, pues, que las decisiones terapéuticas basadas exclusivamente en la clínica pueden conducir a errores graves. En segundo lugar, se ha demostrado que la mejoría o desaparición de las lesiones intestinales se asocia a una evolución más favorable de la enfermedad, con menor probabilidad de complicaciones, necesidad de hospitalización o cirugía3,4. Todo ello ha renovado el interés por la endoscopia y las técnicas de imagen en la evaluación de los pacientes con EII. Estas técnicas proporcionan una valiosa información sobre la gravedad y la extensión de las lesiones y sobre la presencia de complicaciones. Sin embargo, difícilmente pueden aplicarse a la monitorización periódica de la enfermedad dado su elevado coste, su limitada disponibilidad y su carácter invasivo.
Por todo ello, es de gran interés para el clínico disponer de herramientas sencillas y no invasivas con las que monitorizar la actividad de la EII e identificar la presencia de lesiones. Se han propuesto diversos biomarcadores séricos, entre los cuales la proteína C reactiva (PCR) es el más utilizado. Sin embargo, la PCR es inespecífica y puede estar elevada en procesos inflamatorios extraintestinales5. Un biomarcador ideal debería distinguir con precisión la existencia o no de lesiones, así como relacionarse con su gravedad y con la respuesta al tratamiento. Además, debería ser ampliamente accesible, fácil de usar y de precio asequible. La calprotectina fecal (CF) cumple, en mayor o menor medida, estos requisitos y es el biomarcador comercializado mejor caracterizado en este momento en el ámbito de la EII.
La CF es una proteína fijadora de calcio con propiedades antimicrobianas, antiproliferativas y proinflamatorias. Deriva predominantemente de los neutrófilos, de los que es la principal proteína citosólica y, en menor medida, de monocitos y macrófagos activados. Es liberada en fases muy precoces del proceso inflamatorio y su concentración en las heces es directamente proporcional a la presencia de neutrófilos en la luz intestinal6. Los niveles de CF presentan una buena correlación con la excreción de leucocitos marcados con indio-1117 y con la permeabilidad de la mucosa intestinal8. Es resistente a la degradación bacteriana y estable a temperatura ambiente durante días, características que la hacen adecuada para su uso en la práctica clínica.
El presente documento pretende ofrecer una visión actualizada de la utilidad de la CF en pacientes con EII en la práctica clínica.
Técnicas disponibles para la determinación de calprotectina fecal¿De qué técnicas disponemos para determinar la calprotectina fecal?Las técnicas más utilizadas son el enzimoinmunoanálisis (ELISA) y la inmunocromatografía de flujo lateral, utilizada esta última en los llamados «test rápidos». Los anticuerpos empleados en ambas técnicas pueden ser policlonales o monoclonales. Los kits que utilizan anticuerpos monoclonales son preferibles por haber mostrado una mayor precisión9,10.
Los test ELISA son los más contrastados, resultan más baratos y proporcionan un resultado cuantitativo que suele abarcar un rango más amplio de valores. Sin embargo, precisan de un laboratorio especializado y se han de acumular varias decenas de muestras para que el coste de cada determinación sea asumible, con el consiguiente retraso en la obtención del resultado. Por su parte, los test inmunocromatográficos (test rápidos) tienen la ventaja de no precisar de un laboratorio, permitir el análisis individual de cada muestra y obtener un resultado en pocos minutos. Algunos test inmunocromatográficos, mediante un lector con el software adecuado, pueden proporcionar un resultado cuantitativo que se correlaciona muy bien con el obtenido mediante ELISA11,12. Otros proporcionan un resultado semicuantitativo o cualitativo de forma rápida, sencilla y barata, aunque se dispone de menos información sobre su precisión diagnóstica.
Cabe destacar que recientemente se han desarrollado kits con un dispositivo de preparación rápida de la muestra fecal que combinan la técnica de inmunocromatografía con una aplicación específica para smartphone que permite la lectura desde el propio teléfono y envía el resultado a un servidor al que el médico responsable tiene acceso13,14.
En centros que procesen un gran número de muestras, la técnica de ELISA sería la mejor opción por proveer el resultado con un rango más amplio, ser más económica y de precisión mejor contrastada. En el caso de necesitar un resultado inmediato, o de no disponer de suficientes muestras para que el test ELISA facilite el resultado en un plazo de tiempo razonable, los test rápidos cuantitativos podrían ser una opción adecuada. Si bien la experiencia con este tipo de test es más limitada, alguno de estos kits ha demostrado una fiabilidad similar a la de los test ELISA en la predicción de lesiones endoscópicas11,12.
Los test rápidos semicuantitativos o cualitativos resultan atractivos por su sencillez y bajo coste. Han demostrado una buena precisión para el diagnóstico diferencial entre EII y patología no inflamatoria, por lo que podrían utilizarse con este fin. Sin embargo, se dispone de pocos datos sobre su capacidad para identificar lesiones endoscópicas en pacientes con EII. Una limitación importante de este tipo de test es la pérdida de información que supone dicotomizar una variable cuantitativa. Existe un compromiso entre sensibilidad y especificidad a lo largo del continuum de valores de CF, por lo que en diferentes circunstancias o indicaciones pueden considerarse óptimos diferentes puntos de corte, según se prefiera maximizar sensibilidad o especificidad.
¿Son comparables los resultados con las diferentes técnicas de determinación o marcas comerciales?Se ha demostrado que existe una considerable variabilidad en los resultados obtenidos con diferentes kits comerciales, utilicen o no la misma técnica15-18 (ELISA, inmunocromatografía). Este hecho puede determinar que una muestra esté por encima o por debajo de un determinado punto de corte en función del kit escogido, y pone de manifiesto la necesidad urgente de estandarizar el procedimiento. Mientras esto no sea así, cada fabricante debería determinar sus propios límites de referencia o informar respecto a qué kit ha calibrado su producto. Por la misma razón, no es recomendable comparar los resultados obtenidos con diferentes kits en un mismo paciente.
Contrariamente, los resultados obtenidos con diferentes técnicas (ELISA vs. test rápido cuantitativo) de un mismo fabricante han demostrado una buena correlación11-14,19
Normas básicas para la recolección de muestras¿Cómo y cuándo debemos recoger la muestra?Se recomienda recoger una pequeña cantidad de heces (aproximadamente 3-5g, equivalentes a una cucharada de café) y depositarla en un bote de recogida que se dispensa habitualmente en el centro solicitante. Dicho recipiente no requiere ningún tratamiento específico. Se puede tomar la muestra de cualquier parte de la deposición, ya que se ha demostrado que la CF se distribuye de manera homogénea20.
El momento ideal para la recogida de la muestra ha sido motivo de controversia. Se había sugerido que las muestras obtenidas de la primera deposición del día podrían ser las más adecuadas20. Sin embargo, un riguroso estudio realizado en nuestro medio y diseñado específicamente para aclarar este punto demostró que el momento en que se recoge la muestra es irrelevante21.
Se ha constatado un marcado descenso de los niveles de CF durante la preparación para una colonoscopia22. Por ello, en caso de que el paciente tenga programada una, se debe tener la precaución de recoger la muestra antes de iniciar la limpieza del colon o varios días después de la prueba.
¿Podemos conservar la muestra o debemos procesarla inmediatamente?Una vez recogida la muestra, puede permanecer a temperatura ambiente durante 3días; posteriormente los niveles tienden a disminuir20. Si la muestra no se va a analizar directamente, se puede conservar hasta una semana a 2-8°C o hasta 12meses a −20°C, tal y como indican la mayoría de fabricantes.
¿Qué causas pueden elevar la calprotectina fecal, además de la enfermedad inflamatoria intestinal?Existen diversos factores que pueden afectar los niveles de CF. En diferentes estudios se ha demostrado que los antiinflamatorios no esteroideos (AINE) pueden elevar la CF en pacientes asintomáticos, probablemente debido a la enteropatía provocada por dichos tratamientos23-26. En voluntarios sanos que recibieron diclofenaco durante dos semanas, la CF aumentó en una cuarta parte de los casos, pero en la mayoría de ellos el incremento de la CF fue modesto (<100μg/g), muchos normalizaron la CF aun durante el tratamiento y todos la normalizaron a las dos semanas de su retirada26. Por ello se recomienda la suspensión de los AINE las dos semanas previas a la determinación de CF. En caso contrario, se deberá tener en cuenta la posibilidad de que un resultado positivo sea debido al tratamiento con AINE.
La aspirina, utilizada como fármaco antitrombótico a dosis de 100mg al día, no parece tener un efecto clínicamente relevante en los niveles de CF27. Aunque se ha constatado un aumento significativo de la CF en voluntarios sanos que recibían 100mg diarios de aspirina, los niveles máximos alcanzados eran bajos (<60μg/g)28. Con la información disponible hasta el momento, y teniendo en cuenta la importancia del tratamiento antitrombótico en pacientes de riesgo, no está justificada la retirada del tratamiento con aspirina cuando se considere necesario determinar la CF.
Los inhibidores de la bomba de protones incrementan el riesgo de lesiones intestinales en consumidores de AINE29, pero disponemos de muy pocos datos sobre el impacto que estos fármacos pueden tener en los niveles de CF. En un estudio publicado en forma de carta, el tratamiento con inhibidores de la bomba de protones se asoció a una elevación en la CF por encima de la normalidad30. Sin embargo, la evidencia es demasiado escasa como para dar una recomendación formal.
La edad puede afectar los niveles de CF. Los niños sanos menores de 4años presentan concentraciones de CF superiores a las de los adultos, a menudo situadas entre 50 y 250μg/g31,32. En cambio, en población adulta sana la concentración de CF aumenta con la edad, aunque dentro de niveles considerados normales (<50μg/g)33. La obesidad, el sedentarismo y una dieta pobre en fibra también se han relacionado con niveles de CF más elevados pero dentro de la normalidad (<50μg/g), y por tanto son factores sin relevancia clínica que no afectan la precisión del test33.
Finalmente, hay que tener en cuenta que cualquier condición inflamatoria del intestino, como infecciones o diverticulitis, puede elevar la CF34-36. Se ha sugerido que la determinación de CF podría ser de utilidad en la evaluación de la diarrea aguda para diferenciar origen bacteriano o vírico. Valores marcadamente elevados apuntarían a etiología bacteriana y permitirían seleccionar aquellos pacientes que más se beneficiarían de la práctica de un coprocultivo37,38. Serían necesarios más estudios para identificar los puntos de corte óptimos para este fin.
Calprotectina fecal en el diagnóstico de la enfermedad inflamatoria intestinal¿Nos puede ayudar la calprotectina fecal en el diagnóstico diferencial de un paciente con síntomas digestivos?Los síntomas digestivos son frecuentes en la población general y poco específicos de enfermedad orgánica. Por ello, utilizar exclusivamente la clínica como método para decidir si el paciente requiere la práctica de exámenes endoscópicos para descartar una enfermedad orgánica resulta poco eficiente. El valor de la CF para discriminar síntomas digestivos funcionales y orgánicos ha sido analizado en numerosos estudios. Un metaanálisis que incluyó 2.475 pacientes determinó la sensibilidad y la especificidad para diferenciar enfermedad orgánica de funcional, siendo estas del 83 y del 84%, respectivamente39. El principal inconveniente de la CF en este contexto es su baja precisión para detectar cáncer colorrectal (CCR)40. Por este motivo, en una población de estudio en riesgo de CCR (p.ej., paciente de >50años o con antecedentes familiares de CCR) la CF no será el test más adecuado. En cambio, en un contexto de bajo riesgo de CCR (p.ej., población de menos de 50años) la CF puede resultar una herramienta muy valiosa para diferenciar una EII del síndrome de intestino irritable. Ambas enfermedades comparten síntomas similares y diferenciarlas mediante exploraciones endoscópicas puede ser costoso, invasivo y poco eficiente. Un metaanálisis que incluyó 13 estudios con 1.041 pacientes (670 adultos y 371 niños) demostró una sensibilidad y una especificidad para la identificación de una EII en adultos del 93 y del 96%, respectivamente. En población pediátrica, la sensibilidad fue similar, aunque con una menor especificidad (76%)41.
Un reciente estudio evaluó los niveles de CF de 895 pacientes de entre 18 y 50años con síntomas gastrointestinales42. En este estudio, el 10% fue diagnosticado de EII. El área bajo la curva ROC de las concentraciones fecales de calprotectina para discriminar EII de enfermedad funcional fue de 0,97. Con la finalidad de maximizar la sensibilidad, se observó que combinando los niveles de CF y 5 síntomas de alarma (sangrado rectal, diarrea sanguinolenta, síntomas nocturnos, pérdida de peso y anemia) se obtenían una sensibilidad del 100% y una especificidad del 55%.
De este modo, podemos considerar la CF como un test adecuado para identificar aquellos pacientes sintomáticos que muy probablemente presentan enfermedad orgánica y que por tanto precisan exploraciones adicionales, especialmente en población de bajo riesgo de CCR. Esto podría ser especialmente útil en el ámbito de atención primaria como método de cribado para decidir la idoneidad de colonoscopia o de derivación al especialista.
El punto de corte de CF más aceptado en este contexto clínico es de 50μg/g. En este sentido, una revisión sistemática incluyó 28 estudios que evaluaban la precisión diagnóstica de la CF para discriminar entre EII y síndrome de intestino irritable. Utilizando este umbral de CF se obtuvo una sensibilidad global del 93% (intervalo, 83-100%) y una especificidad del 94% (intervalo, 60-100%). En población pediátrica, con este mismo punto de corte, la sensibilidad oscilaba entre el 95 y el 100% y la especificidad, entre el 44 y el 93%43.
No obstante, en el estudio de Kennedy et al.42, con un punto de corte CF de 100μg/g, se obtenía una sensibilidad del 96% y un valor predictivo negativo del 99%, muy similar al obtenido con un punto de corte en 50μg/g (97 y 99%, respectivamente), mejorando de forma significativa el valor predictivo positivo (del 37 al 54%) y la especificidad (del 74 al 87%). Asimismo, en un estudio reciente llevado a cabo en el ámbito de la atención primaria en 789 pacientes jóvenes, una CF≥100μg/g diferenciaba enfermedad funcional de EII con valores predictivos positivo y negativo del 49 y del 99%, respectivamente44. Hay que destacar que este estudio incluyó 311 pacientes con signos clínicos de alarma en los que la CF mantuvo un alto valor predictivo negativo (98%).
Así pues, en el diagnóstico diferencial de un paciente joven con síntomas digestivos, parece razonable no indicar exploraciones invasivas si la CF es inferior a 100μg/g. Ante valores comprendidos entre 100 y 150μg/g debería plantearse la repetición de la CF en el plazo de unas semanas. Finalmente, ante valores superiores a 150μg/g sería prudente indicar exploraciones adicionales.
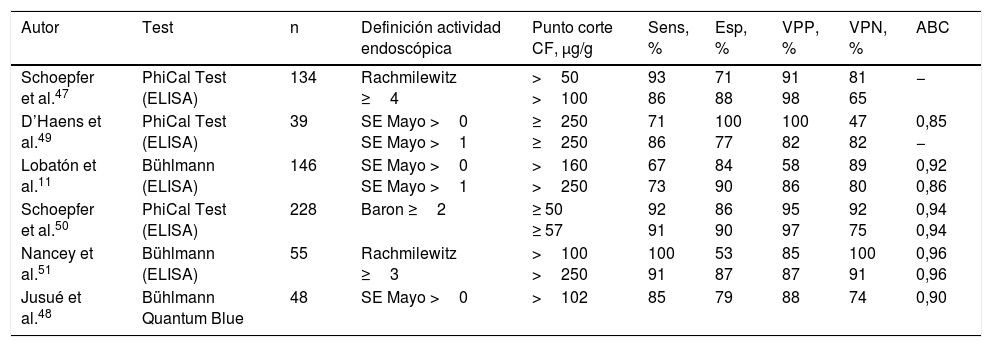
Calprotectina fecal como biomarcador en la colitis ulcerosa¿Es fiable la calprotectina fecal como marcador de actividad endoscópica en la colitis ulcerosa?Múltiples estudios han demostrado que la CF es un marcador fiable de actividad endoscópica en la CU, y dos recientes metaanálisis así lo confirman45,46. Con este fin, la CF es superior a la PCR y a otros biomarcadores fecales11,47,48. Globalmente, la sensibilidad y la especificidad obtenidas en estos estudios han sido del 80-90% y del 70-80%, respectivamente, dependiendo del punto de corte empleado (tabla 1)11,45-50. En la mayoría de estudios, la CF ha demostrado correlacionarse no solo con la presencia o ausencia de actividad endoscópica, sino con el grado de actividad endoscópica evaluada mediante diferentes índices endoscópicos11,47-51, si bien no se ha definido el punto de corte óptimo para identificar lesiones graves.
Precisión diagnóstica de la calprotectina fecal en la identificación de actividad endoscópica en la colitis ulcerosa
| Autor | Test | n | Definición actividad endoscópica | Punto corte CF, μg/g | Sens, % | Esp, % | VPP, % | VPN, % | ABC |
|---|---|---|---|---|---|---|---|---|---|
| Schoepfer et al.47 | PhiCal Test (ELISA) | 134 | Rachmilewitz ≥4 | >50 >100 | 93 86 | 71 88 | 91 98 | 81 65 | − |
| D’Haens et al.49 | PhiCal Test (ELISA) | 39 | SE Mayo >0 SE Mayo >1 | ≥250 ≥250 | 71 86 | 100 77 | 100 82 | 47 82 | 0,85 − |
| Lobatón et al.11 | Bühlmann (ELISA) | 146 | SE Mayo >0 SE Mayo >1 | >160 >250 | 67 73 | 84 90 | 58 86 | 89 80 | 0,92 0,86 |
| Schoepfer et al.50 | PhiCal Test (ELISA) | 228 | Baron ≥2 | ≥ 50 ≥ 57 | 92 91 | 86 90 | 95 97 | 92 75 | 0,94 0,94 |
| Nancey et al.51 | Bühlmann (ELISA) | 55 | Rachmilewitz ≥3 | >100 >250 | 100 91 | 53 87 | 85 87 | 100 91 | 0,96 0,96 |
| Jusué et al.48 | Bühlmann Quantum Blue | 48 | SE Mayo >0 | >102 | 85 | 79 | 88 | 74 | 0,90 |
ABC: área bajo la curva ROC; CF: calprotectina fecal; Esp: especificidad; SE: subíndice endoscópico; Sens: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La sensibilidad, la especificidad y los valores predictivos se han calculado considerando «verdadero positivo» al paciente con actividad y CF >al punto de corte.
La extensión de la enfermedad parece tener una influencia escasa sobre los niveles de CF, inferior a la que tiene la gravedad de las lesiones endoscópicas49,52,53. En dos estudios, uno español y otro belga, la extensión de la colitis se relacionó significativamente con la cifra de CF en el análisis univariante, pero en el multivariante, tras ajustar para extensión y gravedad de la actividad endoscópica, solo esta última mantuvo la significación estadística11,54.
La CF es, por tanto, un biomarcador altamente fiable para detectar actividad endoscópica en la CU.
¿Qué puntos de corte son indicativos de remisión endoscópica en la colitis ulcerosa?El punto de corte dependerá de la definición de remisión endoscópica y del compromiso entre sensibilidad y especificidad que se decida (tabla 1). En general, se suele aceptar como remisión endoscópica, además de la completa normalidad de la mucosa, la presencia de cambios leves sin erosiones ni sangrado espontáneo (subíndice endoscópico de Mayo0 o1). Con esta definición de remisión endoscópica, el punto de corte más adecuado sería 250μg/g11,49,51.
Sin embargo, si se considera una definición más exigente de remisión, definiendo como tal la completa normalización de la mucosa (subíndice endoscópico de Mayo0) el punto de corte sería más bajo. Aunque sobre este aspecto hay menos evidencia, un punto de corte de entre 100 y 150μg/g ha demostrado una muy buena precisión diagnóstica11,48.
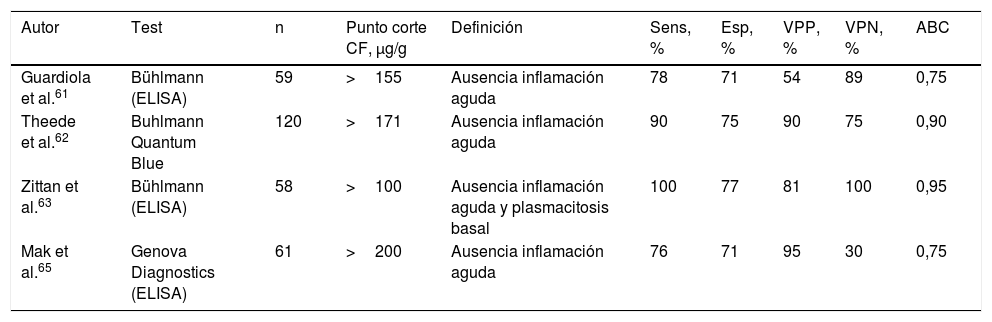
¿Puede la calprotectina fecal predecir la existencia de actividad histológica en la colitis ulcerosa?Una de las características más interesantes de la CF es su capacidad para detectar inflamación intestinal precozmente, incluso antes de que se hayan producido cambios endoscópicos6.
En la CU la normalización histológica de la mucosa es a menudo incompleta, incluso en pacientes que alcanzan la remisión clínica y endoscópica. Existe una creciente evidencia de que la inflamación microscópica persistente, aun en ausencia de lesiones endoscópicas, se asocia con un mayor riesgo de recidiva55-58. Además, la gravedad de la inflamación es un determinante importante del riesgo de neoplasia colorrectal59,60. Por todo ello, puede resultar interesante estimar la actividad histológica de forma incruenta. Diversos estudios han demostrado que la CF permite identificar con aceptable precisión la remisión histológica en pacientes con CU, con una sensibilidad y una especificidad de entre el 76-100% y el 71-77%, respectivamente61-65 (tabla 2). Los puntos de corte propuestos para este fin se sitúan entre 100 y 170μg/g.
Precisión diagnóstica de la calprotectina fecal en la identificación de remisión histológica en la CU
| Autor | Test | n | Punto corte CF, μg/g | Definición | Sens, % | Esp, % | VPP, % | VPN, % | ABC |
|---|---|---|---|---|---|---|---|---|---|
| Guardiola et al.61 | Bühlmann (ELISA) | 59 | >155 | Ausencia inflamación aguda | 78 | 71 | 54 | 89 | 0,75 |
| Theede et al.62 | Buhlmann Quantum Blue | 120 | >171 | Ausencia inflamación aguda | 90 | 75 | 90 | 75 | 0,90 |
| Zittan et al.63 | Bühlmann (ELISA) | 58 | >100 | Ausencia inflamación aguda y plasmacitosis basal | 100 | 77 | 81 | 100 | 0,95 |
| Mak et al.65 | Genova Diagnostics (ELISA) | 61 | >200 | Ausencia inflamación aguda | 76 | 71 | 95 | 30 | 0,75 |
ABC: área bajo la curva ROC; CF: calprotectina fecal; Esp: especificidad; Sens: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La sensibilidad, la especificidad y los valores predictivos se han calculado considerando «verdadero positivo» al paciente con actividad y CF >al punto de corte.
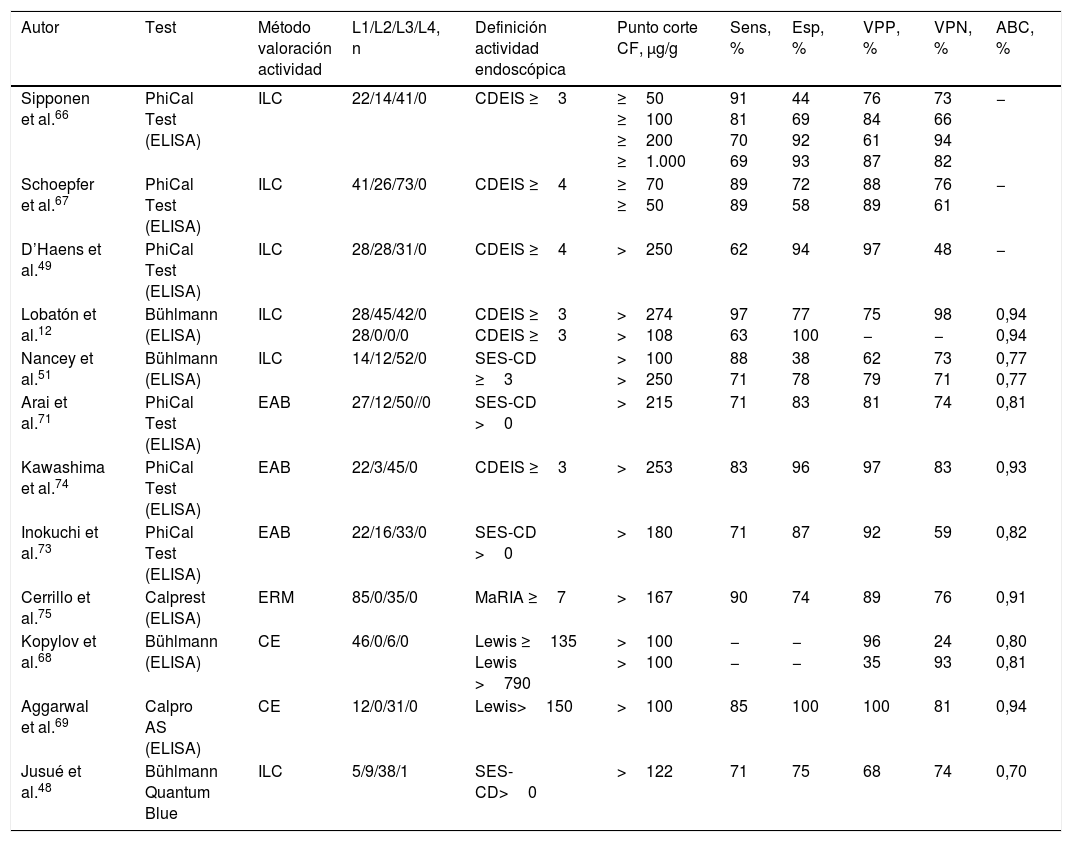
Los estudios realizados hasta la fecha y dos metaanálisis recientes demuestran que existe una buena correlación entre la concentración de CF y la actividad endoscópica de la EC evaluada mediante diversos índices endoscópicos, como el Crohn's Disease Endoscopic Index of Severity (CDEIS), el Simple Endoscopic Score for Crohn's Disease (SES-CD) o el índice de Lewis (tabla 3)12,45,46,49,51,66-69. Esta correlación es muy superior a la que presentan los índices de actividad clínica y la PCR12,48,67. El área bajo la curva ROC para la predicción de actividad endoscópica se sitúa en torno a 0,85 según un reciente metaanálisis46. Además, la CF ha sido el único marcador que ha mostrado capacidad para discriminar la remisión frente a la actividad leve, moderada y grave12,67.
Precisión diagnóstica de la calprotectina fecal en la identificación de actividad endoscópica en la enfermedad de Crohn
| Autor | Test | Método valoración actividad | L1/L2/L3/L4, n | Definición actividad endoscópica | Punto corte CF, μg/g | Sens, % | Esp, % | VPP, % | VPN, % | ABC, % |
|---|---|---|---|---|---|---|---|---|---|---|
| Sipponen et al.66 | PhiCal Test (ELISA) | ILC | 22/14/41/0 | CDEIS ≥3 | ≥50 ≥100 ≥200 ≥1.000 | 91 81 70 69 | 44 69 92 93 | 76 84 61 87 | 73 66 94 82 | − |
| Schoepfer et al.67 | PhiCal Test (ELISA) | ILC | 41/26/73/0 | CDEIS ≥4 | ≥70 ≥50 | 89 89 | 72 58 | 88 89 | 76 61 | − |
| D’Haens et al.49 | PhiCal Test (ELISA) | ILC | 28/28/31/0 | CDEIS ≥4 | >250 | 62 | 94 | 97 | 48 | − |
| Lobatón et al.12 | Bühlmann (ELISA) | ILC | 28/45/42/0 28/0/0/0 | CDEIS ≥3 CDEIS ≥3 | >274 >108 | 97 63 | 77 100 | 75 − | 98 − | 0,94 0,94 |
| Nancey et al.51 | Bühlmann (ELISA) | ILC | 14/12/52/0 | SES-CD ≥3 | >100 >250 | 88 71 | 38 78 | 62 79 | 73 71 | 0,77 0,77 |
| Arai et al.71 | PhiCal Test (ELISA) | EAB | 27/12/50//0 | SES-CD >0 | >215 | 71 | 83 | 81 | 74 | 0,81 |
| Kawashima et al.74 | PhiCal Test (ELISA) | EAB | 22/3/45/0 | CDEIS ≥3 | >253 | 83 | 96 | 97 | 83 | 0,93 |
| Inokuchi et al.73 | PhiCal Test (ELISA) | EAB | 22/16/33/0 | SES-CD >0 | >180 | 71 | 87 | 92 | 59 | 0,82 |
| Cerrillo et al.75 | Calprest (ELISA) | ERM | 85/0/35/0 | MaRIA ≥7 | >167 | 90 | 74 | 89 | 76 | 0,91 |
| Kopylov et al.68 | Bühlmann (ELISA) | CE | 46/0/6/0 | Lewis ≥135 Lewis >790 | >100 >100 | − − | − − | 96 35 | 24 93 | 0,80 0,81 |
| Aggarwal et al.69 | Calpro AS (ELISA) | CE | 12/0/31/0 | Lewis>150 | >100 | 85 | 100 | 100 | 81 | 0,94 |
| Jusué et al.48 | Bühlmann Quantum Blue | ILC | 5/9/38/1 | SES-CD>0 | >122 | 71 | 75 | 68 | 74 | 0,70 |
ABC: área bajo la curva ROC; CDEIS: Crohn's Disease Endoscopic Index of Severity; CE: cápsula endoscópica; CF: calprotectina fecal; EAB: enteroscopia asistida por balón; ERM: entero-resonancia magnética; Esp: especificidad; ILC: ileocolonoscopia; L1-L4: localización de la enfermedad según clasificación de Montreal; MaRIA: Magnetic Resonance Index of Activity; Sens: sensibilidad; SES-CD: Simple Endoscopic Score for Crohn's Disease; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La sensibilidad, la especificidad y los valores predictivos se han calculado considerando «verdadero positivo» al paciente con actividad y CF >al punto de corte.
A diferencia de lo que ocurre en la CU, el punto de corte no está claramente establecido, entre otros motivos porque tampoco está bien definido el concepto de remisión para cada uno de los índices endoscópicos. Los estudios realizados proponen puntos de corte que oscilan entre 70 y 270μg/g12,48,49,51,66,67. En todos los casos se evidencia una sensibilidad en torno al 70-80% y una especificidad alrededor del 80-97%.
Un reciente metaanálisis ha sugerido que el mejor compromiso ente sensibilidad y especificidad para determinar la existencia de lesiones endoscópicas clínicamente relevantes se obtiene con un punto de corte de 250μg/g, valor que se asocia a una sensibilidad y especificidad del 80 y del 82%, respectivamente (área bajo la curva ROC 0,89)45.
¿Es fiable la calprotectina fecal como marcador de actividad endoscópica en la enfermedad de Crohn exclusivamente ileal?No hay un acuerdo unánime en cuanto a la influencia de la localización de la EC en la precisión de la CF para predecir la presencia de lesiones endoscópicas. Mientras que en algunos estudios la precisión es similar en las distintas localizaciones70,71, en la mayoría la correlación entre CF y actividad endoscópica es menor en la enfermedad ileal que en la cólica o ileocólica12,66,67,72. La validez de estos trabajos se ve limitada por el hecho de que en los mencionados estudios la exploración del íleon fue realizada mediante ileocolonoscopia y fue, por tanto, incompleta (ya que no es posible visualizar tramos de intestino delgado proximales).
Seis trabajos recientes abordan específicamente esta cuestión mediante un estudio completo del íleon, tres de ellos con enteroscopia asistida por balón71,73,74, uno con resonancia magnética75 y dos con cápsula endoscópica68,69 (tabla 3). Todos ellos sugieren que la CF es un marcador fiable de actividad endoscópica ileal, si bien en menor medida que en la enfermedad cólica. No obstante, el número total de pacientes incluidos con enfermedad exclusivamente localizada en el intestino delgado es aún pequeño y no permite establecer conclusiones definitivas.
¿Qué puntos de corte son indicativos de remisión endoscópica en la enfermedad de Crohn exclusivamente ileal?El valor de CF asociado a remisión endoscópica en la enfermedad exclusivamente ileal es menor que el asociado a enfermedad cólica o ileocólica12,73,74. Se ha propuesto el valor de 150μg/g como punto de corte con un compromiso óptimo para alcanzar una sensibilidad del 85% y una especificidad del 81%70. Esta cifra es coherente con los resultados de Cerrillo et al.75, según los cuales un punto de corte de 167μg/g permite predecir la actividad ileal evaluada mediante resonancia magnética con una sensibilidad del 90% y una especificidad del 74%. Otros estudios proponen un punto de corte ligeramente inferior, de 100μg/g12,69. Son necesarios más estudios para ratificar estos puntos de corte.
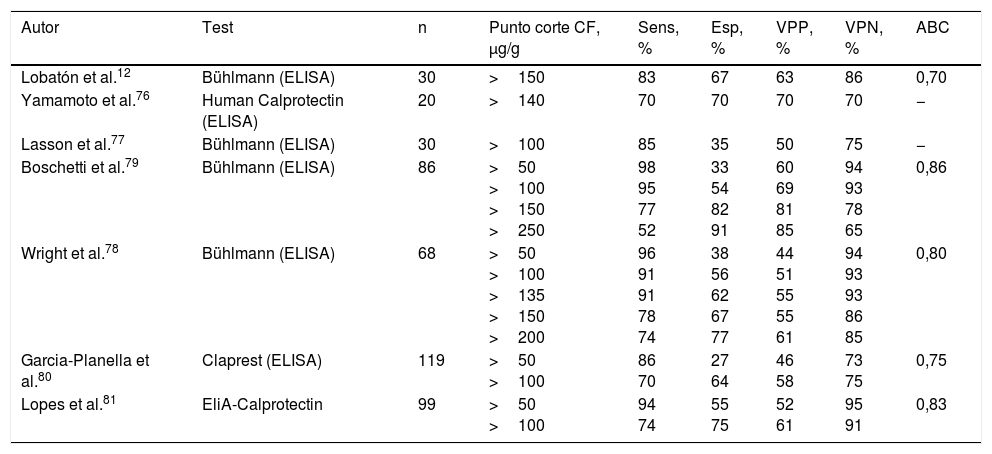
¿Es fiable la calprotectina fecal como marcador de recurrencia posquirúrgica en la enfermedad de Crohn?La monitorización de la recurrencia posquirúrgica es una de las situaciones más atractivas para el uso de biomarcadores en la EC. Un marcador no invasivo simple, fiable y preciso, capaz de detectar la presencia de lesiones recurrentes, podría ser una alternativa a la endoscopia en el seguimiento de los pacientes operados.
Diversos estudios prospectivos han evaluado el papel de la CF en este escenario12,76-81 (tabla 4). Todos ellos indican que la CF posee una elevada sensibilidad y valor predictivo negativo en la identificación de recurrencia posquirúrgica definida como la presencia de lesiones ≥i2 de Rutgeerts. Así pues, la CF posee una elevada fiabilidad para descartar la recurrencia y puede ser un marcador muy útil en la monitorización de estos pacientes tras la cirugía. Debe tenerse en cuenta que los valores de CF pueden persistir elevados en los primeros 3meses tras la cirugía, por lo que no resulta útil su determinación durante este periodo82.
Precisión diagnóstica de la calprotectina fecal en la identificación de recurrencia endoscópica posquirúrgica en la enfermedad de Crohn (Rutgeerts Score ≥i2)
| Autor | Test | n | Punto corte CF, μg/g | Sens, % | Esp, % | VPP, % | VPN, % | ABC |
|---|---|---|---|---|---|---|---|---|
| Lobatón et al.12 | Bühlmann (ELISA) | 30 | >150 | 83 | 67 | 63 | 86 | 0,70 |
| Yamamoto et al.76 | Human Calprotectin (ELISA) | 20 | >140 | 70 | 70 | 70 | 70 | − |
| Lasson et al.77 | Bühlmann (ELISA) | 30 | >100 | 85 | 35 | 50 | 75 | − |
| Boschetti et al.79 | Bühlmann (ELISA) | 86 | >50 >100 >150 >250 | 98 95 77 52 | 33 54 82 91 | 60 69 81 85 | 94 93 78 65 | 0,86 |
| Wright et al.78 | Bühlmann (ELISA) | 68 | >50 >100 >135 >150 >200 | 96 91 91 78 74 | 38 56 62 67 77 | 44 51 55 55 61 | 94 93 93 86 85 | 0,80 |
| Garcia-Planella et al.80 | Claprest (ELISA) | 119 | >50 >100 | 86 70 | 27 64 | 46 58 | 73 75 | 0,75 |
| Lopes et al.81 | EliA-Calprotectin | 99 | >50 >100 | 94 74 | 55 75 | 52 61 | 95 91 | 0,83 |
ABC: área bajo la curva ROC; CF: calprotectina fecal; Esp: especificidad; Sens: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La sensibilidad, la especificidad y los valores predictivos se han calculado considerando «verdadero positivo» al paciente con actividad y CF >al punto de corte.
Los estudios más amplios realizados en este contexto coinciden en que el punto de corte óptimo para la predicción de la recurrencia endoscópica (Rutgeerts ≥i2) es de 100μg/g78-81. Este valor se ha asociado con una sensibilidad y un valor predictivo negativo superiores al 90%. En la práctica clínica puede considerarse que valores de CF inferiores a 100μg/g hacen muy improbable la presencia de recurrencia posquirúrgica y permitirían obviar la colonoscopia. En cambio, ante valores elevados sería conveniente la confirmación endoscópica de la recurrencia antes de tomar decisiones terapéuticas, ya que la especificidad de la CF en este escenario es limitada. Determinaciones repetidas podrían mejorar su precisión, aunque se desconoce la periodicidad óptima con la que deberían llevarse a cabo. Un estudio prospectivo ha evaluado la determinación bimensual de CF durante los dos años siguientes a una ileocolonoscopia inicial sin lesiones recurrentes83. Ningún paciente con CF persistentemente inferior a 140μg/g presentó recurrencia avanzada (i3-i4) y solo un 10% recurrencia leve (i2) a los 24meses. Mientras no dispongamos de estudios que establezcan objetivamente el intervalo más coste-efectivo entre determinaciones de CF en el seguimiento de la EC tras la resección intestinal, es razonable llevarlas a cabo cada 4-6meses, tal como sugieren las recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU)84.
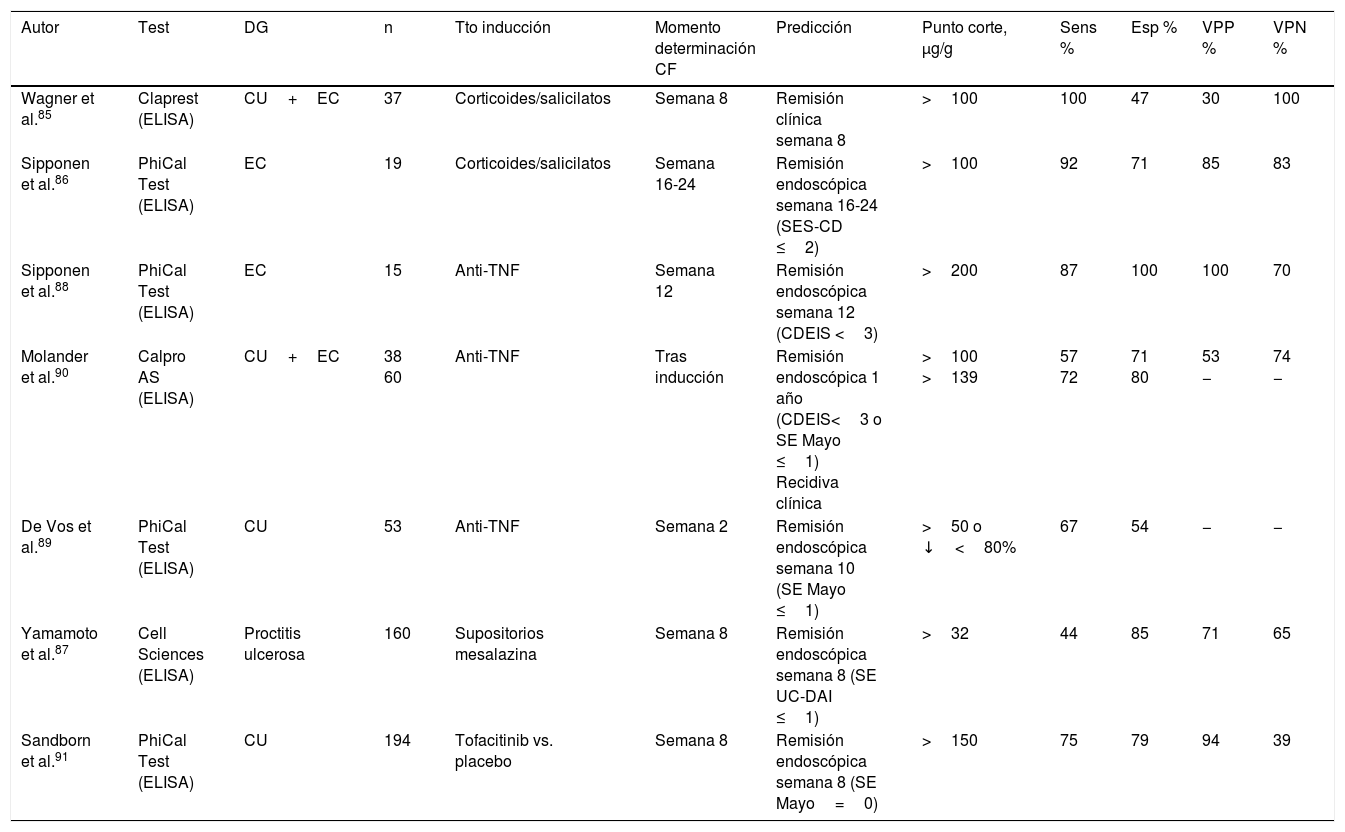
Calprotectina fecal en la monitorización de la respuesta al tratamiento¿Se asocian los niveles de calprotectina fecal al éxito o al fracaso del tratamiento de inducción de la remisión en la enfermedad inflamatoria intestinal?En pacientes con EII activa y niveles elevados de CF tratados de forma convencional con corticoides o salicilatos, la normalización de la CF (<100μg/g) se asocia a una alta probabilidad de remisión clínica y endoscópica85,86. La CF también ha demostrado ser eficaz como marcador de curación mucosa tras tratamiento con supositorios de mesalazina en pacientes con proctitis ulcerosa leve-moderada87. En estos pacientes, la CF es además un buen predictor de recidiva, elevándose unas 8semanas antes de la aparición de clínica87. En cambio, el valor pronóstico de la CF durante el ingreso hospitalario de pacientes con CU grave —situación en la que la CF está extremadamente elevada— se ve limitado por la gran variabilidad diurna que presenta21. En pacientes con EII en tratamiento con fármacos anti-TNF los niveles de CF se reducen de manera significativa y se normalizan en la mayoría de los que alcanzan la remisión endoscópica, tanto durante la inducción como en el mantenimiento88-90, siendo la CF mejor marcador que los índices clínicos. En un análisis post hoc de un ensayo clínico que evaluaba la eficacia de tofacitinib en la CU también se ha observado una estrecha relación entre los niveles de CF y la remisión endoscópica91.
Así pues, los niveles de CF se normalizan cuando el tratamiento, sea cual fuere, consigue la curación mucosa (tabla 5).
Precisión diagnóstica de la calprotectina fecal en la monitorización de la respuesta al tratamiento
| Autor | Test | DG | n | Tto inducción | Momento determinación CF | Predicción | Punto corte, μg/g | Sens % | Esp % | VPP % | VPN % |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Wagner et al.85 | Claprest (ELISA) | CU+EC | 37 | Corticoides/salicilatos | Semana 8 | Remisión clínica semana 8 | >100 | 100 | 47 | 30 | 100 |
| Sipponen et al.86 | PhiCal Test (ELISA) | EC | 19 | Corticoides/salicilatos | Semana 16-24 | Remisión endoscópica semana 16-24 (SES-CD ≤2) | >100 | 92 | 71 | 85 | 83 |
| Sipponen et al.88 | PhiCal Test (ELISA) | EC | 15 | Anti-TNF | Semana 12 | Remisión endoscópica semana 12 (CDEIS <3) | >200 | 87 | 100 | 100 | 70 |
| Molander et al.90 | Calpro AS (ELISA) | CU+EC | 38 60 | Anti-TNF | Tras inducción | Remisión endoscópica 1 año (CDEIS<3 o SE Mayo ≤1) Recidiva clínica | >100 >139 | 57 72 | 71 80 | 53 − | 74 − |
| De Vos et al.89 | PhiCal Test (ELISA) | CU | 53 | Anti-TNF | Semana 2 | Remisión endoscópica semana 10 (SE Mayo ≤1) | >50 o ↓<80% | 67 | 54 | − | − |
| Yamamoto et al.87 | Cell Sciences (ELISA) | Proctitis ulcerosa | 160 | Supositorios mesalazina | Semana 8 | Remisión endoscópica semana 8 (SE UC-DAI ≤1) | >32 | 44 | 85 | 71 | 65 |
| Sandborn et al.91 | PhiCal Test (ELISA) | CU | 194 | Tofacitinib vs. placebo | Semana 8 | Remisión endoscópica semana 8 (SE Mayo=0) | >150 | 75 | 79 | 94 | 39 |
ABC: área bajo la curva ROC; CDEIS: Crohn's Disease Endoscopic Index of Severity; CF: calprotectina fecal; CU: colitis ulcerosa; EC: enfermedad de Crohn; Esp: especificidad; SE: subíndice endoscópico; Sens: sensibilidad; SES-CD: Simple Endoscopic Score for Crohn's Disease; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La sensibilidad, la especificidad y los valores predictivos se han calculado considerando «verdadero positivo» al paciente con actividad y CF >al punto de corte.
En base a la evidencia actual, la monitorización de la CF puede ser útil en la valoración de la respuesta terapéutica. Un reciente ensayo clínico aleatorizado en pacientes con EC ha evaluado la monitorización trimestral de CF y PCR como indicadores respecto a los cuales ajustar el tratamiento anti-TNF92. El grupo en el que se utilizaron estos biomarcadores junto con la evaluación sintomática obtuvo mejores resultados clínicos y mayores tasas de remisión endoscópica que el grupo en el que la optimización terapéutica se basó exclusivamente en síntomas. Estos hallazgos ponen de relieve el papel que la CF puede tener para identificar inflamación subclínica y la necesidad de monitorizar a los pacientes con criterios objetivos.
En la tabla 5 se muestra la precisión diagnóstica de la CF en la predicción de la respuesta terapéutica en diferentes escenarios. Según estos estudios, puede ser útil determinar la CF antes del tratamiento de inducción y a las 8-12semanas, aunque determinaciones más precoces podrían tener valor pronóstico a corto plazo. En general, valores inferiores a 100-150μg/g se asocian a una buena respuesta al tratamiento.
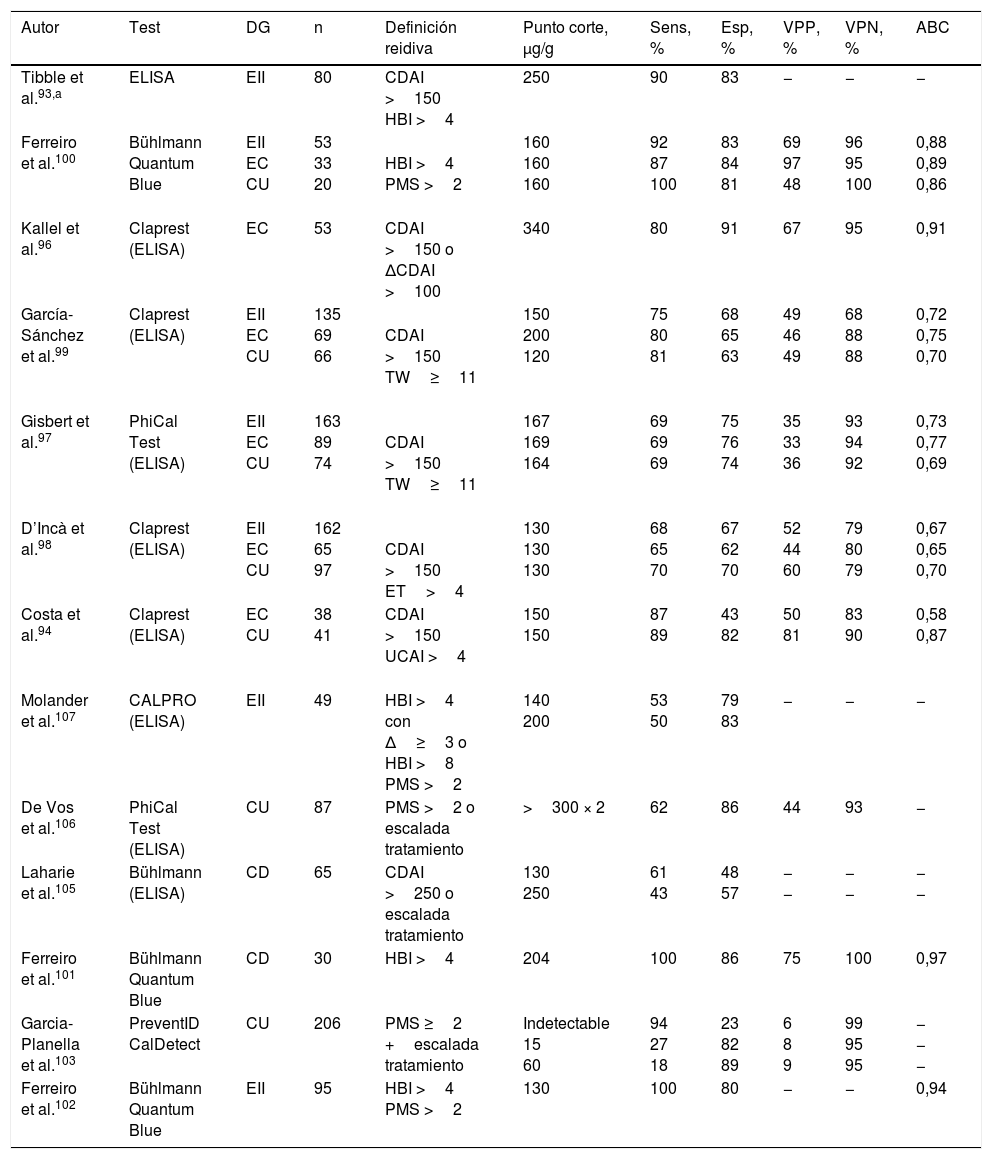
Calprotectina fecal como predictor de la recidiva¿Se puede predecir la recidiva de la enfermedad inflamatoria intestinal mediante la determinación de la calprotectina fecal?Existen numerosos estudios, tanto en EC como en CU, que demuestran el valor pronóstico de la CF93-107, especialmente su alto poder predictivo negativo (tabla 6). Seis de estos estudios se incluyen en el metaanálisis de Mao et al.108, donde la sensibilidad y la especificidad globales para predecir recidiva es del 78 y del 73%, respectivamente. La capacidad pronóstica de la CF es similar en la EC y en la CU, aunque parece inferior en pacientes con EC con afectación exclusivamente ileal. El mejor punto de corte no está claramente definido y dependerá del compromiso deseado entre sensibilidad y especificidad, pero diversos estudios coinciden en situarlo en torno a 150μg/g (tabla 6). La CF también ha demostrado tener valor predictivo independiente de recidiva tras la retirada del tratamiento anti-TNF, incluso en pacientes con cicatrización endoscópica107,109-111.
Precisión diagnóstica de la calprotectina fecal en la predicción de la recidiva
| Autor | Test | DG | n | Definición reidiva | Punto corte, μg/g | Sens, % | Esp, % | VPP, % | VPN, % | ABC |
|---|---|---|---|---|---|---|---|---|---|---|
| Tibble et al.93,a | ELISA | EII | 80 | CDAI >150 HBI >4 | 250 | 90 | 83 | − | − | − |
| Ferreiro et al.100 | Bühlmann Quantum Blue | EII EC CU | 53 33 20 | HBI >4 PMS >2 | 160 160 160 | 92 87 100 | 83 84 81 | 69 97 48 | 96 95 100 | 0,88 0,89 0,86 |
| Kallel et al.96 | Claprest (ELISA) | EC | 53 | CDAI >150 o ΔCDAI >100 | 340 | 80 | 91 | 67 | 95 | 0,91 |
| García-Sánchez et al.99 | Claprest (ELISA) | EII EC CU | 135 69 66 | CDAI >150 TW≥11 | 150 200 120 | 75 80 81 | 68 65 63 | 49 46 49 | 68 88 88 | 0,72 0,75 0,70 |
| Gisbert et al.97 | PhiCal Test (ELISA) | EII EC CU | 163 89 74 | CDAI >150 TW≥11 | 167 169 164 | 69 69 69 | 75 76 74 | 35 33 36 | 93 94 92 | 0,73 0,77 0,69 |
| D’Incà et al.98 | Claprest (ELISA) | EII EC CU | 162 65 97 | CDAI >150 ET>4 | 130 130 130 | 68 65 70 | 67 62 70 | 52 44 60 | 79 80 79 | 0,67 0,65 0,70 |
| Costa et al.94 | Claprest (ELISA) | EC CU | 38 41 | CDAI >150 UCAI >4 | 150 150 | 87 89 | 43 82 | 50 81 | 83 90 | 0,58 0,87 |
| Molander et al.107 | CALPRO (ELISA) | EII | 49 | HBI >4 con Δ≥3 o HBI >8 PMS >2 | 140 200 | 53 50 | 79 83 | − | − | − |
| De Vos et al.106 | PhiCal Test (ELISA) | CU | 87 | PMS >2 o escalada tratamiento | >300 × 2 | 62 | 86 | 44 | 93 | − |
| Laharie et al.105 | Bühlmann (ELISA) | CD | 65 | CDAI >250 o escalada tratamiento | 130 250 | 61 43 | 48 57 | − − | − − | − − |
| Ferreiro et al.101 | Bühlmann Quantum Blue | CD | 30 | HBI >4 | 204 | 100 | 86 | 75 | 100 | 0,97 |
| Garcia-Planella et al.103 | PreventID CalDetect | CU | 206 | PMS ≥2 +escalada tratamiento | Indetectable 15 60 | 94 27 18 | 23 82 89 | 6 8 9 | 99 95 95 | − − − |
| Ferreiro et al.102 | Bühlmann Quantum Blue | EII | 95 | HBI >4 PMS >2 | 130 | 100 | 80 | − | − | 0,94 |
ABC: área bajo la curva ROC; CDAI: Crohn's Disease Activity Index; CU: colitis ulcerosa; DG: diagnóstico; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; Esp: especificidad; ET: Edwards and Truelove score; HBI: Harvey-Bradshaw Index; PMS: Partial Mayo Score; Sens: sensibilidad; TW: modified Truelove Witts score; UCAI: Ulcerative Colitis Activity Index; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En pacientes en remisión, las determinaciones seriadas de CF tienen mayor valor pronóstico que una determinación aislada. Los estudios que incluyen determinaciones periódicas de CF muestran que su elevación se puede detectar entre 3 y 6meses antes de la recidiva103,106,107,111, y que valores repetidamente bajos son altamente predictivos de remisión mantenida. De Vos et al.106 estudiaron el valor predictivo de determinaciones mensuales de CF en pacientes con CU en remisión. Dos determinaciones consecutivas de CF >300μg/g predijeron la recidiva con una sensibilidad del 61% y una especificidad del 100%, ambas superiores a las obtenidas con una sola determinación. Además, en este estudio fueron frecuentes discretas elevaciones aisladas de CF sin consecuencias clínicas.
Por tanto, según la evidencia disponible, puede utilizarse la determinación periódica de CF para para predecir la recidiva. Dado que la elevación de la CF suele preceder en unas 12semanas a la recidiva, parece razonable su determinación con periodicidad trimestral, especialmente en situaciones que requieren monitorización clínica más estrecha, como tras el tratamiento de inducción o modificaciones del tratamiento. En pacientes con bajo riesgo basal de recidiva, como aquellos en remisión de larga duración o con evidencia reciente de curación endoscópica, estos intervalos podrían dilatarse a semestrales. La determinación domiciliaria de la CF podría facilitar la monitorización de la EII en remisión13,14,18.
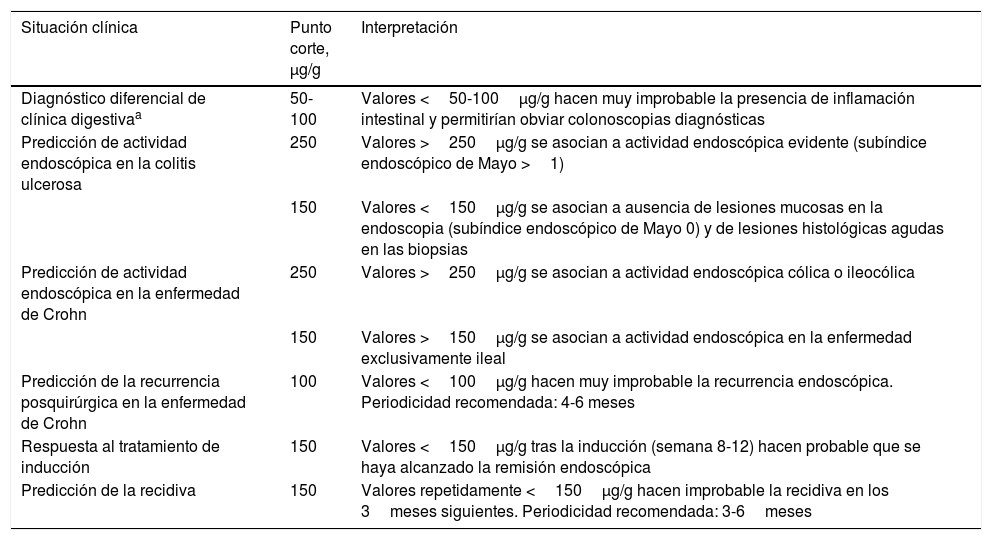
Consideraciones finalesLa CF es el mejor biomarcador de inflamación del que disponemos en la actualidad en el campo de la EII. Es una valiosa herramienta para diferenciar el síndrome de intestino irritable de procesos inflamatorios en pacientes con síntomas digestivos, se correlaciona con la actividad endoscópica tanto en la CU como en la EC, se asocia con la respuesta clínica y endoscópica al tratamiento y predice la recaída a corto plazo, incluso en pacientes en remisión endoscópica. Por todo ello, puede ser de gran ayuda para el clínico en el diagnóstico, la monitorización y la adaptación del tratamiento de la EII. En la tabla 7 se incluyen los puntos de corte orientativos de CF recomendados para diferentes escenarios clínicos y su interpretación.
Interpretación de la determinación de la calprotectina fecal en diferentes escenarios clínicos
| Situación clínica | Punto corte, μg/g | Interpretación |
|---|---|---|
| Diagnóstico diferencial de clínica digestivaa | 50-100 | Valores <50-100μg/g hacen muy improbable la presencia de inflamación intestinal y permitirían obviar colonoscopias diagnósticas |
| Predicción de actividad endoscópica en la colitis ulcerosa | 250 | Valores >250μg/g se asocian a actividad endoscópica evidente (subíndice endoscópico de Mayo >1) |
| 150 | Valores <150μg/g se asocian a ausencia de lesiones mucosas en la endoscopia (subíndice endoscópico de Mayo 0) y de lesiones histológicas agudas en las biopsias | |
| Predicción de actividad endoscópica en la enfermedad de Crohn | 250 | Valores >250μg/g se asocian a actividad endoscópica cólica o ileocólica |
| 150 | Valores >150μg/g se asocian a actividad endoscópica en la enfermedad exclusivamente ileal | |
| Predicción de la recurrencia posquirúrgica en la enfermedad de Crohn | 100 | Valores <100μg/g hacen muy improbable la recurrencia endoscópica. Periodicidad recomendada: 4-6 meses |
| Respuesta al tratamiento de inducción | 150 | Valores <150μg/g tras la inducción (semana 8-12) hacen probable que se haya alcanzado la remisión endoscópica |
| Predicción de la recidiva | 150 | Valores repetidamente <150μg/g hacen improbable la recidiva en los 3meses siguientes. Periodicidad recomendada: 3-6meses |
Es conveniente tener en cuenta algunas consideraciones para el uso adecuado de la CF en la práctica clínica. En primer lugar, cualquier decisión basada en los resultados de la CF debe tener en cuenta determinaciones seriadas coherentes (al menos dos), no una sola determinación. Esto aumentará la precisión del test y anulará el efecto de oscilaciones puntuales que pudieran producirse. En segundo lugar, la interpretación de las determinaciones de CF no puede desligarse del contexto clínico en el que se realizan. Debe tenerse en cuenta que el valor predictivo de una CF alta o baja depende de la probabilidad pre-test de que exista o no actividad endoscópica. Cuanto mayor sea la probabilidad pre-test de actividad, mayor es la posibilidad de que un valor alto de CF sea un verdadero positivo y un valor bajo sea un falso negativo, y viceversa. Así, por ejemplo, en un paciente que tras abandonar el tratamiento presenta diarrea y dolor abdominal, situación con probabilidad pre-test de actividad alta, valores de CF altos casi permiten asegurar que efectivamente existe actividad. En cambio, un valor bajo tendría más posibilidades de ser falso negativo. De la misma manera, ante un paciente en remisión clínica de larga duración, con probabilidad pre-test de actividad baja, valores bajos de CF hacen muy probable la ausencia de actividad y que, por lo tanto, el resultado sea un verdadero negativo. Por último, la toma de decisiones clínicas guiadas por los niveles de CF dependerá, además del valor predictivo del test, de la trascendencia de la decisión, esto es, de las eventuales consecuencias que un falso positivo o un falso negativo pudieran tener. Por ejemplo, el clínico se podría sentir cómodo decidiendo exclusivamente en base al resultado de la CF la frecuencia y el tipo de visita de control (presencial/telemática, médica/enfermería…), un incremento en las dosis de salicilatos o el inicio de un esteroide sistémico de acción tópica o de un tratamiento tópico. En cambio, ante decisiones de gran trascendencia clínica, como ante la posibilidad de una intervención quirúrgica, puede ser preferible recurrir a exploraciones endoscópicas o pruebas de imagen para minimizar la incertidumbre tanto como sea posible.
En definitiva, la CF es una herramienta que puede resultar de gran ayuda en el manejo del paciente con EII para el clínico conocedor de sus bondades y limitaciones.
Conflicto de interesesNinguno de los autores ha declarado tener conflicto de intereses respecto al presente estudio.