La reanimación cardiocerebral (RCC) es un concepto novedoso en la resucitación del paciente que sufre una parada cardiorrespiratoria (PCR) e incluye el conjunto de maniobras realizadas con el fin de restaurar la ventilación efectiva, oxigenación y circulación mediante medidas de resucitación avanzada (desfibrilación, compresiones torácicas externas, acciones sobre la vía aérea, ventilación, medicación intravenosa), realizadas por personal especializado1. La parada cardíaca intrahospitalaria representa un problema con una incidencia entre un 0,4 y 2% de los pacientes ingresados2. Dada la diversidad de pacientes, y de la ubicación en los distintos servicios en un hospital, los resultados se modifican según variables que incluyen no solo la comorbilidad del paciente, sino la ubicación, destreza y conocimiento de las últimas guías de actuación del personal especializado en el hospital3,4. Los resultados en términos de mortalidad y estado neurológico tras la reanimación son desalentadores, con una supervivencia media al alta hospitalaria del 7,9% en general, y del 21% si el ritmo es desfibrilable5, con unos resultados de tan solo el 20% de supervivencia para la PCR dentro del hospital5,6. De los supervivientes, hasta un 30% presenta una lesión cerebral permanente7,8. Probablemente el conocimiento e implantación de programas de desfibrilación precoz y el uso rutinario de un protocolo guiado por objetivos en la resucitación del paciente que sufre una PCR mejoraría estos resultados9.
Conceptos generalesEl término PCR se define como el cese brusco y no esperado de las funciones vitales de respiración y/o circulación, siendo la pérdida de estas potencialmente reversible. A consecuencia de este hecho existirá una incapacidad de oxigenación de los tejidos, siendo el cerebro el órgano más sensible a la anoxia. Tras 8-10 minutos sin recibir sangre ni oxígeno se establece una lesión celular con evolución a daño neuronal irreversible. Nuestro objetivo primordial debe ser mantener un flujo de sangre tisular durante el tiempo de la reanimación con el fin de minimizar en lo posible esta carencia de falta de oxigenación.
Se deben distinguir diferentes conceptos, que se exponen a continuación. PCR: interrupción brusca, inesperada y potencialmente reversible de la respiración y/o de la circulación. Puede iniciarse por parada respiratoria o por parada cardiaca. El diagnóstico es clínico, objetivándose inconsciencia, apnea y ausencia de circulación espontánea. Parada respiratoria (PR): cese de la respiración espontánea, persistiendo latidos cardiacos durante 3-4 minutos, siendo sus causas más frecuentes las intoxicaciones, obstrucción al flujo aéreo, trastornos del sistema nervioso central y traumatismos torácicos. Parada cardiaca (PC): situación que habitualmente se sigue a una PR o en el contexto de arritmias letales como fibrilación ventricular (FV) o taquicardia ventricular sin pulso (TVSP), así como en la actividad eléctrica sin pulso (AESP).
Hablamos de reanimación avanzada cuando se lleva a cabo por un equipo de profesionales cualificados y equipados con el material necesario para efectuar una desfibrilación y optimizar el soporte circulatorio y respiratorio. La reanimación cardiopulmonar o cardiocerebral básica se lleva a cabo sin ningún tipo de material, utilizando exclusivamente elementos básicos como el boca-boca con aire exhalado (el único dispositivo que se emplea es el denominado de barrera) y las manos para dar masaje cardíaco.
Reanimación cardiocerebralLa RCC constituye un nuevo enfoque en el tratamiento de la parada cardiocirculatoria, desarrollado en 2003 por el Grupo de Resucitación de la Universidad de Arizona, basándose en décadas de investigación con el convencimiento de que las guías internacionales desde el año 2000 basadas en ILCOR no eran óptimas10. Aplicando nuevas directrices de reanimación observaron un aumento de la supervivencia entre un 250 y un 300%11,12. Las guías internacionales en ILCOR de 2005 introdujeron parte de estos cambios13 y han sido consolidadas en las recientes guías de reanimación cardiopulmonar (RCP) 2010 ILCOR (International Liaison Committee on Resuscitation)14 y probablemente estarán muy presentes en futuras guías.
La RCC se constituye a partir de 3 pilares fundamentales15:
- 1)
Estudios recientes establecen la ventaja de la realización de 200 compresiones torácicas continuas (CTC) a un ritmo de 100 por minuto16.
- 2)
Darle menor importancia al control de la vía aérea. No se debe priorizar la intubación orotraqueal de estos pacientes, pudiendo usarse ventilación manual con ambú conectado a toma de oxígeno o incluso mascarillas de alto flujo14.
- 3)
Cuidados posresucitación y síndrome posparada17. Entidad clínica que se produce a consecuencia de la aplicación de maniobras de RCP una vez conseguida la recuperación de la circulación espontánea.
La condición indispensable para el inicio de medidas de RCP/RCC es el reconocimiento y diagnóstico de PCR, cuyos criterios clínicos son la inconsciencia, apnea y ausencia de pulso en grandes arterias (carótidas o femorales). Es una situación de urgencia, asumiendo el consentimiento presunto del paciente, salvo que la persona haya dejado por escrito orden expresa de no reanimar, como parte de su testamento vital. No obstante, existen determinadas situaciones clínicas que contraindican el inicio de la reanimación (tabla 1). El objetivo fundamental de las maniobras de reanimación es inicialmente reemplazar y posteriormente restaurar las funciones perdidas (respiración y circulación espontánea) cuando existan posibilidades razonables de recuperar las funciones cerebrales superiores. Se estima que el período óptimo en que se debe indicar la reanimación con el fin de conseguir una aceptable recuperación cerebral corresponde a los primeros 4 minutos para medidas de soporte vital básico y 8 minutos para el avanzado.
Contraindicaciones de inicio de la reanimación intrahospitalaria
| Presencia de signos indiscutibles de fallecimiento (livideces, rigor mortis, etc.) |
| Evolución de un proceso terminal o expectativa de vida digna altamente improbable |
| PCR con más de 10 minutos de evolución (bien documentados) sin que se hayan iniciado maniobras básicas de RCP básica, excepto en pacientes con hipotermia, ahogamiento o en intoxicación por barbitúricos. En caso de que el paciente llevara más de 10 minutos en PCR sin reanimación, puede plantearse el inicio de la misma si el paciente es un potencial donante de órganos |
| Cuando exista riesgo para el equipo reanimador |
PCR: parada cardiorrespiratoria; RCP: reanimación cardiopulmonar.
La reanimación debe ser indicada y finalizada por personal experto, siendo difícil un consenso para detener la RCP. Existe un acuerdo general de prolongar la reanimación cuando la PCR se produce en el contexto de intoxicaciones, consumo de sustancias ilícitas y causas potencialmente reversibles como la hipovolemia, hipotermia, neumotórax y trastornos hidroelectrolíticos18.
Se han estudiado los factores que influyen en la decisión de finalizar la RCP a través de encuesta a profesionales, concluyendo que el tiempo medio de reanimación es de 33 minutos, sin estar relacionado con el resultado19,20; los motivos del cese de la reanimación que se aducen son enfermedades previas (92%), intervalo de más de 5 minutos entre la PCR y el comienzo de la RCP (92%), duración de ésta (90%), edad del paciente (89%), alteraciones electrocardiográficas como asistolia, AESP o FV persistente (83%), pupilas midriáticas y arreactivas (78%), ausencia de reflejos de tronco del encéfalo (31%), temperatura corporal (12%) y sospecha de intoxicación por drogas (8%)21. Analizando estos datos, el cese de la reanimación puede llegar a ser muy subjetiva y con escasa base científica, y parece condicionar el sumatorio de varios elementos para la toma de decisiones (edad, comorbilidad previa y exploración neurológica) independientemente de las variables que han demostrado mayor valor en la morbimortalidad tras la recuperación de una PCR. Por ello, es apropiado guiarse por protocolos internacionales para sentar una decisión tan importante14. El cese de la reanimación podría realizarse más temprano en los pacientes que desarrollasen asistolia o AESP con duración en la RCP (15 y 20 minutos) que en aquellos con FV/TV (30 minutos)22, aunque el factor más importante en la aplicación de estas medidas es el reconocimiento del paciente susceptible de presentar deterioro y alta probabilidad de desarrollo de PCR para favorecer la aplicación precoz de diversas medidas de reanimación23. Las principales indicaciones de suspensión de la reanimación se resumen en la tabla 2.
Indicaciones de suspensión de reanimación intrahospitalaria
| Recuperación de la circulación y respiración espontáneas |
| Conocimiento de que la RCP iniciada es fútil (enfermedad irreversible), confirmación de que la PCR se produjo como consecuencia de la evolución natural de un proceso incurable |
| Presentación de orden de no RCP |
| Confirmación de que las maniobras de reanimación se iniciaron con un retraso superior a 10 minutos (excepto en los casos de ahogamiento, hipotermia accidental o intoxicación por barbitúricos) |
| Ausencia por más de 20 minutos de latido espontáneo a pesar de RCP adecuada, y en ausencia de actividad eléctrica. Se continuará siempre que persista TVSP/FV |
PCR: parada cardiorrespiratoria; RCP: reanimación cardiopulmonar; TVSP/FV: taquicardia ventricular sin pulso/fibrilación ventricular.
Se debe mantener la calma y solicitar ayuda. Hay que confirmar la ausencia de respiración espontánea y comprobar el pulso. En ausencia de pulso central y falta de respiración, nos encontramos ante una PCR, debiendo iniciar maniobras de reanimación avanzada, recordando anotar la hora de inicio y de finalización, con relación de 30 compresiones torácicas/2 ventilaciones (con tabla de resucitación), con una frecuencia de compresiones torácicas por lo menos de 100 por minuto y 10 ventilaciones, debiendo evitar la hiperventilación. Todo ello mientras se realiza la monitorización precoz del paciente y desfibrilación inmediata si se precisa. Este aspecto cobra actualmente mayor importancia, aconsejándose para la identificación del ritmo del paciente el uso de las almohadillas de desfibrilación en lugar de las palas del desfibrilador, ya que su uso nos permite no interrumpir las compresiones torácicas24. Se deben reiniciar precozmente (menos de 5 segundos) las compresiones torácicas tras la desfibrilación, recomendando utilizar, si es posible, un desfibrilador manual para minimizar el tiempo de la descarga25. Las compresiones torácicas deben ser de alta calidad, mínimamente interrumpidas a lo largo de cualquier intervención del soporte vital, y esto solo para permitir intervenciones específicas. Se deberán mantener las compresiones torácicas mientras se carga el desfibrilador, minimizando la pausa-descarga14. Se debe alternar el personal que realiza las compresiones torácicas cada 2 minutos, pero sin largas pausas en el cambio de reanimador24,25.
A su vez, una segunda persona debe controlar la vía aérea, debiendo retirar prótesis dental u otros obstáculos en orofaringe. Se debe mantener una adecuada ventilación-oxigenación con fracción inspiratoria de oxígeno (FiO2) a alto flujo, colocación de cánula de Guedel y ventilación con mascarilla con reservorio o ambú conectado a una fuente de oxígeno a 15 l/min y a una frecuencia de 10-12 ventilaciones/minuto. No se debe priorizar la intubación traqueal precoz, salvo que se lleve a cabo por reanimadores con alta pericia, con mínima interrupción de las compresiones torácicas14.
De forma coordinada, y simultáneamente con los reanimadores, el personal de enfermería deberá realizar la canalización preferentemente de dos vías periféricas y se iniciará una perfusión de suero fisiológico a alto ritmo. Actualmente ya no se recomienda la administración de medicamentos a través de un tubo traqueal. Si no se puede conseguir un acceso intravenoso, los fármacos deben ser administrados por vía intraósea14.
En toda reanimación intrahospitalaria avanzada (RIA) debería a su vez existir un reanimador principal de experiencia en estas situaciones, que tomará las decisiones de actuación terapéutica durante el procedimiento, obtendrá información de la historia clínica, deseos de reanimación del paciente, existencia de enfermedad terminal, etc., siendo la persona encargada de tomar la decisión de concluir la reanimación26.
Reanimación ante ritmos desfibrilables (FV/TVSP)Mediante estudios experimentales controlados se conocen tres fases en el desarrollo de PCR secundaria a FV/TVSP27. La primera fase hace referencia a una etapa eléctrica cuya duración aproximada es de 5 minutos, por ello el beneficio de una terapia de desfibrilación precoz mediante un desfibrilador automático externo (DESA)9, y de ahí que se recomiende el uso de estos en diversos lugares públicos como aeropuertos, estadios de fútbol, etc.9,28,29. La segunda fase en la PCR secundaria a FV corresponde a la fase hemodinámica, que dura un período inconstante, aunque se establece un lapso entre los 5 y 15 minutos tras la parada cardiocirculatoria. Durante este tiempo, la generación de una presión de perfusión cerebral y coronaria es fundamental para establecer una recuperación neurológica normal tras la reanimación. Durante la fase hemodinámica, el factor determinante de perfusión cerebral es la presión generada durante las compresiones torácicas30,31, y ésta se pierde cuando se detienen, por ejemplo, cuando se prioriza la asistencia de la vía aérea30,31. Teniendo presente que la causa más frecuente de FV es la cardiopatía isquémica y su aparición durante eventos coronarios agudos, es posible mantener la actividad eléctrica del miocardio en situación de FV gruesa con las compresiones torácicas externas, cuando las arterias coronarias son permeables y se consiga una presión de perfusión coronaria adecuada30,31. La equivalencia fisiológica de las compresiones torácicas extrínsecas en la RCP/RCC equivale a la «sístole» y la «diástole» en fase de no compresión32. Diversos estudios en animales sometidos a parada cardiaca prolongada relacionan la supervivencia y el retorno de circulación espontánea con las presiones de perfusión coronarias generadas durante las compresiones torácicas extrínsecas31,32, aunque existen otros determinantes que influyen directamente sobre este aspecto, como son el volumen vascular, la resistencia vascular y la presión intratorácica.
En esta fase hemodinámica, las situaciones donde existe un volumen intravascular bajo, como en el shock hemorrágico, o una marcada vasodilatación del sistema venoso, presentan peores resultados en la resucitación, de ahí la indicación de aumentar el volumen intravascular con fluidoterapia intensiva durante la fase de reanimación. Del mismo modo, es determinante la resistencia vascular durante la reanimación; ello explicaría por qué los fármacos vasopresores pueden mejorar los resultados de la reanimación33–36.
La propia presión intratorácica generada en la reanimación con compresiones torácicas extrínsecas es también un factor determinante que suele pasar desapercibido. Una presión intratorácica baja o negativa durante la fase de «diástole» o cese de la compresión favorece que aumente el retorno venoso en el pecho37. Por el contrario, una presión intratorácica alta durante la fase diastólica inhibirá el retorno venoso y la perfusión coronaria. Del mismo modo, se debe tener en cuenta que una ventilación excesiva disminuirá el retorno venoso en el tórax, disminuyendo la supervivencia38. En el estudio de Aufderheide et al. ya se hace mención a este factor y se recomienda una frecuencia ventilatoria entre 12 y 15 por minuto, en lugar de las clásicas 30 ventilaciones por minuto38. La tercera fase se denomina fase metabólica, donde existen numerosos mecanismos de lesión celular mediada por la hipoxia y generación de radicales libres, siendo en esta fase donde más protagonismo tiene la inducción de hipotermia y el síndrome posparada17.
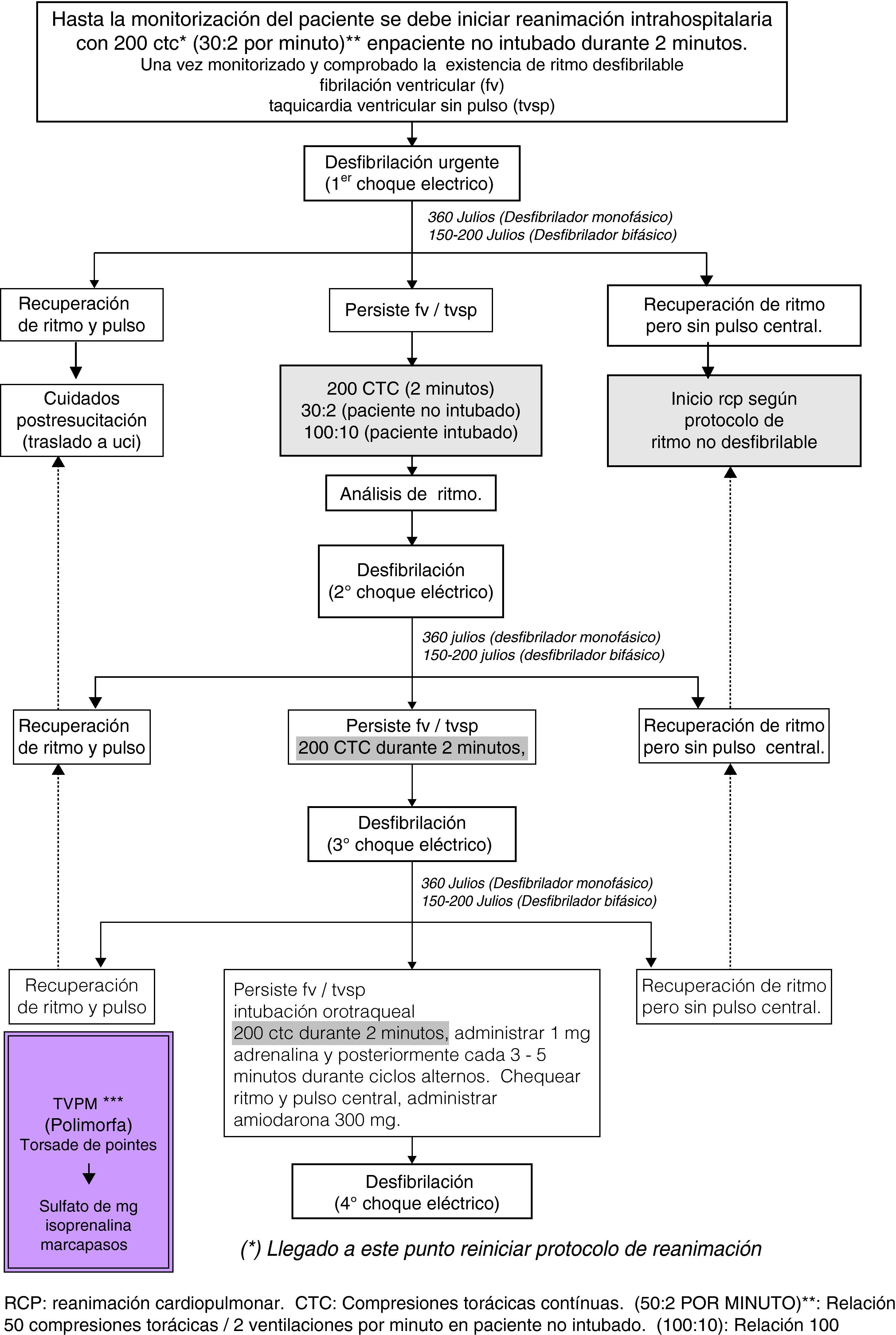
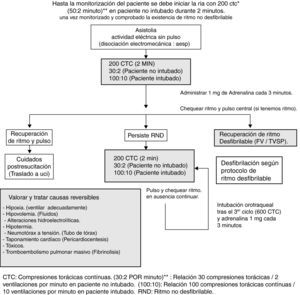
Actuación clínica ante ritmos desfibrilablesDurante la RIA, se iniciará inmediatamente la reanimación con 200 CTC a ritmo de 100 por minuto (frecuencia de 30 compresiones x 2 ventilaciones en paciente no intubado), mínimamente interrumpidas a la vez que se conecta el desfibrilador con los apósitos de desfibrilación en ambos hemitórax o palas y una vez identificado el rimo desfibrilable. En las guías actuales se disminuye el énfasis sobre el papel del golpe precordial14, cuya intención es generar una pequeña corriente eléctrica a partir de la energía mecánica desencadenada por el golpe. Esa energía (algo menos de 1-2 julios) puede llegar a resolver hasta un 40% de las taquicardias ventriculares y un 2% de las FV. Esta técnica no retrasa el uso de otras y los riesgos que presenta (desencadenar taquicardia o FV) no son valorables en un paciente en PCR. El primer choque eléctrico (TVSP preferiblemente en modo sincronizado y en FV asincrónico) debe realizarse con una energía de 360 julios si el desfibrilador es monopolar y 150-200 julios en desfibriladores bifásicos (se mantendrán las compresiones torácicas mientras se realiza la carga del desfibrilador). Si persiste la situación de PCR inmediatamente continuaremos con 200 CTC durante dos minutos. Durante este período se deberán haber canalizado dos accesos venosos periféricos y monitorizado al paciente. Transcurridos 2 minutos de reanimación se comprobará el ritmo por monitor, de manera que si persiste en situación de FV o TVSP se realizará el segundo choche eléctrico con las mismas características anteriormente descritas. Si éste no es efectivo continuaremos con 200 CTC. Transcurridos los 2 minutos de reanimación se valorará el ritmo. Si persistiera la situación se administrará el tercer choque eléctrico; si persiste la situación, y una vez reiniciadas las compresiones torácicas, se administrará 1mg de adrenalina y después cada 3-5 minutos (durante ciclos alternos de RCP)12,13. Después de la tercera descarga se administrarán 300mg de amiodarona y si persiste la situación de TVSP/FV se administrará un cuarto choque eléctrico. Si a pesar de todo ello seguimos en situación de TVSP o FV, está indicada la administración de 600-900mg de amiodarona en perfusión continua y seguir con el algoritmo. Únicamente tras verificar la existencia de ritmo por monitor valoraremos la existencia de pulso central; su presencia es indicación de traslado a unidad de posreanimación y en ausencia de pulso con ritmo deberemos iniciar el algoritmo de AESP (fig. 1).
Algoritmo de actuación ante una parada cardiocirculatoria con ritmo desfibrilable. CTC: compresiones torácicas continuas; RCP: reanimación cardiopulmonar; TVPM: taquicardia ventricular polimorfa; (50:2): relación 50 compresiones torácicas/2 ventilaciones por minuto en paciente no intubado; (100:10): relación 100 compresiones torácicas continuas/10 ventilaciones por minuto en paciente intubado.
El concepto de desfibrilación exitosa, según las recomendaciones del ILCOR, es la reversión de FV 5 segundos después del choque eléctrico39, aunque este concepto no incluye el retorno mantenido a un ritmo organizado y efectivo de la circulación40. Se define como FV recurrente o refractaria aquella que persiste tras 3 choques eléctricos sin éxito, siendo su frecuencia de casi un 25% de todas las paradas cardiocirculatorias con una mortalidad muy elevada (87-98%)41. La recurrencia de la FV es un fenómeno relativamente frecuente en las PCR, aunque lo habitual es conseguir un ritmo adecuado antes de un máximo de 5 choques eléctricos42. El tiempo medio desde la administración de un choque eléctrico y la reaparición de la arritmia es de 45 segundos, proceso independiente de aquel que provoca la PCR, del tipo de ritmo, onda y algunas características del propio enfermo (edad, sexo)42.
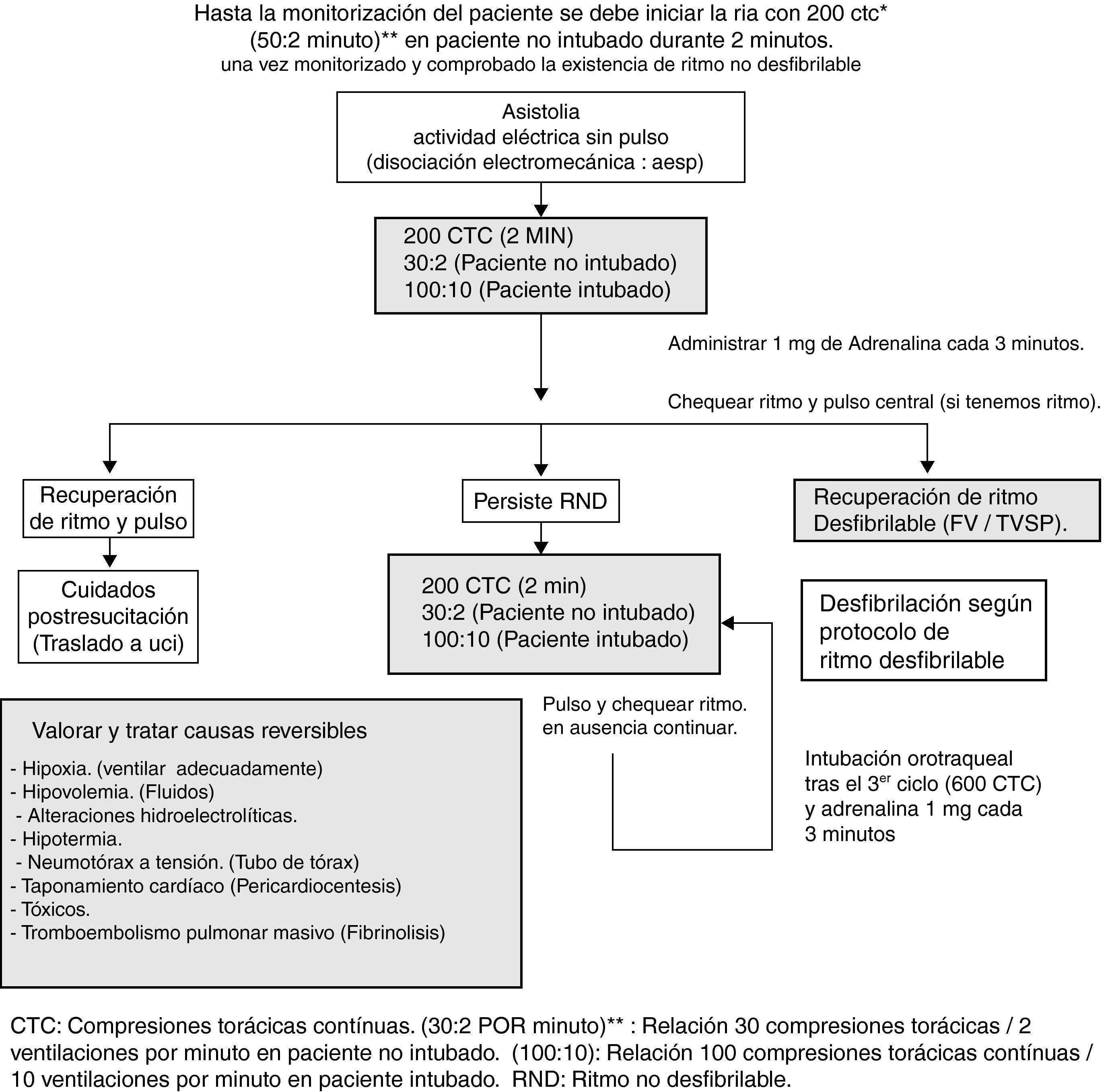
Reanimación ante ritmos no desfibrilables: asistolia y actividad eléctrica sin pulsoSe iniciará inmediatamente el protocolo de RIA con 200 CTC y frecuencia de 30 compresiones x 2 ventilaciones en pacientes no intubados, durante 2 minutos. Durante este período se deberán haber canalizado dos accesos venosos periféricos y monitorizado al paciente. Descartando la existencia de ritmo desfibrilable, se administrará precozmente 1mg de adrenalina iv (debiendo administrarse posteriormente cada 3-5 minutos). Actualmente no se recomienda la utilización rutinaria de atropina14, y continuaremos con 200 CTC durante 2 minutos, tras los cuales volveremos a analizar el ritmo y pulso. Si persiste la situación continuaremos con 200 CTC otros 2 minutos y si tras los mismos se constata la misma situación, se procederá a la intubación orotraqueal (esta debe durar menos de 30 segundos). Una vez el paciente esté intubado y comprobado en vía aérea no se requiere la sincronía entre las compresiones y ventilaciones, recomendando un ritmo de compresiones de 100 por minuto con 10 ventilaciones, reiniciándose el algoritmo. Se debe realizar el diagnóstico diferencial de causas potencialmente reversibles: hipoxia, hipovolemia, alteraciones hidroelectrolíticas, hipotermia, neumotórax a tensión, taponamiento cardiaco, tóxicos, tromboembolia pulmonar masiva (fig. 2).
Algoritmo de actuación ante una parada cardiocirculatoria con ritmo no desfibrilable (RND). CTC: compresiones torácicas contínuas; (30:2): relación 30 compresiones torácicas/2 ventilaciones por minuto en paciente no intubado. (100:10): relación 100 compresiones torácicas continuas/10 ventilaciones por minuto en paciente intubado.
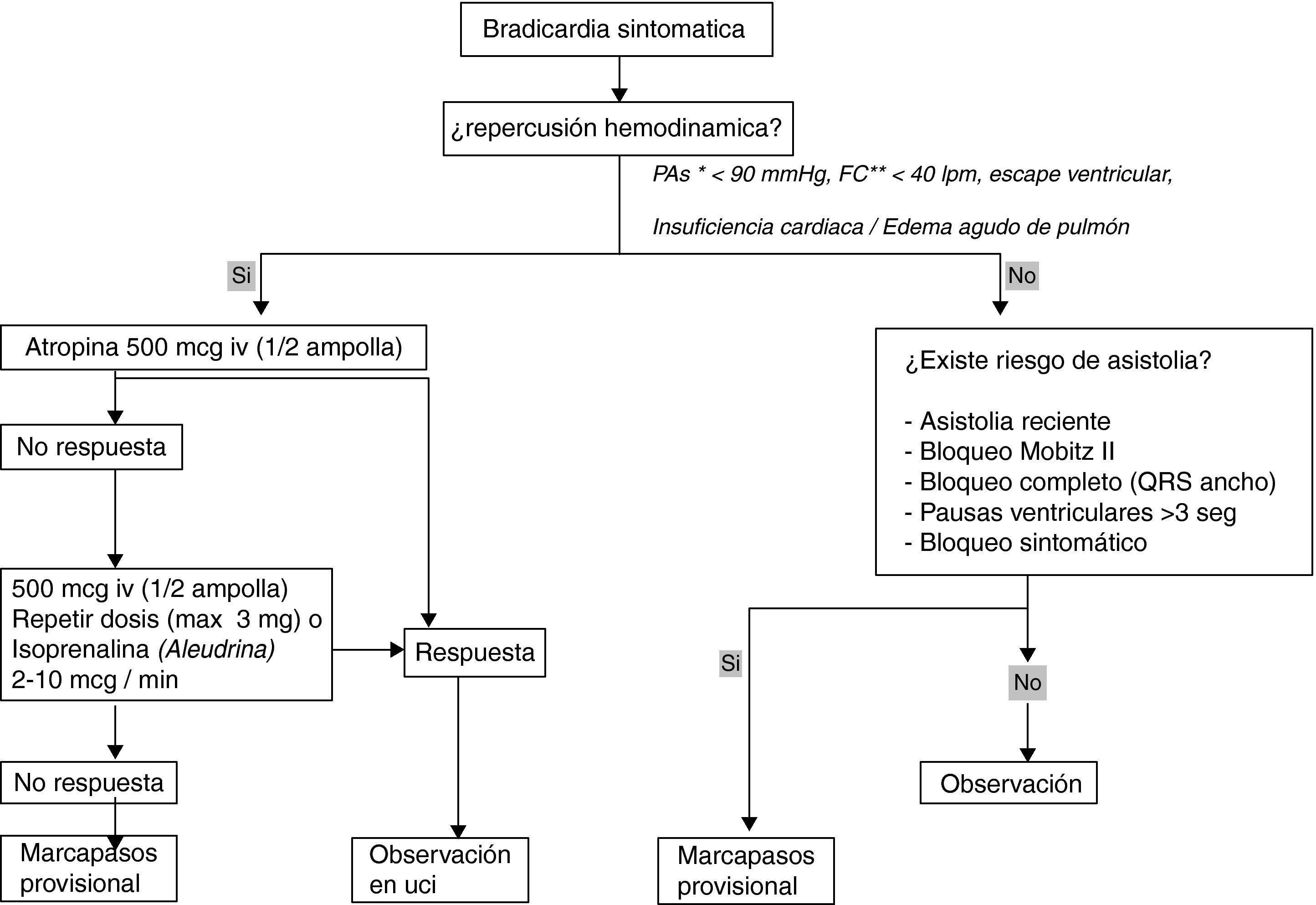
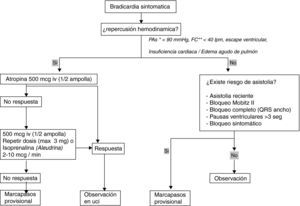
Ante un paciente que presenta una bradicardia con repercusión hemodinámica se administrarán 500 mcg de atropina (1/2 ampolla) iv y si no responde o existe riesgo de asistolia se administrarán otros 500 mcg, pudiendo repetir hasta un máximo de 3mg. En caso de falta adecuada de respuesta a la atropina, podemos utilizar la isoprenalina (Aleudrina®) como paso a implantación de marcapasos provisional (fig. 3).
Farmacoterapia en la parada cardiorrespiratoriaEl fármaco estrella en la reanimación avanzada es la adrenalina, por su naturaleza inotrópica y vasoconstrictora. Debe ser administrada a razón de 1mg iv cada 3-5 minutos. El uso de atropina actualmente no se aconseja de forma sistemática en los ritmos no desfibrilables y se reserva para los ritmos lentos hemodinámicamente inestables, siendo la dosis máxima recomendada 3mg iv (dosis que proporciona el máximo bloqueo vagal). Actualmente no está indicado el uso sistemático de bicarbonato sódico en la PCR, porque puede contribuir a una acidosis respiratoria grave que empeore la acidosis intracelular. Se utilizará bicarbonato 1M (1 mEq=1ml) siempre con control gasométrico, o cuando no sea posible, con una dosis inicial de 1 mEq/kg, una vez transcurridos al menos 10-15 minutos de reanimación. En la única situación en la que la administración debe realizarse sin demora es en la PCR secundaria a hiperpotasemia. No se debe mezclar la adrenalina con bicarbonato sódico porque se inactiva, así como tampoco se debe mezclar cloruro cálcico con bicarbonato sódico porque precipita; este último no está indicado en la actualidad en el tratamiento habitual de la PCR, salvo que ésta sea secundaria a intoxicación por antagonistas del calcio, hiperpotasemia o hipocalcemia. Desde el punto de vista terapéutico, en la recurrencia de la FV/TVSP se ha utilizado amiodarona (300mg tras el tercer choque) y lidocaína en el caso de falta de disponibilidad o contraindicación de la anterior43, aunque parece que la primera proporciona mayor supervivencia (el 27,7 frente al 15,3%)44. Actualmente no está indicado el uso de procainamida ni bretilio en este tipo de arritmias recurrentes. Se puede plantear el empleo de betabloqueantes o magnesio, respectivamente, cuando se sospecha como origen la cardiopatía isquémica o hipomagnesemia como causa de la FV39.
ConclusionesConsideramos que es inadmisible la baja supervivencia de los pacientes que sufren una PCR en el hospital fuera de áreas con personal entrenado para enfrentarse a estas situaciones3, y deberían existir cursos de formación práctica de forma continuada en el personal sanitario tanto eventual como estatutario que permitan identificar a aquellos pacientes con alto riesgo de sufrir un deterioro cardiorrespiratorio, conocer aspectos básicos como son la ubicación y el contenido del «carro de paradas» y del desfibrilador, así como iniciar las medidas básicas de reanimación mientras acude el equipo de asistencia especializada. La intubación orotraqueal en PCR no es imprescindible si se consigue ventilar correctamente al paciente y por tanto es preferible que la realice un facultativo entrenado en la técnica. Las compresiones torácicas deben ser ininterrumpidas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.