La nefropatía inducida por contraste (NIC) es una complicación derivada de procedimientos de intervencionismo coronario percutáneo, caracterizada por el deterioro agudo o subagudo de la función renal debido a la exposición a un medio de contraste yodado, que se asocia a un aumento de la morbimortalidad tanto a corto como a largo plazo.
Los factores favorecedores para el desarrollo de NIC han sido ampliamente descritos, así como las medidas de hidratación y farmacológicas para prevenir su desarrollo, pero pocas han demostrado hasta la fecha un nivel de evidencia A, con lo que se mantiene abierto un importante frente de investigación tanto en la prevención como en el tratamiento de esta enfermedad.
En este artículo se revisan aspectos epidemiológicos y fisiopatológicos de la NIC, así como distintas modalidades preventivas y terapéuticas existentes en la actualidad.
Contrast-induced nephropathy is a major complication resulting from percutaneous coronary interventional procedures characterized by acute or subacute deterioration of renal function due to exposure to iodinated contrast medium that is associated with increased morbidity and mortality.
Promoting factors for the development of nephropathy have been widely described in literature as well as hydration and pharmacological measures to prevent its development; However, few of them have shown evidence level A so far, hence a major research front remains open, not only in the prevention but also in the treatment of this pathology.
In this article we review epidemiological and pathophysiological aspects of this complication, and various preventive and therapeutic modalities currently available.
La definición actualmente aceptada para la nefropatía inducida por contraste (NIC) es la elevación de las cifras basales de creatinina en 0,5mg/dl en las primeras 24–72h tras exposición a un medio de contraste1. Se han aplicado otras definiciones como el incremento de cifras basales de 1mg/dl o el incremento superior al 25% del valor basal de creatinina. Sin embargo, el criterio de NIC como una elevación de creatinina mayor de 0,5mg/dl en las primeras 24–72h2 predice mayor tasa de episodios cardiovasculares mayores a los 6 meses de seguimiento, por lo que debería utilizarse de manera universal, ya que permitiría una comparativa adecuada de resultados de ensayos clínicos y metaanálisis.
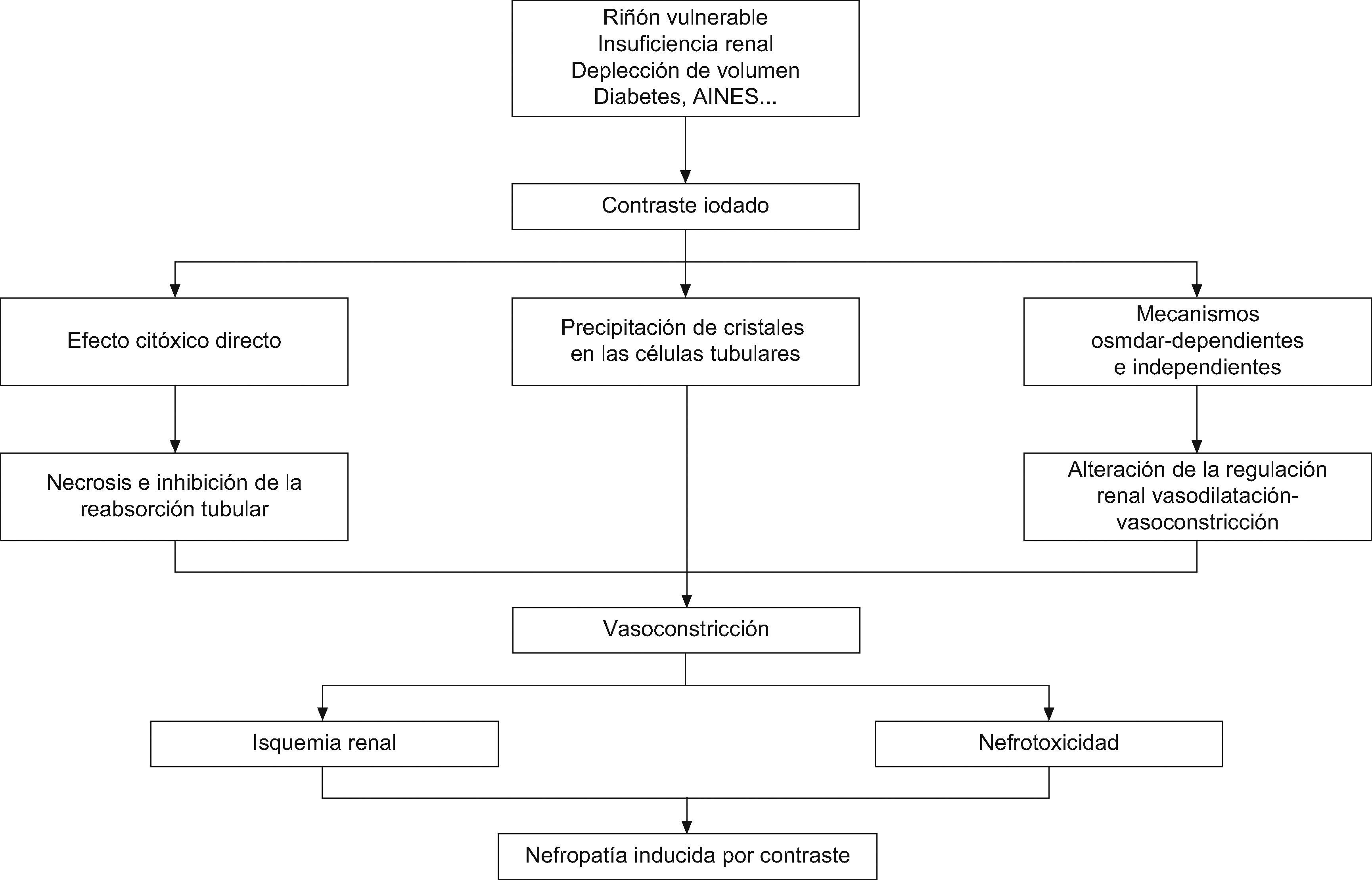
FisiopatologíaLa fisiopatología está directamente asociada al efecto sobre las células renales de los agentes de contraste yodado mediante un triple mecanismo3 (fig. 1): 1) el efecto citóxico directo del contraste yodado, que favorece fenómenos de vacuolización, apoptosis, necrosis e inhibición de la reabsorción tubular de proteínas; 2) favorecer la precipitación de cristales en las células tubulares, y 3) alterar el equilibrio de regulación renal vasodilatación-vasoconstricción, lo que conduce a la hipoxia medular renal y al desencadenamiento de una cascada oxidativa que provoca la pérdida de nefronas y tubular en última instancia.
EpidemiologíaLa incidencia de la NIC es variable según la población de referencia y los factores de riesgo del paciente. En la población general se ha descrito una incidencia del 0,6–2,3%4, que puede alcanzar el 6,1–8,5% en pacientes con insuficiencia renal (IR) crónica (IRC)5. En pacientes a los que se les realiza un procedimiento de intervencionismo coronario percutáneo (ICP) de carácter urgente por un síndrome coronario agudo (SCA), la incidencia alcanza el 12%6. En pacientes hospitalizados, con comorbilidad y alto riesgo, llega al 38% según las series7.
Relevancia clínica y pronósticoLa NIC es la tercera causa de IR de origen iatrogénico8 en pacientes hospitalizados y causante del 11% de los casos de IR adquirida en el hospital9. Los pacientes que presentan esta complicación tienen, tras ajuste por comorbilidad, una tasa de muerte intrahospitalaria del 22 frente al 1,4% de los que no la presentan. La tasa de mortalidad en el seguimiento a un año (12,5%) y a los 5 años (44,6%) también es superior (el 3,7 y el 14,5%, respectivamente)10.
Gruberg et al11 observaron en 440 pacientes con IR grave que la mortalidad intrahospitalaria en los pacientes complicados con NIC fue del 17 frente al 3,9% de los pacientes no complicados (p<0,01) y también al año de seguimiento (el 43,3 frente al 20,1%; p<0,001).
En cuanto a la necesidad de diálisis, McCullough et al12 refieren en una serie de 1.826 pacientes un 0,8% de necesidad de diálisis temporal y, de estos, un 13% requirió tratamiento renal sustitutivo definitivo por IR permanente. En el subgrupo de pacientes de alto riesgo (diabetes mellitus o IRC), la tasa de diálisis temporal o permanente fue del 12%.
Asimismo, en términos de gasto sanitario, la NIC incrementa en una media de 10.345 dólares la estancia hospitalaria y en 11.812 dólares el gasto sanitario en el primer año13.
Factores de riesgoLa determinación de factores de riesgo que favorecen el desarrollo de NIC tras ICP ha sido objeto de estudio en numerosas ocasiones.
Se han clasificado en 2 grandes grupos: 1) aquellos relacionados intrínsecamente con el paciente, como IR previa, edad, diabetes mellitus, uso de fármacos nefrotóxicos, fracción de eyección deprimida, situaciones de bajo gasto cardiaco, anemia, trasplantes renales e hipoalbulinemia, y 2) factores dependientes del procedimiento, como volumen de contraste utilizado14, uso de agentes de high-osmolal contrast media (HOCM, «contrastes de alta osmolaridad»), inyección intraarterial, múltiples inyecciones de contraste en un plazo inferior a 72h y utilización de balón de contrapulsación intraaórtico.
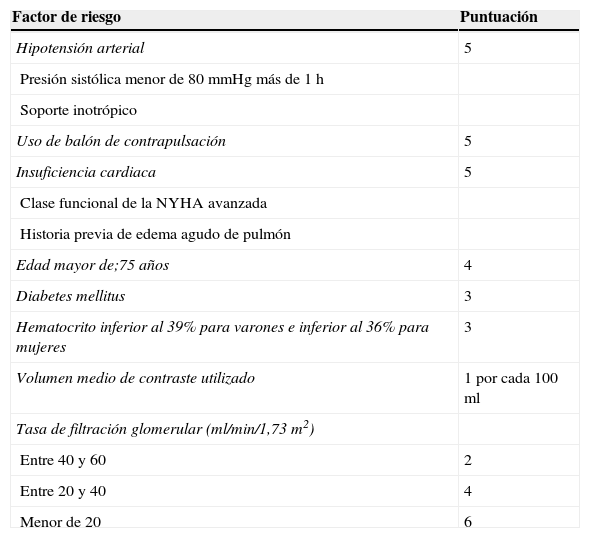
La preexistencia de IR grado 3, definida como la tasa de filtrado glomerular renal inferior a 60ml/min/1,73m2, es el factor predisponente con más peso para el desarrollo de NIC tras ICP. Una creatinina previa al procedimiento superior a 3mg/dl incrementa el riesgo de IR aguda (IRA) y de mayor mortalidad intrahospitalaria. El riesgo de IRA grave aumenta con la asociación de creatinina elevada y diabetes15. Por esto, se han propuesto modelos de cálculo de riesgo de NIC teniendo en cuenta los factores predisponentes conocidos. Mehran et al16 proponen una puntuación de riesgo (tabla 1) en la que una puntuación inferior a 5 puntos supone un riesgo de NIC del 7,5% y una necesidad de diálisis del 0,04%, mientras que por encima de 16 puntos los porcentajes de NIC alcanzan el 57,3% y la necesidad de diálisis el 12,6%. Estos autores señalan una correlación clara ente la puntuación en la escala de riesgo y la mortalidad a un año.
Predicción del riesgo de nefropatía inducida por contraste después de un procedimiento percutáneo coronario (adaptado de Mehran et al16)
| Factor de riesgo | Puntuación |
| Hipotensión arterial | 5 |
| Presión sistólica menor de 80mmHg más de 1 h | |
| Soporte inotrópico | |
| Uso de balón de contrapulsación | 5 |
| Insuficiencia cardiaca | 5 |
| Clase funcional de la NYHA avanzada | |
| Historia previa de edema agudo de pulmón | |
| Edad mayor de;75 años | 4 |
| Diabetes mellitus | 3 |
| Hematocrito inferior al 39% para varones e inferior al 36% para mujeres | 3 |
| Volumen medio de contraste utilizado | 1 por cada 100ml |
| Tasa de filtración glomerular (ml/min/1,73m2) | |
| Entre 40 y 60 | 2 |
| Entre 20 y 40 | 4 |
| Menor de 20 | 6 |
| Puntuación | |||
| Puntos totales | Riesgo de incremento de creatinina sérica mayor de 0,5 mg/dl o del 25%, % | Riesgo de diálisis, % | Mortalidad al año, % |
| Menos de 5 | 7,5 | 0,04 | 2 |
| 6–10 | 14 | 0,12 | 5,7 |
| 11–16 | 26,1 | 1,09 | 13,5 |
| Más de 16 | 57,3 | 12,6 | 33,3 |
NYHA: New York Heart Association.
En este contexto, los datos respecto a la incidencia y los factores predictores de NIC son escasos, ya que muchos estudios que los han evaluado han excluido a los pacientes con infarto agudo de miocardio. En un subestudio del ensayo CADILLAC 217, la incidencia descrita de NIC tras angioplastia primaria fue tan solo del 4,6%; esto puede deberse a la exclusión de pacientes con IR previa o en situación de shock cardiogénico, así como a no disponer de mediciones diarias de la función renal, ya que únicamente se consideró el valor de creatinina al ingreso y al alta hospitalaria.
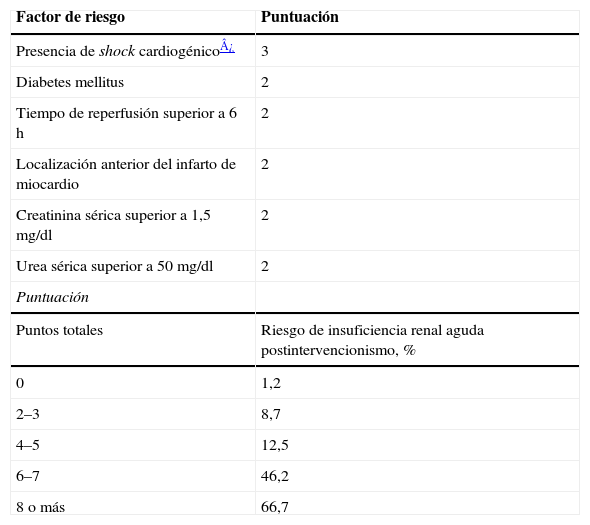
En el caso de ICP por SCA, la incidencia de desarrollo de IRA fue del 12% en la serie de Bouzas-Mosquera et al6 de 602 pacientes a los que se les realizó angioplastia primaria por SCA con elevación del segmento ST (SCACEST). En el análisis de los factores determinantes resultaron significativos la presencia de shock cardiogénico, diabetes mellitus, tiempo de reperfusión superior a 6h, localización anterior del infarto, creatinina sérica superior a 1,5mg/dl y urea sérica superior a 50mg/dl. Todas las variables presentaron valores de odds ratio similares (en torno a 3), excepto el shock cardiogénico. Con ellas se elaboró una puntuación de riesgo y se clasificó a los pacientes en 5 categorías (tabla 2). Se observó un incremento significativo en el riesgo de IRA por cada incremento en la puntuación, que fue del 1,2% en los pacientes con 0 puntos y del 66,7% en aquellos con más de 8 puntos. Tanto la mortalidad intrahospitalaria como la supervivencia libre de episodios cardiovasculares mayores a largo plazo resultaron significativamente superiores en el grupo de pacientes que desarrollaron IRA frente a los que no la desarrollaron.
Predicción del riesgo de nefropatía inducida por contraste y fracaso renal agudo después de un cateterismo cardiaco urgente (adaptado de Bouzas-Mosquera et al6)
| Factor de riesgo | Puntuación |
| Presencia de shock cardiogénico¿ | 3 |
| Diabetes mellitus | 2 |
| Tiempo de reperfusión superior a 6h | 2 |
| Localización anterior del infarto de miocardio | 2 |
| Creatinina sérica superior a 1,5mg/dl | 2 |
| Urea sérica superior a 50mg/dl | 2 |
| Puntuación | |
| Puntos totales | Riesgo de insuficiencia renal aguda postintervencionismo, % |
| 0 | 1,2 |
| 2–3 | 8,7 |
| 4–5 | 12,5 |
| 6–7 | 46,2 |
| 8 o más | 66,7 |
El grupo de Marenzi et al18 identificó la edad de 75 años o más, la utilización de balón intraaórtico de contrapulsación, la localización anterior del infarto, el volumen de contraste y el tiempo a la reperfusión como predictores de NIC tras angioplastia primaria.
La función renal basal es un poderoso predictor de IRA tras el procedimiento. La función renal basal varía con la edad, el sexo y la masa muscular. Para una evaluación más fiable puede usarse una estimación de la tasa de filtrado glomerular o del aclaramiento de creatinina. Sadeghi et al19, en 2.082 pacientes a los que se les realizó ICP urgente por SCA sin shock cardiogénico, describieron una incidencia de NIC en el grupo con IR previa casi 3 veces superior a la de una cohorte que presentaba una función renal basal normal, además de una mortalidad mayor a 30 días y al año, una mayor tasa de reinfarto, doble tasa de complicaciones hemorrágicas y una mayor tasa de reestenosis grave del stent en el subgrupo de pacientes que presentaban IR.
Intervencionismo sobre oclusiones crónicasEl intervencionismo sobre oclusiones crónicas conlleva la exposición a mayores volúmenes de contraste, por lo que el riesgo de desarrollo de IRA es mayor tras este tipo de procedimientos. La incidencia y los factores predictores de NIC en el intervencionismo sobre oclusiones crónicas han sido escasamente señalados hasta la fecha. Aguiar Soto et al20 refirieron, en el análisis retrospectivo de 227 pacientes a los que se les realizó este tipo de intervencionismo, una incidencia del 6,16% de IRA, que en ningún caso precisó diálisis. Entre las limitaciones de este análisis está, por un lado, el perfil de bajo riesgo de los pacientes incluidos (el 55% tenía menos de 5 puntos en la escala de Mehran et al16) y, por otro, que solo se analizó el incremento superior al 25% de las cifras de creatinina en las primeras 24h, de esta manera, es posible una infraestimación de las cifras de IRA, por lo que deben abrirse más frentes en la determinación de la incidencia y los factores predictivos de desarrollo de NIC en el intervencionismo sobre oclusiones crónicas.
Estrategias de prevenciónDado que una vez establecida la NIC no hay tratamientos efectivos, el interés por estrategias de prevención de esta forma de IRA ha cobrado interés creciente en los últimos años, ya que los ensayos clínicos realizados han permitido obtener conclusiones limitadas. En la tabla 3 se indican las recomendaciones de evidencia actuales en la prevención de la NIC.
Recomendaciones de evidencia actuales en la prevención de la nefropatía por contraste
| Nivel de evidencia A |
|
| Nivel de evidencia B |
|
| Nivel de evidencia C |
|
NIC: nefropatía inducida por contraste; IR: insuficiencia renal; UCI: unidad de cuidados intensivos.
A pesar de que no hay ensayos clínicos aleatorizados, parece obvio que la supresión de fármacos nefrotóxicos debe realizarse días previos a procedimientos electivos de ICP. Deberían incluirse como fármacos de riesgo los antiinflamatorios no esteroideos, los diuréticos de asa o los antibióticos nefrotóxicos (subgrupo aminoglucósidos). No están contraindicados en principio los fármacos antihipertensivos del grupo de inhibidores de la enzima conversiva de renina-angiotensina, y puede continuarse su uso en el periprocedimiento. La metformina debe suspenderse al menos 48h antes del procedimiento dado el riesgo de desencadenar una acidosis láctica en el contexto de una IRA inducida por contraste.
Pautas de hidrataciónLa administración de tratamiento con fluidos y evitar situaciones de depleción de volumen son 2 pilares básicos en la profilaxis de la NIC. Mueller et al21 compararon la pauta de suero salino al 0,9 frente al 0,45% en 1.620 pacientes a los que se les realizó ACTP. La incidencia de NIC en el subgrupo que recibió suero salino al 0,9% fue del 0,7 frente al 2% del grupo con pauta con suero al 0,45% (p=0,04). No se demostró que la pauta de suero al 0,9% fuera más nefroprotectora que la de suero al 0,45% en el subgrupo de pacientes con IRC (creatinina >1,6mg/dl), pero sí en otros 3 subgrupos (diabéticos, mujeres y aquellos pacientes que recibieron más de 250ml de contraste yodado). El bicarbonato sódico ha sido objeto de estudio dada la hipótesis de que la alcalinización del túbulo renal puede disminuir la formación de radicales libres y reducir el daño renal. Merten et al22 evaluaron la incidencia de NIC en 137 pacientes aleatorizados a recibir suero salino al 0,9% frente a 124mEq/l de bicarbonato sódico. Se utilizaron en ambos casos protocolos de hidratación similares, y los resultados fueron favorables al uso de bicarbonato sódico, puesto que en este grupo la incidencia de NIC fue inferior (el 1,7 frente al 13,6%; p=0,02). Posteriormente, en el estudio MEENA23 se compararon de nuevo el suero salino al 0,9% y 124mEq/l de bicarbonato en un ensayo clínico aleaorizado de 353 pacientes, y no se obtuvieron diferencias significativas en el criterio primario de valoración (incremento superior al 25% de cifras basales de creatinina en las 96h subsiguientes al procedimiento).
Como conclusiones, hasta la fecha no se ha demostrado superioridad de ninguna pauta de hidratación intravenosa ni se ha establecido la superioridad de la administración intravenosa frente a la vía oral24. Nos encontramos ante la necesidad de futuros estudios para determinar el régimen óptimo de hidratación en la nefroprofilaxis, así como para determinar protocolos específicos para subgrupos de alto riesgo.
Contrastes yodadosLos medios de contraste poseen una nefrotoxicidad secundaria a las moléculas de carbono y los átomos yodados que los componen que se asocia al volumen de contraste utilizado, a la osmolaridad y a la viscosidad de este.
Se clasifican en los siguientes tipos: 1) HOCM; 2) low-osmolal contrast media (LOCM, «contrastes de baja osmolaridad»), y 3) iso-osmolal contrast media (IOCM, «contrastes isoosmolares»). Entre los HOCM destaca el diatizoato, entre los LOCM destacan el iohexol, ioversol, el iopamidol y el ioxaglato, y entre los IOCM destaca el iodixanol.
El volumen de contraste utilizado se ha identificado como un factor predictor independiente de desarrollo de NIC, especialmente en pacientes con IR previa25. Sin embargo, no se ha establecido un volumen de contraste límite hasta la fecha, por lo parece razonable limitar el uso de contraste yodado en los procedimientos de ICP en la medida que sea posible.
La osmolaridad de los diferentes medios de contraste ha sido objeto de numerosas comparaciones. Un metaanálisis de 39 estudios26 encontró que en pacientes con IR previa, el uso de LOCM disminuye el riesgo relativo de desarrollo de NIC frente al uso de HOCM. En cuanto a los estudios que han comparado IOCM frente a LOCM, los resultados no han sido concluyentes. En el estudio NEPHRIC27, que comparó iohexol frente a iodixanol en 135 pacientes con IRC, se encontró que las cifras de creatinina a los 3 días eran superiores en los pacientes que recibieron iohexol (p=0,002). En el estudio RECOVER28 (ioxaglato frente a iodixanol), de los 300 pacientes con IRC analizados, la incidencia de NIC fue también mayor con el agente de menor osmolaridad. Sin embargo, en el estudio ICON29, que comparó iodixanol frente a ioxaglato en 146 pacientes con IRC, no se hallaron diferencias significativas. En el estudio CARE30, que comparó iopamidol frente a iodixanol en un total de 482 pacientes con IRC, tampoco se encontró diferencias significativas en la incidencia de NIC en ambos grupos.
N-acetilcisteinaLa N-acetilcisteína (N-AC) es el fármaco que reúne más ensayos en la profilaxis de la NIC. A pesar de los numerosos metaanálisis31–33 que se han realizado tratando de establecer la indicación formal de este fármaco, no existe una evidencia científica clara sobre las dosis adecuadas que deben utilizarse tanto en los procedimientos habituales como en los urgentes y, de hecho, en las guías clínicas aparece como indicación con nivel de evidencia B. La principal limitación de los metaanálisis disponibles hasta la fecha es que recogen ensayos clínicos que parten de diferentes criterios de inclusión de pacientes, utilizan diferentes protocolos de administración de N-AC o bien hacen referencia a procedimientos electivos o urgentes, por lo que es extremadamente difícil obtener conclusiones homogéneas y aplicables en la práctica clínica.
El papel nefroprotector de la N-AC se atribuye a propiedades directas antioxidantes y vasodilatadoras (que aumentan la actividad vasodilatadora de oxido nítrico), y a otras indirectas que podrían tener relación con la inducción de la síntesis de glutatión hepático. La vida media de la sustancia en sangre es baja (6–40min) y, administrada por vía oral, sufre metabolización de primer paso intestinal y hepática, lo que condiciona baja biodisponibilidad y alta variabilidad (6–20%) de las concentraciones plasmáticas34.
El primer grupo que documentó una pauta profiláctica con N-AC fue el de Tepel et al35, con 600mg/día de N-AC el día previo al procedimiento y el día del procedimiento. El último metaanálisis publicado36 concluyó que el uso de N-AC reduce significativamente la incidencia de NIC, por lo que, a pesar de la necesidad de futuros estudios, su bajo coste y bajo perfil de efectos indeseables justifican su uso en la profilaxis de NIC.
Varios estudios han combinado distintas pautas de hidratación con N-AC para identificar una combinación más nefroprotectora. En el estudio REMEDIAL37 se comparó, en 326 pacientes con IR previa a los que se les realizó un procedimiento de ICP, la eficacia de 3 pautas de hidratación (con suero salino y N-AC, con bicarbonato sódico y N-AC, y con suero salino, ácido ascórbico y N-AC). Las dosis de N-AC utilizadas en los 3 grupos fueron de 1.200mg por vía oral/12h el día previo al procedimiento y en el día del procedimiento. La incidencia de NIC fue significativamente mayor en los pacientes que recibieron suero salino frente a los que recibieron bicarbonato sódico (p=0,019). En oposición a estos resultados, un estudio de 502 pacientes con IRC38 aleatorizados para recibir suero salino y 600mg por vía oral de N-AC 2 veces al día frente a bicarbonato sódico y la misma pauta de N-AC no demostró superioridad del bicarbonato sódico frente al suero salino, por lo que la hidratación con bicarbonato 154mEq/l no se ha demostrado a día de hoy superior al suero salino en pacientes con IRC.
Chen et al39 evaluaron la eficacia de hidratación con suero salino y N-AC en 936 pacientes en los que se realizó intervencionismo. Un total de 660 pacientes tenían cifras basales de creatinina inferiores a 1,5mg/dl (n=660), de los cuales la mitad se aleatorizó para no recibir profilaxis y los restantes recibieron pauta de hidratación con suero salino, sin que existieran diferencias significativas en la incidencia de NIC en estos subgrupos. El resto de pacientes incluidos tenían cifras de creatinina superiores a 1,5mg/dl (n=276) y se aleatorizaron para recibir pauta de N-AC sin hidratación o N-AC con hidratación con suero salino; los primeros tuvieron una incidencia de NIC superior, por lo que concluyeron que, en pacientes con creatinina basal superior a 1,5mg/dl, la pauta de hidratación y no el uso de N-AC aporta el mayor peso en el efecto nefroprotector, mientras que en los pacientes con creatinina basal inferior a 1,5mg/dl, la hidratación no conlleva beneficios adicionales. Estudios posteriores40,41 reafirmaron estos resultados al concluir que es la pauta de hidratación y no la N-AC (independientemente de la dosis) la clave en la nefroprotección en pacientes con IRC a los que se les haya realizado ICP. Carbonell et al42 han concluido que la administración intravenosa de N-AC en pacientes con IRC confiere beneficio frente a placebo en el combinado de desarrollo de NIC, la necesidad de diálisis y la mortalidad en unidad coronaria.
Parece justificada a día de hoy la puesta en marcha de ensayos clínicos aleatorizados y controlados con placebo que definan el papel nefroprotector de la N-AC sobre la base de una evidencia clínica sólida y no de parámetros de laboratorio. Quizá en esta línea el estudio ACT-trial43 pueda aportarnos mayor evidencia para el uso de altas dosis de N-AC en la profilaxis de NIC.
Otros fármacosOtros fármacos han sido objeto de estudio en análisis previos. Ninguno de los 4 estudios con dopamina demostró beneficio en su uso en cuanto a reducción de la incidencia de NIC. En el caso de la teofilina, los 9 ensayos clínicos que compararon este fármaco frente a placebo obtuvieron resultados conflictivos. En un ensayo clínico reciente44, la administración intravenosa de vitamina E previamente al procedimiento demostró efecto protector frente a placebo en pacientes con IRC. Similar resultado se obtuvo en la profilaxis de NIC con iloprost45, péptido natriurético46 y probucol47.
El resto de fármacos no han demostrado nefroprotección, incluso alguno de ellos ha resultado estar contraindicado, como es el caso de la furosemida, el feneldopán y el receptor de la endotelina48. El ácido ascórbico ha demostrado menor eficacia nefroprotectora que dosis altas de N-AC en pacientes con IR y diabetes a los que se les realizó ICP49.
Patti et al50 han estudiado el efecto nefroprotector de las estatinas en 434 pacientes a los que se les realizó intervencionismo. La incidencia de NIC fue del 3% en el grupo pretratado con estatinas frente al 27% en el grupo de no tratados (p=0,001). Sin embargo, en el análisis por subgrupos, este beneficio no se demostró para los pacientes que tenían de base IR con filtrado glomerular renal inferior a 40ml/min1/1,73m2. Recientemente se ha demostrado que dosis altas de atorvastatina (80mg), junto con una pauta de hidratación y N-AC previa al procedimiento de ICP, no reducen la incidencia de NIC en pacientes con IR51.
Nefroprotección en procedimientos de urgenciaLa carencia de pautas profilácticas de NIC en procedimientos de urgencia se justifica por la dificultad que conlleva la selección de pacientes para ensayos clínicos aleatorizados, por la imposibilidad de retirada de fármacos que el paciente está tomando en ese momento (p. ej., metformina) y por la situación de shock que puede presentarse en pacientes con SCA que requieren un intervencionismo urgente y en los que las pautas de infusión de tratamiento con suero no son posibles, además de que suelen precisar altas dosis de diuréticos.
Marenzi et al52 aleatorizaron un total de 354 pacientes con SCACEST en los que se indicó un ICP urgente en 3 grupos de tratamiento. El grupo A (n=119) recibió una dosis alta de N-AC (bolo de 1.200mg por vía intravenosa y, posteriormente, 1.200mg/24h durante 48h). El grupo B (n=116) recibió un bolo por vía intravenosa de 600mg y continuó con 600mg/24h durante 48h. El grupo C recibió placebo. En el análisis final, el criterio de valoración primario combinado de muerte o IR grave con necesidad de diálisis fue menor en el grupo A (p=0,02).
El estudio RENO53 seleccionó a 111 pacientes con SCACEST y comparó en 2 grupos aleatorizados el efecto nefroprotector de una infusión de bicarbonato sódico y dosis altas de N-AC (bolo por vía intravenosa de 2.400mg en la hora previa al procedimiento, seguido de 1.200mg/24h en las 48h siguientes) frente al efecto protector de una pauta de suero salino con dosis estándar de N-AC (1.200 en bolo por vía intravenosa, seguido de 1.200mg/24h durante 48h). La incidencia de nefropatía fue menor en el primer grupo (el 1,8 frente al 21,8%; p=0,001), aunque es difícil establecer hasta qué punto el beneficio nefroprotector está otorgado por la hidratación con bicarbonato sódico o por las dosis altas de N-AC, pero se indica un posible efecto dependiente de la dosis de este fármaco.
Tratamiento renal sustitutivo; hemodiálisis y hemofiltraciónSe sabe que la hemodiálisis es una técnica efectiva en cuanto a capacidad de lavado rápido de contraste en pacientes con IR54, pero los resultados de los 4 ensayos clínicos realizados para valorar el beneficio de la hemodiálisis profilática con respecto a las medidas habituales ofrecen resultados contradictorios. Un ensayo clínico aleatorizado reciente55 estableció el beneficio de la hemodiálisis profiláctica en pacientes de alto riesgo (con IRC) frente a una pauta de profilaxis con hidratación con suero salino con menor necesidad de diálisis posprocedimiento por deterioro grave de la función renal (p<0,001), lo que indica que los pacientes con aclaramiento menor de 25ml/min/1,73m2 podrían beneficiarse de la hemodiálisis como profilaxis previa al ICP.
La hemofiltración es una técnica que, previa a la coronariografía, se ha demostrado efectiva en la prevención de NIC en pacientes con IR si se compara con una pauta de hidratación exclusivamente56; a pesar de que es una técnica, resulta coste-efectiva en pacientes con IR y alto riego de desarrollo de NIC57. Lee et al58 indicaron que la hemofiltración debe comenzar previamente al procedimiento y mantenerse durante al menos las 12–18h posteriores. Sin embargo, se precisan estudios futuros previamente a su establecimiento como medida profiláctica sistemática en pacientes con IR.
ConclusionesLa NIC es una complicación grave derivada del uso de contraste yodado en los procedimientos de ICP que se asocia a elevada morbimotalidad intrahospitalaria y a largo plazo, así como a un mayor consumo de recursos sanitarios. La IR y la diabetes mellitus son los factores predictores con más peso para el desarrollo de esta, aunque son necesarios más estudios para la identificación de pacientes de alto riesgo y así validar las puntuaciones de riesgo que están aceptadas actualmente.
En los últimos años se han desarrollado numerosos ensayos clínicos con diferentes pautas de hidratación y fármacos en el intento de buscar fórmulas de profilaxis óptimas. Sin embargo, el empleo de diferentes criterios en la definición de NIC, el tamaño muestral pequeño y el uso de diferentes protocolos de administración de tratamiento con fluidos y fármacos dificultan en los metaanálisis realizados la obtención de pautas aplicables a la práctica clínica.
Las técnicas de hemodiálisis y hemofiltración parecen ser efectivas en la profilaxis de la NIC en pacientes con IR al menos moderada, aunque aún no hay evidencia firme para su empleo en el momento actual.
En el futuro, ensayos clínicos aleatorizados, con un número muestral suficiente y con unanimidad en los criterios de definición tanto de NIC como del paciente de alto riesgo serían necesarios para establecer pautas profilácticas con alto nivel de evidencia tanto en el ICP programado como en el urgente.
A manera de resumen y siguiendo los datos científicos y los niveles de evidencia actuales, en la tabla 4 se exponen las recomendaciones que han demostrado un mayor impacto en los diferentes estudios clínicos realizados.
Recomendaciones clínicas para la prevención de la nefropatía por contrastes yodados
| Recomendaciones para la prevención de la nefropatía por contraste |
|
AINE: antiinflamatorios no esteroideos.
Los autores declaran no tener ningún conflicto de intereses.