El hipotiroidismo primario es el déficit hormonal más frecuente en la práctica clínica, que afecta a un 4 a un 6% de la población1. Es más prevalente en el sexo femenino y aumenta con la edad. Diferentes situaciones pueden favorecer su aparición: puerperio, antecedentes familiares de enfermedad autoinmunitaria, antecedentes de cirugía tiroidea o de cuello y el tratamiento con radioyodo, radioterapia cervical o la ingesta de determinados fármacos (yodo, amiodarona, carbonato de litio, interferón-α, interleucina-2, denileukin diftitox, etc.). También son pacientes de riesgo los portadores de otras enfermedades autoinmunitarias endocrinas (diabetes, insuficiencia suprarrenal crónica e insuficiencia ovárica), o no endocrinas (anemia perniciosa, celiaquía, síndrome de Sjögren, artritis reumatoide, esclerosis múltiple y vitíligo)1–3, así como aquéllos con hipertensión pulmonar primaria4 o determinadas enfermedades genéticas como los síndromes de Turner, de Down o de Prader-Willi1,2,5.
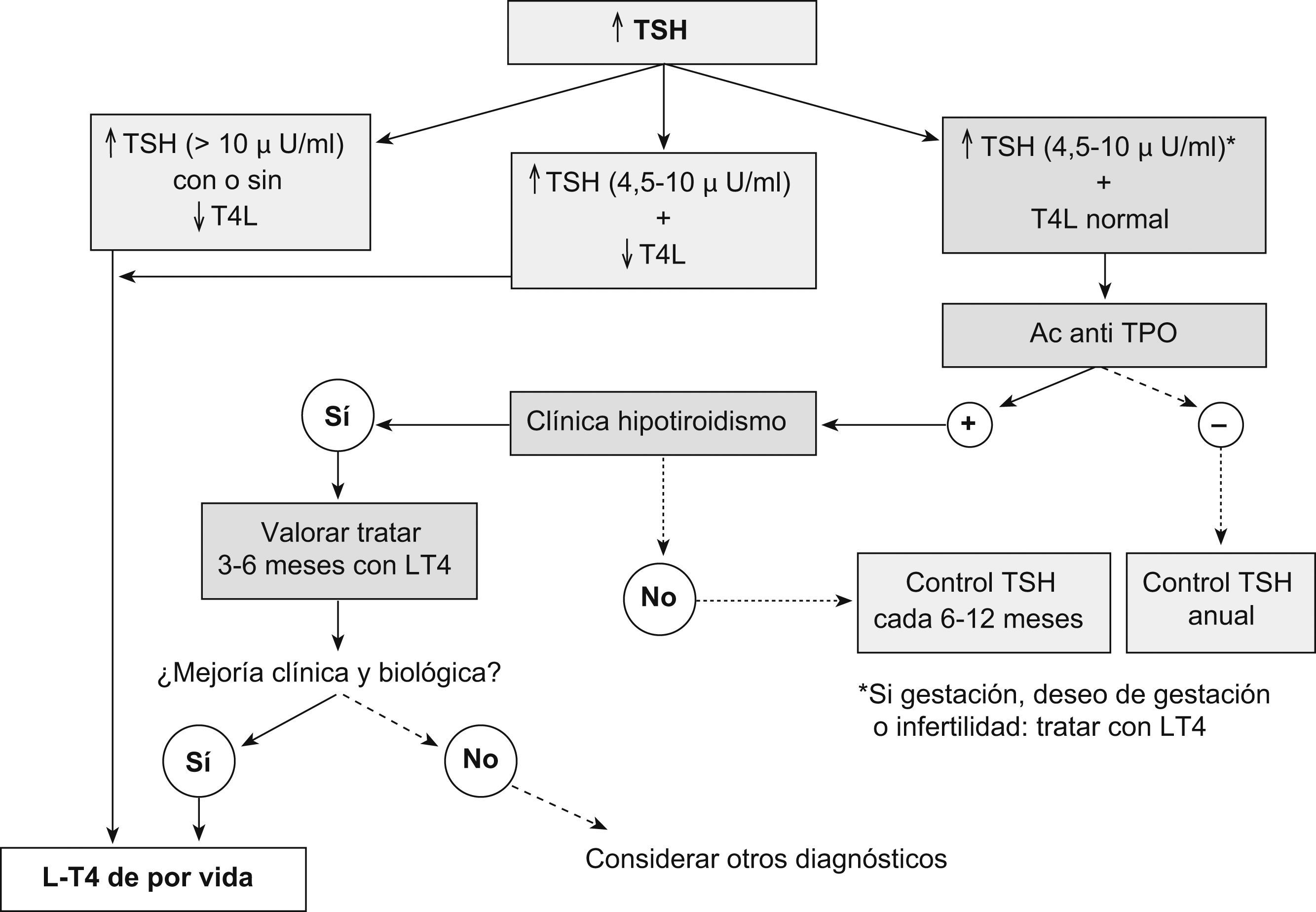
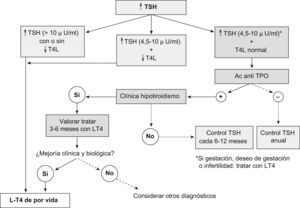
Como consecuencia del déficit primario de la función tiroidea, la concentración plasmática de la tiroxina libre (T4l) se encuentra disminuida en mayor o menor grado, mientras que la concentración de la TSH (thyroid-stimulating hormone ‘tirotropina’) está elevada. Así, los valores elevados de la TSH identifican a personas con hipotiroidismo primario (clínico o subclínico), con independencia de la gravedad y de la etiología de la enfermedad1. Con la T4l disminuida y la TSH normal o baja conviene pensar en un hipotiroidismo central1,6,7 o en la interferencia de fármacos que alteren los resultados hormonales, aún en ausencia de enfermedad tiroidea1,8. Los expertos2 consideran buena praxis confirmar el diagnóstico con una segunda determinación de la función tiroidea.
Aunque el tratamiento clínico del hipotiroidismo es relativamente sencillo y puede ser perfectamente asumido por la asistencia primaria, en la práctica diaria se presenta una serie de factores que pueden originar errores en la dosificación de la levotiroxina, deteriorar el control y complicar el seguimiento de los pacientes con visitas y análisis más frecuentes9. En general, los principales factores de confusión en el seguimiento clínico del hipotiroidismo están relacionados con una adherencia insuficiente al tratamiento, interferencias farmacológicas y dietéticas y variaciones en el peso, así como con la presencia de situaciones clínicas (diagnosticadas o no) que ocasionan cambios en las necesidades de levotiroxina. En el nivel asistencial especializado, estos factores son con frecuencia motivo de debate y reflexión entre los profesionales más expertos y los médicos en formación. Según las anteriores consideraciones, ha parecido interesante revisar la bibliografía disponible al respecto para actualizar, agrupar y divulgar unos conocimientos que los autores de este estudio creen de utilidad clínica para el tratamiento terapéutico óptimo del hipotiroidismo.
Levotiroxina: farmacodinámica y farmacocinéticaLa T4l sintética es el paradigma del tratamiento sustitutivo del hipotiroidismo. Sus efectos son idénticos a los de la hormona natural. La absorción de la levotiroxina es buena, aunque variable. Se absorbe entre un 60 y un 80% en el intestino delgado proximal y esta absorción no varía en relación con la función tiroidea6. La situación de ayuno favorece su absorción y desde este punto de vista se aconseja tomar el tratamiento unos 30 a unos 60min antes del desayuno7. La necesidad de un medio gástrico ácido para una absorción efectiva de la levotiroxina es motivo de debate8,10–15. La absorción máxima se presenta entre 1 a 4h y el tiempo medio de eliminación suele ser de 6 a 7 días. Circula unida a una proteína transportadora específica (TBG [thyroxine-binding globulin 'tiroglobulina']), pero también se une a prealbúmina y albúmina. Su metabolismo es hepático y renal y desarrolla sus efectos en el receptor de triyodotironina (T3)7.
Dosis de la levotiroxina y cambios en las necesidades del tratamiento sustitutivoEl objetivo del tratamiento del hipotiroidismo es el tratamiento sustitutivo con la dosis necesaria de levotiroxina que permita mejorar la clínica de hipofunción tiroidea, recuperar las concentraciones fisiológicas de la T4l y mantener las concentraciones de la TSH en la mitad inferior de los valores del intervalo normal1,2,7. La dosis óptima en los adultos puede oscilar entre 1,6 y 1,8μg/kg/día. Esta dosis suele ser más baja en los ancianos (0,5μg/kg/día)1,7 y más alta en los niños. En general, la dosis de un varón de peso normal suele variar entre 100 y 150μg/día, mientras que la de una mujer en la misma situación suele ser algo menor (entre 75 y 100μg/día)1,7, aunque puede oscilar entre 50 y 200μg/día15. Esta dosis puede depender de la etiología del hipotiroidismo y parece relacionada con el remanente del tejido tiroideo funcionante7. A pesar de que la levotiroxina tiene una vida media larga y que la omisión de alguna toma no comporta ningún riesgo14, en aquellas situaciones (cirugía y enfermos críticos) en que no se pueda garantizar el aporte oral de la T4l durante un período mayor de 5 a 7 días debe administrarse tiroxina endovenosa (del 70 al 80% de la dosis oral habitual)7. El algoritmo para iniciar el tratamiento sustitutivo se esquematiza en la figura 1. En este sentido, para iniciar el tratamiento oral hay 2 posibilidades (tabla 1). Una posibilidad es iniciar el tratamiento con una dosis plena de levotiroxina de 1,6μg/kg/día (de 100 a 125μg/día para un adulto de unos 70kg de peso). Esta posibilidad suele ser la más utilizada al iniciar el tratamiento sustitutivo de una tiroidectomía total, siempre que no haya enfermedad cardíaca grave de base. La otra posibilidad es iniciar el tratamiento con 25 a 50μg/día y ajustar la dosis cada 6 a 8 semanas, según la magnitud del hipotiroidismo. Esta opción es la de elección en los pacientes de edad >60 a 65 años o con enfermedad cardiovascular2,6, aunque en los pacientes geriátricos con cardiopatía isquémica también se contempla la posibilidad de iniciar el tratamiento con una dosis más baja (12,5μg)2. Para determinados autores1, la segunda opción es innecesaria en los adultos sanos, ya que retrasa la recuperación clínica y precisa más análisis y visitas. Para otros7,16, aunque la normalización de la función tiroidea se consigue antes con una dosis plena, la clínica y la calidad de vida mejoran de forma similar en ambas opciones terapéuticas. Desde este punto de vista, conviene recordar que algunas de las manifestaciones clínicas del hipotiroidismo pueden persistir meses después de normalizada la función tiroidea y algunos pacientes pueden insistir en este aspecto2. Una situación especial puede ser la aparición de un claro empeoramiento clínico al iniciar el tratamiento sustitutivo (a pesar de mantener la TSH en la mitad inferior del intervalo normal). En estos casos conviene descartar la asociación con una enfermedad de Addison también autoinmunitaria2,17. Considerada esta excepcionalidad, en general, si el paciente presenta clínica indicativa de hipotiroidismo a pesar de mantener la función tiroidea bien regulada, algunos autores2 indican aumentar la dosis del tratamiento sustitutivo en 12,5 a 25μg (cada día o días alternos) o bien administrar levotiroxina por la noche, ya que para algunos investigadores la toma nocturna aumenta su absorción18. Otros14 proponen cambiar 50μg de levotiroxina por 12,5μg de liotironina (T3), sobre la base de que algunas puntuaciones psicométricas mejoran significativamente con esta pauta. De momento, las pruebas disponibles no apoyan la utilización generalizada de esta propuesta de tratamiento combinado en las personas con hipotiroidismo2,7,9. En estos casos conviene informar al paciente que el cambio puede ser transitorio y reversible, en función de la respuesta terapéutica, además de explicar los síntomas guía de un exceso de dosis. Desde este mismo punto de vista, si en los pacientes de edad >60 años la concentración de la TSH es baja, es aconsejable reducir la dosis de la levotiroxina en 25μg (diarios o en días alternos), ya que en esta situación aumenta el riesgo de osteoporosis y de fibrilación auricular2,19,20. La dosis final parece estar relacionada con el peso corporal (masa magra) y con la concentración inicial de la TSH.
Tratamiento sustitutivo con levotiroxina en los pacientes con hipotiroidismo primario del adulto
|
TSH: tirotropina.
Después de iniciado el tratamiento sustitutivo del hipotiroidismo primario, es necesario controlar la función tiroidea a los 2 o 3 meses2. Para esto, la piedra angular es la determinación de la TSH sola antes de la toma diaria de la levotiroxina14, aunque en situaciones especiales pueden realizarse extracciones no basales con una fiabilidad aceptable. Monitorizar el seguimiento del tratamiento sustitutivo sólo con la TSH suele ser suficiente en casi todos los pacientes, con la clara excepción de los casos de hipotiroidismo central. En esta situación concreta la concentración de la TSH habitualmente será baja y el objetivo terapéutico será mantener la levotiroxina en la mitad superior del intervalo normal1,6. En el hipotiroidismo primario, si la concentración de la TSH sigue alta, es recomendable mantener controles periódicos cada 2 a 3 meses. En los pacientes jóvenes de bajo riesgo, se puede ajustar la dosis de la levotiroxina mediante la incrementación de 25 a 50μg cada 4 semanas, pero en los ancianos y en los pacientes de riesgo elevado conviene ser más cautos y aumentar 12,5 a 25μg cada 4 a 6 semanas. Una vez identificada la dosis necesaria y estabilizada la concentración de la TSH, los controles pueden realizarse anualmente. Conviene tener presente que después de la toma de una dosis de levotiroxina la concentración sérica de la T4l aumenta más deprisa en comparación con el descenso de la TSH7. La situación de eutiroidismo suele alcanzarse a los 3 a 6 meses de iniciado el tratamiento15. En ocasiones, puede encontrarse con la aparente incongruencia de que la TSH esté elevada y la T4l se sitúe en el límite alto de la normalidad o algo por encima. En este caso, lo más probable es que se trate de un paciente poco cumplidor que intenta enmendar su mala adherencia al tratamiento con un exceso de dosis los días previos al análisis1,6,21. Aunque en general el ajuste de dosis es sencillo, la efectividad terapéutica no es siempre la deseada y, en la práctica, un 20% de los pacientes están infratratados y otro 20% recibe una dosis excesiva6.
Malabsorción y seudomalabsorciónDiferentes situaciones y factores pueden alterar las necesidades del tratamiento sustitutivo y condicionar un ajuste de dosis (tabla 2). Desde este punto de vista, conviene diferenciar 2 conceptos distintos: malabsorción y seudomalabsorción. De manera simple y concisa se conoce como malabsorción a la alteración de la absorción de nutrientes. No obstante, de manera más amplia, parece aceptado que se trata de un defecto de la mucosa intestinal que origina una alteración de la absorción y transporte de nutrientes y otras sustancias desde el tubo digestivo hasta la circulación general, debida a causas congénitas (defectos en el sistema de trasporte de membrana del intestino delgado) o, principalmente, a defectos adquiridos en la superficie epitelial de absorción, ya sea por enfermedades intestinales inflamatorias o por la administración de determinados fármacos22,23. Así, la malabsorción de la levotiroxina se puede definir como una disminución de la absorción de la hormona tiroidea sintética relacionada con interacciones farmacológicas, o alimentarias, u otras enfermedades asociadas. Por otra parte, se habla de seudomalabsorción si hay una mala adherencia al tratamiento (no siempre reconocida por los pacientes), aunque Ain et al la definen como «mal cumplimiento terapéutico con intención de engañar»24. Esta situación puede obligar al terapeuta a incrementar la dosis de tratamiento sustitutivo de manera no habitual hasta 200 a 400μg/día. Para algunos autores1,6 debe sospecharse seudomalabsorción cuando hay un control insuficiente de la función tiroidea con levotiroxina en la mitad superior de los valores normales y una TSH superior al doble del límite máximo de la normalidad, a pesar de las dosis anormalmente altas de levotiroxina. En la bibliografía se han publicado distintas pruebas diagnósticas y opciones de tratamiento para la seudomalabsorción25. La opción más habitual2 es la de administrar una vez por semana la dosis semanal total de levotiroxina (ejemplo: 700μg a la semana si la dosis diaria es de 100μg). Esta opción no debería utilizarse en los pacientes con enfermedad coronaria7.
Factores que aumentan las necesidades de la tiroxina libre (levotiroxina)
|
|
TBG: thyroxine-binding globulin ‘tiroglobulina’.
Si la adherencia al tratamiento es buena y la concentración de la TSH supera el límite normal, sin otras interferencias o situaciones clínicas que lo justifiquen, conviene considerar la posibilidad de una disminución de la actividad biológica del preparado comercial utilizado y verificarlo con un cambio de envase o de marca6. También se sabe que algunos pacientes, en apariencia resistentes al tratamiento sustitutivo con hormona tiroidea, absorben bien los preparados comerciales de la levotiroxina si se pulverizan las respectivas tabletas antes de ingerirlas7. Otras posibilidades para tener en cuenta pueden ser el error en la dosis al extender la receta (por ejemplo: 50μg en lugar de 150μg), el error de dispensación en la oficina de farmacia o bien un cambio de marca, pues aunque se mantenga la misma dosis la bioequivalencia puede ser distinta9.
La seudomalabsorción suele deberse a la coexistencia de enfermedad psiquiátrica de base, principalmente un síndrome depresivo24,25, agravado o manifestado por el mal control de la función tiroidea, que a la vez incrementa la mala adherencia al tratamiento. Según los expertos25, confrontar al paciente con las razonables dudas del clínico respecto a la mala adherencia al tratamiento no mejora la actitud del paciente ni los resultados terapéuticos y agrava la seudomalabsorción. En consecuencia, los pacientes con alteraciones facticias o con estigmas de síndrome de Munchhausen precisan un abordaje muy meticuloso y conservador. Cuando sea posible, una estrategia terapéutica en colaboración con expertos en psicología y psiquiatría puede ser de una gran ayuda, pero no siempre suficiente.
Malabsorción de la levotiroxina relacionada con interacciones farmacológicasAlgunos fármacos influyen en el transporte sanguíneo de las hormonas tiroideas al aumentar o al disminuir las concentraciones de la TBG (modifican la tiroxina total [T4], pero no modifican las concentraciones de la T4l y de la T3 libre [T3l] ni las de la TSH). Otros interfieren el metabolismo de estas hormonas de la misma manera que determinados medicamentos inhiben la absorción de la levotiroxina cuando se toman conjuntamente8. En la tabla 2 se resumen las distintas posibilidades.
Fármacos que reducen la absorción intestinal de la tiroxina libreSulfato ferroso. Estudios in vitro26 indican que la administración conjunta de sulfato ferroso y levotiroxina forman un compuesto insoluble tiro-férrico que reduce la absorción de la hormona. Este hecho parece especialmente relevante en el tratamiento con levotiroxina en aquellas personas más susceptibles a presentar ferropenia (mujeres en edad fértil, gestantes y ancianos) y que deberían recibir información específica para evitar dicha interferencia medicamentosa26–28. Conviene recordar que algunos polivitamínicos contienen también sales férricas.
Carbonato de calcio. También hay pruebas de que el carbonato de calcio reduce la absorción de la levotiroxina sintética8,27. In vitro y en un medio ácido, la levotiroxina adsorbe el carbonato de calcio y se reduce la biodisponibilidad de la hormona12,17. Hay pruebas de que el tratamiento crónico con levotiroxina aumenta el riesgo de osteoporosis29, especialmente a partir de los 60 años2. El tratamiento habitual de la osteoporosis incluye las sales de calcio y, en consecuencia, conviene informar a la población hipotiroidea sobre los posibles efectos del carbonato cálcico en la eficacia terapéutica de la levotiroxina.
Resinas. Las resinas utilizadas en el tratamiento de la hipercolesterolemia (principalmente colestiramina, pero también colestipol) se ligan a las hormonas tiroideas y disminuyen su absorción8. Así mismo, se han descrito casos de inhibición de la absorción intestinal de la levotiroxina con resinas de intercambio iónico para el tratamiento de la hiperpotasemia30 y con un quelante del fósforo como sevelamer31.
Sucralfato. En este caso las pruebas son menos claras. Estudios in vitro32 demuestran la unión de sucralfato con levotiroxina, pero los estudios in vivo13 son discrepantes. No obstante, distintos autores1,6,9,15,25 incluyen este principio activo en las listas de fármacos inhibidores de la absorción de la levotiroxina.
Hidróxidos de aluminio y de magnesio. Diferentes estudios33–35 con antiácidos que contienen hidróxido de aluminio demuestran que este principio activo inhibe la absorción de la levotiroxina. Los estudios in vitro34,35 concluyen que la razón fundamental de este hecho es la adsorción de la levotiroxina al hidróxido de aluminio. El hidróxido de magnesio también puede disminuir la absorción de la levotiroxina, aunque el mecanismo in vitro no se ha podido demostrar35.
Inhibidores de la bomba de protones. Se ha demostrado un aumento de las necesidades de la levotiroxina en los pacientes con bocio multinodular bajo tratamiento frenador con levotiroxina y tratados con 40mg/día de omeprazol por reflujo gastroesofágico. Las necesidades de la levotiroxina no se modifican durante los 6 primeros meses de tratamiento con omeprazol10, pero sí posteriormente. En otro estudio realizado con lansoprazol36, en los pacientes con hipotiroidismo bien controlado se evidencia un aumento significativo en las concentraciones de la TSH a los 2 meses de iniciado el tratamiento con este inhibidor de la bomba de protones. Otras investigaciones no evidencian cambios en la absorción de la levotiroxina después de una semana de tratamiento con esomeprazol37 o pantoprazol38. Por otra parte, el efecto supresor de estos fármacos sobre la secreción gástrica, así como el aumento de las necesidades del tratamiento sustitutivo en enfermedades asociadas con hipoclorhidria, indica la necesidad de un medio ácido para una absorción efectiva de levotiroxina8, pero, como ya se comentará, no hay unanimidad al respecto. En esta misma línea, otros fármacos que pueden reducir el medio ácido gástrico también pueden interferir la absorción de la levotiroxina8,10, aunque hay poca información respecto a los antagonistas de los receptores H2. Parece ser que la ranitidina no aumenta la concentración de la TSH39 y que la famotidina no induce malabsorción de la levotiroxina37.
Orlistat. Se trata de un potente inhibidor de la lipasa pancreática que se utiliza en el tratamiento de la obesidad y que puede originar malabsorción de la levotiroxina. Se cree que la unión de el orlistat con la hormona origina la malabsorción de la levotiroxina40,41. Es bien conocido que, en la práctica, la obesidad y el hipotiroidismo pueden coincidir y, en consecuencia, conviene prevenir la toma conjunta de ambos fármacos.
Raloxifeno. Se trata de un modulador selectivo de los receptores de estrógenos utilizado en la osteoporosis posmenopáusica. En este caso, el mecanismo que origina la disminución de la absorción de la levotiroxina todavía se desconoce. Se han descrito casos42,43 de pacientes bien controladas con dosis estables de levotiroxina que precisaron incrementar su dosis habitual mediante la coincidencia de la ingesta simultánea de raloxifeno; al separar las tomas de ambos fármacos la dosis de levotiroxina disminuyó hasta los valores habituales. Estos datos indican una malabsorción de la levotiroxina cuando ésta se administra junto al raloxifeno. Sin embargo, conviene tener presente que también se han comunicado aumentos significativos, pero mínimos, de la TBG en relación con el tratamiento con el raloxifeno, aunque algunas pruebas existentes44,45 indican que es poco probable que altere a largo plazo la función tiroidea a través de este mecanismo de acción. Para otros autores8 puede alterar los análisis de función tiroidea sin que haya ninguna disfunción en la tiroides. Desde un punto de vista práctico, si se tiene en cuenta que el hipotiroidismo es una enfermedad frecuente en las mujeres posmenopáusicas y que ésta es una población diana para el tratamiento con raloxifeno, parece razonable contemplar la posibilidad de esta interacción y evitar la toma simultánea de ambos fármacos.
Tamoxifeno. Se trata de un antiestrógeno no esteroideo que se utiliza en el tratamiento del cáncer de mama, con un efecto sobre la función tiroidea que es motivo de controversia. La información disponible en la actualidad es dispar y, para unos autores46,47, no modifica las necesidades de la levotiroxina ni la función tiroidea a pesar de incrementar las concentraciones de la TBG. Para otros, origina un incremento reversible de la TSH a los 3 meses del tratamiento48, pero al año de iniciado el tratamiento disminuyen la T4l y la T3l e incrementa la concentración de la TSH, lo que puede indicar un descenso de la biodisponibilidad de las hormonas tiroideas49. En este sentido, algunos autores27 atribuyen el incremento de las necesidades de la levotiroxina al aumento de la concentración de la TBG por tamoxifeno y así lo clasifican en las listas de interferencias medicamentosas, aunque no lo consideran un caso de malabsorción. Según otros8, puede alterar los resultados de la función tiroidea sin que haya ninguna disfunción en la tiroides.
El picolinato de cromo31 y el ciprofloxacino8,50 pueden reducir la absorción de la levotiroxina si se administran conjuntamente. No se conocen interacciones con otras quinolonas.
Desde un punto de vista práctico, es aconsejable separar la administrarción de la levotiroxina de cualquiera de estos fármacos. El tiempo entre la administración de la hormona tiroidea y el otro medicamento puede variar en función de las características de este fármaco, aunque si se tiene en cuenta que la absorción máxima de la levotiroxina se sitúa entre la primera y la cuarta hora, en la mayoría de los casos de 4 a 6h pueden ser suficientes9,27,30.
Fármacos que aumentan las necesidades de la levotiroxina por interferencias con su metabolismoAunque para algunos autores8 la disminución de la T4l puede ser un artefacto en la mayoría de las técnicas de la T4l comercializadas, algunos fármacos (fenobarbital, fenitoína, carbamacepina y rifampicina) aumentan el metabolismo de la T4 y de la T3 y originan un aumento de las necesidades de la levotiroxina8,51. Otro antiepiléptico como la oxcarbacepina se relaciona con los descensos de la T4 y las concentraciones normales de la TSH, lo que indica un posible efecto central8,52. Algunos autores27,53 incluyen en este apartado a la sertralina, a la que atribuyen un aumento del metabolismo hepático de la levotiroxina27, aunque para otros15 el mecanismo es desconocido.
La cloroquina y el proguanil aumentan el metabolismo hepático de la levotiroxina e incrementan las necesidades del tratamiento sustitutivo54. Esta interferencia adquiere especial importancia en áreas con paludismo endémico y en los pacientes hipotiroideos que deban viajar a estas zonas y que precisen profilaxis antipalúdica.
La simvastatina y la lovastatina aumentan las necesidades de la levotiroxina por una interacción hepática con citocromo P450 3A4 que acelera el catabolismo de la hormona tiroidea. No hay datos disponibles sobre la atorvastatina, pero esta misma interacción no se ha detectado con otras estatinas como la pravastatina y la fluvastatina55. En consecuencia, parece razonable iniciar con uno de estos 2 fármacos el tratamiento con estatinas en los pacientes hipotiroideos. Según pruebas recientes, el ezetimibe no influye en la dosificación de la levotiroxina31. También se ha descrito el aumento de las necesidades de la levotiroxina en los pacientes que toman dosis estables del tratamiento sustitutivo y que precisan un tratamiento con un fármaco antiblástico como el imatinib8.
Fármacos que inhiben la secreción de la tirotropinaAlgunos fármacos inhiben la secreción de la TSH sin alterar la función tiroidea (tabla 3). La administración de estos medicamentos puede ser un factor más de confusión en la interpretación de los resultados de laboratorio, siempre según el grado de sensibilidad a la técnica de determinación de la TSH utilizada8. Los fármacos como los glucocorticoides (> 20mg/día de prednisona o equivalente), la dopamina (>1μg/kg/min), las altas dosis de dobutamina, el octreótido (>100μg/día) y el bexarotene8 inhiben la secreción de la TSH sin que se altere la función tiroidea. De manera reciente se ha informado que la metformina (1.700mg/dia) suprime la concentración plasmática de la TSH en los pacientes hipotiroideos bien controlados con dosis estables de levotiroxina, pero sin aumentar la concentración de la T4l8,56; se desconoce la causa y se ha propuesto56 aprovechar estos resultados en el tratamiento supresor del cáncer de tiroides. No obstante, otros autores describen aumentos de la T4l y descensos de la TSH (aunque sin supresión de ésta) en las pacientes diabéticas y obesas tratadas con metformina57.
Fármacos que pueden alterar los resultados de la función tiroidea sin causar disfunción
| 1. Disminución de la TBG: andrógenos, glucocorticoides, danazol, asparaginasa, niacina de liberación retardada |
| 2. Aumento de la TBG: estrógenos, raloxifeno, tamoxifeno, metadona, fluorouracilo, clofibrato, heroína, mitotane |
| 3. Disminución de la afinidad de la tiroxina por la TBG: salicilatos, salsalato, furosemida, heparina (in vitro, por vía de ácidos grasos libres), algunos antiinflamatorios no esteroideos |
| 4. Aumento del metabolismo de la tiroxina: rifampicina, carbamacepina, fenitoína, fenobarbital, cloroquina |
| 5. Supresión de la TSH: glucocorticoides, dopamina, dobutamina, octreotide, bexarotene, metformina (?) |
| 6. Conversión de T4 a T3 alterada: glucocorticoides, propiltiouracilo, propanolol, nadol, amiodarona, contrastes yodados (ácido iopanoico) |
T3: triyodotironina; T4: tiroxina; TBG: thyroxine-binding globulin ‘tiroglobulina’; TSH: thyroid stimulating hormone ‘tirotropina’.
Se puede afirmar que el 60 al 80% de una dosis oral de levotiroxina se absorbe principalmente en el intestino delgado11,58. Así, distintas enfermedades digestivas pueden influir en la absorción de la hormona tiroidea sintética y diferentes autores15,27 han confirmado una disminución de la absorción de la levotiroxina en relación con los procedimientos quirúrgicos como el bypass yeyunoileal y las resecciones intestinales con intestino corto. También otras enfermedades, como la pancreatitis crónica, la enteropatía diabética, la enfermedad intestinal inflamatoria crónica2,6, la celiaquía2,7,15,21,25,59 y la intolerancia a la lactosa60, pueden inhibir la absorción de la levotiroxina. En este sentido, es preciso resaltar que los preparados comerciales de la levotiroxina contienen lactosa como excipiente y pueden agravar la intolerancia a este carbohidrato y ésta, a la vez, deteriorar más la malabsorción de la levotiroxina. De otra parte, algunas pruebas59 sitúan la prevalencia de la celiaquía en los pacientes con enfermedad tiroidea autoinmunitaria sobre el 4%. En consecuencia, no es de extrañar que se deba considerar la posibilidad de asociación de la celiaquía con la enfermedad tiroidea autoinmunitaria2,21,59 y realizar la determinación de anticuerpos para el cribado de esta enfermedad si la dosis de levotiroxina supera los 2μg/kg/día61.
Diferentes autores8,10–13 sostienen la hipótesis de que la levotiroxina necesita un medio gástrico ácido para que la absorción de esta hormona sea efectiva. En este sentido, la presencia de enfermedades como la gastritis atrófica y la gastritis por Helicobacter pylori (o ambas) en los pacientes hipotiroideos aumenta las necesidades de la levotiroxina, aunque una vez erradicada la infección por H. pylori estas necesidades disminuyen hasta su dosis habitual10. En un reciente estudio11 se demuestra que la gastritis autoinmunitaria aumenta las necesidades diarias de la levotiroxina en los pacientes con hipotiroidismo autoinmunitario. Además, el incremento de las necesidades está directamente relacionado con el grado de atrofia gástrica. En este mismo trabajo, también la presencia de anticuerpos anticélula parietal gástrica en los pacientes con hipotiroidismo postiroidectomía influye en la absorción de la levotiroxina, aunque en menor medida que cuando se demuestra histológicamente la presencia de gastritis atrófica. Para estos autores la determinación de estos anticuerpos debería formar parte del procedimiento diagnóstico de los pacientes con necesidades inexplicablemente altas de la levotiroxina. Otros investigadores están en contra de esta hipótesis y sostienen que la alteración en la absorción de la levotiroxina se justifica por el proceso inflamatorio gástrico per se, con independencia de cuál sea el pH38,62. También se ha descrito la infección intestinal crónica por Giardia lamblia como causa de la malabsorción de la levotiroxina y del hipotiroidismo25, así como la enfermedad obstructiva y la cirrosis hepática1,6.
Malabsorción de la levotiroxina relacionada con alimentos y fibrasLa ingesta de un desayuno muy rico en grasa reduce la absorción de la levotiroxina en un 40%7. Asimismo, una dieta rica en pan con mucha fibra también puede interferir la absorción de la levotiroxina25,27. No obstante, se puede afirmar que los sustitutos sintéticos de la fibra no influyen en esta absorción8,27. En este sentido, algunos autores27 confirman que las dosis habituales de polycarbophil y de psyllium no inducen malabsorción de la levotiroxina en voluntarios sanos. El plantago ovata y la goma guar pueden afectar la absorción de diferentes fármacos, pero no hay referencias concretas sobre su influencia en la absorción de la levotiroxina. Un caso especial, por su creciente utilización en España, es el de la proteína de soja y las isoflavonas. Según una reciente revisión sistemática63, conviene diferenciar sus efectos en función de que las personas sean eutiroideas o hipotiroideas. En las primeras, esta revisión llega a la conclusión de que no tienen efectos negativos sobre la función tiroidea, a pesar de la facilidad demostrada in vivo e in vitro para inactivar la peroxidasa tiroidea en modelos animales. No obstante, parece razonable preguntarse qué efectos pueden tener la soja y las isoflavonas en la tiroides de las personas susceptibles para desarrollar hipotiroidismo, especialmente y según los autores si el aporte de yodo no es el adecuado. En este caso, los mismos autores confirman que la proteína de soja puede inhibir la absorción de la levotiroxina e incrementar las necesidades del tratamiento sustitutivo. Este hecho podría atribuirse a que las isoflavonas tienen una estructura química parecida al raloxifeno que, como ya se ha comentado, también aumenta las necesidades de la levotiroxina si se toman conjuntamente. Otros estudios demuestran que la ingesta de leche de soja en los niños con hipotiroidismo congénito aumenta las necesidades de levotiroxina64, igual que lo hacen los suplementos de soja en los adultos25,65. De manera reciente, otros autores66 han demostrado que cuando el café se toma junto con la levotiroxina, inhibe la absorción de la hormona tiroidea sintética y recomiendan añadir el café a la lista de sustancias capaces de interferir esta absorción.
Necesidades de la levotiroxina relacionadas con un aumento de estrógenosDurante el embarazo aumentan los valores plasmáticos de los estrógenos y las necesidades del tratamiento sustitutivo con levotiroxina. Desde este punto de vista, el incremento de la TBG inducido por el aumento de estrógenos propio de la gestación explicaría sólo en parte el aumento de las necesidades de la levotiroxina. Probablemente, el mayor aclaramiento de la T4 y el paso de ésta al feto7 con una mayor degradación por la deyodinasa placentaria6 también pueden contribuir a incrementar las necesidades de la levotiroxina. En general, las necesidades de la levotiroxina durante la gestación aumentan un 45%1,7,67,68 en el 75% de las mujeres6,67, principalmente entre las 8 y las 16 semanas de embarazo, aunque algunos pacientes pueden precisar también aumento de dosis durante el último trimestre. De manera aproximada, incrementar un 30% la dosis de la levotiroxina al confirmar la gestación puede ser inicialmente suficiente, aunque puede ser necesario ajustar la dosis de manera progresiva en función de los controles de la TSH7. Después del parto, la dosis de la levotiroxina debe disminuirse inmediatamente a la dosis habitual de antes del embarazo6. También el tratamiento con estrógenos incrementa la concentración de la TBG y, según algunos autores7,69, puede aumentar las necesidades de la levotiroxina en los pacientes bajo tratamiento sustitutivo. En un estudio69, las pacientes hipotiroideas posmenopáusicas que recibieron un tratamiento con estrógenos conjugados (0,625mg/día durante 48 semanas) presentaron un descenso de la concentración de la T4l y un aumento de la TSH que no se produjo en el grupo comparador de las mujeres posmenopaúsicas no hipotiroideas. Un 30% de estas mujeres hipotiroideas presentaron TSH >7μU y precisaron incrementar la dosis de la levotiroxina. Estos datos indican la necesidad de comprobar la función tiroidea de las personas tratadas con levotiroxina a los 3 meses de iniciado el tratamiento estrogénico y verificar si precisan aumentar la dosis de levotiroxina. Para determinados autores70 el tratamiento con estrógenos transdérmicos no influye en la función tiroidea y ésta podría ser una opción terapéutica para tener en cuenta.
En conclusión, el hipotiroidismo es un déficit hormonal muy común en la práctica diaria, fácil de tratar y perfectamente controlable en la atención primaria. No obstante, en el día a día, se pueden presentar determinados factores que pueden confundir y complicar su tratamiento. Las recomendaciones y las consideraciones expuestas en esta publicación van encaminadas para facilitar un abordaje terapéutico óptimo del hipotiroidismo primario. Con esta finalidad, a modo de resumen, se sintetizan los puntos más importantes en un decálogo (tabla 4) que según los autores de este estudio pueden ser de utilidad tanto para formadores como para profesionales en formación.
Decálogo para expertos y para menos expertos
| Es necesario informar al paciente que el tratamiento con levotiroxina es de por vida. |
| Los pacientes deben conocer que la dosis de la levotiroxina hay que tomarla en ayunas, 30 a 60min antes del desayuno (con agua) para facilitar su absorción. |
| Cuando la TSH se encuentra elevada (> doble del límite alto de la normalidad) y la T4l se mantiene en la mitad superior del rango normal con dosis demasiado altas de levotiroxina, conviene sospechar una mala adherencia al tratamiento sustitutivo. |
| Si la concentración de la TSH permanece elevada en los pacientes con buena adherencia al tratamiento a pesar de una dosis correcta (o a veces alta) de levotiroxina, hay que sospechar la presencia de «factores de confusión» como interferencias alimentarias y farmacológicas, o bien enfermedades asociadas que originen malabsorción. |
| Siempre que sea posible, conviene distanciar unas 4 a 6h la ingesta de la levotiroxina de la de otros fármacos e informar de las posibles interferencias, especialmente si se encuentran en la lista facilitada en la tabla 2. |
| Cuando se inicie o se finalice un tratamiento con alguno de estos fármacos es necesario monitorizar las concentraciones de la TSH y ajustar la dosis de la levotiroxina, si es preciso. |
| Para monitorizar el tratamiento sustitutivo, la determinación aislada de la TSH es adecuada en la mayoría de los pacientes. La principal excepción sería el hipotiroidismo central (hipofisario e hipotalámico), que requiere la determinación de T4l. |
| En situaciones de enfermedad coronaria inestable y durante la gestación (o con deseo de gestación) el control especializado es especialmente recomendable y las pacientes en edad fértil deben de estar informadas sobre la conducta para seguir. |
| Ocasionalmente, pueden detectarse alteraciones de las pruebas de función tiroidea sin que haya enfermedad en la tiroides. |
| Es posible que los comprimidos de las distintas marcas de levotiroxina disponibles no sean bioequivalentes y, en consecuencia, no se puedan intercambiar. |
T4l: tiroxina libre; TSH: thyroid stimulating hormone ‘tirotropina’.