Los programas de optimización del diagnóstico microbiológico (PRODIM) promueven actuaciones coordinadas orientadas a optimizar el uso de las técnicas diagnósticas, propiciando la toma de decisiones terapéuticas, clínicas y preventivas adecuadas y «coste-efectivas». La implementación de los PRODIM debe sustentarse en la creación de comités multidisciplinares liderados por microbiólogos clínicos para el diseño de algoritmos diagnósticos, la adecuación del sistema informático del laboratorio para el control de la pertinencia de las pruebas diagnósticas solicitadas, la puesta en marcha de un sistema de control de calidad, el diseño y realización de estudios de análisis de coste-efectividad, la educación del peticionario y del personal técnico y de enfermería y la evaluación continua del programa. La incorporación de PRODIM en la rutina asistencial reporta beneficios tangibles para el paciente a la vez que afianza el papel clave del microbiólogo clínico en el manejo de las enfermedades infecciosas.
Microbiological diagnostic stewardship programs promote coordinated measures aimed at optimizing the use of diagnostic techniques, thus favouring the adoption of adequate and cost-effective therapeutic, clinical and preventive decisions. The implementation of microbiological diagnostic stewardship relies upon the creation of multidisciplinary committees led by clinical microbiologists for the design of diagnostic algorithms, the adequacy of the laboratory computer system to monitor the relevance of the requested diagnostic tests, the implementation of a quality control system, the design and performance of studies of cost-effectiveness, the training of the petitioner and the technical and nursing staff and the continuous evaluation of the program. The incorporation of microbiological diagnostic stewardship in routine care reports tangible benefits for the patient while strengthening the pivotal role of the clinical microbiologist in the management of infectious diseases.
El concepto programa de optimización del diagnóstico microbiológico (PRODIM) entronca con el de «diagnostic stewardship», cuya traducción literal es «la tutela en el diagnóstico» y que consiste, de acuerdo con el manual Global Antimicrobial Resistance Surveillance System, avalado por la Organización Mundial de la Salud1, en la «actuación coordinada orientada a optimizar el uso de las técnicas diagnósticas con objeto de propiciar la toma de decisiones terapéuticas adecuadas». PRODIM amplía los límites conceptuales del «diagnostic stewardship» en cuanto a que incorpora la noción de que la implementación de una prueba diagnóstica en el catálogo de prestaciones de un laboratorio de Microbiología debe estar avalada por un análisis favorable de coste-oportunidad, y que el uso de esta no solo ha de revelarse clínicamente útil, sino también debe ser «coste-efectivo»2–10. En este sentido los PRODIM se alinean con los postulados de la campaña «Choosing Wisely» (http://www.choosingwisely.org/), que hacen suyos dos grupos de estudio pertenecientes a la European Society of Clinical Microbiology and Infectious Diseases, el Study Group for Genomic and Molecular Diagnostics y el Study Group for Antimicrobial Stewardship11, y que abogan porque las pruebas de diagnóstico deben ser seleccionadas cuidadosamente para garantizar una «mejora en salud» al tiempo que sean rentables para el sistema que las financia. En este contexto, el Real Decreto (RD) 16/2012 de 20 de abril señala la necesidad de instruir estudios de evaluación económica para las tecnologías sanitarias, entre las que se incluyen las pruebas diagnósticas, en línea con el RD 9/2011 del 19 de agosto, que ya apuntaba a que el criterio de coste-efectividad había de ser un requisito oficial para negociar el precio y la financiación de los medicamentos12,13.
Si bien los programas PRODIM, al igual que los de «diagnostic stewardship», nacen vinculados a los de optimización del uso de antimicrobianos (programas de optimización del uso de antibióticos)14, su aplicación en el manejo de las enfermedades infecciosas excede, en la actualidad, el mero propósito de guiar adecuadamente la selección de los antimicrobianos, ya que persiguen la toma de decisiones clínicas y preventivas de cualquier naturaleza que mejoren la salud de los pacientes y de la colectividad a un coste asumible por el sistema sanitario15.
¿Por qué los PRODIM?El laboratorio de Microbiología Clínica se encuentra en el epicentro de una revolución diagnóstica global propiciada por el advenimiento de nuevas tecnologías de diagnóstico molecular basadas en la amplificación, hibridación o secuenciación de ácidos nucleicos microbianos o acopladas al uso de resonancia magnética y proteómica (espectrometría de masas – MALDI-TOF)16, cuya implantación en la mayoría de nuestros hospitales no ha encontrado grandes trabas. El uso de esta tecnología permite llegar a un diagnóstico en menos tiempo que hace unos años, en los que el cultivo tradicional y los métodos rápidos basados en la detección de antígenos microbianos y de anticuerpos específicos (serología) eran dominantes. Sin embargo, la incorporación de estos avances tecnológicos no solo conlleva desafíos prácticos desde el punto de vista logístico para el laboratorio, sino también para los clínicos peticionarios: «nuestras capacidades técnicas están excediendo nuestra capacidad de aplicarlas efectiva y razonablemente en la resolución de problemas clínicos»17,18. El laboratorio de Microbiología se enfrenta hoy en día a problemas de distinta naturaleza y magnitud, cuya enumeración y análisis exceden el propósito de esta revisión; en nuestra opinión, son especialmente pertinentes en relación con los programas PRODIM, de un lado la gran presión asistencial para llevar a cabo pruebas «sindrómicas» capaces de detectar simultáneamente una amplia variedad de microorganismos potencialmente implicados en la etiología de un proceso determinado, a menudo costosas, y sin un soporte clínico razonable, y, de otro, la disyuntiva entre proveer o no de una información cuya relevancia clínica puede ser cuestionable.
La implementación de programas PRODIM minimiza el riesgo de «sobrediagnosticar» a la vez que favorece el uso adecuado de los antimicrobianos, resultando de lo anterior una mejora sustancial en la seguridad y el cuidado del paciente11–15. Sin embargo, los programas PRODIM no están exentos de «efectos indeseados», ya que mejorar el valor predictivo positivo pretest de las pruebas puede conducir a «pasar por alto» algunos diagnósticos y limitar la autonomía del clínico para solicitar pruebas diagnósticas siendo una fuente potencial de tensión que inevitablemente puede ir en perjuicio de una buena asistencia médica19.
Fundamentos de los PRODIMEl proceso diagnóstico se sustenta en el denominado «brain-to-brain loop» conceptuado por Lundberg20,21, que comienza con la formulación de una serie de preguntas concatenadas: ¿tiene el paciente una infección?, si es así, ¿cuál es el microorganismo causal? y ¿cómo debo tratarlo?17,22, y termina cuando el resultado de la/s prueba/s se interpreta y genera una actuación clínica consecuente (accionable). En este camino, los microbiólogos clínicos nos aseguramos de la idoneidad de los procesos preanalíticos (conciliación de muestra-paciente, selección de la muestra correcta, toma, transporte y procesamiento adecuados), analíticos (ejecución de la prueba ajustada a estándares reconocidos de calidad) y postanalíticos (emisión de informes inteligibles, juiciosos, clínicamente relevantes y en el menor tiempo posible). En última instancia, la eficacia y eficiencia del proceso diagnóstico dependen de la colaboración productiva entre todos los intervinientes: el microbiólogo clínico, el peticionario, los técnicos de laboratorio, el personal auxiliar y de enfermería, y, naturalmente, de los gestores. El resultado final de esa colaboración debería plasmarse en una guía de diagnóstico microbiológico adaptada a la realidad y a las posibilidades de cada departamento de salud.
Elección de la prueba diagnóstica correcta («the right test»)La inadecuación en la elección de las pruebas diagnósticas microbiológicas, ya sea por sobreutilización (pruebas solicitadas, pero no indicadas) o infrautilización (pruebas indicadas, pero no solicitadas) es presuntamente un fenómeno global23, si bien su magnitud varía previsiblemente en relación con el grado de restricción o permisividad de los criterios en uso que rigen la indicación de una prueba en un centro dado. El coste directo de las peticiones inadecuadas para el laboratorio de Microbiología es probablemente despreciable, si se considera que las pruebas diagnósticas practicadas en los laboratorios (en conjunto, no solo en el de Microbiología) representan una pequeña fracción (3-5%) del gasto total sanitario24. Sin embargo, a los costes directos se han de sumar los denominados costes repercutibles a decisiones derivadas de los resultados de las pruebas: prescripciones farmacológicas y de pruebas de imagen, cirugías, ingreso hospitalario…).
No se trata aquí de delimitar responsabilidades ni de adscribirlas a los distintos participantes en el proceso diagnóstico, porque de un modo u otro, todos, microbiólogos, clínicos, gestores, e incluso los pacientes, somos responsables en mayor o menor medida. Recientemente, Salina et al.25 señalan con acierto algunas de las causas que explican la ingente cantidad de peticiones de pruebas de laboratorio inapropiadas (referidas a los laboratorios generales de análisis clínicos, pero extensibles a los laboratorios especializados de Microbiología). Por lo que respecta a los microbiólogos clínicos, sin pretender ser exhaustivos, la incorporación a las carteras de servicio de técnicas cuya eficacia y efectividad no han sido sólidamente establecidas, el exceso de «perfiles de petición», alimentados por sistemas de petición electrónica, o la implementación en el laboratorio de algoritmos diagnósticos con pruebas reflejas (que no solicita el peticionario), cuyo valor clínico no ha sido suficientemente contrastado, son factores que merman la idoneidad de las peticiones.
Sucintamente, las políticas PRODIM persiguen la elección de la prueba diagnóstica adecuada para un paciente concreto en el momento óptimo, con objeto de actuar con máxima eficacia clínica y «coste-efectividad» («right test for the right patient at the right time with the right cost for producing the right outcome»). Pero, ¿cómo graduamos la pertinencia de una prueba diagnóstica? Indudablemente, la robustez de la evidencia científica disponible ha de ser el criterio primario en que se fundamente la elección de una prueba u otra. En este contexto, el Parlamento Europeo aprobó recientemente el nuevo Reglamento Europeo 2017/74640 que rige y regula la autorización de comercialización de las pruebas de diagnóstico in vitro en los países de la Unión Europea26. De acuerdo con este reglamento, la obtención del marcado CE requiere de la acreditación de que dicha prueba es científicamente válida, es decir que se adecua técnicamente a la exigencia diagnóstica que pretende resolver, la documentación de sus características analíticas intrínsecas (veracidad-sesgo, precisión-repetitividad y reproducibilidad-exactitud, límites de detección y cuantificación, rango de medida, linealidad), la especificación de los requerimientos preanalíticos (recogida y manipulación de la muestra, interferencias en la medición por sustancias exógenas y endógenas) para su ejecución y detallar sus prestaciones clínicas en términos de sensibilidad y especificidad diagnósticas, valores predictivo positivo y negativo, tomando en consideración la prevalencia de la enfermedad en cuestión, cociente de verosimilitud y los valores previstos en poblaciones sanas y enfermas. Esta legislación requiere además que la validación se realice mediante un ensayo clínico que mimetice la situación de necesidad diagnóstica para la que se ha diseñado («en vida real»).
A menudo, sin embargo, la literatura científica genera más dudas que certezas, de modo que, en ausencia de datos concluyentes, la priorización de una prueba en detrimento de otra ha de ser consensuada entre los peticionarios y los microbiólogos, y en la medida de lo posible en sintonía con recomendaciones de expertos, si las hay, y explicitada en documentos o guías de actuación clínica adaptadas a una realidad local, puesto que la utilidad clínica y coste-efectividad de una prueba diagnóstica concreta puede variar considerablemente dependiendo de la tipología de pacientes a quienes se les practica.
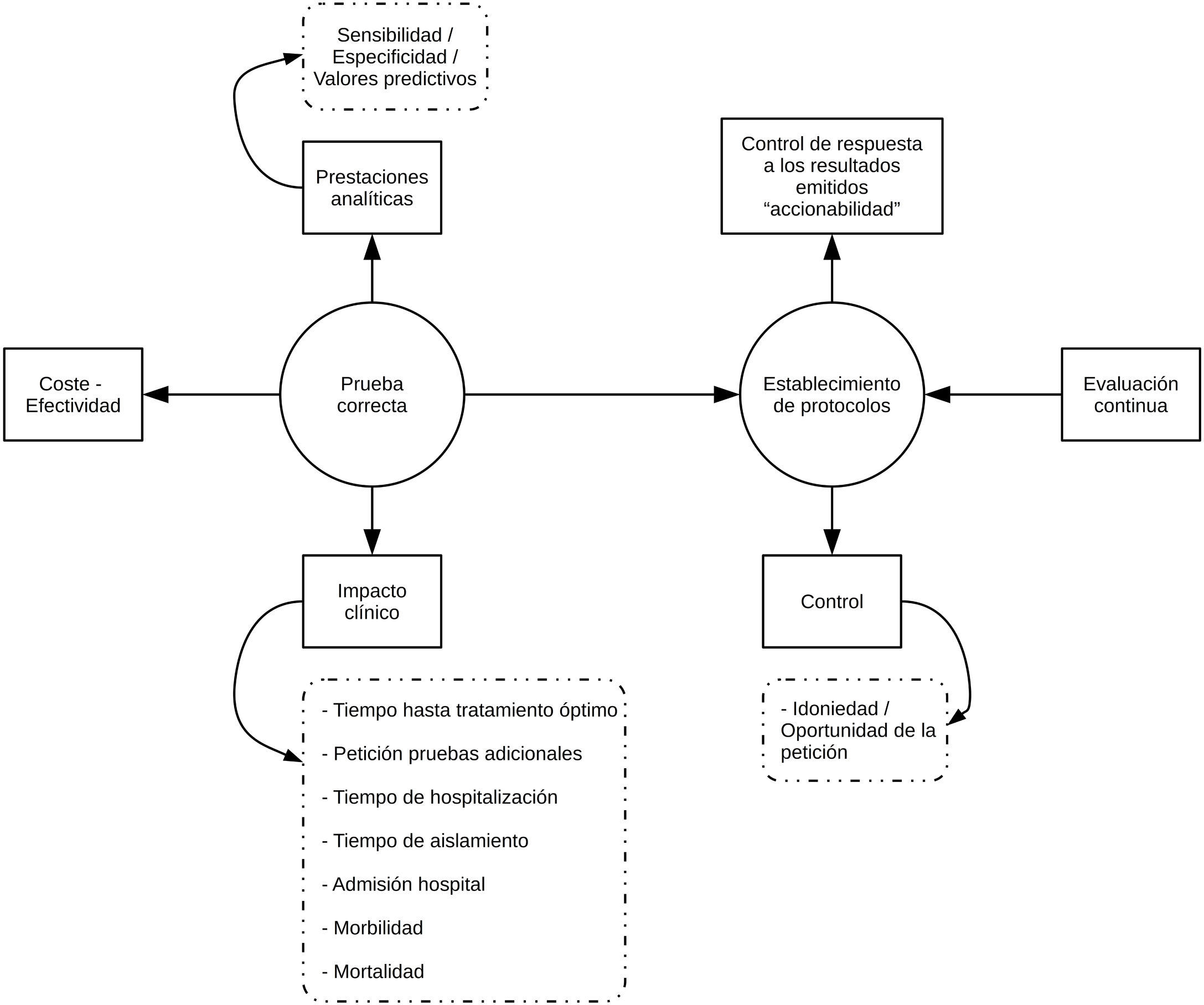
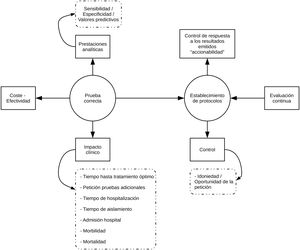
Implementación de PRODIMEn nuestra opinión, la implementación de PRODIM debe sustentarse en las siguientes actuaciones (fig. 1): (a) diseño de una cartera de servicios que incorpore pruebas de acreditado valor clínico, que evite duplicidades y que se adapte, en la medida de lo posible, a las posibilidades económico-financieras del hospital correspondiente. Debe incluir tiempos de respuesta. (b) Creación de comités multidisciplinares (con otros servicios), que debe liderar el microbiólogo clínico, para el diseño de algoritmos diagnósticos, política de aceptación/rechazo de muestras, rutas de pruebas reflejas («reflex»), decisión sobre la «deslocalización» de pruebas diagnósticas («point of care»), y los tiempos de respuesta deseables, elaboración de los contenidos de los informes y programación de «accionables», esto es, actuaciones médicas preestablecidas en respuesta a resultados de las pruebas microbiológicas (especialmente de pruebas rápidas). No hay duda de que la colaboración estrecha entre el laboratorio de microbiología y los servicios médicos o quirúrgicos redunda en un mejor cuidado de los pacientes, que minimiza la morbimortalidad asociada al proceso infeccioso en cuestión. El manejo clínico de las bacteriemias es un ejemplo paradigmático que prueba esta afirmación; en efecto, el impacto clínico del diagnóstico rápido mediante MALDI-TOF o pruebas moleculares genotípicas es sustancialmente mayor cuando interviene un equipo de programas de optimización del uso de antibióticos en el ajuste del tratamiento empírico27–32. (c) Adecuación del sistema informático (LIS) para el control de la pertinencia de las pruebas diagnósticas solicitadas, que permita limitar el acceso a estas según la procedencia o cuando no se justifiquen debidamente. El uso de programas que persiguen ese fin se ha demostrado útil en el control de la idoneidad de la prescripción de fármacos (computerized provider order entry and clinical decision support systems)33. (d) Implementación de un sistema de control de calidad (procesamiento de muestras, analítica y postanalítica) sobre las pruebas diagnósticas. (e) Diseño y realización de estudios para el análisis de la coste-efectividad de las pruebas o algoritmos diagnósticos que se pretende/n implantar. (f) Educación del peticionario (actualización sobre la tecnología diagnóstica utilizada, prestaciones e interpretación de los resultados de las pruebas diagnósticas…) y del personal de técnico y de enfermería (toma y procesamiento de muestras, ejecución de las pruebas diagnósticas...). (g) Evaluación continua del programa: informes periódicos, benchmarking, retroalimentación a los peticionarios…).
Los laboratorios de Microbiología deben fomentar la innovación tecnológica y la adopción de pruebas diagnósticas con criterios PRODIM como actuación prioritaria. La incorporación de PRODIM en la rutina asistencial reporta beneficios tangibles para el paciente a la vez que afianza el papel clave del microbiólogo clínico en el manejo de las enfermedades infecciosas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a MSD su colaboración en la organización de la logística de las reuniones PRODIM 1 y PRODIM 2, que se celebraron en Madrid en el mes de junio de 2018 y 2019, respectivamente, en las que se perfilaron algunas de las ideas contenidas en este manuscrito.