Se informa del caso de un recién nacido que presentó trombocitopenia, hematuria y proteinuria. En el líquido cefalorraquídeo tenía aumento de proteínas y leucocitos, VDRL no reactiva. La madre tenía historia de sífilis gestacional. Las determinaciones de IgM para citomegalovirus, rubéola, Toxoplasma, herpes i y ii fueron negativas por lo que se consideró caso de sífilis congénita con compromiso de sistema nervioso central. Por persistir la trombocitopenia después del tratamiento, se tomó muestra de sangre para PCR para citomegalovirus, encontrándose 181.171copias/ml. Se dio tratamiento con ganciclovir intravenoso 12mg/kg de peso durante 21 días y solución al 10% de inmunoglobulina humana hiperinmune para citomegalovirus administrada así: 4ml/kg de peso los días 0, 4 y 8, seguido de 2ml/kg de peso los días 12 y 16. La evolución fue satisfactoria. Se evidenció la utilidad de PCR en el diagnóstico de infección congénita por citomegalovirus.
We report a case of a newborn with persistent thrombocytopenia, hematuria, proteinuria, as well as increased proteins and leukocytes in cerebrospinal fluid, with a non-reactive VDRL. His mother had history of gestational syphilis. IgM levels against cytomegalovirus, rubella, toxoplasma, herpes i and ii were negative, which led to suspicion of congenital syphilis with central nervous system involvement. A polymerase chain reaction test for cytomegalovirus showed 181.171 copies/ml in serum. The newborn was treated with intravenous ganciclovir at 12mg per kg body weight for 21 days and a 10% solution of human cytomegalovirus hyperimmune immunoglobulin, administered as follows: 4ml per kg body weight on days 0, 4 and 8, followed by 2ml per kg weight on days 12 and 16. The clinical outcome was satisfactory. This study highlights the usefulness of PCR for the diagnosis of congenital CMV infection.
La infección congénita, que es una infección intrauterina transplacentaria, es ocasionada por múltiples agentes: Toxoplasma, Treponema pallidum, herpes simple, parvovirus B19, varicella-zoster, citomegalovirus (CMV), rubéola, virus de la inmunodeficiencia humana, virus de hepatitis B y bacilo de la tuberculosis, entre otros1.
La causa más frecuente de infección viral congénita es el CMV; esta infección puede originar secuelas permanentes como sordera neurosensorial, alteración visual y retardo mental. A partir de una revisión de 15 estudios en los que se reunieron 117.986 niños, la prevalencia estimada de la infección fue del 0,7% y la frecuencia de casos sintomáticos al nacer fue del 12,7%. En esta misma revisión, se estima que desarrollarán secuelas permanentes el 40-58% de los casos sintomáticos y el 13,5% de los asintomáticos2.
Las manifestaciones clínicas en los sintomáticos incluyen: restricción de crecimiento en el 23% de los casos, microcefalia en el 23%, ictericia en el 47%, hepatoesplenomegalia en el 76%, petequias en el 41%, coriorretinitis en el 12%, hipoacusia en el 41% y calcificaciones intracraneales en el 35%; las alteraciones de laboratorio más frecuentes son trombocitopenia en el 40%, anemia en el 53%, hiperbilirrubinemia en el 30% y aumento de aminotransferasas en el 35% de los casos3.
La mortalidad varía del 4-12% en las primeras semanas de vida y puede llegar al 30% en el primer año ocasionada por el compromiso hepático o por las infecciones bacterianas asociadas resultantes de la alteración del sistema inmunológico causada por la infección viral4.
El diagnóstico de la infección congénita debe hacerse en las 3 primeras semanas de vida por aislamiento del virus en cultivo de orina o por detección del ADN viral mediante reacción en cadena de la polimerasa (PCR) a partir de muestras de sangre, orina, saliva o líquido cefalorraquídeo (LCR) o por la detección del antígeno PP65 en sangre o por determinación de IgM específica en sangre4,5.
La sensibilidad del cultivo varía entre el 80 y el 90% con especificidad de más del 95%6, la sensibilidad de la PCR varía entre el 80 y 100%, la sensibilidad del antígeno p65 oscila entre el 35 y 50% con una especificidad del 100%5,6 y la sensibilidad de la IgM oscila entre el 25 y el 40% con una especificidad del 100%3, por lo que la PCR en suero y orina es el método diagnóstico posnatal de elección3,5,6.
En el recién nacido la infección por CMV también puede ser adquirida por contacto con secreciones cervicales maternas durante el parto, por ingestión de leche materna de la madre infectada, por contaminación en salas de neonatos o por fluidos biológicos de personas infectadas o por administración de derivados sanguíneos7. En estos casos, cuando el diagnóstico de la infección se hace en un niño de más de 3 semanas de vida, el diagnóstico de infección congénita por CMV se puede realizar por PCR en la muestra de sangre seca tomada en papel de filtro del tamizaje neonatal para enfermedades metabólicas, que es una muestra que se toma entre el tercero y el cuarto día de vida4,8.
Presentación del casoRecién nacido masculino, a término, peso 2.775g, talla 48cm, perímetro cefálico 34cm, Apgar 6, 7 y 8 a 1, 5 y 10min. Madre de 21 años, segunda gestación, rotura prematura de membranas de 13h. La madre tuvo un antecedente de óbito en la primera gestación por sífilis, con un resultado durante esa primera gestación, de un VDRL materno de 1:64. La madre recibió tratamiento para sífilis, la pareja no.
Durante el presente embarazo la mamá volvió a presentar un VDRL 1:2 a las 8 semanas de gestación; la gestante y su pareja recibieron tratamiento con 3 dosis de penicilina benzatínica. Luego, el VDRL materno fue de 1:1 a las 31 semanas de gestación; en el momento del parto el VDRL fue de 1:2, y se sospechó reinfección. Las serologías para Toxoplasma, virus de la inmunodeficiencia humana y hepatitis B fueron negativas.
Se hospitalizó al recién nacido con diagnóstico de caso presuntivo de sífilis congénita, se solicitó cuadro hemático, parcial de orina, VDRL, hemocultivos y urocultivo, que mostraron: hemoglobina 21,9g; hematocrito 63%; leucocitos 19.550×mm3; segmentados 44%; linfocitos 51%; monocitos 5%; plaquetas 100.000×mm3; VDRL no reactivo; parcial de orina: pH 6; densidad 1.015; proteínas+ sangre+. Se inició penicilina cristalina 50.000U×kg/12h. A los 2 días de vida, el recuento de plaquetas fue 83.000×mm3; aspartato aminotransferasa 35U/L; bilirrubina total 14,9mg%; y bilirrubina directa 0,3mg%.
A las 30h de vida presentó importante eritema y edema periumbilical, tenía aspecto séptico y alteración de la perfusión distal; se adicionó oxacilina y gentamicina. Al tercer día se informó hemocultivos y urocultivo negativos.
A los 4 días, el reporte de LCR mostró 29 leucocitos×mm3; linfocitos 95%; proteínas 166,4mg%; VDRL no reactivo. Se solicitó determinación de IgM para Toxoplasma, rubéola, CMV, herpes i y ii para definir etiología de la meningitis aséptica. No hubo mejoría clínica esperada, aumentó el área de celulitis periumbilical; se suspendieron oxacilina y gentamicina, se solicitaron hemocultivos y se inició cefepime.
Al quinto día el recuento de plaquetas fue 62.000×mm3; las ecografías cerebral y cardíaca fueron normales. Las determinaciones de IgM para Toxoplasma, CMV, rubéola, herpes i y ii resultaron negativas. Ante los hallazgos en LCR y la persistencia de trombocitopenia a pesar del tratamiento con penicilina cristalina, se tomó muestra para PCR para CMV en sangre y se envió a un laboratorio externo a la Institución.
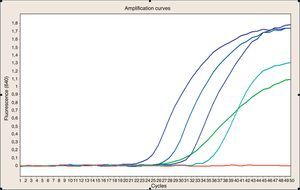
A los 6 días informaron aislamiento en los hemocultivos de Staphilococcus aureus resistente; se inició vancomicina, se suspendió cefepime. El resultado de PCR para CMV mostró 181.171 copias/ml de sangre (fig. 1).
Reacción en cadena de la polimerasa en sangre para citomegalovirus. EL ADN de la muestra de sangre fue extraído con el sistema automatizado Maxwell y la cuantificación de la carga viral se realizó mediante reacci¿lon en cadena de la polimerasa en tiempo real usando iniciadores y sondas FRET específicas para la región de la glucoproteína B del citomegalovirus. La amplificación y detección se llevaron a cabo en un equipo Lightcycler 2.0 usando diluciones de plásmidos a concentraciones determinadas.
Se suspendió la penicilina cristalina; por el cuadro multisistémico de infección por CMV con compromiso de sistema nervioso central y se inició ganciclovir intravenoso 12mg/kg de peso durante 21 días y solución al 10% de inmunoglobulina humana hiperinmune para CMV administrada así: 4ml/kg de peso los días 0, 4 y 8, seguido de 2ml/kg de peso los días 12 y 16.
Los controles del recuento de plaquetas realizados a los 14 días y 22 días de vida informaron 153.000×mm3 y 227.000×mm3 respectivamente. La evolución clínica fue satisfactoria; la PCR para CMV realizada a los 36 días de vida no detectó ninguna copia del virus. La valoración por oftalmología fue normal. Se dio salida para seguimiento ambulatorio.
DiscusiónEn el caso que se presenta, la trombocitopenia persistente, presente desde el nacimiento, en conjunto con las alteraciones en el LCR compatibles con meningitis aséptica fueron las claves para sospechar infección por CMV, pues el recién nacido no tenía ninguna alteración en el examen físico, ni en la valoración por oftalmología. La infección bacteriana asociada y la ausencia de IgM específica para CMV se consideraron manifestaciones del compromiso del sistema inmunológico por CMV4–6.
Se sabe que la IgM para CMV puede ser negativa en neonatos infectados, incluso en pacientes sintomáticos6, por lo que en la actualidad, para el diagnóstico de infección congénita por CMV se recomienda la identificación del genoma mediante PCR; muchos centros consideran la PCR en orina como la técnica de referencia por su alta sensibilidad8. En el caso que se informa, la determinación de IgM para CMV fue negativa y la PCR realizada en sangre mostró un recuento elevado de copias del virus.
Si bien múltiples publicaciones dan cuenta de la utilidad del ganciclovir en el tratamiento de la infección congénita por CMV, en el tratamiento de este paciente, por el cuadro sistémico con compromiso del sistema nervioso central, se utilizó la asociación de ganciclovir con inmunoglobulina humana hiperinmune para CMV. El uso de esta asociación ha sido descrito previamente en neonatos con infección severa que mejoraron en forma importante9,10; igualmente ha sido usada con éxito en los pacientes con trasplante de médula ósea complicados con neumonía por CMV.
La infección congénita por CMV es la principal causa no hereditaria de sordera en los niños, su diagnóstico representa una oportunidad para tratar la infección y prevenir esta secuela; en algunos países se ha considerado el tamizaje neonatal para la detección de infección congénita por CMV mediante PCR utilizando las gotas de sangre seca en papel de filtro, obtenidas para el programa de tamizaje de enfermedades metabólicas4.
En Colombia no se dispone de información acerca de la frecuencia de infección congénita, existe reporte de la alta frecuencia (66%) de seropositividad para CMV en las gestantes11 y de la tasa de positividad (1,5%) para CMV en un estudio colaborativo en recién nacidos con bajo peso12. Hay informe de caso de infección congénita diagnosticada mediante PCR10.
Los neonatos que presentan síntomas o signos como restricción de crecimiento, microcefalia, petequias, hepatoesplenomegalia y/o ictericia con hiperbilirrubinemia conjugada deben ser estudiados para infección congénita por CMV; proponemos que este espectro se amplíe incluyendo a los recién nacidos con trombocitopenia persistente, tal como lo consigna la guía española para el diagnóstico y manejo de la infección congénita8, configurando así una población neonatal de riesgo para infección congénita por CMV, en quienes, en las 3 primeras semanas de vida, mediante PCR en muestra de orina, se detectaría la infección.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesEl caso no necesitó financiación y las autoras no tenemos ningún conflicto de intereses.