La ehrlichiosis es una infección no reconocida ni sospechada en nuestro medio, sin embargo, ciertas características epidemiológicas hacen que deba pensarse en esta entidad a la hora de abordar a un paciente con un cuadro clínico compatible. Presentamos el caso de un soldado joven con factores de riesgo claros para zoonosis, con fiebre, erupción petequial, trombocitopenia, hepatitis y disfunción orgánica múltiple a quien se le confirmó infección por Ehrlichia chaffeensis por medio de serología luego de descartar infecciones comunes y otras infecciones por vectores.
Existen limitaciones en los registros de este tipo de enfermedades pues no son de notificación obligatoria y un alto número cursan de manera subclínica, lo que hace probable un elevado subregistro. La importancia de tener en mente esta condición radica en que el retraso del tratamiento se asocia a mayor incidencia de complicaciones, incluyendo desenlaces fatales.
Human ehrlichiosis is an infection that is neither suspected or recognized in our country. Certain epidemiologic clues should arouse suspicion for this entity when the symptoms are suggestive. We present a case of a young soldier with clear risk factors for zoonotic infection, with fever, a petechial rash, thrombocytopenia, hepatitis and multiple organ failure, for whom a diagnosis of Ehrlichia chaffeensis was confirmed by serology after ruling out common infections and other infections caused by vectors.
There are important limitations in documenting these cases, because there is no mandatory public reporting and a significant proportion of these cases are asymptomatic, leading to underdocumentation. It is however, of critical importance to raise awareness about this entity since delays in treatment portend a higher incidence of complications, including death.
La diversidad geográfica propia de Colombia da lugar a un amplio espectro de posibilidades nosológicas vistas en la práctica clínica; sin embargo las enfermedades trasmitidas por garrapatas (fiebre de las Montañas Rocosas, enfermedad de Lyme, ehrlichiosis humana) usualmente predominan en otras latitudes. La ehrlichiosis humana comprende 3 presentaciones clínicas ocasionadas por 3 gérmenes diferentes; la ehrlichiosis monocítica humana es causada por Ehrlichia chaffeensis1. Existen casos de infección y estudios de seroprevalencia para otras especies reportados desde 1986, muchos de ellos en América del Sur2–6. En nuestro país se realizó un estudio de seroprevalencia en el departamento de Sucre, encontrando en trabajadores de área rural una prevalencia para ehrlichiosis del 3,3%5. Todas las formas de ehrlichiosis humana se caracterizan clínicamente por fiebre, cefalea, mialgias, malestar general, trombocitopenia, leucopenia e injuria hepática; sin embargo los pacientes con ehrlichiasis monocítica humana tienen mayor riesgo de choque, meningoencefalitis, rabdomiolisis y, en general, de falla orgánica multisistémica y complicaciones amenazantes de la vida7. El método diagnóstico ideal dependerá del tiempo de evolución de la enfermedad, pero después de una semana de síntomas la serología es el método de elección, preferiblemente, documentando seroconversión mediante el cambio de 4 veces en la titulación de anticuerpos o 2 veces en la dilución7,8.
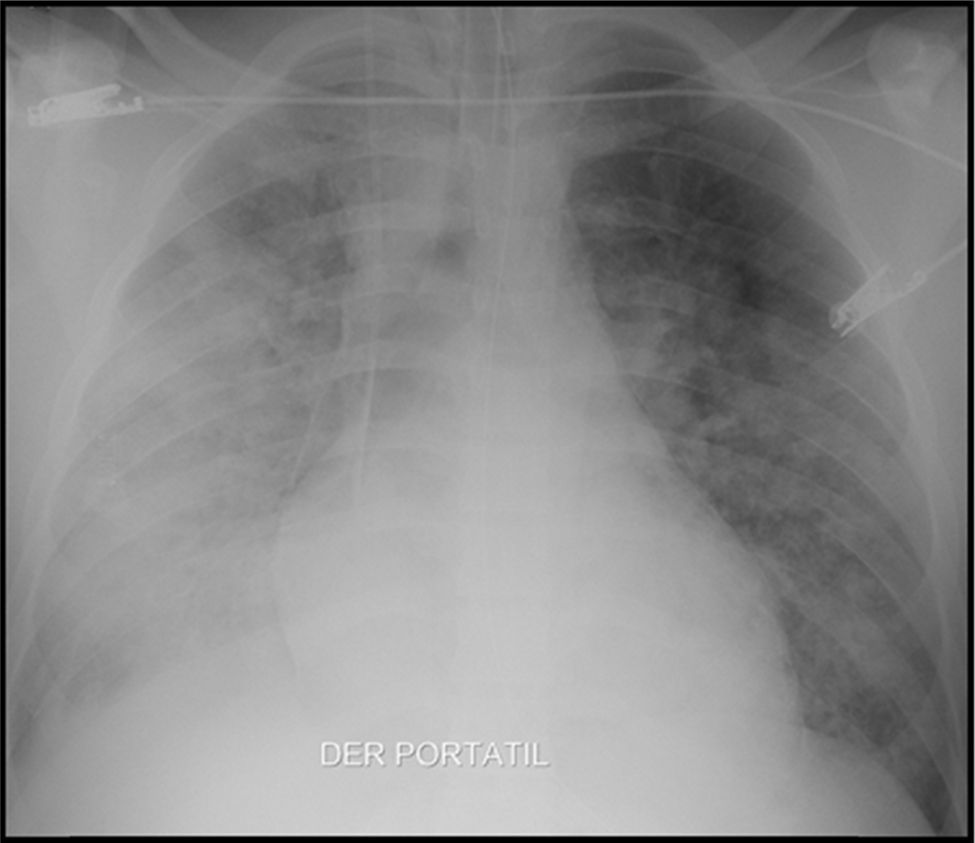
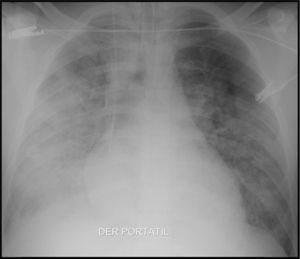
Caso clínicoHombre de 19 años, residente en Quibdó, integrante de las fuerzas militares, sin antecedentes de importancia, quien durante sus operaciones militares presenta exposición a aguas estancadas, consumo de aguas contaminadas, contacto con perros, aves y otros animales. Es remitido del hospital local por un cuadro de 3 días de fiebre alta, malestar general y vómito. Dos compañeros presentaban síntomas similares, siendo diagnosticados y tratados para malaria por Plasmodium vivax (P. vivax) con evolución satisfactoria. Previamente a su remisión, a este paciente se le hace diagnóstico de malaria por P. vivax a través de gota gruesa, y se les inicia tratamiento. El paciente evoluciona con falla respiratoria y coagulopatía, por lo cual lo remiten a nuestra institución. Ingresa en malas condiciones, taquicárdico, normotenso, en falla respiratoria aguda, requiriendo soporte ventilatorio mecánico en la unidad de cuidados intensivos (fig. 1).
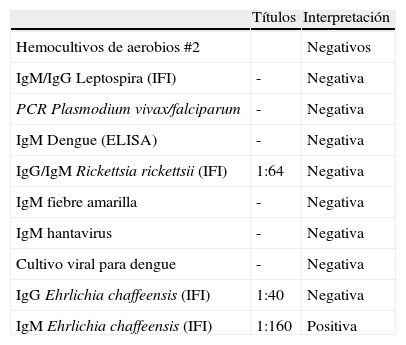
En piel, con lesiones petequiales a nivel de miembros inferiores. Los laboratorios evidencian trombocitopenia, linfopenia, disfunción renal, disfunción hepática, prolongación de los tiempos de coagulación, acidosis metabólica e hipoxemia. Se inicia tratamiento dirigido hacia una posible malaria complicada. Sin embargo, presenta deterioro progresivo, tornándose persistentemente febril, con altos requerimientos ventilatorios, de soporte vasopresor y requiriendo terapia de reemplazo renal continua. Desde su ingreso (6 h después de la admisión) se adiciona doxiciclina ante la sospecha de leptospirosis y el potencial cubrimiento de otras infecciones tipo Rickettsia y Ehrlichia, la cual recibe por 7 días. Se solicitan estudios adicionales para aclarar etiología de su cuadro presuntamente infeccioso, todos negativos (tabla 1).
Pruebas microbiológicas realizadas en suero
| Títulos | Interpretación | |
| Hemocultivos de aerobios #2 | Negativos | |
| IgM/IgG Leptospira (IFI) | - | Negativa |
| PCR Plasmodium vivax/falciparum | - | Negativa |
| IgM Dengue (ELISA) | - | Negativa |
| IgG/IgM Rickettsia rickettsii (IFI) | 1:64 | Negativa |
| IgM fiebre amarilla | - | Negativa |
| IgM hantavirus | - | Negativa |
| Cultivo viral para dengue | - | Negativa |
| IgG Ehrlichia chaffeensis (IFI) | 1:40 | Negativa |
| IgM Ehrlichia chaffeensis (IFI) | 1:160 | Positiva |
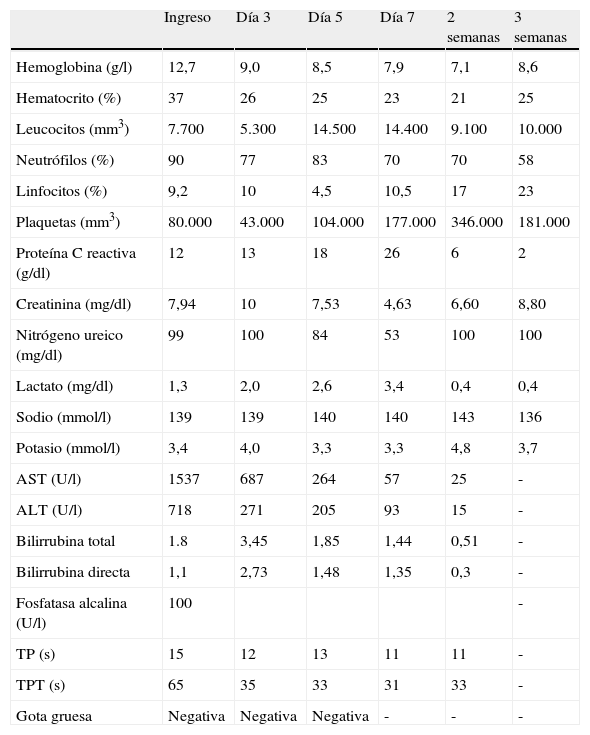
Los hemocultivos institucionales, los cultivos para aerobios, hongos y micobacterias tomados a través de fibrobroncoscopia no aportan ningún aislamiento. Se revisa nuevamente la gota gruesa de sitio de remisión, sin encontrar evidencia de parásitos. Tras una recuperación gradual del compromiso sistémico es trasladado a hospitalización donde es dado de alta luego de 37 días de estancia sin terapia de reemplazo renal. En este último período se documentan títulos de anticuerpos para Ehrlichia chaffeensis (E. chaffeensis) IgM 1:160 (valor de referencia<1:20) con IgG: 1,40 (valor de referencia<1:64). La serología se hizo a través del instituto de referencia andina por medio de la técnica de inmunofluorescencia indirecta. La prueba se realizó durante la segunda semana de síntomas ante la gravedad del caso y la sospecha clínica, habiendo descartado otras infecciones por vectores. En la tabla 2 se evidencia la evolución de los paraclínicos durante su estancia.
Evolución de química sanguínea durante seguimiento
| Ingreso | Día 3 | Día 5 | Día 7 | 2 semanas | 3 semanas | |
| Hemoglobina (g/l) | 12,7 | 9,0 | 8,5 | 7,9 | 7,1 | 8,6 |
| Hematocrito (%) | 37 | 26 | 25 | 23 | 21 | 25 |
| Leucocitos (mm3) | 7.700 | 5.300 | 14.500 | 14.400 | 9.100 | 10.000 |
| Neutrófilos (%) | 90 | 77 | 83 | 70 | 70 | 58 |
| Linfocitos (%) | 9,2 | 10 | 4,5 | 10,5 | 17 | 23 |
| Plaquetas (mm3) | 80.000 | 43.000 | 104.000 | 177.000 | 346.000 | 181.000 |
| Proteína C reactiva (g/dl) | 12 | 13 | 18 | 26 | 6 | 2 |
| Creatinina (mg/dl) | 7,94 | 10 | 7,53 | 4,63 | 6,60 | 8,80 |
| Nitrógeno ureico (mg/dl) | 99 | 100 | 84 | 53 | 100 | 100 |
| Lactato (mg/dl) | 1,3 | 2,0 | 2,6 | 3,4 | 0,4 | 0,4 |
| Sodio (mmol/l) | 139 | 139 | 140 | 140 | 143 | 136 |
| Potasio (mmol/l) | 3,4 | 4,0 | 3,3 | 3,3 | 4,8 | 3,7 |
| AST (U/l) | 1537 | 687 | 264 | 57 | 25 | - |
| ALT (U/l) | 718 | 271 | 205 | 93 | 15 | - |
| Bilirrubina total | 1.8 | 3,45 | 1,85 | 1,44 | 0,51 | - |
| Bilirrubina directa | 1,1 | 2,73 | 1,48 | 1,35 | 0,3 | - |
| Fosfatasa alcalina (U/l) | 100 | - | ||||
| TP (s) | 15 | 12 | 13 | 11 | 11 | - |
| TPT (s) | 65 | 35 | 33 | 31 | 33 | - |
| Gota gruesa | Negativa | Negativa | Negativa | - | - | - |
La ehrlichiosis es una zoonosis trasmitida por la picadura de garrapatas que afecta principalmente a los mamíferos1. Reconocida como enfermedad que afecta a los humanos desde 19862, predominantemente identificada en el sureste de Estados Unidos, donde la incidencia presenta una marcada variación geográfica y estacional1. Esta entidad también ha sido reportada en Europa, África y Latinoamérica; en esta última, la incidencia es incierta por falta de registros3–5. En Colombia disponemos de poca información acerca de esta entidad. En 2003, se analizaron 81 muestras de suero de personas con ocupaciones en el área rural de los departamentos de Córdoba y Sucre. El 20% de los individuos evaluados fueron seropositivos para Anaplasma phagocytophilum6(A. phagocytophilum). Un año después en la misma región colombiana, se evaluó la seroprevalencia de Ehrlichia en trabajadores rurales, demostrando que el 3,3% de las personas evaluadas tenían serología positiva para Ehrlichia spp.6. Aún no disponemos de información local acerca de infecciones clínicas en nuestro país. Ehrlichia es una bacteria perteneciente a la familia Anaplasmataceae, de los géneros Ehrlichia y Anaplasma. Tres especies tienen mayor importancia en humanos, cada una responsable de un síndrome clínico de acuerdo al tipo de leucocito que compromete: anaplasmosis granulocítica humana (AGH) causada por Anaplasma phagocytophilum afecta a los granulocitos; E. chaffeensis afecta a monocitos/macrófagos, causando la ehrlichiosis monocítica humana (EMH) y E. ewingii, que es serológicamente similar a E. chaffeensis pero invade neutrófilos, por lo cual su enfermedad se denomina ehrlichiosis humana ewingii (EHE)7. Desde 1986 hasta 2005 se habían reportado 2.396 casos de infección por E. chaffeensis, con variación geográfica de su incidencia, siendo 0,3% en algunas regiones y 0,02-0,06% en otras. Su incidencia aumenta en los meses de mayo-agosto. El principal vector para E. chaffeensis es la garrapata de estrella solitaria Amblyoma americanum7 cuya presencia ya ha sido documentada en nuestro país en reportes anteriores9,10. La EMH es un síndrome clínico inespecífico, puede cursar asintomática o tener un curso severo (en pacientes con o sin compromiso inmunológico subyacente), con complicaciones multisistémicas, requiriendo hospitalización hasta en el 56% de los casos y alcanzando una mortalidad del 3%, suele ir asociada principalmente a diagnósticos tardíos y tratamientos retardados1,7,8. Afecta a personas cercanas a los 50 años con un ligero predominio en el sexo masculino (57-61%) probablemente relacionado con el mayor número de actividades rurales1,7,9. E. chaffeensis es una bacteria en forma de coco, gramnegativa, intracelular obligado, con un tamaño entre 1-3 μ10. El humano adquiere la enfermedad tras la picadura de una garrapata infectada. Posteriormente la bacteria se replica en monocitos/macrófagos, donde es interiorizada. Dentro de ellos forma microcolonias (mórulas) que pueden observarse en sangre periférica bajo microscopia de luz. Estas estructuras se forman mientras la bacteria aumenta la expresión de factores antiapoptóticos y disminuye la expresión de citocinas Th1 (IL-12 e IL-18), favoreciendo su replicación intracelular11.
Es importante considerar las enfermedades trasmitidas por garrapatas en pacientes con síndromes febriles prolongados en áreas endémicas1. Tras un periodo de incubación de 5-10 días aparecen síntomas inespecíficos como fiebre, cefalea, fatiga y mialgias1. La enfermedad tiene un comportamiento similar a la fiebre de las Montañas Rocosas pero sin erupción cutánea2; sin embargo, la EMH tiene mayor probabilidad de desarrollar erupción que la AGH7. La erupción (cerca de un 30% de los pacientes con EMH) suele ser maculopapular, petequial o una eritrodermia difusa que respeta palmas, plantas y cara12. Las complicaciones: falla renal, coagulación intravascular diseminada, hemorragias espontáneas, encefalopatía, neumonía intersticial, síndrome de dificultad respiratoria del adulto (SDRA), miocarditis, son más comunes en los pacientes infectados con E. chaffeensis que con A. phagocytophilum1,11. En los paraclínicos es frecuente encontrar alteraciones hematológicas como leucopenia y trombocitopenia, elevación de las aminotrasferasas, hiponatremia y elevación de creatinina7. Existen varias maneras de establecer el diagnóstico. En el extendido de sangre periférica pueden identificarse las «mórulas» hasta en el 75% de los pacientes con AGH, pero en menos del 20% de los pacientes con EMH1,7. La PCR para detectar ADN de la bacteria en sangre es útil en la fase aguda de la enfermedad cuando aún los títulos de anticuerpos son bajos, alcanzando una sensibilidad entre 60-85% en la primera semana de la enfermedad, con una especificidad del 100%8. Los títulos de IgG e IgM pueden medirse mediante inmunofluorescencia indirecta (IFI); la sensibilidad de la prueba varía de acuerdo a las semanas después de aparición de los síntomas: en la primera semana 20-55%, entre una y 2 semanas 68% y después de 3 semanas mayor de 90%7. El diagnóstico se hace cuando existe un aumento de 4 veces en el valor inicial o caída de los títulos entre 2 muestras tomadas en la fase aguda y durante la convalecencia, separadas por 2-3 semanas1. Los altos títulos de IgM con títulos bajos de IgG en un paciente con factores de riesgo epidemiológicos y un cuadro clínico compatible que proviene de una zona no endémica hacen este diagnóstico altamente sugestivo. La determinación de anticuerpos es, actualmente, la técnica más empleada para el diagnóstico, con el inconveniente de que la alta seroprevalencia (en zonas con alta endemicidad) hace difícil la interpretación de la presencia de anticuerpos IgG1,7. Solo en casos experimentales se realiza cultivo de la bacteria (E. chaffeensis y A. phagocitophilum; E. egwingii no se cultiva) pues técnicamente es difícil por su lento crecimiento7. También pueden realizarse tinciones de inmunohistoquímica en médula ósea1.
Las recomendaciones sobre el tratamiento parten de series de casos y de estudios in vitro. Los medicamentos más estudiados son doxiciclina y cloramfenicol, prefiriendo la doxiciclina como tratamiento de elección por mayor eficacia y adecuado perfil de seguridad7. No es necesario ni prudente esperar a la confirmación del diagnóstico para el inicio del tratamiento antibiótico pues existe mayor riesgo de deterioro clínico y complicaciones si se retrasa la terapia1,8,9. La duración de tratamiento es de 7 a 14 días, algunos sugieren 3-5 días después de la defervescencia y hasta 14 días si hay compromiso de SNC1. En las primeras 72 h de tratamiento se espera una mejoría significativa de los síntomas, de lo contrario, debe reevaluarse el diagnóstico7,12. Dentro del diagnóstico diferencial deben incluirse otras enfermedades trasmitidas por garrapatas (fiebre de las Montañas Rocosas, fiebre recurrente, tularemia, babesiosis), y otras enfermedades como leptospirosis, hepatitis virales, dengue, fiebre tifoidea, salmonelosis y endocarditis, entre otros.
La principal dificultad del caso es la ausencia de títulos en la fase de convalescencia, esto debido a las grandes dificultades en realizar la serología en nuestro país. Se realizó la prueba en los días posteriores al ingreso a la institución y el resultado estuvo disponible 3 semanas después, cuando el paciente ya estaba recuperado. Para ese momento a pesar de la importancia académica de la prueba, los costos económicos y la logística para enviar nuevamente la muestra para fuera del país no estaban justificados, pues el paciente evolucionó satisfactoriamente. Sin embargo, consideramos que el cuadro clínico altamente sugestivo (síndrome febril con hepatitis, falla renal, trombocitopenia, erupción petequial que evoluciona a la falla orgánica múltiple) en un paciente con factores de riesgo para zoonosis donde se descartan infecciones comunes y otras infecciones por vectores (tabla 1) y que presenta una elevación de más de 4 veces en los títulos de IgM con una IgG negativa (descartando infección previa), constituye evidencia de la infección a pesar de las limitaciones descritas. La motivación de este reporte es concientizar acerca de la presencia de la ehrlichiosis en Colombia, con el fin de incluirla entre los diagnósticos diferenciales en casos clínicos compatibles, teniendo en cuenta el riesgo de deterioro rápido y progresivo ante un eventual retraso del tratamiento. Una extensa parte de la población colombiana está propensa a sufrir una zoonosis, en especial soldados, campesinos y residentes o trabajadores del área rural, por lo cual es importante que el personal de salud sospeche la presencia de la entidad.
ConclusiónLa ehrlichiosis monocítica humana es una entidad clínica no reconocida en nuestro país con una alta morbimortalidad de no instituirse un tratamiento apropiado de forma oportuna. Gracias a la temprana sospecha clínica de una infección por vectores que permitió el inicio de un manejo terapéutico empírico, cuyo diagnóstico se confirmó posteriormente mediante pruebas serológicas, se logró que el paciente inicialmente críticamente enfermo evolucionara hacia la mejoría. El fin de este reporte es concientizar a la comunidad médica de la existencia de la erlichiosis como entidad clínica en nuestro país, con el fin de considerar tratamiento empírico oportuno en pacientes con factores de riesgo epidemiológico (soldados, combatientes, residentes en área rural) y un cuadro clínico compatible.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.