La resistencia a carbapenémicos en Klebsiella pneumoniae ha aumentado de manera considerable, incrementando las tasas de morbimortalidad. El objetivo de este trabajo fue describir las características epidemiológicas, microbiológicas y las medidas de intervención que permitieron el control exitoso de un brote de Klebsiella pneumoniae productora de KPC-2.
MétodosEl estudio se realizó en 2 periodos: el primero durante el brote, con instauración de un protocolo de medidas de intervención; y el segundo, de seguimiento posbrote. Se realizaron pruebas de identificación y susceptibilidad por sistema automatizado, tamización de carbapenemasas por test de Hodge modificado, PCR para detección de los genes blaKPC, blaKPC-2, NDM-1 y estudio de clonalidad por electroforesis de campos pulsados.
ResultadosDurante el brote, se identificaron 18 aislamientos de Klebsiella pneumoniae productora de KPC en 11 pacientes. Tres casos fueron confirmados como infección intrahospitalaria. La técnica de PCR reveló la presencia del gen blaKPC en 21 de 22 aislamientos (pacientes y medio ambiente) y se identificó la presencia de un clon con una similitud superior al 75%. En el periodo posbrote los cultivos ambientales y de búsqueda de colonizados fueron negativos.
DiscusiónSe evidenció un control exitoso del brote producido por un clon. La implementación de un protocolo de intervención y la monitorización de su cumplimiento, la comunicación efectiva y el trabajo en equipo fueron indispensables para evitar su propagación y evitar un comportamiento endémico posbrote.
The considerable increase in carbapenem-resistant Klebsiella pneumoniae has caused an increase in mortality and morbidity rates. The aim of this study was to describe its epidemiological and microbiological characteristics and the intervention measures that controlled an outbreak caused by K. pneumoniae-producing KPC-2 B-lactamase.
MethodsThe study was divided into 2 periods: the first during the outbreak with the implementation of a bundle and the second a post-outbreak surveillance. We performed tests for identification and susceptibility by using an automated system, screening carbapenemases by the Modified-Hodge test, blaKPC, blaKPC-2 and NDM-1 identification by PCR and clonal relationship characterisation by PFGE.
ResultsDuring the outbreak, there were 18 isolates of Klebsiella pneumoniae-producing KPC-2 in 11 patients. Three cases were confirmed as hospital-acquired infection. Of 22 isolates, 21 were positive to blaKPC by PCR (samples from patients and environment) and a clone was identified with a similarity of greater than 75%. During the post-outbreak surveillance, we did not find any new positive cultures from surfaces and there were no new colonisations.
DiscussionThis was a successful control of an outbreak produced by a clone. The implementation of a bundle and a subsequent surveillance to monitor its fulfilment, effective communication and teamwork were crucial to inhibit propagation of the infection and to prevent an endemic behaviour post-outbreak.
Las infecciones asociadas al cuidado de la salud causadas por Klebsiella pneumoniae (K. pneumoniane) resistente a carbapenémicos se han incrementado en los últimos años y se han convertido en un problema de salud pública debido a diversos factores como su alta capacidad de diseminación, el comportamiento endémico alrededor del mundo, la escasez de antibióticos efectivos para su control —por lo que las opciones terapéuticas se han limitado a la combinación sinérgica de carbapenémicos con polimixinas o aminoglucósidos y la adición de tigeciclina o fosfomicina—, las elevadas tasas de fracaso terapéutico, el aumento de la morbimortalidad y los considerables costos en salud que esto conlleva1–5.
La resistencia a carbapenémicos en enterobacterias puede ser mediada por diferentes mecanismos, entre los cuales, la adquisición de carbapenemasas tipo A de Ambler, conocidas como K. pneumoniae carbapenemasa (KPC), es el más frecuente en nuestro medio. En 1996 se realizó el primer aislamiento productor de KPC en Carolina del Norte (Estados Unidos)1,6–10 y en Colombia en el año 2005, se encontró la variante KPC-2, lo que convirtió a este caso en uno de los primeros aislamientos reportados en Latinoamérica9,11.
A nivel mundial existen múltiples reportes de brotes causados por K. pneumoniae productora de KPC-2 y, recientemente, de la variante KPC-312, que denotan su facilidad de diseminación por el hecho de que los genes que codifican carbapenemasas son generalmente llevados en trasposones e integrones que se pueden difundir fácilmente entre los demás patógenos bacterianos. Debido a esta trasferencia de genes, los brotes presentan un componente monoclonal u oligoclonal, lo que amerita el establecimiento de un protocolo de estrategias de intervención para el control de infecciones como higiene adecuada de manos, baños con clorhexidina, aislamiento de contacto estricto, limpieza y desinfección medioambiental12–15, y vigilancia activa que permita identificar pacientes tanto infectados como colonizados para interrumpir la cadena de contagio y evitar su transmisión cruzada2,7,9,14,15. Los pacientes con mayor riesgo de infección o colonización por K. pneumoniae KPC son aquellos con estancia prolongada en una Unidad de Cuidados Intensivos (UCI), antecedente de trasplante de órgano sólido o hematológico, uso de ventilación mecánica, tiempo prolongado de hospitalización y uso previo de antibióticos de amplio espectro2,3,6,8,16.
Colombia es reportada a nivel mundial como un país endémico para K. pneumoniae productora de KPC12. En estudios locales recientes en UCI de 23 hospitales de Colombia entre el año 2009 y 2012, K. pneumoniae fue el bacilo gram negativo más frecuentemente aislado y su resistencia a carbapenémicos se incrementó del 7,1% en el año 2009 al 12,8% en el año 2012, un incremento que es clínica y estadísticamente significativo17,18.
El objetivo de este trabajo fue describir las características clínicas, epidemiológicas, microbiológicas y las medidas de intervención que permitieron el control exitoso de un brote de K. pneumoniae productora de KPC-2 en una UCI.
Materiales y métodosEstudio observacional, prospectivo, donde se recopilaron datos clínicos, epidemiológicos y microbiológicos relevantes de los pacientes con infección por K. pneumoniae KPC y el desenlace de las estrategias de intervención para el control de brote. Realizado en 2 periodos, el primero durante el desarrollo del brote, comprendido entre agosto y octubre de 2012, y el segundo periodo fue de seguimiento posbrote durante 14 meses, entre noviembre de 2012 y diciembre de 2013.
Se definió como caso todo paciente hospitalizado en la UCI polivalente con un aislamiento de K. pneumoniae resistente a carbapenémicos y con un proceso infeccioso, definido según los criterios de infecciones asociadas al cuidado de la salud (CDC/NHSN)13, traducidos y adaptados por la Secretaría Distrital de Salud (SDS) de Bogotá. Como colonizado se definió a todo paciente con un aislamiento de K. pneumoniae resistente a carbapenémicos sin manifestaciones clínicas o paraclínicas de un proceso infeccioso.
Estrategias de intervención «bundle»En agosto de 2012, se instauró un conjunto de intervenciones para controlar el brote de K. pneumoniae productora de carbapenemasas tipo KPC, las cuales se describen a continuación.
Cultivos ambientalesSe tomaron 40 muestras ambientales en la UCI, durante el periodo de brote, divididas de la siguiente manera: 24 muestras de superficies (lavamanos, mesas de noche, teléfonos, puertas, entre otros), 7 de equipos médicos (bombas de infusión, ventiladores de respiración mecánica, oxímetros, entre otros) y 9 muestras de manos de personal asistencial (médicos, enfermeras, auxiliares, fisioterapeutas). Estos fueron tomados con hisopo estéril y caldo de enriquecimiento, incubados a 37°C por 48 h; posteriormente se pasaron a agar sólido nutritivo.
Baños de chlohexidina diariosSe intensiicaron los baños diarios con clorhexidina al 4% a todos los pacientes hospitalizados en la UCI y a pacientes con estancia superior a 5 días. Para pacientes que iban para cirugía cardiovascular se formularon 5 baños diarios con clorhexidina al 4%. Así como también el uso de ungüento con mupirocina por 5 días para decolonización nasal.
Limpieza ambientalSe realizaron ajustes en los procesos de limpieza y desinfección con amonio cuaternario de cuarta generación de manera recurrente en todas las superficies, con un seguimiento y control a través de técnica de bioluminiscencia y cultivos microbiológicos. Se implementó la utilización de paños desechables para los procesos de limpieza y desinfección de equipos biomédicos de todas las áreas asistenciales.
InfraestructuraSe realizaron algunas reformas de infraestructura en UCI como acondicionamiento de lavamanos, nuevas puertas de acceso controlado y aumento de los puntos de dispensación de alcohol glicerinado en los diferentes servicios, así como la instalación de una cámara de vigilancia para realizar seguimiento de la adherencia al protocolo de higiene de manos.
Cultivos de vigilancia activaSe tomaron cultivos de secreción orotraqueal, hisopado rectal y orina de todos los pacientes de UCI, para determinar colonización. Esta actividad se realizó con una periodicidad de 15 días durante 2 meses.
Precauciones de aislamiento y de contactoSe realizó un ajuste a la guía de aislamiento de contacto en hospitalización, en la que se definió que los pacientes colonizados o infectados por microorganismos productores de KPC fueran ubicados en habitación individual o cohortizados con paciente con igual patrón de resistencia, con personal de enfermería y fisioterapia y equipo de monitorización de uso exclusivo. Este ajuste se implementó de igual forma en la guía de salas de cirugía, hemodinamia, electrofisiología, neurointervencionismo y radiología intervencionista. Se protocolizó el manejo y transporte de estos pacientes con estricto control de las medidas de aislamiento de contacto, y se determinó la restricción de ingreso a la UCI del personal en formación.
Educación continuadaEl programa de higiene de manos se fortaleció mediante sesiones educativas a todo el personal asistencial y familiares, con seguimiento intensivo por parte de los líderes del programa de higiene de manos (personal encargado de revisar la adecuada higienización en los 5 momentos de atención del paciente). Se instalaron afiches con el protocolo de higiene de manos (OMS) en diferentes puntos. Se realizó además un reentrenamiento en limpieza y desinfección de equipos médicos y superficies a todo el personal auxiliar encargado de este proceso.
Estudio microbiológico de pacientes y muestras ambientalesLas muestras clínicas y los cultivos medioambientales fueron procesados por el sistema automatizado MicroScan WalkAway Plus (Siemens®) para identificación y susceptibilidad antimicrobiana por el método de concentración inhibitoria mínima (MIC). La resistencia a carbapenémicos fue confirmada por el método de Kirby Bauer y la aplicación del test de Hodge19.
Fueron enviados al Centro Internacional de Entrenamiento e Investigaciones Médicas (CIDEIM) un total de 22 aislamientos: 5 ambientales y 17 aislamientos de pacientes (procedentes de los 3 casos y 8 colonizados) para la detección del gen blaKPC por reacción en cadena de la polimerasa (PCR) y para su respectivo estudio de clonalidad por electroforesis de campos pulsados (PFGE por su sigla en inglés). Igualmente, los aislamientos fueron enviados a la SDS de Bogotá para la detección de serin-betalactamasa KPC (gen blaKPC-2) y de metalo-betalactamasa New Delhi (NDM-1), este último destacado por el hallazgo de este tipo de carbapenemasa en Colombia y Centroamérica16,20.
Consideraciones éticasDurante todo el estudio se cumplieron con las responsabilidades éticas, se dio protección a los datos de los pacientes y no se vulneró la confidencialidad ni ningún derecho en su atención.
Igualmente, se contó con la aprobación y autorización de la dirección de la institución y de los jefes de departamento involucrados para la realización de este estudio.
No se utilizó ningún programa estadístico para este estudio, por el tipo de investigación realizada.
ResultadosDurante el primer periodo se identificó en 3 pacientes K. pneumoniae productora de KPC causantes de infección asociada al cuidado de la salud en 3 pacientes hospitalizados. Por ello se precisó la existencia de un brote, debido al incremento de este tipo de microorganismo comparado con el comportamiento durante el año inmediatamente anterior. Además, se obtuvieron 9 aislamientos de K. pneumoniae productora de KPC en 8 pacientes colonizados.
En los 3 pacientes confirmados como infección intrahospitalaria (2 infecciones de sitio operatorio y una infección de torrente sanguíneo asociada a catéter), se recuperaron 8 aislamientos con un patrón fenotípico de multirresistencia similar, donde solo 2 conservaron sensibilidad a tigeciclina y gentamicina; no se tamizó colistina (tabla 1). El primer caso (caso índice) fue detectado en líquido peritoneal; el segundo caso, en muestra de secreción de safenectomía, hisopado rectal y secreción orotraqueal; el tercer caso se detectó en muestras de sangre periférica, secreción orotraqueal, hisopado rectal y secreción del sitio de inserción inguinal de marcapasos. En los 3 casos se observó la presencia de elementos invasivos como catéter venoso central, sonda vesical, ventilación mecánica y el uso de antimicrobianos previos a la infección por K. pneumoniae KPC.
Datos clínicos, epidemiológicos y desenlace de los pacientes confirmados como caso que determinaron el brote en la Unidad de de Cuidados Intensivos
| Paciente | Edad/género | Fecha del primer aislamiento | Estancia previa al primer aislamiento | Total de días de estancia en UCI | Sitio anatómico del primer aislamiento | Otros sitios anatómicos | N.° de aislamientos con K. pneumoniae KPC | Terapia antimicrobiana previa (empírica) | Terapia antimicrobiana ajustada | Desenlace |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 77/M | 17-ago-12 | 16 días | 40 días | L. peritoneal | N/A | 1 | P/T | ME | Falleció |
| 2 | 76/M | 24-ago-12 | 27 días | 57 días | S. safenectomía | SOT, HR | 3 | ME, P/T | CO, ME, TI | Vivo |
| 3 | 73/M | 10-sep-12 | 14 días | 13 días | Sangre | SIM, SOT, HR | 4 | P/T | ME, CO, DO, TI | Falleció |
CO: colistina; DO: doripenem; HR: hisopado rectal; L: liquido; M: masculino; ME: meropenem; N/A: no aplica; P/T: piperacilina/tazobactam; S: secrecion; SIM: secreción en sitio de inserción de marcapasos; SOT: secreción orotraqueal; TI: tigeciclina.
De los cultivos ambientales tomados, 5 fueron positivos, 4 pertenecientes a la habitación de un paciente caso, tomados 4 h después del proceso de limpieza y desinfección, y uno procedente del lavamanos contiguo a la habitación.
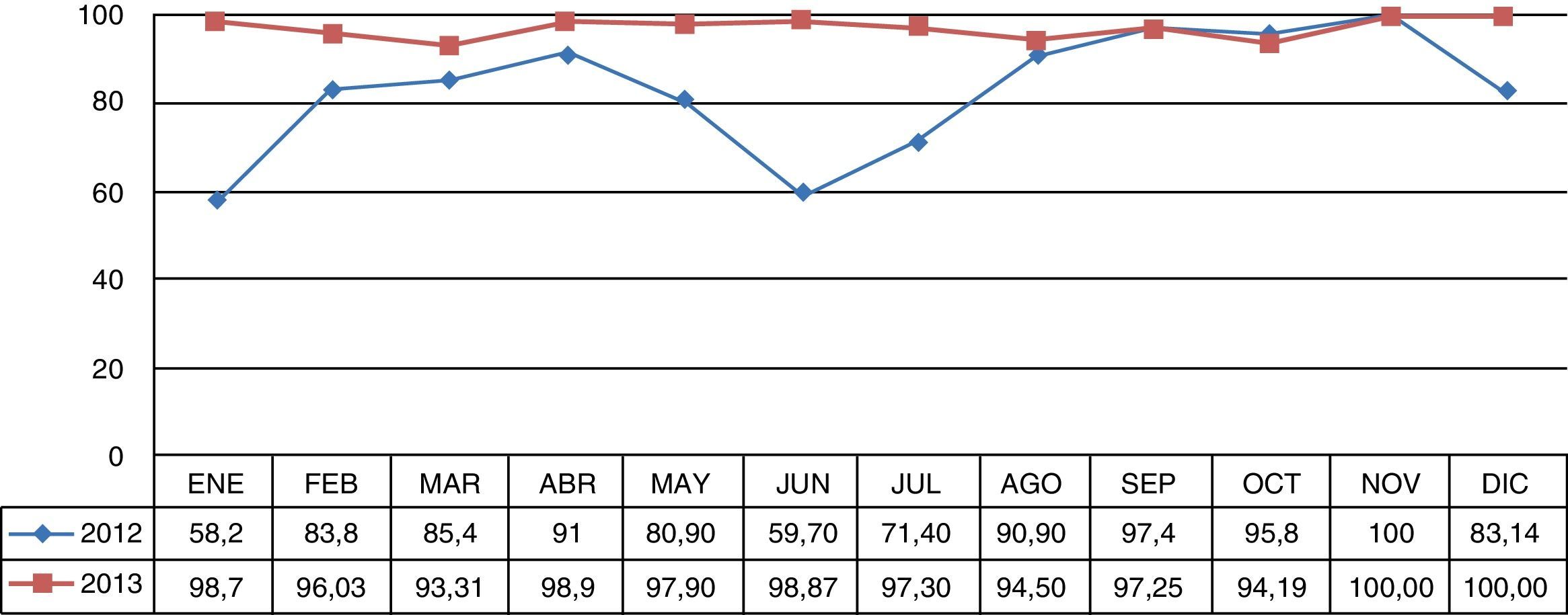
La monitorización de higiene de manos del personal de salud en la UCI evidenció una adherencia mayor del 90% posterior al brote, la cual se mantuvo durante el periodo de seguimiento posbrote (fig. 1).
Por el sistema MicroScan se observaron MIC mayores de 8mg/dL para meropenem y mayores de 4mg/dL para ertapenem, confirmadas por el método de Kirby Bauer con halos entre 6 y 10mm. El test de Hodge realizado a todos los aislamientos fue positivo, lo que permitió evidenciar la producción de carbapenemasas.
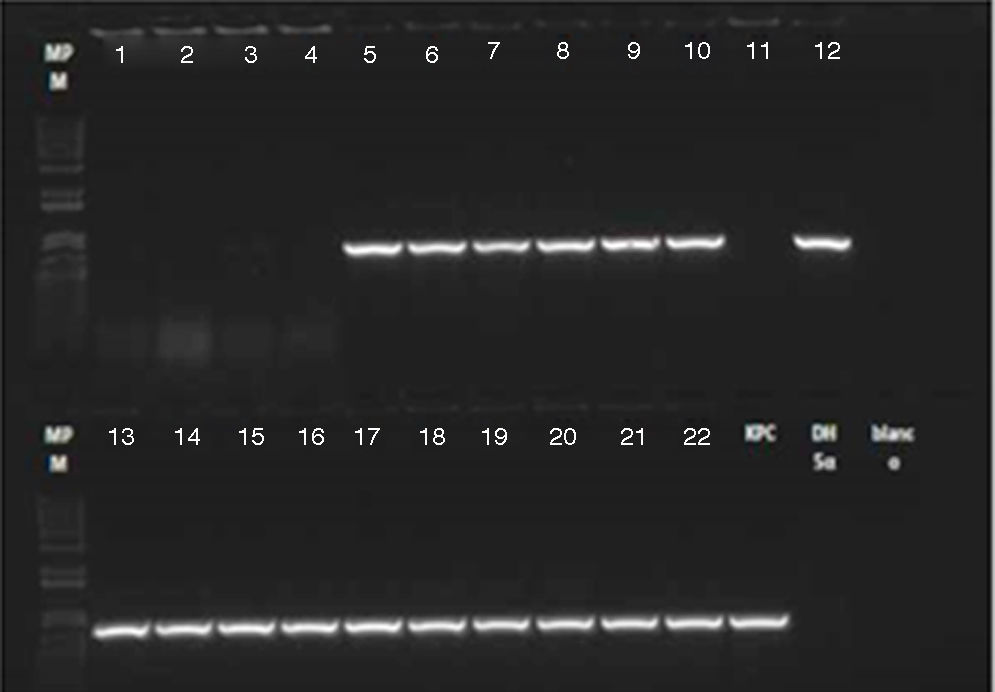
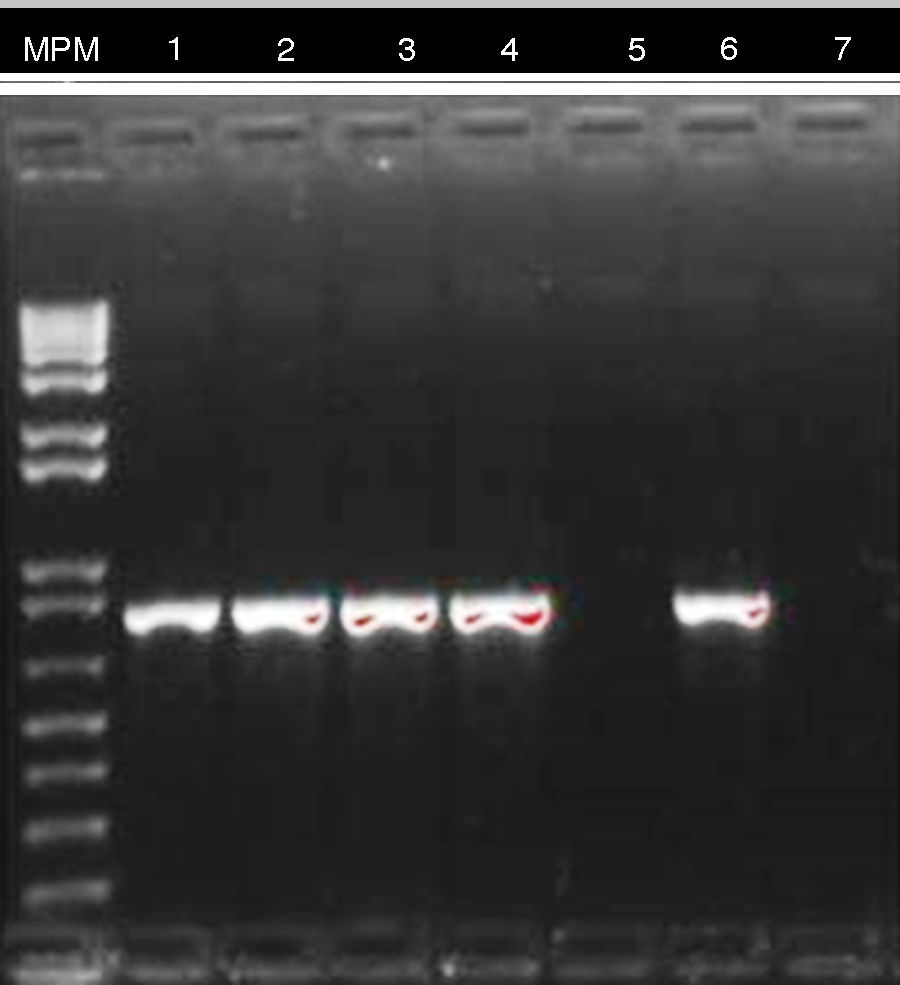
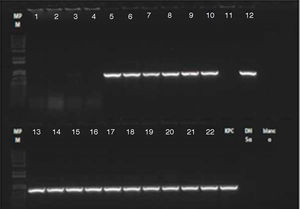
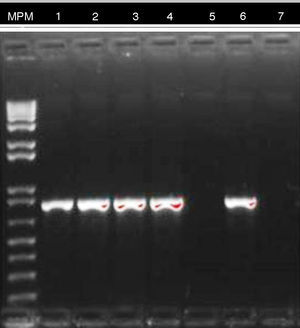
El resultado de PCR dado por CIDEIM para detección del gen blaKPC mostró positividad en 17 aislamientos (fig. 2). Los 5 aislamientos restantes que fueron negativos se reprocesaron nuevamente mediante una técnica alterna de extracción de ADN (obtención de ADN total)21, con la cual se obtuvo positividad para 4 aislamientos y solamente uno permaneció como negativo (fig. 3). En la SDS evidenciaron la presencia del gen blaKPC-2 en todos los aislamientos y ninguno fue positivo para el gen NDM-1 (datos no mostrados).
Electroforesis PCR gen blaKPC. Líneas 1-4: caso confirmado paciente 3 (sangre, hisopado rectal, secreción orotraqueal, secreción del sitio de inserción de marcapasos inguinal). Línea 5: caso confirmado paciente 1 (líquido peritoneal). Líneas 6-8: caso confirmado paciente 2 (secreción safenectomía, secreción orotraqueal, hisopado rectal). Líneas 9-11: pacientes colonizados. Líneas 12-16: muestras ambientales. Líneas 17-22: pacientes colonizados.
DH5α: control negativo; KPC: control positivo; RX blanco: control de reactivos.
El estudio de clonalidad por PFGE reveló el patrón específico de un clon (cuadro azul) con un porcentaje de similitud superior al 75%. También se observó la presencia de grupos de aislamientos indistinguibles entre ellos con un porcentaje de similitud del 100% (fig. 4).
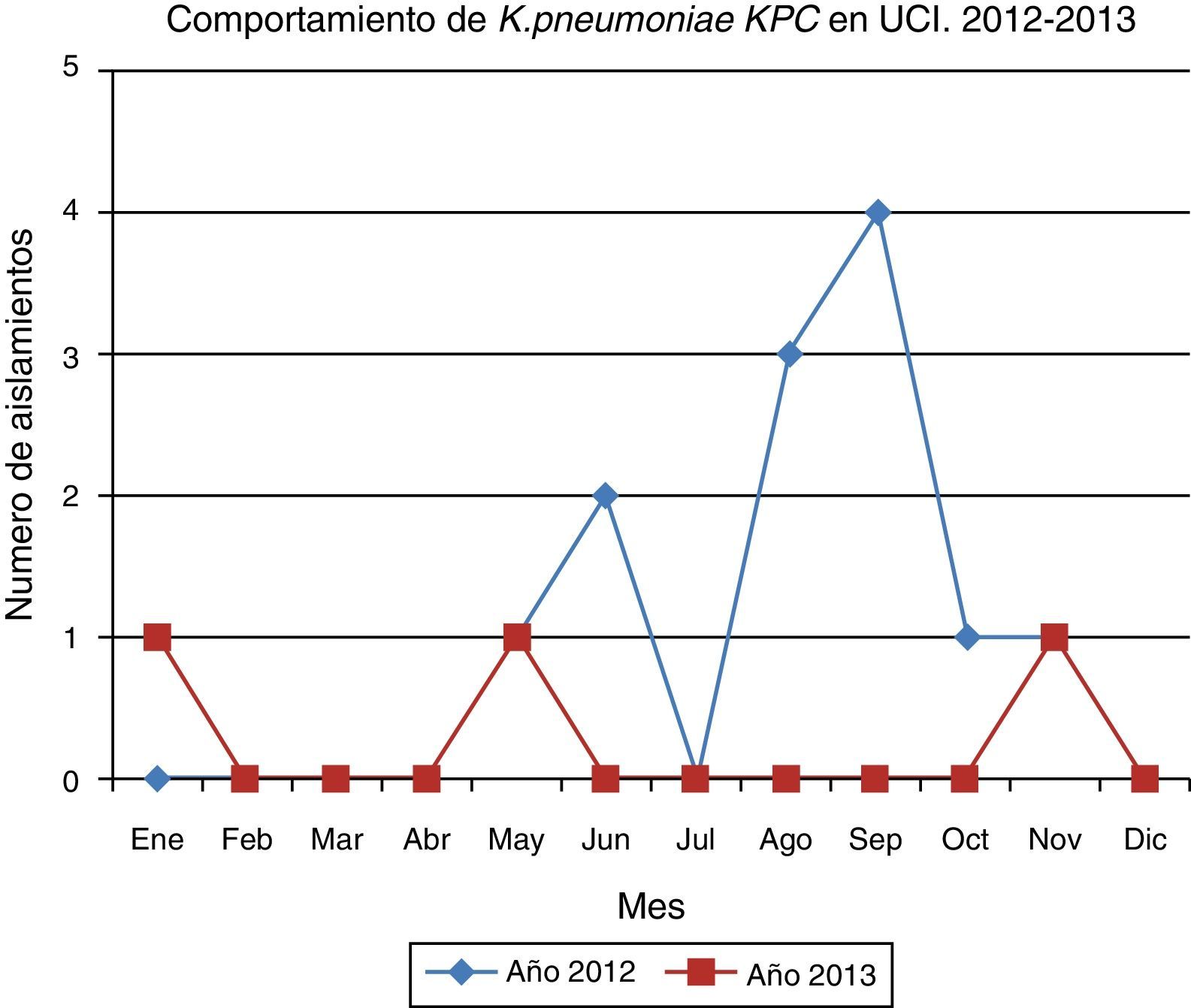
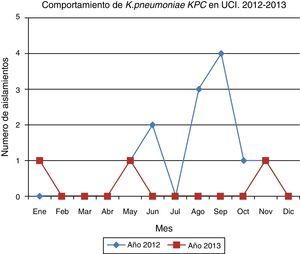
En el periodo de seguimiento posbrote se documentaron 3 aislamientos de K. pneumoniae KPC, cada uno en un mes diferente, con lapsos de tiempo amplios que fueron determinados como casos aislados, sin ningún nexo epidemiológico con el brote documentado.
DiscusiónEn el presente estudio se reporta la presencia de un brote por K. pneumoniae KPC-2 con patrón monoclonal en una UCI. Aunque no fue posible determinar claramente el factor que lo propició, la PFGE reveló la presencia de bandas idénticas, lo que permitió identificar la presencia de un gran clon formado por 21 de los 22 aislamientos y la transmisión cruzada como el principal factor asociado (muy probablemente los pacientes colonizados e infectados se comportaron como reservorio para la presentación de nuevos casos).
Se logró un control exitoso del brote mediante el establecimiento de un grupo de estrategias de intervención y la monitorización de su cumplimiento, con retroalimentación de líderes médicos y de enfermería y el reentrenamiento de observadores de higiene de manos. Además, se implementó la vigilancia con bioluminiscencia del proceso de limpieza y desinfección, y la supervisión de la adherencia a las medidas de aislamiento de contacto, a través de rondas realizadas por el personal de vigilancia epidemiológica. Adicionalmente, se decidió realizar la decolonización gastrointestinal para pacientes inmunosuprimidos (pacientes con trasplante de órgano sólido con documentación de colonización en hisopado rectal) con un protocolo de uso diario de gel oral de polimixina y gentamicina durante 7 días, aunque no se logró establecer un seguimiento en estos pacientes para evaluar la efectividad de la intervención. Saidel-Odes et al. demostraron en un estudio ciego aleatorizado la limitación en efectividad de esta intervención22. Por su parte, Lübbert et al. evidenciaron la aparición de resistencia a colistina posterior a la descolonización, por lo que esta medida no puede ser una recomendación universal23.
Los estudios publicados evidenciaron la importancia de la implementación de medidas de control tempranas para contener la diseminación del brote, evitar brotes prolongados, e incluso, para lograr un control exitoso. Giuffre et al. reportaron un control exitoso de un brote de enterobacterias productoras de KPC en una UCI neonatal con seguimiento posbrote durante 6 meses sin reporte de casos colonizados ni infectados. El control se logró a través del reforzamiento de medidas de control de infecciones que incluyeron higiene de manos, aislamiento de contacto estricto, limpieza y desinfección medioambiental, restricción de ingreso a la UCI (pero sin cierre de la unidad), vigilancia activa con búsqueda de pacientes colonizados y de cultivos medioambientales. En este estudio no se identificó colonización medioambiental24.
De igual forma, Munoz-Price et al. implementaron un paquete de medidas similares, con inclusión de baño diario de pacientes con clorhexidina gluconato y realización de cultivos a la admisión y cultivos de seguimiento mensual para evaluar la colonización, documentando prevalencia inicial de KPC de 21%. En los 5 meses posteriores a la implementación se mostró un descenso de la colonización de 12, 5, 3, 0 y 0% respectivamente (p=0,001)12.
El Centro para el Control de Enfermedades de Atlanta, EE. UU. (CDC en inglés) publicó en el año 2012 la guía para el control de las enterobacterias resistentes a carbapenémicos que incluye como núcleo de recomendaciones: higiene de manos, aislamiento de contacto individual o en cohortes con monitorización y retroalimentación, minimización del empleo de dispositivos invasivos, promoción del uso prudente de antibióticos, baños con clorhexidina al 2% y tamización (inicial y periódica) para la identificación de pacientes colonizados e infectados13.
Se confirmó por PCR la presencia del gen blaKPC en cada uno de ellos. En cuanto a la discrepancia presentada en uno de los aislamientos procesados en CIDEIM y en SDS, posiblemente fue dada por la pérdida del plásmido en el cual se aloja el gen blaKPC o por la amplia variabilidad de la técnica de PCR, que puede verse alterada por factores como exceso de ADN o exposición del ADN a lisis mecánica, lo cual afecta principalmente a microorganismos que poseen cápsula. Para nuestro caso, la utilización de ADN total mostró la obtención de mejores resultados21.
El perfil de sensibilidad de los aislamientos obtenidos limitó las opciones terapéuticas, en las que fue necesario ajustar la terapia antimicrobiana empírica inicial a una terapia específica combinada con meropenem más polimixinas (±tigeciclina)10,25–29. Aunque no se contó con un reporte de susceptibilidad a polimixinas, justificamos su empleo basados en reportes locales previos de adecuada susceptibilidad a estas. Sin embargo, consideramos necesaria la implementación de una vigilancia de los perfiles de susceptibilidad a polimixinas ante el reporte a nivel mundial de resistencia a estas30.
La comunicación efectiva y el trabajo en equipo entre UCI, infectología, epidemiología, microbiología y demás áreas involucradas permitió la identificación del brote y la adecuada implementación de estrategias de intervención que llevaron al control exitoso, el cual permitió evitar un comportamiento endémico posbrote (fig. 5).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración al Centro Internacional de Entrenamiento y de Investigaciones Médicas (CIDEIM) y a la Secretaría Distrital de Salud (SDS) por su colaboración.