Se presenta un caso de una mujer de 56 años, quien presentó un cuadro de encefalopatía secundario a sepsis por infección urinaria por Proteus mirabilis. El cuadro respondió a tratamiento con ciprofloxacina y fue dada de alta al día 11.
We reported a case in a woman of 56 years of encephalopathy, secondary a urinary tract infection by Proteus mirabilis. The patient improved after 11 days of hospitalization, under treatment with ciprofloxacin.
La encefalopatía asociada a la sepsis (EAS) se define por una disfunción cerebral difusa secundaria a la respuesta sistémica a la infección1,2, entidad poco conocida y subestimada por los clínicos, y que se presenta como primera disfunción orgánica en muchos pacientes sépticos1.
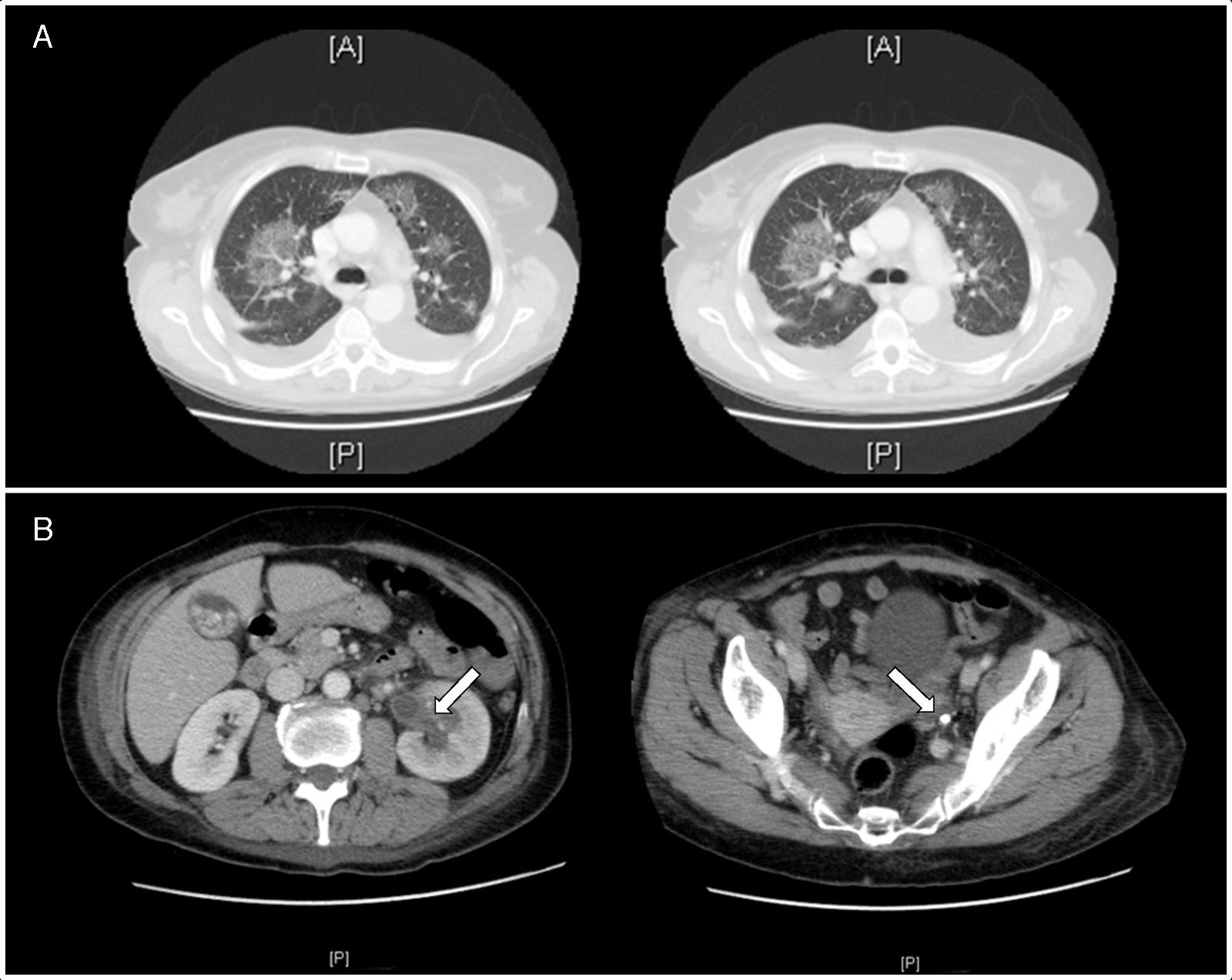
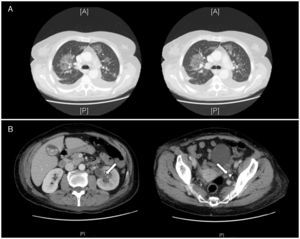
Descripción del casoMujer de 56 años, sin antecedentes, con 24h de evolución de fiebre, bradipsiquia y mala coordinación de las extremidades superiores durante episodios de tiritona; temperatura 38,3°C, con resto de constantes normales. La tomografía computarizada (TC) craneal, radiografía de tórax, bioquímica y sedimento urinario y punción lumbar fueron normales. El hemograma: leucocitos 14.700μl (88% neutrófilos), plaquetas 67.000μl; la bioquímica sanguínea: creatinina 1,6mg/dl, urea 51mg/dl, iones y perfil hepático normales. Ingresó en planta con fluidoterapia, antipiréticos e imipenem. Normalizó función renal en 12h, y empeoró la trombocitopenia con una procalcitonina de 58,24ng/ml y lactato normal, ingresando en la unidad de cuidados intensivos por sepsis grave de foco desconocido. La ecografía abdominal no mostraba alteraciones; 48h después se aisló Proteus mirabilis resistente a imipenem en orina y sangre, descartándose una hiperamonemia no hepática por este microorganismo3 que justificase la sintomatología neurológica. Se pautó tratamiento con ciprofloxacino por antibiograma, y la procalcitonina fue descendiendo con progresiva recuperación plaquetaria. Se realizó al 6.° día una TC toraco-abdominal por fiebre persistente e insuficiencia respiratoria: se diagnosticó de infiltrados parahiliares bilaterales (fig. 1A) atribuidos, tras un ecocardiograma transtorácico normal, a síndrome de distrés respiratorio por la sepsis; dilatación ureteropielocalicial izquierda secundaria a litiasis en tercio distal del uréter con pionefrosis asociada (fig. 1B). No precisó ventilación mecánica; se colocó un catéter doble J izquierdo con resolución de la fiebre, y las disfunciones neurológica y respiratoria hasta el alta el día 11.°.
DiscusiónEl factor de necrosis tumoral-alfa (TNF-α), interleucina-1beta (IL-1β) e interleucina-6 (IL-6) son las citocinas más importantes en la fisiopatología de la EAS1,2,4. La detección de la inflamación sistémica por el cerebro sucede a través de: a) órganos circunventriculares, desprovistos de barrera hematoencefálica (BHE), y b) nervio vago, que detecta la inflamación visceral1,2,4. La inflamación aumenta la transcripción de citocinas en el cerebro; la IL-1β, activa células gliales con propiedades neurotóxicas por liberación de óxido nítrico (NO) y especies reactivas del oxígeno (ROS)1,4. El TNF-α provoca la infiltración de neutrófilos en tejido cerebral, apoptosis de neuronas y edema cerebral, probablemente mediante la expresión de aquaporina-41,4. La IL-6 induce la ciclooxigenasa-2 en células gliales, aumentando la síntesis de prostaglandina-E2, causando fiebre y alteraciones del comportamiento1. Los lipopolisacáridos (LPS) de bacterias Gram negativas sobrerregulan la óxido nítrico sintetasa, inducible en los astrocitos y otras células con aumento del NO y ROS, responsables de procesos patológicos en las neuronas1,2; inducen la producción de IL-1β, TNF-α e IL-62, y la expresión de moléculas de adhesión en las células endoteliales cerebrovasculares aumentando la permeabilidad de la BHE1,5, permitiendo el paso de factores neurotóxicos desde la circulación periférica al cerebro2,4.
La EAS se caracteriza por la disminución de la atención y confusión fluctuantes en fases precoces que pueden evolucionar a delirio, agitación y coma en tardías1,2,4. Su diagnóstico, de exclusión, obliga a descartar infección directa o patología primaria en el sistema nervioso central, efectos de fármacos, tóxicos y alteraciones metabólicas1,2. La TC y el líquido cefalorraquídeo son habitualmente normales1,2,4; la resonancia magnética puede mostrar anormalidades inespecíficas: edema vasogénico, accidentes cerebrovasculares isquémicos múltiples, encefalopatía posterior reversible y lesiones en la sustancia blanca subcortical1,4. La electroencefalografía (EEG), es muy sensible, mostrando alteraciones incluso cuando la exploración neurológica es normal, pero muy poco específica1; sus alteraciones están relacionadas con la gravedad de la encefalopatía6, resultando además útil en la exclusión de un estatus epiléptico no convulsivo1,2. Sin embargo, continúa sin quedar claro si la EEG, lo mismo que los potenciales evocados somatosensoriales, tiene un rol potencial en la detección, cuantificación y pronóstico de la EAS6. Los biomarcadores proteína beta S-100 y enolasa neuro-específica tampoco resultan útiles por su baja sensibilidad y especificidad1,2. Su tratamiento es el de la sepsis1,2,4, tratar alteraciones metabólicas y evitar fármacos neurotóxicos1,2,4; la dexmedetomidina se ha demostrado de elección frente a las benzodiacepinas o propofol en esta entidad1,4. El estudio de Martí et al.7 muestra que aquellos pacientes ingresados por fiebre y bacteriemia, particularmente de foco urinario, presentan concentraciones más elevadas de TNF-α, IL-1β e IL-6, que aquellos que cursan sin bacteriemia. Otros 2 estudios8,9 también revelan un aumento significativo de TNF-α en pacientes con bacteriemia, especialmente por microorganismos Gram negativos8. Martínez et al. relacionan la confusión y la bacteriemia en neumonías con un aumento de IL-610. Nuestra hipótesis es que la EAS se hizo clínicamente más evidente en los periodos de bacteriemia intermitente, expresados por la tiritona, por una mayor concentración de estas citocinas en esos periodos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que no realizaron experimentos en seres humanos ni animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este articulo no aparecen datos que permitan la identificación de la paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.