La detección del cáncer gástrico precoz y de sus lesiones precursoras constituye un desafío para gran parte de los endoscopistas occidentales. Los cambios morfológicos que se producen en la mucosa gástrica generalmente son sutiles y, por tanto, difíciles de visualizar. En esta revisión se analiza la utilidad de la cromoendoscopia convencional, así como de sus modalidades digitales, y de la endoscopia con magnificación para reconocer y caracterizar estas lesiones.
Diagnosis of early gastric cancer and its precancerous lesions remains a challenge for great part of western endoscopists. Changes seen in the mucosal pattern are generally subtle and hence difficult to identify. In this article, we will review the usefulness of conventional and virtual chromoendoscopy and magnification endoscopy in the recognition and classification of these lesions.
La incidencia de cáncer gástrico en España se sitúa en niveles bajos (5,8 casos por cada 100.000 habitantes). No obstante, esta neoplasia presenta una elevada mortalidad debido en parte a que su detección suele ser tardía1.
El diagnóstico del espectro de lesiones malignas y premalignas gástricas mediante endoscopia de luz blanca y biopsias no dirigidas carece de una precisión suficiente, lo que explica el desarrollo de nuevas técnicas que han supuesto importantes avances en los últimos años.
La detección de lesiones precursoras (LPCG) permite identificar a los pacientes que precisan un seguimiento más estrecho, dada su mayor probabilidad de desarrollar cáncer gástrico precoz (CGP).
Por otra parte, la mejora en detección del CGP durante la endoscopia digestiva alta permite llevar a cabo tratamientos endoscópicos más conservadores y con porcentajes de curación equiparables a los obtenidos con cirugía.
En esta revisión narrativa se resume la evidencia disponible con respecto al diagnóstico endoscópico y al empleo de las técnicas auxiliares que mejoran su rendimiento, como la cromoendoscopia convencional, la digital y la endoscopia de magnificación.
El valor de la imagen de luz blanca y la alta definiciónEn los siguientes apartados sobre detección de LPCG y CGP revisaremos la precisión diagnóstica de la endoscopia de luz blanca de alta definición (HD-ELB) para la identificación de estas lesiones. Otros aspectos también relevantes en el diagnóstico y el manejo de estas lesiones ya han sido tratados extensamente en el reciente documento de posicionamiento sobre la calidad de la endoscopia en las LPCG y no son objeto de esta revisión2.
En cuanto a la detección de CGP, la imagen de resolución estándar con luz blanca (ELB) posee un rendimiento limitado. En un estudio japonés, ya clásico, en el que se emplearon endoscopios de resolución estándar, la sensibilidad de esta prueba diagnóstica fue solo del 81%3.
La HD-ELB, sin embargo, ha mostrado mayor exactitud diagnóstica en la detección de CGP. Así, en un estudio prospectivo que comparó la HD-ELB frente a la resolución estándar con endoscopio transnasal, el porcentaje de lesiones no detectadas con HD-ELB fue del 12,2% y el de diagnósticos incorrectos, del 9,8%. Estos resultados empeoraron con la imagen estándar, alcanzando el 26,8% y el 14,6%, respectivamente. De las 41 neoplasias confirmadas histológicamente, 11 no fueron detectadas con los endoscopios que carecían de alta definición y 3 se diagnosticaron erróneamente como lesiones no neoplásicas4.
Aunque estos resultados con HD-ELB podrían considerarse aceptables, estudios recientes5 han demostrado una baja sensibilidad cuando se compararon con el uso de tecnologías auxiliares. Así, aunque para la detección de displasia la especificidad de la HD-ELB alcanzó el 99%, la sensibilidad fue manifiestamente inferior que la obtenida con alta definición y narrow band imaging (HD-NBI) (74% vs. 92%, respectivamente). En el caso concreto de CGP de morfología deprimida y diámetro inferior a 10mm, la HD-ELB mostró, en un estudio aleatorizado y multicéntrico6, una sensibilidad, una especificidad y una precisión diagnóstica manifiestamente mejorables (40%, 67,9% y 64,8%, respectivamente).
Las técnicas clásicas de cromoendoscopiaPara incrementar la precisión diagnóstica se han utilizado diferentes técnicas de cromoendoscopia (CE). El empleo de las diferentes tinciones permite evaluar con detalle la morfología de la superficie mucosa cuyas características resultan más difíciles de estudiar con la imagen de luz blanca.
La eficacia diagnóstica de las diferentes técnicas de CE convencional respecto a la HD-ELB se comparó en un metaanálisis que incluyó 10 estudios7. Cuando se realizó un subanálisis para evaluar la precisión diagnóstica de la CE en la detección de CGP, esta fue del 86,6% en el caso de la CE y del 54,9% para la ELB. Globalmente, la sensibilidad y la especificidad de la CE para detectar CGP y lesiones preneoplásicas fueron del 90% y del 82%, respectivamente, con una validez diagnóstica, medida con el valor del área bajo la curva ROC (AUROC), de 0,94.
A continuación revisaremos algunos de los datos disponibles referentes a las técnicas de CE convencional más habituales.
Azul de metilenoEl azul de metileno tiñe selectivamente las áreas de metaplasia intestinal (MI). Cuando se ha empleado al 1% y con magnificación, su sensibilidad y su especificidad resultaron adecuadas para el diagnóstico de displasia (97,4% y 81,1%, respectivamente), con un elevado valor predictivo negativo (99,7%). Por tanto, permitiría excluir razonablemente la presencia de lesiones avanzadas cuando se utiliza esta tinción8. En este estudio, se empleó una clasificación en tres grupos (I: sin captación; II con captación de patrón regular, y III: con captación heterogénea y patrón mucoso irregular), que fue validada posteriormente9 y mostró una sensibilidad del 100% para detectar displasia y una especificidad del 99%, con un elevado porcentaje de acuerdo interobservador (0,92). Su validez diagnóstica, medida con el AUROC, fue de 0,99.
Ácido acéticoEl ácido acético (AA) modifica reversiblemente la estructura de las proteínas celulares, dando lugar a una reacción que resalta la arquitectura de la mucosa al inducir una coloración más blanquecina de la mucosa normal, mientras que el CGP aparece más rosado. De hecho, el aclaramiento precoz del AA en la mucosa se ha correlacionado con la invasividad de la lesión10.
La CE con AA se empleó para valorar la extensión topográfica de la MI comparada con la toma de biopsias según el protocolo de Sidney11. El empleo de AA detectó un 18% de los casos con MI extensa. Este porcentaje fue solo del 1% en el grupo en que no se aplicó la tinción. La especificidad del AA llegó al 94% y la sensibilidad fue del 77%. En este estudio, hasta el 14% de los pacientes presentaron efectos secundarios leves relativos al empleo de la tinción (dolor epigástrico o náuseas). Esta precisión diagnóstica del AA para detectar MI ha mostrado12, en combinación con NBI, una sensibilidad (AA-NBI: 87,9% vs. NBI: 66,7%) y un valor predictivo negativo superiores que el empleo aislado de NBI (AA-NBI: 84,9% vs. NBI: 67,2%). En este mismo estudio, la sensibilidad y la especificidad de la HD-ELB fueron solo del 33,3% y del 28,8%, respectivamente.
BicromoendoscopiaLa bicromoendoscopia (biCE) con AA e índigo carmín (IC) también se ha empleado en el diagnóstico de neoplasias gástricas. La adición de IC al AA acentúa los cambios al hacer la mucosa normal azulada y la lesión de coloración rosada más pálida.
En un estudio prospectivo de Yep-Gamarra et al.13, en el que evaluaron a 50 pacientes con diagnóstico de LPCG, la endoscopia sistemática con biCE identificó más pacientes con displasia (9 versus 3, p<0,05) y se obtuvieron más biopsias con diagnóstico de displasia, tanto en lesiones visibles (6 vs. 0, p<0,05) como en no visibles (6 vs. 3, p=NS).
En cuanto a la delimitación de los márgenes del CGP, en un estudio prospectivo realizado por Sakai et al.14, que comparó cuatro tipos de imágenes endoscópicas (HD-ELB, CE con IC, tinción con AA y biCE), el rendimiento diagnóstico fue muy pobre para la ELB (17%), se incrementó con AA (41,5%) e IC (52,8%), empleados ambos aisladamente, y resultó claramente superior empleando biCE, alcanzando el 94,3%.
En un ensayo similar, la utilidad de esta tinción mixta fue más decisiva para delimitar los márgenes cuando las lesiones eran de bordes más difusos, en comparación con el uso aislado de IC (86% presentaron mayor nitidez del contorno con biCE vs. 56% con IC). Sin embargo, cuando la lesión ya parecía tener un contorno bien definido con HD-ELB, el empleo de biCE no ayudó de manera significativa a obtener una visión más precisa de los márgenes (100% con IC vs. 95% con AA +IC). De hecho, no en todos los casos la tinción combinada es de utilidad. En 3/55 CGP con márgenes nítidos en la HD-ELB, el empleo de biCE se consideró que empeoraba la imagen original. Esto se debe a que, en algunos casos, el AA incrementa la secreción de moco en la mucosa, reduciendo el contraste entre la lesión y la mucosa normal15. Estos hallazgos referentes al empleo de la biCE se han confirmado en posteriores publicaciones. Así, Lee et al.16 obtuvieron una mejor delimitación de los márgenes con AA +IC en comparación con ELB (84% vs 67%). Concretamente, de las lesiones con menor nitidez de su contorno, la biCE mejoró su visualización en el 66% de los casos. En este estudio, la histología indiferenciada fue el único factor de riesgo que se asoció con una ausencia de mejoría en la detección de los márgenes con AA +IC.
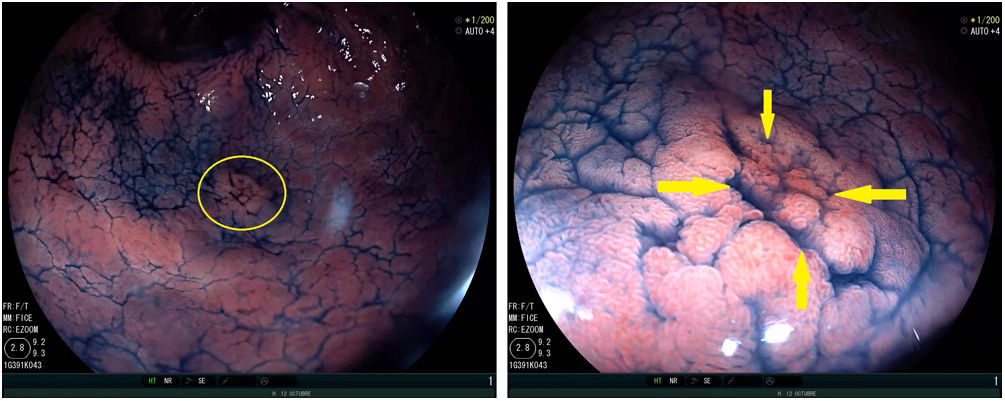
En la figura 1 se muestra un ejemplo de delimitación de los márgenes de un CGP con IC.
Neoplasia gástrica precoz antral de 11×9mm (círculo amarillo) en visión lejana. Cromoendoscopia con índigo-carmín (izquierda). En visión cercana se observa nítidamente la irregularidad del patrón glandular superficial en el interior de la línea de demarcación (flechas amarillas) (derecha).
Aunque, como hemos visto, existen evidencias que apoyan la utilización de CE convencional para la detección de las LPCG y el CGP, esta no se halla exenta de inconvenientes. Se deposita en zonas declives, interfiriendo con la visualización adecuada de algunas zonas, e incrementa discretamente la duración del procedimiento. Por ello, las diferentes técnicas de CE digital son herramientas cada vez más empleadas en estas indicaciones. De las diferentes modalidades existentes, se dispone de mayor información acerca de los sistemas NBI, Blue Laser Imaging (BLI) y Linked Color Imaging (LCI).
Cromoendoscopia digital en la detección de las lesiones precursorasNBIUn estudio prospectivo, aleatorizado y multicéntrico del grupo de Ang et al.17 comparó la HD-ELB con el NBI para detectar lesiones focales en la mucosa gástrica. Se aleatorizaron 579 pacientes, de los que en 286 la endoscopia se realizó con HD-ELB y en 293 con NBI. La sensibilidad del NBI fue claramente superior a la de la HD-ELB para detectar MI (92,3% vs. 59,1%), con valores de especificidad muy similares (94,3% vs. 98,6%).
Dado que resulta fundamental caracterizar las lesiones y clasificarlas adecuadamente con las técnicas de CE digital, Pimentel-Nunes et al.18 llevaron a cabo una validación multicéntrica de una clasificación basada en el NBI para las LPCG y el CGP. Se establecieron categorías basadas en el patrón mucoso y vascular para establecer los diagnósticos de mucosa normal, MI, infección por Helicobacter pylori y displasia. Se observó una elevada reproducibilidad en la identificación de los diferentes patrones mucosos y vasculares con HD-NBI y magnificación a baja potencia. La presencia de una mucosa tubulovellosa presentó una elevada exactitud diagnóstica para diagnosticar MI (precisión: 84%). Asimismo, las imágenes de mucosa de arquitectura irregular junto a un patrón vascular también irregular tuvieron una elevada precisión (95%) para diagnosticar displasia. El patrón de mucosa normal se correlacionó con la ausencia de hallazgos patológicos en el estudio histológico con una precisión del 83%.
Puesto que las LPCG son frecuentemente difíciles de diagnosticar con ELB y que el mapeo histológico propuesto por el protocolo de Sydney actualizado puede llegar a no diagnosticar hasta un 50% de los pacientes con MI, Buxbaum et al.19 diseñaron un estudio cuyo objetivo era comparar la capacidad de las biopsias dirigidas por NBI para diagnosticar MI comparado con la toma de biopsias dirigida por HD-ELB y la toma de especímenes histológicos aleatorios según el protocolo de Sydney. La toma de biopsias guiada por HD-ELB detectó el 29% de los casos con MI, las biopsias guiadas por NBI, el 65%, y la toma de biopsias según el protocolo de Sydney, el 76%. La capacidad para detectar MI entre las biopsias guiadas por NBI y las biopsias aleatorias según el protocolo de Sydney no mostraron diferencias estadísticamente significativas. La combinación de NBI y mapeo protocolizado detectó todos los casos de MI, así como el 95% de las localizaciones en la cámara gástrica en que existía dicha lesión. El 9% de las áreas con MI solo se detectaron con la toma de biopsias. Por localizaciones, el NBI detectó más zonas de MI en antro, y el mapeo, en cuerpo e incisura. Cuando se empleó el NBI para dirigir la toma de muestras, el número de biopsias preciso para diagnosticar un paciente con MI fue de 14,7, frente a las 21,5 necesarias para llegar a esa conclusión con el protocolo de mapeo. En este estudio, además, tanto la toma de biopsias dirigidas por NBI como el mapeo detectaron dos veces más casos de MI que la HD-ELB. De cualquier forma, se observó que, aun dirigiendo la toma de biopsias con NBI, hasta el 29% de los pacientes con MI no se hubieran diagnosticado. La combinación ideal, por tanto, para el diagnóstico de MI incluiría la toma de biopsias dirigida por NBI y el mapeo convencional propuesto por el protocolo de Sydney.
La capacidad del NBI para diagnosticar la presencia de MI extensa (afectación del cuerpo y del antro) se ha comparado con la imagen HD-ELB en otros estudios. Así, Lage et al.20 demostraron que la precisión para diagnosticar MI extensa con HD-ELB solo llegaba al 47%. Sin embargo, al emplear también NBI y near focus se incrementaba hasta el 75%. El empleo de NBI, sin embargo, se correlacionó pobremente con la clasificación histológica OLGIM. Aun en esa situación, el 90% de los pacientes se asignarían correctamente a realizar seguimiento endoscópico, y más del 95% a la recomendación de no continuar realizándolo.
Con la intención de hacer más reproducible el diagnóstico de MI con NBI, se ha propuesto, en un estudio multicéntrico prospectivo5, una clasificación endoscópica, denominada Endoscopic Grading of Gastrict Intestinal Metaplasia (EGGIM), que puntúa su presencia o ausencia en cinco áreas diferentes de la mucosa (curvatura menor y mayor del antro, incisura y ambas curvaduras del cuerpo) según esta no esté presente (0 puntos), sea focal, con afectación de ≤30% de la superficie (1 punto) o difusa, afectando a >30% de la mucosa (2 puntos). El sistema de puntuación obtenido puede encontrarse en un rango entre 0 (normal sin áreas de MI) y 10 (extensa MI en todas las áreas de la mucosa gástrica) (tabla 1). La exactitud diagnóstica pasó a ser del 83% con HD-ELB al 94% con NBI. La sensibilidad para el diagnóstico de MI se incrementó también con el empleo de NBI del 53% al 87%, con especificidad similar (98% para HD-ELB y 97% con NBI). En cuanto a la detección de displasia, la sensibilidad pasó del 74% al 92%, con elevada especificidad, cualquiera que fuera la técnica de imagen empleada (99% en ambas). El beneficio adicional del NBI en el diagnóstico de MI fue mayor en los estadios avanzados de MI (OLGIM III/IV) y la validez diagnóstica del sistema de puntuación EGGIM, definida por el valor del AUROC, para la presencia de MI extensa fue de 0,98. Por tanto, el uso de NBI demostró una elevada concordancia con el diagnóstico histológico, en comparación con HD-ELB. En este estudio, el punto de corte óptimo para recomendar seguimiento, en base a la precisión diagnóstica para detectar MI extensa (OLGIM III/IV), fue un EGGIM de 5 puntos. Esta clasificación endoscópica se ha validado en un estudio prospectivo multicéntrico del mismo grupo21 en el que se observó que ningún EGGIM0 tenía lesiones OLGIM III/IV. Solamente el 10,6% de EGGIM1-4 tenían OLGIM III/IV, mientras que el 89,4% de los EGGIM >4 mostraron lesiones OLGIM III/IV. La presencia de infección por Helicobacter pylori, en este estudio, no afectó a la precisión diagnóstica de la clasificación EGGIM, pero sí la presencia de hiperplasia foveolar, que se asoció con sobreestimación de la existencia de MI.
BLILa capacidad del modo BLI-bright (una variante del BLI que mejora la visibilidad a distancia de la óptica) para el diagnóstico de la MI también ha sido estudiada por el grupo de Pimentel-Nunes22 en un estudio prospectivo, unicéntrico y enmascarado, con una cohorte de 47 pacientes. Se incluyó todo el espectro de cambios gástricos (OLGIM 0-IV) que previamente ya habían sido estadificados endoscópicamente (con CE NBI y de acuerdo a la clasificación EGGIM) e histológicamente (con la clasificación OLGIM). Se valoró la capacidad diagnóstica del modo BLI-bright en el diagnóstico y la estadificación de la MI. Se observó que el modo BLI-bright era tan preciso como el NBI para clasificar el patrón mucoso: existía un 84% de acuerdo en los intervalos EGGIM (<5, ≥5) con respecto al diagnóstico previo con NBI, y el área bajo la curva para el diagnóstico de los estadios OLGIM III-IV era del 90% (sensibilidad 100%, especificidad 79%, valor predictivo positivo 72% y valor predictivo negativo 100%).
También se ha valorado la capacidad diagnóstica del modo BLI combinado con AA para el diagnóstico de MI. En un estudio unicéntrico, no aleatorizado, con 106 pacientes, se comparó la precisión diagnóstica para detectarla con HD-ELB, BLI y con la combinación de BLI y AA al 0,6%23. El modo BLI-AA mostró los mejores resultados (sensibilidad 80,4%, especificidad 90,9%), con un porcentaje de detección de MI del 77,8% vs. 53,8% con BLI y 40,4% con HD-ELB.
LCIEn cuanto al diagnóstico de lesiones premalignas con el modo LCI (sistema que potencia el contraste entre la gama de rojos y blancos), en un estudio observacional prospectivo se comparó la capacidad diagnóstica de la ELB frente al LCI para detectar las zonas con MI24. Estas áreas aparecen de color lavanda con LCI, mientras que se muestran como mínimas sobreelevaciones blanquecinas con ELB. La sensibilidad del LCI fue superior a la ELB, con una especificidad similar y mayor precisión diagnóstica (19% vs 91,4%; 98,6% vs. 87,1%, y 62,5% vs. 89,1%, respectivamente).
En otro estudio prospectivo, enmascarado, en tándem y bicéntrico en Singapur (un área con población de bajo riesgo de cáncer gástrico), 90 pacientes fueron aleatorizados a realizarse una gastroscopia con luz blanca seguida de LCI (por dos endoscopistas diferentes) o viceversa25. Se observó que el porcentaje de detección de gastritis atrófica y de MI era mayor con LCI que con luz blanca (2,2% vs. 0,5% y 19,7% vs. 7,7%, respectivamente). La sensibilidad del LCI fue mayor que la de la HD-ELB tanto en el diagnóstico de gastritis atrófica (88,9% vs. 22,2%) como en el de MI (84,7% vs. 32,9%), mientras que la especificidad de ambas técnicas fue comparable.
Cromoendoscopia digital y magnificación en la detección de cáncer gástrico precozNBICon respecto a la detección de CGP, en el estudio de Ang et al. ya mencionado17 la sensibilidad del NBI fue claramente superior a la de HD-ELB para detectar malignidad (100% vs. 28,6%), con valores de especificidad muy similares (80,9% vs. 78,9%). A pesar de esta mejor sensibilidad, no se detectaron más casos de CGP en el grupo NBI: 3/293 pacientes (1%) en el grupo NBI y 7/286 (2,4%) en el grupo HD-ELB, respectivamente (p=0,19). En otro estudio multicéntrico, aleatorizado y en tándem se realizó una gastroscopia a un total de 4.523 pacientes con mayor riesgo de cáncer gástrico en un área de alta incidencia, con el objetivo de evaluar si el modo NBI detectaba mayor número de CGP que la ELB26. El porcentaje de detección con ELB fue del 1,9% (44/2.258 pacientes) y con NBI del 2,3% (53/2.265), sin diferencias estadísticamente significativas entre ambos métodos (p=0,41). Tampoco se observaron diferencias estadísticamente significativas en el número de CGP no detectados cuando la primera exploración se realizaba con luz blanca (27,5%) o con NBI (22,4%). La sensibilidad y la especificidad para detectar CGP fueron del 80% y del 88%, respectivamente, con la ELB, y del 76,8% y del 91% con NBI.
En cuanto a la caracterización, la presencia de un patrón mucoso superficial y microvascular irregulares con NBI se asoció también con una elevada precisión en el diagnóstico de cáncer en una revisión sistemática en la que se pretendía evaluar los resultados del NBI, FICE e i-Scan para diagnosticar CGP y LPCG27. Se incluyeron 31 estudios con NBI y 7 con FICE. Ninguna de las publicaciones con i-Scan cumplió los criterios de inclusión, y los datos recopilados sobre FICE resultaron insuficientes para extraer conclusiones. El 90% de los estudios con NBI incluían el empleo de magnificación. Los resultados con NBI para diagnosticar el patrón mucoso normal fueron de una sensibilidad del 67% y una especificidad del 81%. Para MI, la sensibilidad fue del 86% y la especificidad del 77%, mientras que, para detectar displasia o cáncer, la sensibilidad fue del 90% y la especificidad del 83%.
La utilización de la clasificación vessels plus surface (VS), descrita por Yao et al.28, mediante el uso de NBI junto con endoscopia de magnificación, permite caracterizar y delimitar el CGP con elevada precisión. Esta clasificación se basa en la presencia de un área demarcada junto con un patrón microvascular y/o mucoso irregulares.
El empleo de magnificación con NBI (M-NBI) para el diagnóstico de CGP ha sido evaluado en dos metaanálisis que se examinan a continuación. En el publicado por Hu et al.29 se incluyeron 14 estudios con un total de 2.171 pacientes. En la mitad de los estudios, el criterio diagnóstico empleado para identificar el CGP fue la clasificación VS. En 6 de ellos se compararon los resultados con HD-ELB. La calidad global de los estudios se consideró excelente. Aunque se detectó marcada heterogeneidad en la sensibilidad y la especificidad, el empleo de M-NBI para diagnosticar CGP mostró valores del 86% y del 96%, respectivamente, con una precisión según el AUROC del 96%. En el caso de la ELB, todos estos parámetros fueron notablemente inferiores, del 56%, del 79% y del 66%, respectivamente. Adicionalmente, se observó que el rendimiento diagnóstico del M-NBI se veía influenciado negativamente por la morfología deprimida de la lesión y un tamaño <10mm. En el metaanálisis de Zhang et al.30 se incluyeron 10 publicaciones con 1.724 pacientes y 2.153 lesiones. Se comparó la eficacia diagnóstica de la imagen M-NBI con la ELB. La sensibilidad, la especificidad y el AUROC en el caso de M-NBI fueron del 83%, del 96% y del 0,96, respectivamente. En los cuatro estudios que evaluaron la eficacia diagnóstica de la ELB para CGP, esta mostró un pobre rendimiento, con una sensibilidad que fue solo del 48%, una especificidad del 67% y un valor del AUROC del 62%.
También se ha estudiado la capacidad para la delimitación de los márgenes del CGP con M-NBI en comparación con la CE convencional con IC (modalidad inicialmente utilizada con este propósito). En un estudio multicéntrico y aleatorizado del grupo de Nagahama et al.31 en el que se incluyeron 384 pacientes, no se observaron diferencias estadísticamente significativas en la correcta delineación de los márgenes, que fue del 85,7% con CE con IC y del 88% con NBI (p=0,63). Ambas técnicas parecen, por lo tanto, comparables.
BLILa capacidad del modo BLI-bright para detectar CGP se evaluó en un estudio aleatorizado, controlado y prospectivo con diseño back-to-back32. Se incluyeron 298 pacientes en cada una de las dos ramas del estudio (BLI de inicio y luego ELB vs. ELB de inicio y luego BLI). Los pacientes se encontraban en seguimiento por diagnóstico previo de gastritis atrófica con MI o por resección endoscópica previa de CGP. La detección de CGP en tiempo real fue superior de manera estadísticamente significativa en el grupo cuya exploración comenzó activando el sistema BLI (93% vs. 50%).
En otro estudio, esta vez prospectivo y multicéntrico, con un diseño de no inferioridad33, se evaluaron 104 neoplasias gástricas, previo a programar DSE, con tres tecnologías: M-BLI, M-BLI-bright y M-NBI. Para estudiar las lesiones se empleó la clasificación VS. Se realizaron dos exploraciones diferentes separadas menos de un mes y se evaluaron las imágenes tomadas en dichos procedimientos por un grupo de expertos. Se observó que la visualización del patrón superficial irregular era más fácilmente visible con modos BLI que con NBI: 97,1% con M-BLI; 90,4% con M-BLI-bright, y 78,8% con M-NBI (p<0,001). En el subtipo de adenocarcinomas de histología moderadamente diferenciada, el patrón superficial irregular se visualizó más frecuentemente en los modos M-BLI que con M-NBI (35% vs 9,9%; p=0,002).
La capacidad diagnóstica del modo BLI en la detección del cáncer gástrico y las lesiones preneoplásicas se ha comparado con la del NBI en un metaanálisis del grupo de Zhou et al.34. En él se incluyeron 28 estudios, con un total de 7.581 pacientes. La práctica totalidad de estos eran asiáticos, la mayoría (22) eran estudios con NBI y solo 6 con BLI. Las dos técnicas fueron altamente precisas en el diagnóstico de cáncer gástrico (BLI: sensibilidad 89% y especificidad 92%; NBI: sensibilidad 83% y especificidad 95%) y en el diagnóstico de lesiones precancerosas (BLI: sensibilidad 81%, especificidad 90%; NBI: sensibilidad 80%, especificidad 88%), sin encontrarse diferencias estadísticamente significativas. No obstante, el análisis estadístico mostró una alta heterogeneidad, ninguno de los estudios con BLI era de muy alta calidad y en ninguno se comparaban directamente ambas técnicas.
Otro metaanálisis reciente comparó la endoscopia con magnificación, sola o junto con diferentes técnicas de CE digital (NBI, BLI), en el diagnóstico del CGP, con respecto a la HD-ELB35. Se incluyeron 8 estudios prospectivos, con un total de 5.731 lesiones. La endoscopia con magnificación mostró una precisión diagnóstica mayor que la endoscopia convencional con luz blanca para detectar CGP (OR: 2,97). Comparada con HD-ELB, la precisión diagnóstica fue mayor cuando se asoció magnificación a la luz blanca (OR: 1,43) y aún mayor con magnificación con NBI (OR: 2,56) y con magnificación con BLI (OR: 3,13). No hubo diferencias significativas entre M-NBI y M-BLI.
LCIEl grupo de Gao et al.36 comparó el modo LCI con la endoscopia convencional con luz blanca para la detección del CGP. En este estudio prospectivo y multicéntrico se aleatorizaron 2.382 pacientes a realizarse una gastroscopia con luz blanca o con luz blanca y LCI, con toma de biopsias de las lesiones sospechosas, siendo la histología el patrón oro. La detección de CGP fue superior con el modo LCI, con una OR diagnóstica de 1,93 (IC95%: 1,36-2,74).
La detección del cáncer gástrico con LCI también ha sido valorada por el grupo de Yamaoka et al.37, en un estudio prospectivo y unicéntrico en Japón, en el que a 500 pacientes en seguimiento por gastritis atrófica se les realizó una endoscopia explorando primero la cavidad gástrica con luz blanca, seguido del modo LCI y finalmente con BLI-bright. Se detectaron un total de 16 cánceres gástricos (13 CGP y 3 adenomas), de los cuales el 25% no fueron visibles con luz blanca y sí con el modo LCI (3 EGC y un adenoma). Estas lesiones visibles con LCI eran de menor tamaño comparado con las diagnosticadas inicialmente con luz blanca (diámetro medio 7,7mm vs. 21,2mm). Ninguna lesión fue diagnosticada únicamente con el modo BLI-bright habiendo sido previamente invisible con las otras técnicas. Por su parte, Yoshifuku et al.38 evaluaron la visibilidad del CGP con BLI, LCI y ELB. Para ello, se realizó un análisis retrospectivo en base a las imágenes fijas de las lesiones objeto de estudio. El 73% de las lesiones mejoraron su visibilidad con LCI, y solo el 24% con BLI-bright. El empleo de LCI no se consideró que empeorara la visibilidad del CGP en ningún caso.
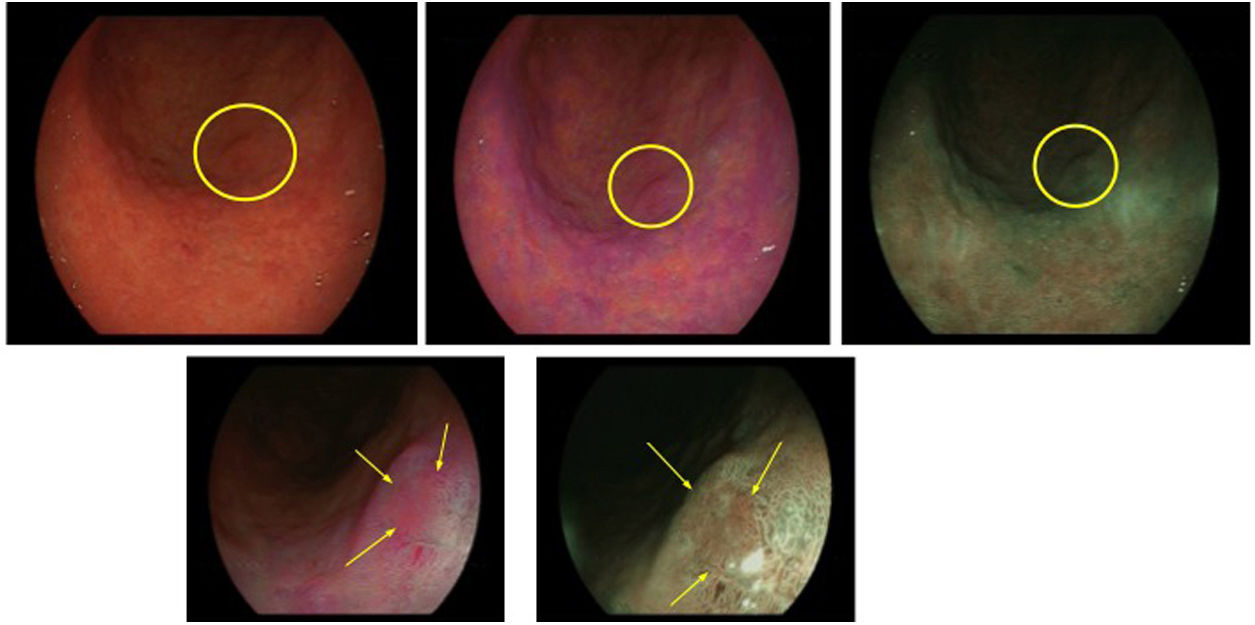
En la figura 2 se observan las características endoscópicas de las lesiones malignas con cada una de las diferentes modalidades anteriormente descritas.
Neoplasia gástrica precoz con histología en toma de biopsias de displasia de bajo grado en curvatura mayor del antro. A)Imagen de luz blanca con alta definición. B)Color violáceo en imagen LCI. C)Imagen BLI. D)Imagen LCI con magnificación. E)Imagen BLI con magnificación. En D y E se observa línea de demarcación periférica y distorsión del patrón superficial y microvascular en su interior.
Recientemente, Rodríguez-Carrasco et al.39 han publicado un metaanálisis sobre el uso de técnicas de imagen avanzada en el diagnóstico de lesiones premalignas gástricas. En él se incluyen un total de 44 estudios y 10.451 áreas biopsiadas. La mayoría de los estudios incluidos eran de grupos orientales y con diseño prospectivo. Por lo general se utilizaba luz blanca antes de la CE y magnificación. En 25 estudios se comparó la luz blanca con CE digital, y en 7 diferentes técnicas de CE. El patrón oro en todos ellos era el estudio histológico.
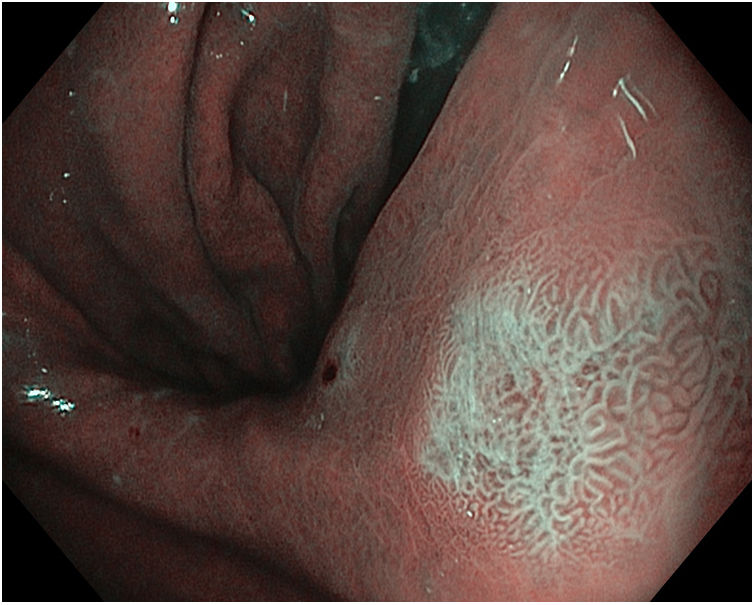
Con respecto al NBI, se analizaron 30 estudios que incluyeron 8.482 pacientes. Para el diagnóstico de MI, en el análisis por biopsia, la sensibilidad fue del 84% y la especificidad del 95%, con elevada heterogeneidad. Cuando se empleaba magnificación, la presencia del signo light blue crest (LBC) como único marcador para MI tenía una baja especificidad si se comparaba con el uso de otros marcadores (patrón tubulovelloso, sustancia blanca opaca y banda turbia marginal) o una combinación de estos (89% vs 96%). En los estudios sin magnificación, la precisión diagnóstica era significativamente más alta en aquellos que utilizaban el patrón tubulovelloso, con o sin LBC. La sensibilidad y la especificidad de este hallazgo fueron del 88% y del 97%, respectivamente. En la figura 3 se observa el aspecto endoscópico de la MI con magnificación y NBI (M-NBI).
Con BLI, se incluyeron 3 estudios con 736 pacientes en este metaanálisis. En el diagnóstico de MI se obtuvo una sensibilidad del 78% y una especificidad del 83%. Sin magnificación, sin embargo, la sensibilidad y la especificidad fueron inferiores (68% y 69%, respectivamente). Los estudios con magnificación obtuvieron una precisión diagnóstica superponible a la conseguida con NBI.
Con LCI, se incluyeron 2 estudios con 176 pacientes. Para el diagnóstico de MI, la sensibilidad fue del 73% y la especificidad del 92%.
Para el diagnóstico de displasia y CGP solo se obtuvieron resultados con NBI. En el análisis por biopsia, la sensibilidad y la especificidad con NBI fueron del 87% y del 97%, respectivamente, con alta heterogeneidad. La especificidad era significativamente más alta en el grupo que utilizaba magnificación (97% vs. 84%). También en los estudios con magnificación, la especificidad era más alta en el subgrupo que empleaba la clasificación VS (98% vs. 94%), aunque con una menor sensibilidad (86% vs. 94%). La morfología deprimida incrementó la precisión diagnóstica (sensibilidad 88%, especificidad 96%).
Con respecto a las lesiones precursoras de cáncer gástrico, los resultados de los principales estudios se resumen en la tabla 2. En cuanto al diagnóstico de displasia y CGP, los resultados se resumen en la tabla 3.
Lesiones precursoras de cáncer gástrico: resumen de los principales estudios
| Estudio; año | Asiático (sí/no) | Diseño | Pacientes, n | Resultados MI | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Song K H; 2017 | Sí | ProspectivoUnicéntricoNo aleatorizado | 105 | ELB-HD + AA | |||||||
| S 77% | E 94% | ||||||||||
| Ang TL; 2015 | Mixto | ProspectivoMulticéntricoAleatorizado | 579 | NBI | ELB-HD | ||||||
| S 92,3% | E 94,3% | S 59,1% | E 98,6% | ||||||||
| Pimentel-Nunes P; 2012 | No | RetrospectivoBicéntricoNo aleatorizado | 85 | NBI-M (x1,5) | |||||||
| Patrón tubulovelloso | Signo light blue crest | ||||||||||
| S 89% | E 90% | S 48% | E 96% | ||||||||
| Buxbaum JL; 2017 | No | ProspectivoUnicéntricoNo aleatorizado | 112 | NBI | ELB-HD | Biopsias de mapeo | |||||
| S 65% | S 29% | S 76% | |||||||||
| Lage J, 2015 | No | UnicéntricoNo aleatorizado | 35 | L-NBI | ELB-HD | NBI-NF-M(× 1,5) | |||||
| S 63% | S 60% | S 73% | |||||||||
| Esposito G; 2019 | No | MulticéntricoProspectivoNo aleatorizado | 250 | NBI EGGIM >4 (diagnóstico de OLGIM III/IV) | |||||||
| S 89,4% | E 94,6% | ||||||||||
| Sha J; 2017 | Sí | UnicéntricoProspectivoNo aleatorizado | 132 | NBI-AA | NBI | ELB | |||||
| S 87,9% | E 68,2% | S 66,7% | E 68,2% | S 33,3% | E 28,8% | ||||||
| Chen H; 2019 | Sí | ProspectivoUnicéntricoNo aleatorizado | 106 | BLI-AA | BLI | ELB | |||||
| S 85,4% | E 84,6% | S 68,3% | E 69,2% | S 41,5% | E 38,5% | ||||||
| Castro R; 2019 | No | ProspectivoUnicéntricoNo aleatorizado | 37 | MI (EGGIM ≥ 5) | |||||||
| BLI-bright | NBI | ||||||||||
| S 100% | E 79% | ||||||||||
| Ono S; 2018 | Sí | ProspectivoUnicéntricoNo aleatorizado | 128 | LCI | ELB | ||||||
| S 91,4% | E 81,7% | S 19% | E 98,6% | ||||||||
| Wu C; 2021 | Sí | ProspectivoBicéntricoEn tándem | 90 | LCI | ELB | ||||||
| S 84,7% | E 92,2% | S 32,9% | E 97,2% | ||||||||
| Kikuste I; 2013 | Mixto | Revisión sistemática | 31 estudios | NBI-M | |||||||
| S 86% | E 77% | ||||||||||
| Rodríguez-Carrasco M; 2020 | Mixto (mayoría asiáticos) | Metaanálisis | 10.175 | NBI | FICE-M | BLI | LCI | ||||
| S 84% | E 95% | S 96% | E 80% | S 78% | E 83% | S 73% | E 92% | ||||
| Zhou J; 2020 | Sí | Metaanálisis | 7.581 | NBI | BLI | ||||||
| S 80% | E 88% | S 81% | E 90% | ||||||||
AA: ácido acético; E: especificidad; ELB-HD: endoscopia de luz blanca con alta definición; M: magnificación; NF: near focus, S: sensibilidad.
Displasia y cáncer gástrico precoz: resumen de los principales estudios
| Estudio; año | Asiático (sí/no) | Diseño | Pacientes, n | ResultadosDisplasia y/o CGP | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ang TL; 2015 | Mixto | ProspectivoMulticéntricoAleatorizado | 579 | NBI | ELB-HD | |||||||
| S 100% | E 80,9% | S 28,6% | E 78,9% | |||||||||
| Pimentel-Nunes P; 2012 | No | RetrospectivoBicéntricoNo aleatorizado | 85 | NBI-M (× 1,5) | ||||||||
| S 96% | E 98% | |||||||||||
| Yoshifuku Y; 2017 | Sí | RetrospectivoUnicéntricoNo aleatorizado | 82 | LCI | BLI-bright | |||||||
| Mejora visibilidad 73% | Mejora visibilidad 20% | |||||||||||
| Dohi O; 2019 | Sí | ProspectivoBicéntricoAleatorizado (back to back) | 629 | BLI-bright | ELB-HD | |||||||
| S 93% | S 50% | |||||||||||
| Dohi O; 2017 | Sí | ProspectivoMulticéntricoNo aleatorizado | 104 | LD | Irregular MSP | Irregular MVP | ||||||
| BLI-M96% | BLI-bright-M98% | NBI-M98% | BLI-M97% | BLI-bright-M90% | NBI-M79% | BLI-M95% | BLI-bright-M95% | NBI-M96% | ||||
| Gao J; 2021 | Sí | ProspectivoUnicéntricoAleatorizado | 2.382 | ELB-HD | ELB-HD + LCI | |||||||
| Tasa de detección 4,3% | Tasa de detección 8% | |||||||||||
| Yamaoka M; 2020 | Sí | ProspectivoUnicéntricoNo aleatorizado | 500 | 1° ELB | 2° LCI | 3° BLI-bright | ||||||
| S 75% | S 100% | S 100% | ||||||||||
| Kikuste I; 2013 | Mixto | Revisión sistemática | 31 estudios | NBI-M | ||||||||
| S 90% | E 83% | |||||||||||
| Hu Y.Y; 2015 | Sí | Metaanálisis | 2.171 | NBI-M | ELB-HD | |||||||
| S 86% | E 96% | S 57% | E 79% | |||||||||
| Zhang Q; 2016 | Sí | Metaanálisis | 1.724 | NBI-M | ELB-HD | |||||||
| S 83% | E 96% | S 48% | E 67% | |||||||||
| Rodríguez-Carrasco M; 2020 | Mixto (mayoría asiáticos) | Metaanálisis | 19 estudios | NBI | ||||||||
| S 87% | E 97% | |||||||||||
| Zhou J; 2020 | Sí | Metaanálisis | 7.581 | NBI | BLI | |||||||
| S 83% | E 88% | S 89% | E 92% | |||||||||
| Le H; 2021 | Sí | Metaanálisis | 5.731 | Diagnóstico comparado con ELB-HD | ||||||||
| ELB-M | NBI-M | BLI-M | ||||||||||
| ORD 2,97 | ORD 2,56 | ORD 3,13 | ||||||||||
CGP: cáncer gástrico precoz; E: especificidad; ELB-HD: endoscopia de luz blanca con alta definición; LD: línea de demarcación; M: magnificación; MSP: microsurface pattern; MVP: microvascular pattern; ORD: odds ratio diagnóstica; S: sensibilidad.
La endoscopia es la principal herramienta para detectar las LPCG y el CGP. Sin embargo, su capacidad diagnóstica es mejorable, especialmente si se utiliza exclusivamente endoscopia de luz blanca, aun con el empleo de alta definición. Estos resultados mejoran con el uso de CE y magnificación.
La expansión del uso de técnicas de imagen avanzada puede conseguirse con una adecuada formación en la materia. En este sentido, estudios recientes señalan que la formación on-line con un adecuado feedback podría ser suficiente40,41.
Para la detección y la caracterización de la MI se recomienda el uso de CE convencional o digital de forma rutinaria, ya que ambas han demostrado mejorar la precisión diagnóstica. En el caso de las diferentes modalidades de CE digital, el NBI es el más ampliamente estudiado, y se han diseñado y validado patrones mucosos (patrón tubulovelloso, signo LBC) y escalas (EGGIM) que predicen tanto la existencia de MI como su extensión. Las nuevas modalidades de CE digital (BLI y LCI) consiguen resultados superponibles al NBI, aunque todavía se necesitan estudios más robustos que confirmen estos hallazgos.
Con respecto al CGP, el uso de técnicas de imagen avanzada no ha demostrado aumentar el número de lesiones detectadas. Tanto la CE convencional como la digital mejoran la delimitación de los márgenes del CGP. Por lo que se refiere a las diferentes técnicas de CE digital, su sensibilidad para caracterizar adecuadamente estas lesiones parece superior a la obtenida con HD-ELB. Existe suficiente evidencia para recomendar el uso de magnificación y de la clasificación VS, mediante técnicas de CE, con el fin de caracterizar estas lesiones.
En definitiva, la evidencia a favor del empleo de técnicas de imagen avanzada para la detección y seguimiento de LPCG y CGP sustenta las recomendaciones realizadas recientemente por varias sociedades científicas de nuestro ámbito más próximo2.
FinanciaciónEste artículo no cuenta con financiación.
Conflicto de interesesMaria Moreno-Sanchez, Gloria Fernández Esparrach y Joaquín Cubiella declaran no tener ningún conflicto de intereses.
Jose Carlos Marin-Gabriel ha recibido honorarios de Fujifilm por impartir conferencia.