Los pacientes con ciertas enfermedades inflamatorias mediadas inmunológicamente, como la artritis reumatoide (AR) y la enfermedad inflamatoria intestinal (EII), presentan una mayor incidencia y gravedad de enfermedades infecciosas que la población general, asociadas especialmente a los tratamientos inmunosupresores que reciben.
Dichos tratamientos actúan sobre el sistema inmunitario a través de diferentes mecanismos, causando diferentes grados de inmunosupresión y un riesgo variable dependiendo de si el patógeno es un virus, una bacteria o un hongo. Este artículo es una revisión de la bibliografía más relevante sobre el tema, seleccionada y debatida por un panel de expertos. El objetivo de este artículo es revisar el riesgo de infecciones en pacientes con EII y AR y las potenciales medidas preventivas.
Patients with certain immune-mediated inflammatory diseases, such as rheumatoid arthritis (RA) and inflammatory bowel disease (IBD), have an increased risk of severe infectious diseases than the general population, which are mainly associated with the immunosuppressive treatments that they receive.
These treatments act on the immune system through different mechanisms, causing different degrees of immunosuppression and a variable risk depending on whether the pathogen is a virus, bacteria or fungus. This article reviews the most relevant literature on the subject, which was selected and discussed by a panel of experts. The aim of this article is to review the risk of infections in patients with IBD and RA, and the potential preventive measures.
La artritis reumatoide (AR) y la enfermedad inflamatoria intestinal (EII) se encuentran entre las enfermedades inflamatorias crónicas o autoinmunes más prevalentes. Tanto los pacientes con AR como los pacientes con EII presentan una mayor incidencia y gravedad de enfermedades infecciosas que la población general. El riesgo de infección se asocia a la edad, a la propia enfermedad y su grado de actividad y a los tratamientos inmunosupresores que reciben1-3. Algunas de las infecciones pueden prevenirse mediante el tratamiento de la infección latente (p.ej., tuberculosis) o mediante vacunación4-7.
El cumplimiento de las recomendaciones de vacunación descrito tanto en pacientes con EII como en aquellos con enfermedades reumáticas es muy bajo4,8-11. Entre las razones argumentadas se incluye el miedo a efectos adversos, la preocupación respecto de la eficacia de la vacuna debido al estado de inmunosupresión, la creencia injustificada de que la vacunación puede exacerbar la enfermedad y por la falta de conocimiento de los especialistas respecto a las vacunas recomendadas4,8,12. Es, por tanto, importante que tanto médicos como pacientes conozcan el riesgo de infección asociada a cada terapia y las medidas de prevención de infecciones en este tipo de enfermedades13.
Una de las causas más importantes del aumento del riesgo de infecciones son los medicamentos inmunosupresores. Entre los tratamientos inmunosupresores o fármacos modificadores de la enfermedad (FAME) convencionales (sc) más utilizados se encuentran corticoides, tiopurinas (azatioprina, mercaptopurina), ciclosporina, metotrexato (MTX), leflunomida y biológicos. Recientemente se han incorporado a este arsenal terapéutico pequeñas moléculas orales dirigidas a dianas, entre ellas baricitinib y tofacitinib, ambos inhibidores de las quinasas de Janus o JAK (de Janus Kinase, en inglés)8. Dichos tratamientos actúan sobre el sistema inmunitario a través de diferentes mecanismos causando diferentes grados de inmunosupresión. Además, el riesgo es variable dependiendo de si el patógeno es un virus, una bacteria o un hongo14.
El objetivo de este artículo es revisar el riesgo de infecciones en pacientes con enfermedades inmunomediadas, en concreto en EII y AR y las potenciales medidas preventivas.
Riesgo de infección en pacientes con EII que reciben tratamiento inmunosupresorEl incremento de riesgo de infecciones en pacientes con EII parece ser atribuido principalmente a los tratamientos inmunosupresores3,15. Así, el tratamiento con corticoides sistémicos se asocia a un riesgo muy elevado de infección grave. La combinación de terapias inmunosupresoras también aumenta notablemente el riesgo de infección16-18. Otros factores relacionados son la edad avanzada, la actividad de la enfermedad y la malnutrición7,16-18. En un reciente estudio observacional y retrospectivo utilizando el registro ENEIDA, de Zabana et al.3, incluyó a 6.914 pacientes con EII tratados con inmunosupresores (tiopurina, MTX) y/o terapia biológica (anti-TNF-α) seguidos durante una media de 12años. El riesgo de infección durante el periodo de tratamiento fue 30 veces superior que antes del inicio del tratamiento y 6 veces mayor que tras su retirada. Dentro de los diferentes tratamientos analizados, el 5% de los pacientes sufrieron al menos una infección grave3.
Los resultados publicados sobre el riesgo de infecciones y la estrategia terapéutica empleada difieren según se analicen ensayos clínicos13 o la experiencia a largo plazo en estudios observacionales en práctica habitual15,16. Wheat et al.13, en un metaanálisis que incluyó 38 estudios aleatorizados y 24 estrategias terapéuticas diferentes, no observaron diferencias significativas en el riesgo de infecciones graves entre los tratamientos inmunosupresores13.
Por el contrario, los estudios observacionales muestran un riesgo distinto de infecciones graves en relación con el tratamiento empleado y con el tiempo de exposición3,15,16. Así, Singh et al.16, analizaron el riesgo de infecciones graves asociado a la administración de inhibidores del factor de necrosis tumoral alfa (anti-TNF-α) en una reciente revisión sistemática y metaanálisis que incluyó 15 estudios observacionales. El tratamiento con anti-TNF-α en monoterapia aumentó notablemente el riesgo de infección respecto a la monoterapia con tiopurinas o MTX16. La terapia combinada con anti-TNF-α y tiopurinas o MTX se asoció a un incremento adicional del riesgo16.
Estos hallazgos han sido reproducidos en estudios de bases de datos poblacionales por otros autores15. Así, Kirchgesner et al.15 evaluaron el riesgo de infecciones graves en 190.694 pacientes con EII (base de datos francesa del Sistema Nacional de Información sobre Seguros de Salud entre Regiones [SNIIRAM]). La tasa de incidencia (TI) de infecciones graves fue de 0,84 por 100 pacientes-año en pacientes no tratados con anti-TNF-α ni tiopurinas, aumentando a tasas de 1,05, 1,89 y 2,24 por 100 paciente y año en aquellos que recibieron tratamiento en monoterapia con tiopurinas, anti-TNF-α o una combinación de ambos, respectivamente. Comparado con el tratamiento en monoterapia, la terapia combinada con anti-TNF-α y tiopurinas se asoció con un aumento del riesgo de infección grave con un hazard ratio (HR) de 1,23; IC95%: 1,05-1,4515. Asimismo, la monoterapia con anti-TNF-α se asoció con un incremento significativo del riesgo de infección grave (HR: 1,72; IC95%: 1,56-1,88), infecciones por micobacterias (HR: 1.98; IC95%: 1,15-3,40) e infecciones bacterianas (HR: 2,38; IC95%: 1,23-4,58) comparado con la monoterapia con tiopurinas15.
Con respecto a vedolizumab, el análisis de seguridad del estudio aleatorizado realizado en 374 pacientes con colitis ulcerosa que recibieron vedolizumab frente a 521 con placebo no mostró diferencias respecto a la incidencia de enfermedades infecciosas graves entre los dos grupos19. La tasa de incidencia (TI) de infecciones graves fue de 1,8 por 100 pacientes-año20.
Sands et al.21, no observaron diferencias en incidencia de infecciones graves en la semana 44 (mantenimiento) entre los grupos que recibían ustekinumab y placebo en un estudio aleatorizado que evaluó ustekinumab en 961 pacientes21. En el estudio de extensión, entre la semana 44 y la 96 la tasa de infección grave de ustekinumab fue 2.33 vs. 2.99 por 100 pacientes-año en el grupo placebo22
Tofacitinib ha sido recientemente aprobado para el tratamiento de la colitis ulcerosa (CU) moderada a grave. Un metaanálisis23 comparó la eficacia y la seguridad de los biológicos y tofacitinib como tratamientos de primera línea (naïve a anti-TNF-α) y de segunda línea (fallo previo a anti-TNF-α) para el tratamiento de CU moderada a grave23. En los ensayos de mantenimiento se observó que vedolizumab y ustekinumab fueron las opciones más seguras en términos de riesgo de infecciones23, siendo en líneas generales las infecciones graves poco frecuentes con biológicos y tofacitinib23. Dentro del programa OCTAVE con tofacitinib, Sandborn et al.24, observaron una tasa de incidencia de infección grave de 2,0 casos por 100 pacientes-año (IC95%: 1,4-2,8)24. La incidencia se mantuvo estable en el seguimiento hasta 6,8 años25.
Riesgo de infección en pacientes con AR que reciben tratamiento inmunosupresorLos pacientes con AR también presentan una mayor susceptibilidad a desarrollar infecciones. En este caso, se considera que pueden estar relacionados tanto con alteraciones inmunológicas asociadas a la enfermedad como con los efectos inmunosupresores de los tratamientos empleados26. Otros factores que incrementan el riesgo de infecciones en estos pacientes son la actividad de la enfermedad, la presencia de manifestaciones extraarticulares (HR: 2,07; IC95%: 1,41-3,06), la edad avanzada (HR: 1,30 por cada 10años, IC95%: 1,16-1,46) y las comorbilidades como enfermedad crónica pulmonar (HR: 1,84; IC95%: 1,40-2,41), diabetes mellitus (HR: 1,60; IC95%: 1,20-2,30) o el alcoholismo (HR: 1,67; IC95% 1,16-2,41)26.
Numerosas revisiones sistemáticas y metaanálisis han evaluado el riesgo de infecciones en AR, en función de los tratamientos y la fase de la enfermedad27-31. Bongartz et al.27 observaron en un metaanálisis que el empleo de anti-TNF-α (infliximab y adalimumab) duplicaba el riesgo de infecciones graves respecto a placebo (OR: 2,0; IC95%: 1,3-3,1). El riesgo aumentaba con el uso de dosis altas (OR: 2,3; IC95%: 1,5-3,6)27. En esta línea, Singh et al.31 publicaron en 2015 una revisión sistemática incluyendo 106 estudios aleatorizados en pacientes con AR con datos de 9 biológicos. Comparado con los FAMEsc, el empleo de anti-TNF-α (con o sin FAMEsc) se asoció con un incremento del riesgo de infecciones graves tanto a las dosis estándar como a dosis altas31. Strand et al.29, evaluaron el riesgo de infección grave asociado a biológicos y al inhibidor de JAK, tofacitinib, en una revisión sistemática y metaanálisis que incluía 66 estudios aleatorizados, 22 estudios de extensión abiertos, 3 estudios fase3 y los estudios de extensión de tofacitinib. La TI de infección grave por 100 pacientes-año estimada para abatacept, rituximab, tocilizumab y anti-TNF-α fue de 3,04 (IC95%: 2,49-3,72), 3,72 (IC95%: 2,99-4,62), 5,45 (IC95%: 4,26-6.96) y 4,90 (IC95%: 4,41-5,44), respectivamente29. La TI para tofacitinib 5mg y 10mg dos veces al día fue de 3,02 (IC95%: 2,25-4,05) y 3,00 (IC95%: 2,24-4,02) por 100 pacientes-año, respectivamente, en los estudios fase3, y de 2,50 (IC95%: 2,05-3.04) y 3,19 (IC95%: 2,74-3,72) para los de extensión29.
Bechman et al.32, en una reciente revisión sistemática y metaanálisis donde se incluyeron 11 estudios sobre tofacitinib y 6 sobre baricitinib, en pacientes con AR, observaron una TI de infecciones graves por 100 pacientes-año de 1,97 (IC95%: 1,41-2,68) en el caso de tofacitinib y de 3,16 (IC95%: 2,07-4,63) con baricitinib32.
En relación con el riesgo de infecciones graves a largo plazo en pacientes tratados con tofacitinib, en el análisis integrado de seguridad a 9,5años33 que incluyó 7.061 pacientes se observó una TI por 100 pacientes-año de infecciones graves de 2,5 (2,3-2,7)33.
Smolen et al.34, en un análisis de seguridad de baricitinib a 2años que incluyó 3.492 pacientes (6.639 pacientes-año) procedentes de 6 estudios, observaron una TI de infecciones graves por 100 pacientes-año en AR tratadas con baricitinib 2mg y 4mg al día de 3,8 y 4,2, respectivamente34. Curtis et al.35, en un análisis llevado a cabo en pacientes con AR tratados con dosis de tofacitinib de 5mg y 10mg dos veces al día mostraron una TI de infecciones graves por 100 pacientes-año de 2,38 y 2,78, respectivamente, en pacientes <65años frente a 3,89 y 8.06, respectivamente, en pacientes >65años35. Fleischmann et al.36 evaluaron la seguridad y la eficacia de baricitinib en pacientes ancianos con AR y observaron también un aumento de infecciones graves en mayores de 65años (2,9% con baricitinib 4mg vs. 1,8% con placebo)36.
Recientemente, la Agencia Europea de Medicamentos (EMA) emitió una recomendación con respecto a los pacientes mayores de 65años en tratamiento con tofacitinib, basado en un estudio clínico poscomercialización, abierto y en curso (estudio A3921133; NCT02092467)37,38. En este estudio se observó que la TI aumentó marcadamente entre los pacientes de 60-70años y los de mayor edad. Se observó la misma tendencia con anti-TNF, aunque el aumento fue menos pronunciado hasta la edad de ≥75años37.
COVID-19 en pacientes con enfermedades inmunomediadasLos pacientes con tratamiento inmunosupresor podrían tener mayor riesgo de infección por el coronavirus SARS-CoV-2 en comparación con la población general. Sin embargo, también es posible que dicho tratamiento esté asociado a una disminución de resultados adversos por la enfermedad por SARS-CoV-2 (COVID-19) al verse limitada la tormenta de citoquinas, característica propia de la COVID-19 grave39. En pacientes con EII o AR, al igual que en la población general, se ha visto que los factores de riesgo para desarrollar una COVID-19 grave son la obesidad, la edad, la diabetes, la enfermedad cardiovascular, la enfermedad pulmonar obstructiva y la enfermedad crónica renal40-42; comorbilidades crónicas como la diabetes mellitus, la enfermedad pulmonar obstructiva, la enfermedad coronaria y la hipertensión influyen en la severidad de la COVID42. Datos muy iniciales apuntaron a que el riesgo de COVID-19 en pacientes reumáticos tratados con agentes biológicos o FAMEsc no parecía ser diferente al de la población general42. Datos de 525 pacientes con EII de 33 países (registro SECURE IBD) para estudiar la historia natural de COVID-19 en pacientes pediátricos y adultos con EII mostraron una tasa global de letalidad del 3%. Los factores de riesgo de sufrir una COVID-19 grave fueron la edad avanzada, el número de comorbilidades, el uso de corticoides sistémicos y el uso de 5-ASA/sulfasalazina. La terapia con anti-TNF-α, no resultó ser un factor de riesgo independiente de COVID-19 grave43.
Un reciente estudio llevado a cabo con 1.439 pacientes con EII (112 [7,8%] desarrollaron COVID-19 grave) procedentes del registro SECURE-IBD39 investigó el impacto de los diferentes tratamientos relacionado con el riesgo de presentar COVID-19 grave. Se observó que comparado con monoterapia de anti-TNF-α, el tratamiento con tiopurinas en monoterapia (OR ajustado [ORa]: 4,08) o en combinación con anti-TNF-α (ORa: 4,01) se asociaba con un aumento de riesgo de COVID-19 grave39. El empleo de mesalazina/sulfasalazina se asoció a aumento del riesgo respecto a la ausencia de uso (ORa: 1,70). Este riesgo estimado se incrementaba cuando se empleaba anti-TNF-α en monoterapia como grupo de referencia (ORa: 3,52)39. No disponemos de datos que sugieran que los inhibidores del JAK aumenten el riesgo de infección por COVID-19 y sus complicaciones, aunque se necesitan más estudios para comprender mejor este riesgo25,44.
Medidas de prevención y vacunas específicas en enfermedades inmunomediadasEn el momento del diagnóstico de una EII o AR y antes de iniciar un tratamiento inmunosupresor es necesario valorar una serie de aspectos clave6,7 (tabla 1). El estado de vacunación y el cribado de infecciones latentes (tabla 1) en el momento del diagnóstico determinarán las medidas de prevención necesarias6,45.
Cribado de seguridad y vacunación antes de iniciar tratamiento inmunosupresor
| Entrevista |
| Historia previa de infecciones por bacterias (en especial las respiratorias y del tracto urinario) |
| Historia previa de infecciones por hongos |
| Riesgo de infección latente o activa de tuberculosis: fecha de la última vacunación, contactos recientes con pacientes con tuberculosis, país de origen, estancias prolongadas en zonas endémicas, historia de tratamiento por tuberculosis latente o activa |
| Historia previa de infección por el virus herpes simple |
| Estado de inmunización de hepatitis B |
| Revisar antecedentes de enfermedad y vacunación contra sarampión, rubeola, parotiditis y varicela |
| Historia de viajes y futuros planes de viajes a zonas con enfermedades infecciosas endémicas |
| Examen físico |
| Signos de infección sistémico o local de infección activa (gingivitis, candidiasis oral o vaginal, intertrigo por infección fúngica) |
| Frotis vaginal |
| Pruebas de laboratorio |
| Proteína C reactiva, neutrófilos y linfocitos |
| Análisis de orina en pacientes con historia de infección urinaria previa o síntomas activos |
| Serología de varicela-zoster en pacientes sin historia previa de inmunización |
| Serología virus hepatitis B y C |
| Serología virus de Epstein-Barr |
| Serología virus VIH |
| Eosinófilos, examen de heces, serología estrongiloidiaisis (viajeros) |
| Serología hepatitis A |
| Serología sarampión, rubeola y parotiditis |
| Cribado de tuberculosis |
| Radiografía de tóraxa |
| Test de tuberculina y/o test de liberación de interferón-ϒ (IGRA) |
La vacunación debe planificarse desde el momento del diagnóstico y, si esto no es posible, antes de iniciarse el tratamiento inmunosupresor, aunque no está justificado retrasar el tratamiento para vacunar si este es urgente46. Se recomienda seguir un esquema de vacunación apropiado a la edad y siguiendo las guías locales46. Es conveniente revisar el estado de vacunación según edad, asegurando la inmunidad contra sarampión, rubeola, parotiditis y varicela previamente al inicio del tratamiento46. El tétanos, la difteria, la tosferina, la poliomielitis y, más recientemente, el virus del papiloma humano en niñas, son vacunas obligatorias de rutina en el calendario vacunal desde la infancia46.
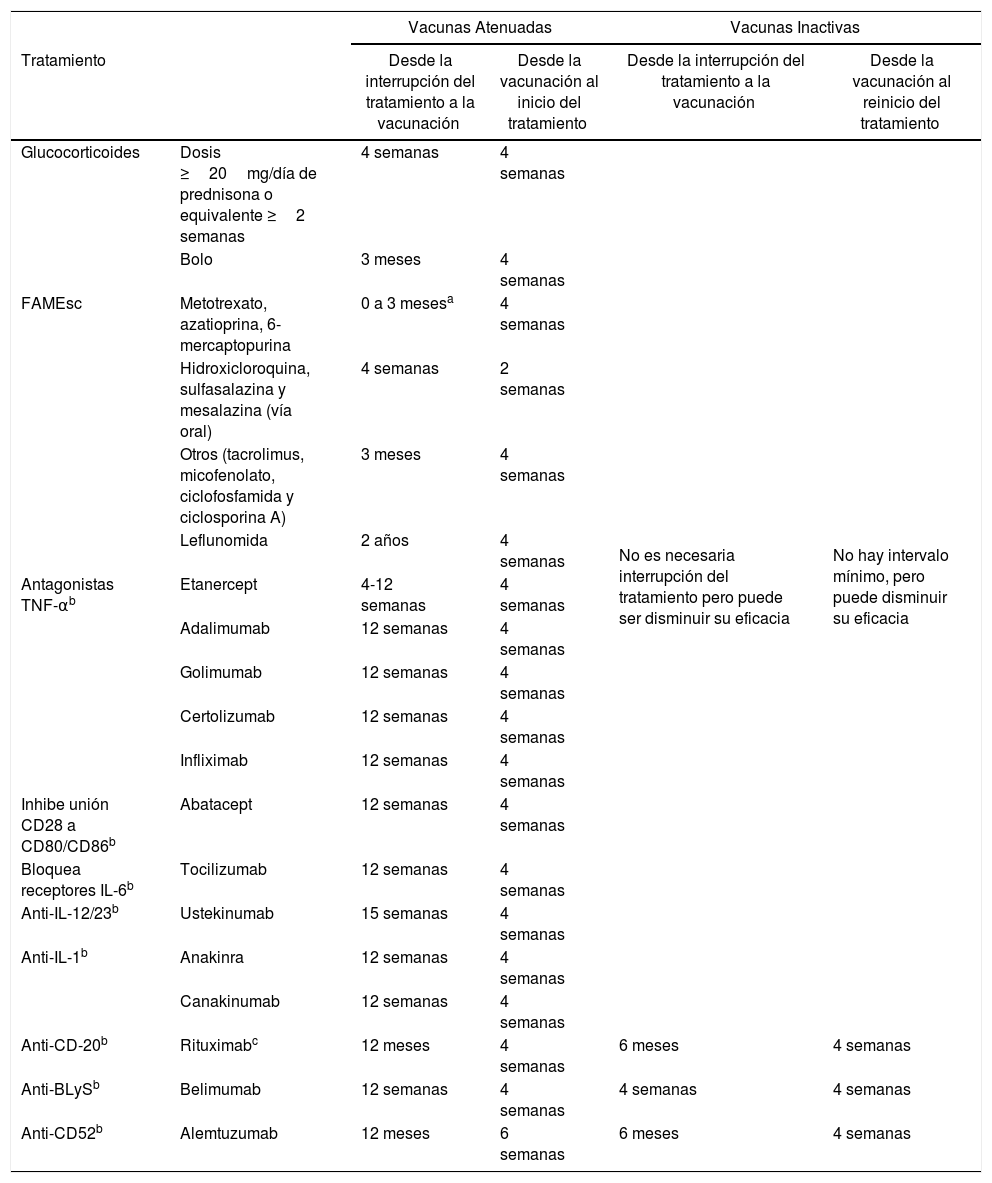
En caso de que el paciente esté ya recibiendo tratamiento, hay que tener en cuenta que el nivel de inmunosupresión puede reducir la respuesta a la vacuna; además, es importante tener en cuenta el tipo de vacuna, si es inactiva o atenuada4,5,46 (tabla 2). La inmunosupresión puede ser clasificada de alto nivel o de bajo nivel5,46 (tabla 3).
Intervalos para administrar vacunas según tratamiento inmunosupresor*
| Vacunas Atenuadas | Vacunas Inactivas | ||||
|---|---|---|---|---|---|
| Tratamiento | Desde la interrupción del tratamiento a la vacunación | Desde la vacunación al inicio del tratamiento | Desde la interrupción del tratamiento a la vacunación | Desde la vacunación al reinicio del tratamiento | |
| Glucocorticoides | Dosis ≥20mg/día de prednisona o equivalente ≥2 semanas | 4 semanas | 4 semanas | No es necesaria interrupción del tratamiento pero puede ser disminuir su eficacia | No hay intervalo mínimo, pero puede disminuir su eficacia |
| Bolo | 3 meses | 4 semanas | |||
| FAMEsc | Metotrexato, azatioprina, 6-mercaptopurina | 0 a 3 mesesa | 4 semanas | ||
| Hidroxicloroquina, sulfasalazina y mesalazina (vía oral) | 4 semanas | 2 semanas | |||
| Otros (tacrolimus, micofenolato, ciclofosfamida y ciclosporina A) | 3 meses | 4 semanas | |||
| Leflunomida | 2 años | 4 semanas | |||
| Antagonistas TNF-αb | Etanercept | 4-12 semanas | 4 semanas | ||
| Adalimumab | 12 semanas | 4 semanas | |||
| Golimumab | 12 semanas | 4 semanas | |||
| Certolizumab | 12 semanas | 4 semanas | |||
| Infliximab | 12 semanas | 4 semanas | |||
| Inhibe unión CD28 a CD80/CD86b | Abatacept | 12 semanas | 4 semanas | ||
| Bloquea receptores IL-6b | Tocilizumab | 12 semanas | 4 semanas | ||
| Anti-IL-12/23b | Ustekinumab | 15 semanas | 4 semanas | ||
| Anti-IL-1b | Anakinra | 12 semanas | 4 semanas | ||
| Canakinumab | 12 semanas | 4 semanas | |||
| Anti-CD-20b | Rituximabc | 12 meses | 4 semanas | 6 meses | 4 semanas |
| Anti-BLySb | Belimumab | 12 semanas | 4 semanas | 4 semanas | 4 semanas |
| Anti-CD52b | Alemtuzumab | 12 meses | 6 semanas | 6 meses | 4 semanas |
No es necesario aplicar estos intervalos en pacientes con inmunosupresión baja: terapia con metotrexato ≤0,4mg/kg/semana, Terapia con azatioprina ≤3mg/kg/día, terapia con 6-mercaptopurina ≤1,5mg/kg/día o con corticoides a dosis no inmunosupresoras.
No hay evidencia suficiente sobre intervalos entre cese del tratamiento inmunosupresor y vacunación. Las recomendaciones se basan en opiniones de expertos y en las propiedades farmacológicas de los diferentes inmunosupresores, tiempo de semivida de eliminación y efecto residual sobre el sistema inmune.
La vacunación se puede realizar dentro de los 6meses posteriores a rituximab, pero en esta situación es alto el riesgo de una respuesta insuficiente a la vacuna. Fuente: * https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/VacGruposRiesgo/docs/
Inmunodeficiencias.pdf
Tofacitinib: la vacunación con vacunas de microorganismos vivos debe realizarse al menos 2 semanas, aunque es preferible 4 semanas, antes del inicio del tratamiento con tofacitinib, o de acuerdo con las guías actuales de vacunación en relación a medicamentos inmunomoduladores**.
Vedolizumab: las vacunas de microorganismos vivos, en particular las vacunas orales de microorganismos vivos, deben utilizarse con precaución cuando sean administradas simultáneamente con vedolizumab***.
** Ficha técnica de tofacitinib.
*** Ficha técnica de vedolizumab.
Tratamientos e inmunosupresión
| Inmunosupresión alta |
| Terapia con agentes quimioterápicos (ciclofosfamida, metotrexato, micofenolato) y combinaciones de fármacos inmunosupresores para enfermedades reumatológicasTerapia diaria de corticoides a dosis de ≥20mg (o ≥2mg/kg/día en pacientes >10kg de peso) de prednisona o equivalente durante ≥14díasTerapia con determinados inmunomoduladores biológicos, como los antagonistas del factor de necrosis tumoral alfa (TNF-α) (adalimumab, certolizumab, infliximab, etanercept, y golimumab), anticuerpos monoclonales anti-linfocitosB (rituximab), anticuerpos monoclonales anti-linfocitosT (alemtuzumab) |
| Inmunosupresión baja |
| Terapia durante menos de 14días con una dosis diaria de corticoides sistémicos inferior que la que ocasiona inmunosupresión alta, o quienes reciben terapia de corticoides a días alternosTerapia con metotrexato ≤0,4mg/kg/semana,Terapia con azatioprina ≤3mg/kg/día, oTerapia con mercaptopurina ≤1,5mg/kg/día |
Fuente: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/VacGruposRiesgo/docs/Inmunodeficiencias.pdf
Las vacunas atenuadas (tabla 4) están contraindicadas en pacientes que reciben tratamiento inmunosupresor y deberán ser administradas al menos 4semanas antes del inicio del tratamiento o respetar un periodo de tiempo una vez finalizado el tratamiento (tabla 2). En el caso de tofacitinib, se podrían administrar 2semanas antes, aunque es preferible aumentar este periodo a 4semanas38.
Vacunas inactivadas y atenuadas
| Vacunas inactivadas |
| Gripe. Una dosis anual |
| Streptococcus pneumoniae. Se administrará la PCV13 seguida de la PPSV23 (primera dosis después de 8semanas si se está inmunocomprometido o ≥1año después si es inmunocompetente; segunda dosis de PPSV23 después de 5años; tercera dosis después de cumplir 65años de edad). Si ha sido vacunado previamente con PPSV23, entonces la PCV13 debe administrarse al menos un año después de la PPSV23 en adultos tanto inmunocompetentes como inmunocomprometidos |
| Hepatitis A. Se administrarán dos dosis (mes 0 y mes 6-12) |
| Hepatitis B. Se administrarán tres dosis (mes 0, mes 1 y mes 6). Se evaluará inmunidad tras 1-2meses de la última dosis; si no hay adecuada respuesta inmune se dará una dosis doble de la vacuna de hepatitisB o una dosis combinada de hepatitisB-A |
| Virus del papiloma humano. Se deberán vacunar todas las personas de edades de 11 a 26años |
| Meningococo. AntimeningocócicaB (2 dosis separadas por un mínimo de 4semanas en adultos y niños mayores de 10años). Antimeningocócica tetravalente (2 dosis separadas por un mínimo de 8semanas en adultos y niños mayores de 2años) |
| Tétanos difteria. Tres dosis administradas en el momento0, a las 4-8semanas y a los 6-12meses con refuerzos cada 10años |
| Herpes zoster. Shingrix indicada en mayores de 50años, 2 inyecciones administradas con 2meses de diferencia. En caso necesario, se administrará una segunda dosis en los 6meses siguientes a la primera dosis |
| Vacunas atenuadas |
| Sarampión, paperas, rubeola. Todos los adultos deben de estar vacunados; en caso de seronegatividad vacunar se administrarán una o dos dosis. Si se requiere la segunda (de refuerzo), se administrará al menos 4semanas después de la primera |
| Varicela zoster. Se administran 2 dosis de por vía subcutánea con un intervalo de 4-8semanas |
| Herpes zoster. Zostavax® una sola dosis, solo está indicada en mayores de 50años |
| PPSV23. Vacuna neumocócica polisacárida; PCV13: la vacuna neumocócica conjugada |
Las vacunas inactivadas son seguras y no están contraindicadas en los pacientes en tratamiento inmunosupresor (tabla 4)46. Entre estas se incluyen las vacunas trivalente de la gripe, neumocócica (PCV13, PPSV23), hepatitisA, hepatitisB, Haemophilus influenzaeB, virus del papiloma y tétanos4. La vacuna antigripal inactivada y la neumocócica son las únicas recomendadas de forma general en personas con inmunodeficiencia46. En general, para aumentar su eficacia se recomienda inmunizar al menos 2semanas antes del tratamiento o 3meses tras su finalización, salvo para rituximab, donde se recomienda 4semanas antes del tratamiento y 6meses tras la finalización46. Es recomendable que las personas que conviven con los enfermos de EII inmunodeprimidos estén también vacunadas de la gripe, paperas, sarampión, rubeola y varicela11.
Virus InfluenzaLa gripe es una enfermedad respiratoria estacional que ocasiona un incremento de la morbilidad en pacientes inmunodeprimidos47. Los pacientes con EII o AR infectados con el virus de la gripe tienen más probabilidades de sufrir complicaciones como hospitalización o neumonía4,45.
La vacuna de la gripe es una vacuna trivalente inactivada que contiene partículas de las tres cepas del virus influenza: dos cepasA (H1N1 y H3N2) y una cepaB1. Recientemente se ha comercializado una formulación cuadrivalente que protege contra una cepaB adicional45. Los datos publicados indican que la respuesta inmune a la vacuna de la gripe no se altera por el uso de anti-TNFα48, tocilizumab49 o tofacitinib50, mientras que no se han publicado datos concluyentes respecto a MTX48 o abatacept51. Sin embargo, la respuesta parece estar claramente disminuida en pacientes tratados con rituximab, o con terapia combinada con tiopurinas y anti-TNF-α4.
A pesar de que la vacuna de la gripe es segura1,45 y genera una respuesta humoral adecuada, la tasa de vacunación entre pacientes con EII o enfermedades inmunomediadas está por debajo de lo esperado4,8,9. Por esto es necesario insistir en la vacunación anual en los pacientes con EII o enfermedades reumatológicas. Se debe utilizar la vacuna inactivada trivalente y siguiendo el esquema de inmunización habitual1,4,45, y está contraindicada la vacuna viva atenuada inhalada en los pacientes en tratamiento inmunosupresor4,45.
Streptococcus pneumoniaeEl Streptococcus pneumoniae es la principal causa de neumonía y meningitis en países occidentales45. En los pacientes con AR45,52 o EII el riesgo de infección neumocócica se encuentra significativamente incrementado4,53. Al igual que con la gripe, la tasa de vacunación contra Streptococcus pneumoniae es subóptima, con datos del estudio COMORA en los que solo el 17% de los pacientes con AR habían sido inmunizados9.
Actualmente existen dos variantes disponibles: la vacuna neumocócica polisacárida (PPSV23) y la vacuna neumocócica conjugada (PCV13)45. La respuesta humoral a PPSV23 no se ve reducida significativamente por certolizumab, ustekinumab, tocilizumab, anti-TNF-α45,48, o vedolizumab54, mientras que con tofacitinib la respuesta puede estar disminuida, especialmente en el grupo tratado con tofacitinib y MTX, desconociéndose el impacto clínico de estos hallazgos37. En los pacientes tratados con MTX y rituximab la respuesta está marcadamente reducida45,48. El empleo conjunto de tiopurinas y anti-TNF-α también parece reducir la respuesta a la vacuna4.
En el caso de pacientes adultos que reciben terapia inmunosupresora y que no hayan sido inmunizados previamente con PPSV23 o PCV13, se recomienda administrar las dos vacunas antineumocócicas disponibles de forma secuencial y empezando por la conjugada con el fin de maximizar la cobertura de serotipos (tabla 4)4,7,55.
Herpes zosterLa aparición de herpes zoster (HZ) es el resultado de la reactivación del virus varicela-zoster que se encuentra latente en los ganglios de las raíces dorsales47. Los pacientes con EII y AR presentan un mayor riesgo de infección de HZ que la población general4,56.
Una reciente revisión sistemática y metaanálisis57 mostró, comparado con los controles, un riesgo mayor de esta infección con el tratamiento con tofacitinib (OR: 2,16; IC95%: 0,84-5,58), biológicos no-anti-TNF-α (OR: 2,19; IC95%: 1,20-4,02) y terapia combinada de tiopurinas y anti-TNF-α (OR: 3,29; IC95%: 2,33-4,65). En pacientes con AR, un estudio basado en datos de la práctica clínica habitual mostró que la incidencia de HZ era superior en pacientes tratados con tofacitinib que en los que recibieron biológicos56.
El aumento de riesgo de HZ en pacientes tratados con tofacitinib es dosis-dependiente57,58. En pacientes con AR que recibían tofacitinib, los factores de riesgo relacionados con HZ fueron el uso de glucocorticoides, el origen asiático (incidencia más del doble de la observada en Europa) y ser no fumador o exfumador59. El riesgo fue similar con bariticinib58. Sin embargo, en el programa de desarrollo clínico en CU solo se observaron la edad (aumento por cada 10años HR: 1,28; IC95%: 1,34-1,87; p<0,0001) y el fallo previo a anti-TNF-α (p<0,05) como factores de riesgo independientes para la infección por HZ60.
En pacientes con CU tratados con tofacitinib, datos del análisis integrado de seguridad hasta 6,8años25 muestran una TI de HZ de 3,48 casos por 100 pacientes-año. La mayoría de los casos se consideraron como leves o moderados (92,1%), y solo hubo 7 casos de HZ diseminado y 4 casos de neuralgia postherpética25. El 92,4% de los casos se resolvieron, y en la mayoría de las ocasiones sin que fuera necesario retirar tofacitinib (70,1% de los pacientes), aunque se decidió interrumpir temporalmente la dosis de tofacitinib en 18 pacientes (20,7%)25.
Winthrop et al.59 analizaron el riesgo de HZ en 6.192 pacientes con AR (16.839 pacientes-año) incluidos en 19 estudios con tofacitinib. Un total de 636 (10%) pacientes desarrollaron HZ. La mayoría de los casos (93%) fueron leves, y en el 94% (597) se afectó un solo dermatoma59. En el análisis integrado de seguridad a 9,5años en pacientes tratados con tofacitinib, la TI por 100 pacientes-año de HZ derivada fue de 3,6 (IC95%: 3,4-3,9)33. Respecto a baricitinib, en un análisis de seguridad a 2años34 se observó una mayor tasa de HZ en pacientes con AR tratados con baricitinib 4mg frente a placebo (1,8% vs 0,4% de los pacientes)34. En la revisión sistemática y metaanálisis de Bechman et al.32 la incidencia por 100 pacientes-año de HZ fue de 2,51 (IC95%: 1,87-3,30) en el caso de tofacitinib y de 3,16 (IC95%: 2,07-4,63) para baricitinib32.
La infección por HZ podría ser prevenible mediante una vacunación adecuada. Actualmente hay disponibles dos tipos de vacuna. La primera de ellas es la vacuna viva-atenuada, que está disponible desde hace más de una década y está aprobada para su uso en adultos mayores de 50años. Se administra una única dosis y requiere una dosis de recuerdo a los 5años. Se recomienda su administración previa al inicio del tratamiento o en pacientes con un bajo nivel de inmunosupresión45,61. Como alternativa, se dispone de una vacuna recombinante inactivada, constituida por la glicoproteínaE, que ha demostrado reducir el riesgo de HZ y neuralgia postherpética en adultos con una eficacia superior a la de la vacuna viva-atenuada, alcanzando unas tasas de prevención del 97% en mayores de 50años62,63. Los resultados preliminares de los estudios de fase3 indican que la vacuna recombinante para HZ puede ser inmunogénica en adultos inmunocomprometidos, incluidos los pacientes con neoplasias malignas hematológicas, aquellos con tumores sólidos que reciben quimioterapia inmunosupresora, los receptores de trasplantes renales en terapia inmunosupresora crónica y los receptores de trasplantes de células hematopoyéticas autólogas. Estos resultados están respaldados por los de los estudios de fase 1/2 en pacientes con infección por VIH64.
La vacuna recombinante no está contraindicada en individuos inmunocomprometidos, y se prefiere a una vacuna viva atenuada de HZ en individuos inmunocompetentes, según las directrices de Estados Unidos y Canadá64.
Esta vacuna, recomendada por el Advisory Committee of Immunization Practices65, podría ser la mejor estrategia en pacientes sometidos a terapia inmunosupresora, en especial en personas sometidas a tratamientos inhibidores JAK18,46. La vacuna recombinante de HZ no está actualmente comercializada en nuestro medio.
Hepatitis B y hepatitis ASe considera recomendable valorar el riesgo individual y solicitar determinaciones serológicas antes de proceder a la vacunación. Diferentes estudios han demostrado el riesgo de reactivación del virus de la hepatitisB (VHB) y sus graves consecuencias en pacientes con EII y AR tras el tratamiento con fármacos inmunosupresores4,66. El riesgo y la cinética de reactivación difieren según el tratamiento inmunosupresor empleado y el estatus de la infección, por lo que es imprescindible estratificar el riesgo individual para así poder adecuar las medidas preventivas67.
Está establecido que el mayor riesgo se produce durante el tratamiento con anti-TNF-α y rituximab45. Recientemente se ha publicado que existe también riesgo de reactivación en pacientes con antígeno de superficie (HBsAg) positivo tratados con abatacept, tocilizumab, tofacitinib y ustekinumab45,68,69, pero no así en pacientes con hepatitisB resuelta70.
Se recomienda realizar un cribado del estado de infección de todos los pacientes mediante los marcadores serológicos (HBsAg, anticuerpo anti-core total [HBcAc] y anticuerpo anti-antígeno de superficie [HBsAc]) antes de iniciar tratamiento inmunosupresor y vacunar a aquellos sin evidencia de infección pero con riesgo4,7,45,67. Además, en los pacientes con HBsAg positivo se debe determinar la carga viral7. Está indicada terapia antiviral (entecavir o tenofovir) en pacientes con EII seropositivos con infección crónica (HBsAg+) que han de iniciar biológicos o inhibidores del JAK, siendo necesario introducirla al menos 2semanas antes, extendiéndose durante 12meses tras su retirada7. En el caso de pacientes seropositivos con evidencia de infección pasada (HBsAg–, anti-HBcAc+ con o sin anti-HBsAc), la reactivación de VHB en EII ocurre muy raramente, por lo no se recomienda profilaxis de rutina7,67. Sí se recomienda en el caso de los pacientes con enfermedades inmunomediadas tratados con rituximab71. Se debe realizar una monitorización de transaminasas (ALT) y ADN-VHB para aquellos con HBsAg positivo e infección oculta por VHB. Entre los pacientes con infección por VHB resuelta con HBsAc positivo seguirá siendo necesaria la monitorización periódica de los niveles de ALT, especialmente en áreas endémicas de VHB67.
En individuos sanos, la vacuna contra VHB presenta una eficacia del 95%4; sin embargo, en individuos con EII el rango de protección se reduce hasta el 33-76%72, por lo que se consideran necesarias estrategias de vacunación más intensivas4,47. La administración de una dosis doble de la vacuna en tres dosis (0, 1 y 2meses) seguida, en caso de una respuesta serológica insuficiente, de la revacunación de nuevo a dosis doble con la misma pauta parece ser más eficaz que el esquema de vacunación recomendado para la población general7.
Los datos sobre el impacto de los tratamientos sobre la vacuna de VHB son escasos, pero parecen indicar que los anti-TNF-α y el rituximab podrían reducir la respuesta humoral45, mientras que vedolizumab no afecta su eficacia73.
TuberculosisLa tuberculosis (TB) es una infección causada por Mycobacterium tuberculosis, que tras la primoinfección puede persistir en estado latente inactivo (LTBI por sus siglas en inglés). En este estado, la infección es asintomática, pero existe riesgo de reactivación en función del estado inmunológico del paciente74. En España, más del 10% de los pacientes candidatos a recibir tratamiento con biológicos presentan LTBI75,76. La terapia con anti-TNF-α se asocia con un incremento entre dos y cuatro veces del riesgo de reactivación de una TB latente, siendo este riesgo menor con etanercept77. Zhang et al.78, en un análisis agrupado de ensayos clínicos y estudios de registro, observaron una TI de tuberculosis por 100 personas-año de 0,08 para tocilizumab, 0,09 para abatacept, 0,2 para tofacitinib y 0,0-0,47 para anti-TNF. Baricitinib presentó una TI de 0,1534. La TI con vedolizumab en los ensayos clínicos fue también baja, de 0,179. La experiencia con ustekinumab es más corta, pero hasta ahora se han descrito pocos casos de TB con este tratamiento80.
Las recomendaciones de cribado de LTBI y su tratamiento antes de administrar la terapia inmunosupresora han reducido el riesgo de tuberculosis activa en un 78-90%76. En España74 se recomienda la realización de dos técnicas: la liberación de interferón-γ (IGRA) y la prueba de la tuberculina (PT) para el diagnóstico de la LTBI. Se considera indicativo de LTBI un resultado positivo en cualquiera de ellas74. Además, deben evaluarse los antecedentes de TB7,81. La radiografía de tórax se realizará únicamente en el caso de una prueba de cribado positivo, sea esta test de liberación de interferón gamma o prueba de la tuberculina81. Un estudio reciente en España puso de manifiesto un bajo grado de adherencia a dichas recomendaciones (56%), donde solo el 36% de los encuestados solicitaba las pruebas diagnósticas recomendadas76. Es esperable que un seguimiento más exhaustivo de las recomendaciones podría contribuir a reducir aún más la incidencia de tuberculosis en los pacientes candidatos a recibir terapias biológicas e inhibidores JAK76.
En el caso de LTBI, se recomienda retrasar el tratamiento biológico durante al menos 3semanas después de iniciar el tratamiento antituberculoso, excepto en los casos de urgencia clínica y bajo asesoramiento del especialista7. El tratamiento adecuado de la TB activa se define como ≥6meses de terapia con fármacos de primera línea, e incluye ≥2meses con la asociación rifampicina +isoniazina +pirazinamida +etambutol74. El tratamiento adecuado de la infección latente se puede realizar con 9meses de isoniazida (esquema más frecuente), 3meses de isoniazida +rifampicina o 4meses de rifampicina sola74. Cabe indicar que la rifampicina es un inductor del CYP450 3A4 y podría disminuir la exposición a diferentes fármacos, incluido tofacitinib, y disminuir su eficacia78.
ConclusionesLos pacientes con EII o AR presentan un aumento del riesgo de desarrollar infecciones. El riesgo de infecciones graves y oportunistas se incrementa especialmente durante la terapia inmunosupresora. Algunas estrategias, como la tasa de vacunación y el cribado de la tuberculosis latente en estos pacientes en nuestro medio, son susceptibles de mejora. Se recomienda, por tanto, valorar el estado de vacunación en el momento del diagnóstico administrando las vacunas necesarias y realizar el cribado de infecciones y tratamiento de la tuberculosis latente antes del inicio de la terapia inmunosupresora.
Conflicto de interesesRosario García-Vicuña ha recibido formación y becas de investigación de Abbvie, BMS, Janssen Lilly, Novartis, MSD, Roche y Sanofi; honorarios por participación en comités de expertos de Abbvie, Biogen, BMS, Celltrion, Mylan, Pfizer, Roche, Sandoz y Sanofi; ha realizado presentaciones patrocinadas por BMS, Lilly, Pfizer, Sandoz y Sanofi; ha recibido ayudas no financieras de Abbvie, BMS, Lilly, MSD, Novartis, Pfizer y Sanofi.
Xavier Calvet ha recibido becas de investigación de Abott, MSD, Vifor; honorarios por participación en comités de expertos de Abott, MSD, Takeda, Pfizer, Janssen y Vifor, y ha impartido conferencias para Abott, MSD, Janssen, Pfizer, Takeda y Allergan.
Jordi Gratacós ha recibido becas de investigación para Pfizer, honorarios por participación en comités de expertos o ponencias para Pfizer, Novartis, Janssen, Amgen, MSD, Abbvie y Lylli.
Daniel Carpio ha recibido honorarios por charlas, ponencias, elaboración de material formativo de Abbvie, Amgen, Ferring, Janssen, Kern, MSD, Pfizer y Takeda; por participar en comité de expertos para Abbvie, Amgen, Celltrion, Dr Falk, Janssen, MSD, Pfizer, Takeda y Tillots; becas de investigación de Janssen, y por apoyo al Servicio/Hospital/Institución de Abbvie, MSD. Los demás autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste manuscrito ha sido financiado por Pfizer España.
Los autores desean agradecer al Dr. Guillermo Bastida Paz del hospital Universitario la Fe, a la Dra. Elisa Trujillo Martin del hospital Universitario de Canarias, a la Dra. Marta Carrillo Palau del hospital Universitario de Canarias, a la Dra. Eva Pérez Pampin del hospital Clínico Universitario de Santiago de Compostela, a la Dra. M. Luz García Vivar del hospital de Basurto, al Dr. Luis Alberto Menchen Viso del hospital Gregorio Marañon y a la Dra. Dolores Martin Arranz del hospital La Paz su participación en el panel de expertos; a Mónica Valderrama, M. del Pilar Fortes, Ana Cábez y Susana Gómez de Pfizer la búsqueda bibliográfica y la revisión del manuscrito, y a Esther Tapia la asistencia en su redacción.