La calprotectina en heces es una técnica útil para detectar actividad en pacientes con colitis ulcerosa. No obstante, puede haber valores elevados debido a otros factores distintos de la actividad de la colitis ulcerosa. Nuestro objetivo fue analizar posibles resultados falsos positivos de calprotectina para la actividad de la colitis ulcerosa debidos a la presencia de pólipos inflamatorios.
Pacientes y métodosEstudio retrospectivo, descriptivo y observacional. Se recogieron los datos de pacientes seguidos durante 2 años en los que se realizó una colonoscopia dentro de los 3 meses posteriores a detectarse valores de calprotectina elevados (>150μg/g) antes de modificar el tratamiento.
ResultadosSe revisaron 39 pacientes y en 5 de ellos, previamente diagnosticados de colitis ulcerosa extensa, se detectaron pólipos inflamatorios. Tres pacientes tomaban mesalazina, uno azatioprina y otro estaba en tratamiento con infliximab. Todos ellos se encontraban asintomáticos y la endoscopia no presentaba actividad macroscópica (Mayo endoscópico=0) ni histológica. La mediana de los valores de calprotectina fue de 422μg/g (RIC: 298-2.408) y permanecieron elevados en una segunda determinación. En 4 de los pacientes los pólipos inflamatorios eran múltiples y de pequeño tamaño. Otro paciente presentaba un pólipo de 4cm.
DiscusiónEn la práctica clínica podemos encontrar valores de calprotectina fecal elevados no debidos a la presencia de actividad de la colitis ulcerosa, sino a otras lesiones, como pólipos inflamatorios. Este hecho debe ser tenido en cuenta antes de llevar a cabo cambios relevantes como la subida de escalón terapéutico a inmunosupresores o biológicos en pacientes con elevación de calprotectina confirmada.
Faecal calprotectin is a useful technique for detecting activity in patients with ulcerative colitis. However, there may be high levels due to factors other than the activity of ulcerative colitis. Our aim was to analyse possible false positive results of calprotectin for the activity of ulcerative colitis owing to the presence of inflammatory polyps.
Patients and methodsRetrospective, observational, descriptive study. Data was collected from patients monitored for 2 years in whom a colonoscopy had been requested within 3 months after detecting high calprotectin values (>150μg/g) and before modifying the treatment.
ResultsWe reviewed 39 patients and in 5 of them, with previous diagnosis of extensive ulcerative colitis, inflammatory polyps were detected. Three patients were on treatment with mesalazine, one with azathioprine and other with infliximab. All of them were asymptomatic and the endoscopy did not show macroscopic activity (endoscopic Mayo score=0) or histological activity. The median values of calprotectin were 422μg/g (IQR: 298-2,408) and they remained elevated in a second measurement. In 4 of the patients the inflammatory polyps were multiple and small in size. The other patient had a polyp measuring 4cm.
DiscussionIn clinical practice we can find high faecal calprotectin levels not due to the presence of ulcerative colitis activity, but due to other lesions such as inflammatory polyps. This fact must be taken into account before carrying out relevant changes such as step-up therapy to immunosuppressive drugs or biological drugs in patients with confirmed high calprotectin levels.
La calprotectina fecal (CF) es un biomarcador útil en el seguimiento de los pacientes con colitis ulcerosa (CU) para predecir el riesgo de recidiva de la enfermedad1, definir a los pacientes que podrían beneficiarse de más pruebas complementarias2 o identificar a aquellos que se encuentran en remisión no solo clínica, sino también biológica3.
La calprotectina es la principal proteína citosólica de los neutrófilos, y también se encuentra en menor medida en monocitos y macrófagos activados. Se libera en fases muy tempranas del proceso inflamatorio y su concentración en las heces es directamente proporcional a la presencia de neutrófilos en la luz intestinal4. Se trata de una proteína resistente a la degradación bacteriana y estable a temperatura ambiente durante días, lo que hace que sea apropiada para su utilización en la práctica clínica5.
La CF es útil para diferenciar entre procesos inflamatorios y funcionales6, y en pacientes diagnosticados de enfermedad inflamatoria intestinal (EII) sus valores se correlacionan con la actividad endoscópica y la respuesta clínica y endoscópica al tratamiento, y tienen valor pronóstico a corto plazo. Pero la elevación de la CF no es específica de la EII. La CF puede elevarse en otras afecciones, como tumores a nivel del tracto digestivo, enfermedad celiaca, procesos infecciosos agudos (como diarreas de origen bacteriano), enfermedad diverticular, pólipos, enteropatía por toma de antiinflamatorios no esteroideos (AINE) y colitis microscópica, entre otras5,7–9.
Por otra parte, debemos tener en cuenta que los síntomas digestivos en algunos pacientes con EII pueden no reflejar lo que verdaderamente está ocurriendo. Así, se ha descrito que más de un tercio de los pacientes en remisión clínica (y, por tanto, asintomáticos) presentan lesiones endoscópicas, y en el extremo opuesto, en más del 10% de los pacientes sintomáticos la endoscopia es normal10,11. Todo ello nos sirve para situar esta técnica (la CF) como una herramienta más de la que disponemos en el manejo y control de los pacientes con EII para detectar actividad, y de la que debemos conocer sus fortalezas y limitaciones. Su determinación en los controles periódicos puede permitir detectar pacientes en riesgo de recaída, pero debemos tener en cuenta la posibilidad de resultados positivos debido a otros factores distintos de la propia actividad de la CU, lo que resulta relevante, pues de los resultados de la técnica podrían derivarse modificaciones terapéuticas que no fueran adecuadas para el paciente.
Entre las entidades en las que se pueden encontrar elevaciones en los valores de CF se incluyen las lesiones polipoideas como los adenomas o los pólipos juveniles12–15. Los pólipos inflamatorios son hallazgos relativamente frecuentes en pacientes con EII16, con mayor frecuencia en CU que en enfermedad de Crohn. Estas lesiones polipoideas se pueden separar en las siguientes categorías: pseudopólipos; pólipos inflamatorios, y pólipos postinflamatorios. Estos términos se utilizan indistintamente en la literatura, lo que crea cierta confusión17. El término pseudopólipos se ha aplicado a la aparición de islotes de mucosa persistentes entre úlceras durante un brote grave de EII, lo que crea la impresión de un pólipo18. Cuando durante el proceso inflamatorio se forma tejido de granulación más intenso en algunas áreas focales, se producen los pólipos inflamatorios19. Por último, durante el proceso de curación puede haber una reepitelización y regeneración excesiva, formándose pólipos postinflamatorios20, cuya forma se relaciona con el efecto de las contracciones peristálticas y el paso de las heces, que provocan un alargamiento de los colgajos mucosos21. Kelly y Gabos dividieron los tipos de pólipos inflamatorios en colgajos de mucosa polipoide y pólipos inflamatorios maduros, abarcando todas las formas anteriores, y propusieron el término pólipo inflamatorio como el más apropiado para el uso general22, y este es el término que vamos a emplear en nuestra descripción.
Algunos autores han reportado el doble de prevalencia de pólipos inflamatorios en la CU en comparación con la enfermedad de Crohn de colon23. Las tasas de prevalencia comunicadas varían del 4 al 74%, pero la mayoría de los datos que respaldan estos hallazgos se obtuvieron de estudios más antiguos que consideraron solo la CU. Las tasas de incidencia informadas con mayor frecuencia en la CU se encuentran dentro del rango del 10 al 20%24–26. Este tipo de pólipos, que podemos encontrar en uno de cada 5-10 pacientes con CU, podrían tener influencia en los resultados de la CF que realizamos en los controles de pacientes en remisión clínica, lo que constituyó nuestra hipótesis de trabajo. Por ello, el objetivo de este estudio fue analizar los posibles resultados falsos positivos de la CF para la existencia de actividad de la CU debidos a la presencia de pólipos inflamatorios.
MétodosEstudio retrospectivo observacional descriptivo en pacientes con CU seguidos en nuestra unidad de EII durante 2 años (desde octubre de 2016 a septiembre de 2018), en los que se realizó una colonoscopia en el período inmediatamente posterior (inferior a 3 meses) a la detección de valores de CF elevados antes de posibles modificaciones de tratamiento. Se estableció como punto de corte para la existencia de actividad clínica de la CU el valor de 150μg/g de CF5. Se excluyeron aquellos pacientes con presencia de sintomatología digestiva en el momento de la determinación de CF, pacientes con otras enfermedades digestivas o pacientes con antecedentes de toma de AINE en el mes previo a la determinación según la información recogida de las historias clínicas.
Se estudiaron los pacientes que presentaron como único hallazgo endoscópico la presencia de pólipos inflamatorios en ausencia de otro tipo de lesiones (Mayo endoscópico=0). Se recogieron variables demográficas como sexo y edad, extensión de la enfermedad mediante la clasificación de Montreal, tratamiento seguido en el momento de la determinación, clínica del paciente según la clasificación Mayo y endoscopia mediante revisión de las historias clínicas informatizadas del hospital. La determinación de CF se realizó mediante el método de fluoroenzimoinmunoanálisis EliA™, de Thermo Fisher.
Respecto al análisis estadístico, las variables categóricas se expresaron mediante frecuencias y porcentajes. En las variables cuantitativas, primero se realizó el test de Kolmogorov-Smirnov para evaluar la normalidad y los datos se expresaron como la media±desviación estándar si la variable seguía una distribución normal, o la mediana y el rango intercuartílico si no lo hacían.
El protocolo de estudio fue aprobado por el comité de ética de nuestro hospital.
ResultadosSe revisaron las historias clínicas de un total de 150 pacientes con CU a los que inicialmente se había realizado la determinación de CF de seguimiento, y que acudieron a una revisión programada de su enfermedad. En 39 de los casos se disponía de los resultados de una colonoscopia dentro de los 3 meses posteriores a las determinaciones de CF. De ellos, se detectaron 5 pacientes (12% de los pacientes con valores elevados de CF y colonoscopia inmediatamente posterior) en los que la endoscopia no presentaba actividad macroscópica (Mayo=0) ni histológica (ausencia de neutrófilos en las biopsias de la mucosa de colon), pero sí lesiones compatibles con pólipos inflamatorios confirmados por biopsias. Todos ellos estaban previamente diagnosticados de CU extensa, y su edad media fue de 39±15 años; el 60% eran hombres. Los 5 pacientes tenían una segunda determinación de CF, con una mediana de 37±6 días de plazo respecto de la primera.
En el resto de los casos (n=34) se detectó algún grado de actividad endoscópica (Mayo≥1) e histológica (que fue leve o moderada según el criterio del patólogo), y se tomó la decisión clínica en el 61,7% de los casos (n=21) de subir la dosis de mantenimiento de 5-aminosalicilatos orales y/o añadir terapia tópica, no realizándose modificaciones terapéuticas inmediatas en el resto de los casos, todos ellos asintomáticos, con afectación leve (Mayo endoscópico=1).
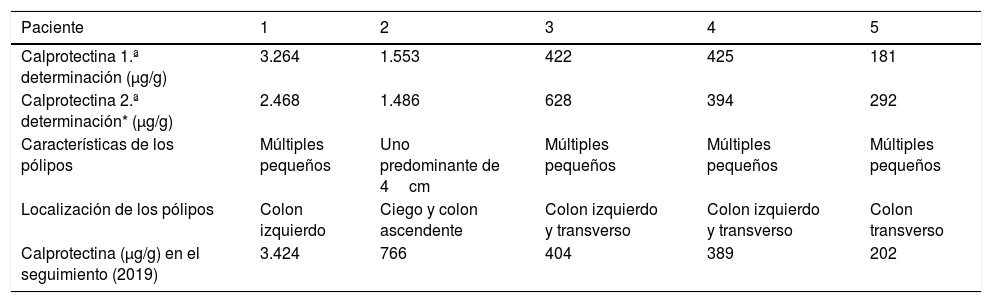
Los 5 pacientes con presencia de pólipos inflamatorios estaban en tratamiento para la CU en el momento de la determinación de CF elevada, 3 de ellos con mesalazina oral (60%), uno con azatioprina (20%) y otro en tratamiento biológico anti-TNF con infliximab (20%). Ninguno de los 5 pacientes estaba en tratamiento con AINE o inhibidores de la bomba de protones. Todos los pacientes se encontraban clínicamente asintomáticos en el momento de la determinación (puntuación índice Mayo parcial=0) y la mediana de los valores de CF fue de 422μg/g (rango intercuartílico 298-2.408) y permanecieron elevados en la segunda determinación. Los valores individuales de CF y las características y la localización de los pólipos inflamatorios se describen en la tabla 1. Se incluyen también en la tabla 1 los valores de CF en el seguimiento posterior de los pacientes (determinaciones realizadas durante 2019), que en todos los casos permanecieron con valores>150μg/g. En 4 de los pacientes los pólipos eran múltiples y de pequeño tamaño. El otro caso se trataba de un pólipo inflamatorio de 4cm en el colon derecho. La presencia de pólipos inflamatorios se había descrito en colonoscopias anteriores en 4 casos, con datos previos al respecto, pero no disponíamos de determinaciones de CF previas debido a la fecha de implementación de la técnica de forma rutinaria en el servicio de laboratorio de nuestro centro, posterior a dichas exploraciones. No se realizó ningún cambio en el tratamiento de los 5 pacientes.
Valores de las determinaciones de calprotectina fecal, y características y localización de los pólipos inflamatorios en los pacientes
| Paciente | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| Calprotectina 1.ª determinación (μg/g) | 3.264 | 1.553 | 422 | 425 | 181 |
| Calprotectina 2.ª determinación* (μg/g) | 2.468 | 1.486 | 628 | 394 | 292 |
| Características de los pólipos | Múltiples pequeños | Uno predominante de 4cm | Múltiples pequeños | Múltiples pequeños | Múltiples pequeños |
| Localización de los pólipos | Colon izquierdo | Ciego y colon ascendente | Colon izquierdo y transverso | Colon izquierdo y transverso | Colon transverso |
| Calprotectina (μg/g) en el seguimiento (2019) | 3.424 | 766 | 404 | 389 | 202 |
Los pólipos inflamatorios se incluyen dentro de las complicaciones locales en pacientes con EII27. Suelen ser asintomáticos, aunque en ocasiones pueden producir sangrado u obstrucción17,22. Estas lesiones pueden presentar una variedad de formas, incluyendo sésiles, pediculadas o puentes mucosos, y pueden ser únicas o múltiples, como en nuestros pacientes, y difusas o localizadas en la distribución17,18. También varían en tamaño, pero suelen ser cortos. Cuando supera los 1,5cm de tamaño se suele denominar pseudopólipo gigante28 (un caso en nuestra serie). Su importancia clínica es incierta, excepto por su relación con un riesgo intermedio de cáncer colorrectal, por lo que las guías de cribado aconsejan realizar una colonoscopia a intervalos de 2 o 3 años29,30. Existe una aceptación general de que si estas lesiones se reconocen adecuadamente utilizando criterios endoscópicos y no provocan complicaciones, no se considera obligatoria su extirpación31. Los pólipos inflamatorios no se incluyen en los índices endoscópicos para monitorizar la actividad de la CU.
La CF es un biomarcador altamente fiable para detectar actividad endoscópica en la CU5,32,33. El punto de corte de CF óptimo para discriminar remisión endoscópica (puntuación endoscópica Mayo≤1) se ha descrito en 250μg/g para la técnica ELISA, con un área bajo la curva ROC de 0,92. Esto supone aceptar como remisión endoscópica, además de la completa normalidad de la mucosa, la presencia de cambios leves sin erosiones ni sangrado espontáneo (subíndices endoscópicos de Mayo=0 o 1). Con esta definición de remisión endoscópica, el punto de corte más adecuado sería 250g/g34,35. Sin embargo, si se considera una definición más exigente de remisión, definiendo como tal la completa normalización de la mucosa (subíndice endoscópico de Mayo=0), el punto de corte sería más bajo. Aunque sobre este aspecto hay menos evidencia, un punto de corte de entre 100 y 150μg/g ha demostrado una muy buena precisión diagnóstica a este respecto35,36; valores<150μg/g se asocian a ausencia de lesiones mucosas en la endoscopia (subíndice endoscópico de Mayo=0) y de lesiones histológicas agudas en las biopsias5. Por ello, en nuestro estudio utilizamos como punto de corte 150μg/g.
Con respecto a la presencia de actividad y el riesgo de recidiva asociado a ello en el seguimiento de los pacientes, en un estudio realizado en nuestro medio con el punto de corte de CF de 150μg/g se predijo la recidiva clínica en los siguientes 12 meses con una sensibilidad del 69% y una especificidad del 69%37. Costa et al., utilizando el mismo punto de corte, describieron que los pacientes con una CF>150μg/g tenían un riesgo 14 veces superior de recaída en los siguientes 12 meses38.
En pacientes en remisión, las determinaciones seriadas de CF tienen un mayor valor pronóstico que una determinación aislada. Valores repetidamente<150μg/g hacen improbable la recidiva en los 3 meses siguientes, mientras que una elevación de la CF se puede detectar entre 3 y 6 meses antes de la aparición de una recidiva39,40. Cualquier decisión basada en los resultados de la CF debe tener en cuenta determinaciones seriadas coherentes (al menos 2), no una sola determinación, para aumentar la precisión del test. Las recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) sobre el uso de CF incluyen seriar la prueba ante un dato que no se corresponda con la clínica del paciente o con una colonoscopia reciente. La CF puede elevarse por otras entidades clínicas intestinales o por motivos ajenos a la actividad intestinal, como, por ejemplo, la toma de AINE5. En el caso de nuestros pacientes, este motivo no interfirió en el estudio debido a las recomendaciones que los pacientes reciben tanto en el momento del diagnóstico de la CU de tratar de evitar el uso de AINE como en las instrucciones que se les dan por escrito, y que incluyen la abstención de la toma de AINE en los 15 días previos a la recogida de la muestra.
Las decisiones clínicas en un paciente con valores de CF elevados y confirmados pueden variar desde modificaciones terapéuticas aparentemente sencillas, como el incremento en la dosis de mantenimiento de 5-aminosalicilatos o añadir o modificar la dosis de una terapia tópica con mesalazina, hasta decisiones como la realización de pruebas endoscópicas o radiológicas en un paciente que se encuentre asintomático, pero en el que planteemos una actitud proactiva de la que pueda derivarse un posible cambio mayor de tratamiento (subida de escalón terapéutico a inmunosupresores o biológicos). Nuestros resultados enfatizan la necesidad de realizar pruebas endoscópicas en aquellos casos en los que pueda plantearse un cambio mayor de tratamiento, debido a que podemos encontrar resultados positivos de CF en pacientes sin actividad de la CU, motivados por otras causas, como son los pólipos inflamatorios (12% de CU con CF elevada y colonoscopia en nuestra serie). Además, la CF en el seguimiento posterior de nuestros pacientes en todos los casos mantuvo valores>150μg/g, lo que evidencia que probablemente este biomarcador no es útil para monitorizar la actividad en el seguimiento de los pacientes con CU y pólipos inflamatorios.
Nuestro estudio tiene algunas limitaciones, como son el limitado número de pacientes incluidos con colonoscopia tras la obtención de determinaciones elevadas de CF y el hecho de no disponer de estudio endoscópico en todos los pacientes en los que la CF era elevada (en algunos pacientes se subió la dosis de mantenimiento de 5-aminosalicilatos sin realizar estudio endoscópico; en otros, la actitud fue expectante con posteriores controles), por lo que no podemos conocer la frecuencia exacta de resultados elevados de CF debidos a la existencia de pólipos inflamatorios.
Podemos concluir que en la práctica clínica pueden existir resultados positivos de CF en pacientes sin actividad de la CU debido a otras causas como son los pólipos inflamatorios. Este hecho debe ser tenido en cuenta para el manejo adecuado de los pacientes con CU y elevación de CP confirmada mediante al menos 2 determinaciones, en los que sería aconsejable corroborar mediante colonoscopia la existencia de actividad antes de valorar decisiones terapéuticas relevantes como una subida de escalón terapéutico a fármacos inmunosupresores o biológicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.