Este documento de posicionamiento, auspiciado por la Asociación Española de Gastroenterología, la Sociedad Española de Endoscopia Digestiva y la Sociedad Española de Anatomía Patológica, tiene como objetivo establecer recomendaciones para el cribado del cáncer gástrico (CG) en poblaciones con incidencia baja, como la española. Para establecer la calidad de la evidencia y los niveles de recomendación se ha utilizado la metodología basada en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation). Se obtuvo el consenso entre expertos mediante un método Delphi. El documento evalúa el cribado en población general, individuos con familiares con CG y lesiones precursoras de CG (LPCG). El objetivo de las intervenciones debe ser la reducción de la mortalidad por CG. Se recomienda el uso de la clasificación OLGIM y determinar el subtipo de metaplasia intestinal (MI) para evaluar las LPCG. No se recomienda establecer cribado poblacional endoscópico de CG ni de Helicobacter pylori. Sin embargo, el documento establece una recomendación fuerte para el tratamiento de H.pylori si se detecta la infección, y su investigación y tratamiento en individuos con antecedentes familiares de CG o con LPCG. En cambio, no se recomienda el uso de test serológicos para detectar LPCG. Se sugiere cribado endoscópico únicamente en los individuos con criterios de CG familiar. En cuanto a los individuos con LPCG, solo se sugiere vigilancia endoscópica ante MI extensa asociada a algún factor de riesgo adicional (MI incompleta y/o antecedentes familiares de CG) tras la resección de lesiones displásicas o en pacientes con displasia sin lesión visible tras una endoscopia digestiva alta de calidad con cromoendoscopia.
This positioning document, sponsored by the Asociación Española de Gastroenterología, the Sociedad Española de Endoscopia Digestiva and the Sociedad Española de Anatomía Patológica, aims to establish recommendations for the screening of gastric cancer (GC) in low incidence populations, such as the Spanish. To establish the quality of the evidence and the levels of recommendation, we used the methodology based on the GRADE system (Grading of Recommendations Assessment, Development and Evaluation). We obtained a consensus among experts using a Delphi method. The document evaluates screening in the general population, individuals with relatives with GC and subjects with GC precursor lesions (GCPL). The goal of the interventions should be to reduce GC related mortality. We recommend the use of the OLGIM classification and determine the intestinal metaplasia (IM) subtype in the evaluation of GCPL. We do not recommend to establish endoscopic mass screening for GC or Helicobacter pylori. However, the document strongly recommends to treat H.pylori if the infection is detected, and the investigation and treatment in individuals with a family history of GC or with GCPL. Instead, we recommend against the use of serological tests to detect GCPL. Endoscopic screening is suggested only in individuals that meet familial GC criteria. As for individuals with GCPL, endoscopic surveillance is only suggested in extensive IM associated with additional risk factors (incomplete IM and/or a family history of GC), after resection of dysplastic lesions or in patients with dysplasia without visible lesion after a high quality gastroscopy with chromoendoscopy.
El cáncer gástrico (CG) es la segunda neoplasia gastrointestinal más frecuente. En nuestro país, al igual que en el resto de Europa, la incidencia de CG se sitúa en niveles de incidencia aceptados como bajos. En el año 2018 se estimaron 7.765 nuevos casos de CG, con una tasa de incidencia ajustada a la población mundial de 9,2 casos/100.000 habitantes en hombres y de 4,3/100.000 habitantes en mujeres1. Las tasas ajustadas de mortalidad fueron de 6,1/100.000 habitantes en hombres y 2,8/100.000 habitantes en mujeres en 20181. Su incidencia se ha reducido progresivamente en las últimas décadas.
El CG es una neoplasia con mal pronóstico y se sigue asociando a una elevada mortalidad2. Así, la supervivencia ajustada por edad a los 5años se sitúa entre el 21% en hombres y el 26% en mujeres3. Esta elevada mortalidad se debe a múltiples factores, entre ellos el hecho de que el diagnóstico se realiza en estadios avanzados y la limitada respuesta a la quimioterapia. Para reducir el impacto del CG se han propuesto estrategias de cribado y tratamiento de la causa principal de CG, la infección por Helicobacter pylori3–8. También se han implementado programas de detección precoz en poblaciones con alta prevalencia de CG y se han propuesto programas de vigilancia en pacientes con lesiones preneoplásicas o condiciones asociadas a un incremento del riesgo de desarrollo de CG9.
La carcinogénesis gástrica se asocia a la infección por H.pylori y se produce a través de lesiones histológicas precursoras de CG (LPCG): gastritis atrófica, metaplasia intestinal (MI) y displasia9. Los pacientes con estas lesiones podrían ser candidatos a medidas dirigidas a reducir el riesgo de CG. Entre ellas destaca la erradicación de H.pylori, la vigilancia mediante endoscopia digestiva alta (EDA) y la resección de las lesiones con alto riesgo de malignización10. El objetivo de cualquiera de estas medidas debería ser reducir la mortalidad por CG en este grupo de pacientes de alto riesgo a través de la detección precoz y/o la reducción de su incidencia.
Durante los últimos años se han publicado múltiples documentos de posicionamiento que sostienen posturas divergentes sobre aspectos importantes del cribado. El objetivo del presente documento de posicionamiento es proponer unas recomendaciones de práctica clínica consensuadas tras evaluar la evidencia y las distintas guías de práctica clínica publicadas. En particular el documento versará sobre dos aspectos diferentes:
Definir qué factores producen incremento de riesgo de CG, en particular la historia familiar de CG y las lesiones histológicas precursoras de CG. En este sentido, se evaluarán los criterios histológicos para su diagnóstico.
Evaluar la eficacia de las diferentes estrategias para reducir la incidencia y/o la mortalidad del CG en estas situaciones (respecto a no realizar): erradicación de H.pylori, vigilancia endoscópica y hacer recomendaciones sobre su pertinencia.
Estas recomendaciones van dirigidas a la prevención del CG en poblaciones con baja incidencia de CG, la situación epidemiológica en la que se encuentra nuestro país. Quedan fuera del ámbito de este documento la prevención del CG difuso, el CG cardial o los tumores neuroendocrinos gástricos, así como el diagnóstico del CG, el diagnóstico y la vigilancia en los síndromes hereditarios de predisposición al CG y el tratamiento de las lesiones precursoras. Este documento de posicionamiento surge como una colaboración de la Asociación Española de Gastroenterología (AEG), la Sociedad Española de Endoscopia Digestiva (SEED) y la Sociedad Española de Anatomía Patológica (SEAP) con el fin de aunar criterios y recomendaciones tanto para gastroenterólogos clínicos como para endoscopistas y patólogos.
MétodosSe constituyó un grupo de trabajo formado por expertos de estas sociedades y metodólogos para la búsqueda y la revisión de la evidencia. El grupo de trabajo propuso las preguntas relevantes desde el punto de vista clínico a las que responde el documento. Se han determinado como objetivos relevantes la incidencia y la mortalidad por CG.
Para establecer los niveles de evidencia y los grados de recomendación de las diferentes preguntas evaluadas en este documento se ha utilizado la metodología basada en el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation Working Group)11. En este sentido, para establecer el nivel de las recomendaciones hemos considerado, además de la calidad de la evidencia, el balance entre beneficios y riesgos, los costes y los valores y preferencias de las personas. No se han formulado ni graduado recomendaciones en los apartados donde no era necesario: definiciones o evaluación de las LPCG.
Una vez realizadas las recomendaciones, se ha evaluado el acuerdo entre los miembros del grupo de trabajo. El consenso se obtuvo utilizando el método Delphi. Las recomendaciones fueron evaluadas por los miembros del panel mediante una escala Likert: 1: completamente en desacuerdo; 2: en desacuerdo; 3: dudoso o con reparos; 4: de acuerdo, y 5: completamente de acuerdo. En caso de desacuerdo se reformularon y votaron nuevamente las recomendaciones. Se presentan y fundamentan las que han obtenido un acuerdo promedio final ≥4 (de acuerdo o completamente de acuerdo). La primera ronda del consenso Delphi se llevó a cabo en noviembre de 2019 utilizando las herramientas electrónicas de captura de datos REDCap alojadas en la AEG (www.aegastro.es)12. Tras reformular las recomendaciones con acuerdo <4 se realizó una segunda ronda en dos videoconferencias los días 22 de mayo y 1 de junio de 2020. Las recomendaciones finales, junto con la evaluación de la evidencia, la fuerza de la recomendación y el grado de acuerdo se muestran en la tabla 1. Se incluye asimismo un algoritmo (fig. 1). El documento ha sido aprobado por las juntas directivas de las tres sociedades científicas implicadas en el documento de posicionamiento.
Recomendaciones del documento de posicionamiento sobre cribado de cáncer gástrico en poblaciones con baja incidencia. Se incluyen el grado de evidencia, la fuerza de recomendación y el acuerdo final entre los expertos
| Recomendación | Grado de evidencia | Fuerza de la recomendación | Acuerdo (1-5) |
|---|---|---|---|
| Generalidades y diagnóstico histológico | |||
| 1. El objetivo de las intervenciones en los pacientes con LPCG ha de ser la reducción de la mortalidad del CG | 5 | ||
| 2.a. Se sugiere suspender o no iniciar los programas de cribado en pacientes mayores de 75años | Muy baja | Débil a favor | 4,75 |
| 2.b. Se sugiere suspender o no iniciar los programas de cribado en pacientes cuya comorbilidad comporte una esperanza de vida estimada inferior a 10años | Muy baja | Débil a favor | 5 |
| 3. Se recomienda utilizar la clasificación OLGIM y determinar el subtipo de MI en los informes anatomopatológicos de las LPCG | 5 | ||
| 4. Se puede realizar una estadificación adecuada de las LPCG, independientemente del estado de erradicación de H.pylori | 4,64 | ||
| 5. No es necesario suspender los IBP para una estadificación adecuada de las LPCG. Sin embargo, se recomienda suspenderlos para detectar adecuadamente la infección por H.pylori | Baja | Fuerte a favor | 5 |
| 6. Se recomienda confirmar siempre la displasia por un segundo patólogo | 5 | ||
| Prevención en población general | |||
| 7. Se sugiere no implantar estrategias poblacionales para la detección y erradicación posterior de la infección por H.pylori | Baja | Débil en contra | 5 |
| 8. En los pacientes con infección por H.pylori se recomienda el tratamiento de la infección, independientemente del motivo de diagnóstico | Alta | Fuerte a favor | 4,64 |
| 9. Se sugiere investigar la infección por H.pylori en los pacientes que van a recibir IBP de manera prolongada con el objetivo de erradicarla antes de su inicio | Baja | Débil a favor | 5 |
| 10. No se recomienda el uso de pruebas serológicas para la detección de LPCG en la población general | Baja | Fuerte en contra | 5 |
| 11. Se sugiere no implantar el cribado endoscópico poblacional del CG en nuestro medio | Muy baja | Fuerte en contra | 5 |
| Prevención en individuos con agregación de CG | |||
| 12. Se recomienda la investigación y el tratamiento de la infección del H.pylori en los individuos con un FPG con CG | Alta | Fuerte a favor | 5 |
| 13. No se recomienda cribado endoscópico rutinario en pacientes con antecedentes de CG sin criterios de CG familiar | Baja | Fuerte en contra | 4,75 |
| 14. En los individuos con agregación familiar de CG se recomienda excluir los síndromes hereditarios asociados al CG | Muy baja | Fuerte a favor | 5 |
| 15. En los individuos que cumplen criterios de CG familiar se sugiere el cribado endoscópico del CG | Muy baja | Débil a favor | 4,25 |
| Prevención en pacientes con LPCG | |||
| 16. Se recomienda la investigación y el tratamiento de la infección de H.pylori en pacientes con atrofia gástrica o MI | Moderada | Fuerte a favor | 4,64 |
| 17. Se recomienda la investigación y el tratamiento de la infección de H.pylori tras la resección endoscópica de displasia o carcinoma in situ | Alta | Fuerte a favor | 4,64 |
| 18. No se recomienda vigilancia endoscópica en los pacientes con atrofia gástrica sin MI, independientemente del grado de extensión | Muy baja | Fuerte en contra | 4,8 |
| 19. Se recomienda realizar una EDA de alta calidad y estadificación mediante OLGIM en 6 a 12meses cuando el diagnóstico de MI se realice en una EDA de baja calidad | Baja | Fuerte a favor | 4,8 |
| 20.a. No se recomienda vigilancia endoscópica en los pacientes con OLGIMI-II (MI focal) | Baja | Fuerte en contra | 4,75 |
| 20.b. Se sugiere no realizar vigilancia endoscópica en los pacientes con OLGIMIII-IV (MI extensa) sin factores de riesgo adicionales | Muy baja | Débil en contra | 4,08 |
| 20.c. Se sugiere vigilancia endoscópica cada tres años en los pacientes con MI extensa (OLGIMIII-IV) asociada a MI incompleta o antecedentes familiares de CG | Muy baja | Débil a favor | 4,64 |
| 21. Se recomienda la resección de las lesiones visibles con displasia para un correcto diagnóstico histológico | Alta | Fuerte a favor | 4,83 |
| 22. Se recomienda endoscopia de calidad para reevaluación antes de 6meses tras el diagnóstico de displasia de cualquier grado | Muy baja | Fuerte a favor | 4,66 |
| 23.a. Se sugiere vigilancia endoscópica anual durante 2años y posteriormente en función del riesgo basal tras la resección endoscópica de una displasia de bajo grado | Muy baja | Débil a favor | 4,41 |
| 23.b. Tras la resección de displasia de alto grado o carcinoma in situ, se sugiere vigilancia endoscópica semestral el primer año, anualmente durante 3años y posteriormente en función del riesgo basal | Muy baja | Débil a favor | 4,42 |
| 24. Ante el diagnóstico de displasia sin lesión visible tras una EDA de calidad con cromoendoscopia, se sugiere seguimiento endoscópico entre 6 (displasia de alto grado) y 12meses (displasia de bajo grado) | Muy baja | Débil a favor | 4,46 |
CG: cáncer gástrico; FPG: familiar de primer grado; IBP: inhibidores de la bomba de protones; LPCG: lesión precursora de cáncer gástrico; MI, metaplasia intestinal.
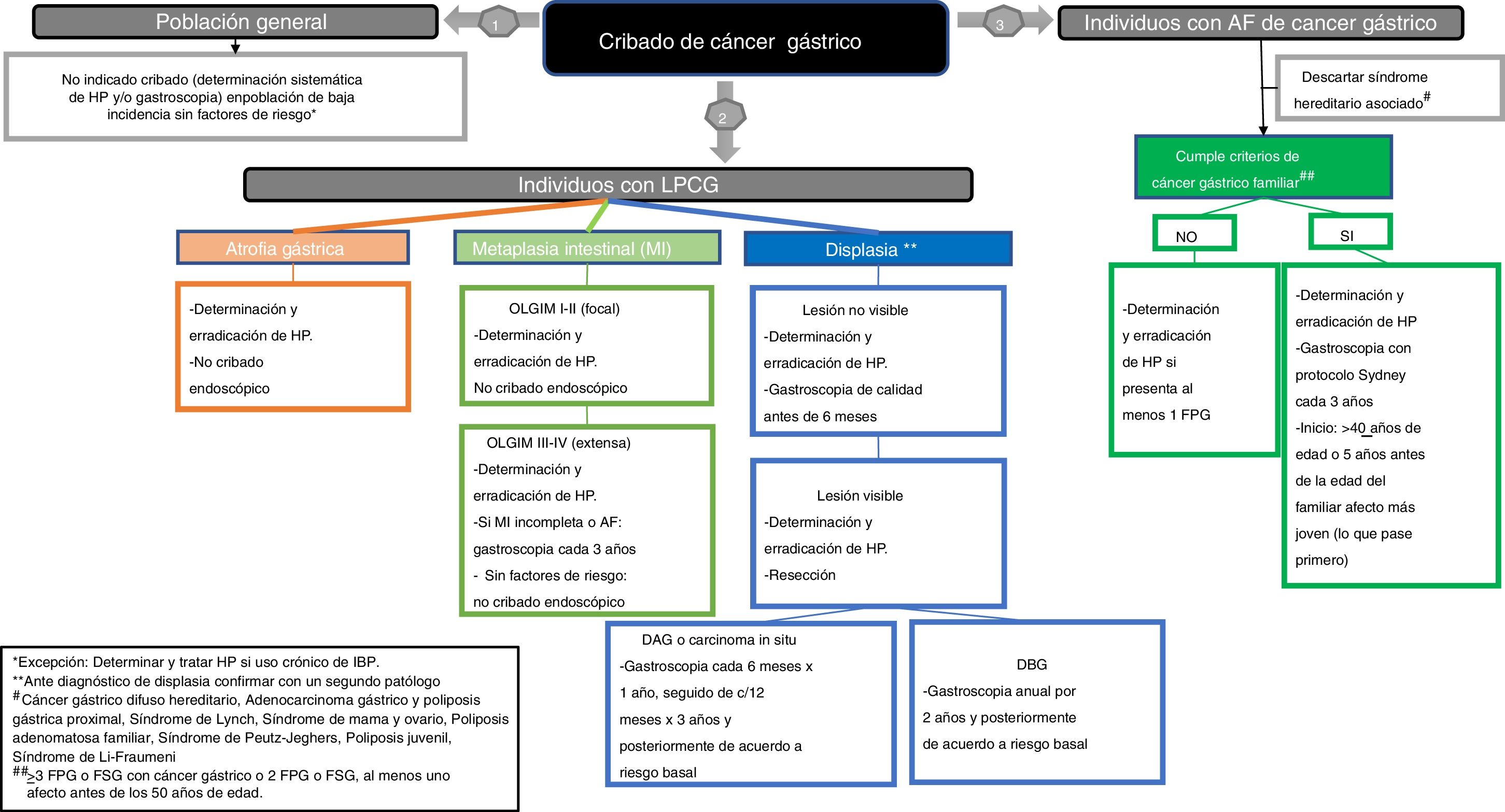
Población de riesgo para CG. Se considera población de riesgo de CG la portadora de LPCG que comporten un potencial aumento de riesgo de evolución a neoplasia.
Atrofia gástrica. Se define como la pérdida de «glándulas apropiadas» de la mucosa gástrica13. Incluye dos fenotipos: a)la atrofia no metaplásica, que cursa con la disminución del número de glándulas en la mucosa gástrica sin cambios en el tipo de epitelio glandular original, y b)la atrofia metaplásica, en la que se produce la sustitución de las glándulas habituales en cada región gástrica por otro tipo glandular no propio de esa región; incluye la metaplasia pseudopilórica sobre mucosa corporal o fúndica y la metaplasia intestinal (MI)13.
Metaplasia intestinal (MI). Se define como la sustitución del epitelio glandular y foveolar de la mucosa gástrica por epitelio de morfología intestinal14. La clasificación más difundida en la práctica diaria es la que diferencia dos tipos de MI: a)MI completa, en la que la mucosa gástrica adquiere el fenotipo propio de la mucosa del intestino delgado; y b)MI incompleta, en la que la mucosa gástrica tendría un aspecto parecido a la del colon.
Indefinido para Displasia/neoplasia / Displasia / Neoplasia intraepitelial / Neoplasia no invasiva. La displasia es una proliferación epitelial con atipia citológica y arquitectural inequívoca, sin evidencia de infiltración15–17. En función del grado de alteración en la arquitectura y de la atipia citológica se clasifican en displasia de bajo y alto grado o carcinoma in situ. El diagnóstico de indefinido para displasia/neoplasia se utiliza cuando existe componente inflamatorio o artefactos que no permiten establecer un diagnóstico de displasia y no debe considerarse inocuo, dado que el 26,8% de lesiones resecadas resultaron ser neoplásicas (5% adenomas y 21,8% carcinomas)18.
CG familiar sin causa genética conocida. Dentro de las situaciones clínicas que engloban mayor riesgo se encuentra la entidad conocida como CG familiar (CGF), en la que se observa una agregación familiar de CG de histología intestinal sin una causa genética identificada. Se define por los siguientes criterios: a)>3 familiares de primer grado (FPG) o de segundo grado (FSG) con CG, con independencia de la edad, o b)>2 FPG o FSG con CG, al menos uno de afecto antes de los 50años19.
Carcinoma intramucoso / Neoplasia infiltrante intramucosal. Se trata de un carcinoma que infiltra la lámina propia o muscularis mucosae, sin infiltración submucosa (pT1a).
Cáncer gástrico precoz (CGP). Incluye pT1a y pT1b (con infiltración submucosa) y es independiente del estado de los ganglios linfáticos. Suelen tener alteraciones arquitecturales distintivas tales como una marcada densidad glandular, patrón cribiforme, gemación, proliferación glandular, además de la presencia de desmoplasia.
EDA de calidad. Es la exploración endoscópica realizada con un endoscopio de alta definición siguiendo un protocolo sistemático con fotos representativas de todas las regiones y de las lesiones y con una duración mínima de 7min20–22.
Riesgo poblacional de CG. El riesgo se define en base a la tasa de incidencia ajustada por edad. Una región se define como de alto riesgo cuando la incidencia anual es mayor de 20/100.000 habitantes, de riesgo intermedio si se sitúa entre 10 y 20/100.000, y de riesgo bajo si es inferior a 10/100.00023.
ResultadosEl grupo de expertos seleccionó y dio respuesta a las siguientes preguntas:
General1. ¿Cuál debería ser el objetivo de las intervenciones evaluadas en los pacientes con LPCG?
El objetivo de las intervenciones en los pacientes con LPCG ha de ser la reducción de la mortalidad del CG.
Acuerdo 5.
2. ¿Hasta qué edad se recomienda realizar cribado del cáncer gástrico?
Se sugiere suspender o no iniciar los programas de cribado en pacientes mayores de 75 años.
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 4,75.
Se sugiere suspender o no iniciar los programas de cribado en pacientes cuya comorbilidad comporte una esperanza de vida estimada inferior a 10 años.
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 5.
Evidencia
La Organización Mundial de la Salud (OMS) define el cribado como la identificación de enfermedades o defectos no diagnosticados previamente mediante pruebas, exámenes u otros procedimientos que se pueden aplicar rápidamente y con facilidad en la población objeto de cribado. El cribado se emplea para detectar enfermedades crónicas graves como el cáncer, en el que la reducción de la mortalidad es el objetivo principal. Los requisitos para determinar la idoneidad de una estrategia de cribado fueron inicialmente definidos por la OMS en 1968 y han sido actualizados por el UK National Screening Committee en 201524,25. En el caso del cáncer los objetivos son reducir la incidencia y la mortalidad, primordialmente, específica del cáncer. El efecto sobre la mortalidad debe determinarse dentro de ensayos clínicos, registros poblacionales o específicos de la población sometida a cribado. Debido a que esto significa dar seguimiento a una población objetivo durante muchos años, estos resultados no serán observables a corto plazo, por lo que, una vez iniciado el programa de cribado, se recomienda monitorizar indicadores intermedios26. En el caso concreto del cribado del CG, la detección precoz y el tratamiento de lesiones de alto grado y neoplasias in situ gástricas, así como las tasas de cáncer de intervalo, podrían ser un indicador intermedio de eficacia.
El beneficio de un cribado para los individuos de la población general puede estar limitado por la edad y la comorbilidad, que reducen la esperanza de vida del paciente y aumentan los riesgos y complicaciones de los procedimientos invasivos. Es improbable que el cribado modifique significativamente la esperanza de vida cuando esta es inferior a los 10años debido a la patología de base del paciente. Como ejemplo, el riesgo de muerte en nuestro país a los 75años es del 2,1% por 100 individuos y año y aumenta rápidamente, de modo que a los 80años es ya del 3,7 por 100 individuos y año27. Además, el riesgo de los procedimientos y de una potencial cirugía aumenta también con la presencia de comorbilidades y la edad. Por todo ello, se sugiere no iniciar —o finalizar— el cribado del CG a los 75años o cuando la esperanza de vida asociada a las comorbilidades del paciente sea claramente inferior a los 10años28.
Diagnóstico histológico3. ¿Cuál es la clasificación histológica recomendada para clasificar el riesgo?
Se recomienda utilizar la clasificación OLGIM y determinar el subtipo de MI en los informes anatomopatológicos de las LPCG.
Acuerdo 5
Evidencia
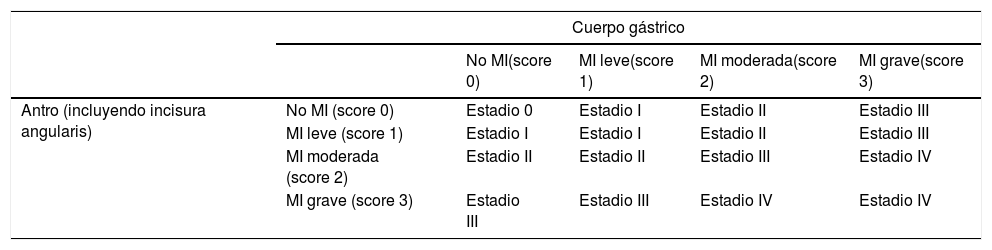
La clasificación Sydney14 permite una valoración semicuantitativa de la gravedad de las lesiones precursoras. Sin embargo, no aporta información pronóstica que permita en la práctica clínica identificar los pacientes con mayor riesgo de progresión de las lesiones. Por ello se han propuesto dos sistemas de graduación y estadificación histológica de las gastritis crónicas: OLGA (Operative Link for Gastritis Assessment)29, basado en la extensión y la gravedad de la atrofia gástrica sin diferenciar la atrofia no metaplásica de la metaplásica, y OLGIM (Operative Link on Gastric Intestinal Metaplasia assessment)30, basado en la extensión y la gravedad exclusivamente de la MI (tabla 2). Los dos sistemas concuerdan en que el riesgo de neoplasia se concentra en estadios avanzados (OLGAIII/IV u OLGIMIII/IV). Dos estudios transversales31,32 y un estudio de cohortes33 en el caso del sistema OLGA y un estudio de seguimiento34 en el caso del sistema OLGIM han puesto de relevancia su fácil manejo y su utilidad en la identificación de pacientes en riesgo de progresión. En la actualidad se recomiendan los dos sistemas10. No obstante, el diagnóstico de atrofia presenta una gran variabilidad intra e interobservador35,36. Por el contrario, el nivel de concordancia para la MI es casi perfecto, tres veces superior al de la atrofia30, por lo que algunos autores consideran que el sistema OLGIM es más adecuado que el sistema OLGA para la identificación de los pacientes con LPCG con alto riesgo de progresión. Así, la extensión de la MI es el parámetro diagnóstico más fiable para predecir el riesgo de CG30. Adicionalmente, la presencia de MI incompleta es un marcador significativo de progresión de las lesiones y de desarrollo de carcinoma gástrico37–39. Además, el seguimiento de pacientes con MI incompleta podría aumentar la probabilidad de diagnosticar un CGP40,41. Tras la erradicación de H.pylori los pacientes con MI incompleta tienen más riesgo de desarrollo de CG que aquellos con MI completa tras 12años de seguimiento (OR: 11,3; IC95%: 1,4-91,4)42. Por otra parte, la presencia de MI incompleta en una biopsia gástrica es un indicador de MI extensa38,43. Por todo ello, sería recomendable incluir el tipo de MI en los informes de anatomía patológica de forma rutinaria.
Clasificación Operative Link on Gastric Intestinal Metaplasia assessment (OLGIM)
| Cuerpo gástrico | |||||
|---|---|---|---|---|---|
| No MI(score 0) | MI leve(score 1) | MI moderada(score 2) | MI grave(score 3) | ||
| Antro (incluyendo incisura angularis) | No MI (score 0) | Estadio 0 | Estadio I | Estadio II | Estadio III |
| MI leve (score 1) | Estadio I | Estadio I | Estadio II | Estadio III | |
| MI moderada (score 2) | Estadio II | Estadio II | Estadio III | Estadio IV | |
| MI grave (score 3) | Estadio III | Estadio III | Estadio IV | Estadio IV | |
MI: metaplasia intestinal.
Adaptado de Capelle et al.30.
Opinión de experto
El sistema OLGA y el sistema OLGIM permiten clasificar el riesgo entre los pacientes con LPCG en función de la gravedad y la extensión de la atrofia gástrica y de la MI, respectivamente. Ambos sistemas coinciden en que los pacientes en estadiosIII yIV tienen un alto riesgo de progresión a CG. La baja concordancia diagnóstica intra e interobservador en el caso de la atrofia comparada con la concordancia diagnóstica casi perfecta de la MI hacen que el sistema OLGIM sea el parámetro diagnóstico más fiable para predecir el riesgo de CG. La determinación de la presencia de MI incompleta podría añadir información adicional sobre el riesgo de CG.
4. ¿Es necesaria la erradicación previa deH.pyloripara una estadificación adecuada de las LPCG?
Se puede realizar una estadificación adecuada de las LPCG, independientemente del estado de erradicación delH. pylori.
Acuerdo 4,64.
Una revisión sistemática y dos metaanálisis evidenciaron que la erradicación de H.pylori mejora la histología gástrica e incluso la normaliza en las primeras etapas de la enfermedad44–46. En estas etapas la gastritis crónica y la atrofia gástrica sin metaplasia regresarían uno a dos años después de la erradicación de H.pylori45, aunque en el caso de la atrofia podría variar en función de la extensión y la localización46. En cuanto a la MI, los dos metaanálisis concluyen que no hay una mejora significativa de la MI después de la erradicación de H.pylori44,46. Sin embargo, un ensayo clínico aleatorizado (ECA) más reciente mostró que en pacientes con LPCG la erradicación de H.pylori conseguía la regresión tanto de la atrofia como de la MI tanto a los 6 como a los 12años de seguimiento en un porcentaje significativo de pacientes47,48. Asimismo, en este estudio también se evidenció regresión de algunos casos con displasia de bajo grado (DBG)47,48. Por el contrario, la displasia de alto grado (DAG) es muy infrecuente que regrese49. Teniendo en cuenta que los pacientes que podrían ser subsidiarios de seguimiento son aquellos con displasia epitelial, atrofia y/o MI extensas y estas lesiones no varían a corto plazo, a pesar del tratamiento erradicador de H.pylori, no sería necesario erradicar previamente para realizar una estadificación adecuada de los pacientes.
5. ¿Es necesario suspender los inhibidores de la bomba de protones (IBP) para una estadificación adecuada de las LPCG?
No es necesario suspender los IBP para una estadificación adecuada de las LPCG. Sin embargo, se recomienda suspenderlos para detectar adecuadamente la infección porH.pylori.
Calidad de la evidencia baja, nivel de recomendación fuerte a favor.
Acuerdo 5.
No hay estudios cuyo objetivo sea evaluar la necesidad de suspender los IBP para realizar una gastroscopia de calidad. Tampoco hay estudios que demuestren que los IBP interfieran en el diagnóstico histológico de atrofia y/o la MI50. En estudios en roedores el uso de IBP incrementaba el riesgo de desarrollo de gastritis atrófica en cuerpo y cáncer51, probablemente en relación con un efecto inhibitorio de la acidez por los IBP52. No hay estudios dirigidos a valorar si el tratamiento con IBP influye en el correcto diagnóstico de las LPCG. Sin embargo, múltiples estudios han demostrado que el uso de IBP enmascara la presencia de H.pylori53.
Opinión del experto
Los datos disponibles son de muy baja evidencia y no permiten hacer una recomendación respecto a la necesidad de suspender los IBP previamente a la realización de una gastroscopia de seguimiento de las LPCG. Sí es necesario suspender los IBP en el caso de la endoscopia inicial al menos dos semanas antes para evitar los diagnósticos falsamente negativos de H.pylori relacionados con estos fármacos54.
6. ¿Cuándo se debe confirmar la displasia por un segundo patólogo?
Se recomienda confirmar siempre la displasia por un segundo patólogo.
Acuerdo 5.
La clasificación de Padova de la displasia gástrica presenta una buena reproductibilidad y una mínima variabilidad interobservador entre los patólogos con experiencia en enfermedades gastrointestinales17. Esta clasificación permitió unificar la nomenclatura entre patólogos occidentales y japoneses. La clasificación de Viena es la más utilizada actualmente16. En 2009, la Organización Mundial de la Salud15 modifica la nomenclatura de la displasia pasando a denominarla neoplasia intraepitelial, manteniendo las tres categorías diagnósticas propuestas en la clasificación de Padova por su fácil manejo: negativo para neoplasia intraepitelial, indefinido para neoplasia intraepitelial y neoplasia intraepitelial de bajo y alto grado49. Ante un diagnóstico de indefinido para displasia se recomienda la repetición de la biopsia. Aunque el pronóstico del diagnóstico «indefinido para displasia» es habitualmente benigno, se recomienda revisión histológica por un segundo patólogo con experiencia en patología gastrointestinal, puesto que hasta el 26,8% de las lesiones resecadas con diagnóstico indefinido para displasia/neoplasia eran neoplásicas18,55,56 y la revisión del diagnóstico de indefinido para displasia por patólogos expertos cambió el diagnóstico a displasia en 11/46 pacientes, sobre todo con factores de riesgo44,55,56. Los criterios diagnósticos de la neoplasia intraepitelial gástrica son controvertidos en todo el mundo, con valores de kappa entre 0,74 y 1 según las instituciones, con un valor general de kappa de 0,83, lo que indica una excelente concordancia. Sin embargo, la concordancia para los distintos diagnósticos es del 91,5% para carcinoma, del 86,3% para displasia de bajo grado y del 50,8% para displasia de alto grado. Esto demuestra que los criterios de diagnóstico para el carcinoma son más reproducibles que los de la displasia, por lo que es recomendable confirmar siempre la displasia por un segundo patólogo57.
Opinión de experto
La reproducibilidad de la clasificación de la displasia no está asegurada entre patólogos no expertos. Por ello se recomienda obtener una segunda opinión cuando los hallazgos histológicos indiquen la necesidad de tratamiento endoscópico y ante un diagnóstico de indefinido para displasia, de displasia de cualquier grado o de carcinoma en biopsias aleatorias no dirigidas18,57.
Cribado del CG en población general7. ¿Se recomienda cribado y tratamiento deH.pylorien la población general para reducir la mortalidad por cáncer gástrico?
Se sugiere no implantar estrategias poblacionales para la detección y erradicación posterior de la infección porH.pylori.
Calidad de la evidencia baja, nivel de recomendación débil en contra.
Acuerdo 5.
8. ¿Se recomienda el tratamiento erradicador en el paciente con infección porH. pylori?
En los pacientes con infección porH.pylorise recomienda el tratamiento de la infección, independientemente del motivo de diagnóstico.
Calidad de la evidencia alta, nivel de recomendación fuerte a favor.
Acuerdo 4.64.
Evidencia
La erradicación de H.pylori en la población general en áreas de alta prevalencia reduce significativamente la incidencia de CG y la mortalidad3–5. Los resultados provienen tanto de metaanálisis de ECA como de metaanálisis de estudios observacionales3,6,58. La reducción en el riesgo de CG es muy similar en todos los estudios (OR: 0,46 para los estudios observacionales, 0,54 para los ECA) con un número necesario a tratar (NNT) de 72 para prevenir un CG y de 137 para prevenir una muerte por CG6. Los estudios de coste-efectividad son altamente heterogéneos pero coinciden en considerar la erradicación como una intervención coste-efectiva59. Por otra parte, no existe evidencia sobre el efecto de la implantación de estrategias poblacionales para la detección de infección por H.pylori y erradicación posterior, especialmente en áreas con incidencia baja de CG como la nuestra60.
Opinión de experto
El nivel de evidencia sobre el efecto de la erradicación de H.pylori en la reducción de la incidencia del CG es fuerte con un NNT de aproximadamente 125 para prevenir un CG. Se dispone de test no invasivos con alta precisión para el diagnóstico de la infección por H.pylori y tratamientos con altas tasas de erradicación. Además, la erradicación de H.pylori se recomienda en nuestro ámbito como estrategia de tratamiento de la dispepsia no investigada, de la úlcera péptica y del linfoma MALT gástrico. Por estos motivos, a nivel individual se justifica la recomendación de erradicar H.pylori en un paciente con infección conocida independientemente del motivo que haya conducido al diagnóstico54.
Existen, sin embargo, factores en contra de recomendar la instauración de un programa de cribado poblacional: a)Se desconoce la aceptabilidad tanto de las pruebas diagnósticas como, sobre todo, del tratamiento de H.pylori en individuos asintomáticos. b)Se desconocen, por tanto, las potenciales tasas de participación de la población en un programa de cribado. c)Tampoco hay datos sobre el efecto en el uso de recursos, el impacto psicológico y la eficacia en una población con incidencia baja de CG60 como la nuestra. Por todo ello, la recomendación respecto a la implantación de estrategias poblacionales es débil en contra, salvo dentro de estudios prospectivos, preferentemente ensayos clínicos. El panel considera que sería recomendable evaluar mediante modelos la viabilidad de las distintas opciones de tratamiento poblacional en nuestro medio. Para que este tipo de modelos sea fiable, es necesario establecer la prevalencia real de H.pylori en el momento actual, puesto que los datos disponibles no son recientes y la prevalencia de la infección se reduce en las cohortes más jóvenes61.
9. ¿Es necesario investigar la infección porH.pylorien pacientes que van a recibir IBP de manera prolongada?
Se sugiere investigar la infección porH.pylorien los pacientes que van a recibir IBP de manera prolongada con el objetivo de erradicarla antes de su inicio.
Calidad de la evidencia baja, nivel de recomendación débil a favor.
Acuerdo 5.
Evidencia
El uso prolongado de IBP empeora la gastritis atrófica corporal en pacientes con infección por H.pylori, lo que podría aumentar el riesgo de CG según resultados de un estudio de casos y controles que incluyó pacientes con enfermedad por reflujo e infección por H.pylori tratados de forma crónica con IBP frente a funduplicatura (81% versus 59%, p=0,007)62,63. Además, en estudios en roedores el uso de IBP incrementaba el riesgo de desarrollo de gastritis atrófica en cuerpo y cáncer51, probablemente en relación con un efecto inhibitorio de la acidez por los IBP52. Según una reciente revisión de 16 estudios (1.920 pacientes) donde se administraron IBP de forma prolongada, los pacientes con H.pylori presentan mayor riesgo de atrofia en cuerpo gástrico que los no infectados64.
Opinión del experto
Aunque actualmente no hay evidencia clara de que el uso de IBP incremente el riesgo de CG, sí se ha observado que el uso prolongado de IBP en pacientes infectados por H.pylori aumenta el riesgo de progresión a LPCG. Dada la relación de estas últimas con el CG, como medida de precaución se recomienda que se investigue la presencia de H.pylori en los pacientes jóvenes que precisen tratamiento prolongado con IBP y tratarlo si está presente7. Por otro lado, el tratamiento de H.pylori tiene una morbimortalidad muy baja y los costes económicos asociados son bajos, mientras que el potencial beneficio a largo plazo es alto54. No parece, en cambio, recomendable identificar la infección por H.pylori en población anciana que requiera tratamiento continuado con IBP, dada la falta de evidencia sobre el efecto preventivo en esta población.
Uso de tests serológicos para la detección de LPCG10. ¿Se recomienda el uso de los test serológicos para la detección de LPCG?
No se recomienda el uso de pruebas serológicas para la detección de LPCG en la población general.
Calidad de la evidencia baja, nivel de recomendación fuerte en contra.
Acuerdo 5
Evidencia
Se ha propuesto que la determinación de pepsinógeno I/II circulante puede ser una prueba útil para detectar a los pacientes con lesiones preneoplásicas. Dos metaanálisis han revisado la utilidad de las pruebas serológicas, objetivando una sensibilidad del 60-69% y una especificidad del 88-89% para el diagnóstico de lesiones preneoplásicas65,66. Se han propuesto otras combinaciones que incluyen datos clínicos junto a combinación de serología para H.pylori, pepsinógeno y gastrina. La sensibilidad y la especificidad de esta clasificación son similares a las del uso del pepsinógeno aislado67. Estudios en nuestro medio utilizando una prueba diagnóstica que combina pepsinógeno, gastrina 17 y serología para H.pylori han mostrado una precisión diagnóstica incluso inferior, con una sensibilidad del 50% y una especificidad del 80%67. Por otro lado, la prevalencia de LPCG es fundamental para evaluar la eficacia de un potencial cribado. En este sentido, aunque la calidad de los datos es muy heterogénea, podemos estimar que la prevalencia en endoscopias de rutina de lesiones avanzadas con riesgo significativo de progresión a CG —incluyendo MI extensa y displasia— es del 7%68. En nuestro medio, la prevalencia de lesiones avanzadas fue incluso inferior, del 4% en la serie de McNicholl et al.69. La evaluación de las pruebas serológicas viene complicada por la metodología diversa de los estudios.
Opinión del experto
El uso poblacional de pruebas serológicas con una sensibilidad baja y una especificidad <90% para la detección de LPCG en el contexto de una prevalencia baja —inferior al 10%— generaría, por un lado, un número muy alto de individuos con resultados falsamente positivos que requerirán endoscopia, y por otro lado detectaríamos solamente la mitad de las LPCG69. A esto hemos de añadir que no existe evidencia de que el cribado de lesiones avanzadas prevenga el CG. Por tanto, si no se ha demostrado la eficacia del cribado de las LPCG para prevenir el CG, se debe recomendar fuertemente en contra en el caso del cribado serológico de la población general para detectar LPCG.
Cribado endoscópico11. ¿Se recomienda cribado con endoscopia en población general para la prevención del CG?
Se sugiere no implantar el cribado endoscópico poblacional del CG en nuestro medio.
Calidad de la evidencia muy baja, nivel de recomendación fuerte en contra.
Acuerdo 5.
Evidencia
Tres cuartas partes de todos los nuevos casos y muertes por CG se producen en países asiáticos, incluidos China, Japón y Corea. En 1960 Japón inició un programa de cribado masivo anual para el CG mediante estudio radiológico. Posteriormente, en otros países se ha introducido el cribado mediante la realización de EDA periódica. La evidencia sobre la eficacia de dicho cribado es moderada y los resultados no son homogéneos. En Japón, varios estudios caso-control y de cohortes, en su mayoría realizados entre 1980 y 2000, mostraron una disminución del 40-60% en la mortalidad por CG con el cribado mediante estudio radiológico70. Sin embargo, estudios posteriores no han confirmado que el estudio radiológico se asocie a una reducción de la mortalidad70.
Estudios clínicos y epidemiológicos han mostrado que el rendimiento de la endoscopia alta es mejor que el de la radiología70. Sin embargo, no existe una evidencia definitiva que demuestre que el cribado de CG mediante endoscopia reduzca la mortalidad. En China, un estudio prospectivo sobre vigilancia endoscópica en poblaciones de alto riesgo no mostró disminución de la mortalidad por CG (relación de mortalidad estándar 1,01; IC95%: 0,77-1,57)71. Por el contrario, Hamashima et al.72 observaron en la población sometida a cribado endoscópico en Japón una reducción del 30% en la mortalidad por CG. Jun et al.73 analizaron el efecto del programa nacional coreano de cribado en un estudio caso-control. La endoscopia bianual redujo significativamente la mortalidad por CG en aproximadamente un 50% (OR: 0,53; IC95%: 0,51-0,56), mientras que el estudio baritado no tuvo ningún efecto (OR: 0,98; IC95%: 0,95-1,01). Los datos de este estudio sugieren, por tanto, un efecto del cribado sobre la mortalidad en poblaciones de alto riesgo. Sin embargo, este tipo de estudios está sujeto a un riesgo considerable de sesgo. En resumen, la evidencia a favor del cribado en poblaciones de alto riesgo es limitada. No hay datos sobre la eficacia del cribado poblacional en áreas de bajo riesgo.
Los estudios de coste-efectividad se han centrado en el del cribado endoscópico de la MI y el seguimiento de los pacientes de alto riesgo con metaplasia extensa. Estos estudios muestran que el coste-efectividad depende de la prevalencia de MI extensa y la tasa de progresión de metaplasia a cáncer, y sugieren que el cribado podría ser coste-efectivo en poblaciones de riesgo medio y alto. Se han evaluado mediante modelos de coste-efectividad distintas estrategias de detección de MI mediante endoscopia. La mayoría sugieren que no se trata de una estrategia coste-efectiva en poblaciones de bajo riesgo. Dos estudios de coste-efectividad sugieren que el cribado de CG y MI mediante endoscopia alta en el momento de la colonoscopia de cribado de cáncer de colon, con seguimiento posterior de las LPCG, podría ser coste-efectivo en áreas de riesgo medio y alto10,74. El estudio de Pimentel-Nunes sugiere que el cribado podría ser efectivo en grupos de riesgo con una incidencia anual de CG por encima de 10 casos por 100.000 individuos por año. De acuerdo con estos datos y a la prevalencia publicada en España, el cribado mediante endoscopia podría ser útil únicamente en poblaciones seleccionadas en algunas áreas de alto riesgo de Castilla y León o Galicia.75,76
Opinión de experto
Existen factores en contra de recomendar la instauración de un programa de cribado poblacional con endoscopia. Se desconocen las potenciales tasas de participación de la población en un programa de cribado. Tampoco hay datos sobre el efecto en el uso de recursos, el impacto psicológico y la eficacia en una población con incidencia baja de CG como la nuestra. Los datos disponibles se basan en estudios indirectos de coste-efectividad, son heterogéneos y sugieren que el cribado endoscópico de CG y MI no es efectivo en poblaciones de bajo riesgo. No disponemos de datos clínicos que den soporte al cribado ni de datos sólidos en que basar las asunciones de los estudios de coste-efectividad.
Pacientes con antecedentes familiares de CG12. ¿Se recomienda investigar y tratar la infección porH.pylorien pacientes con un FPG con CG?
Se recomienda la investigación y el tratamiento de la infección delH.pylorien los individuos con un FPG con CG.
Calidad de la evidencia alta, nivel de recomendación fuerte a favor.
Acuerdo 5.
13. ¿Se recomienda cribado endoscópico en pacientes con antecedentes familiares de CG sin criterios de CG familiar?
No se recomienda cribado endoscópico rutinario en pacientes con antecedentes de CG sin criterios de CG familiar.
Calidad de la evidencia baja, recomendación fuerte en contra.
Acuerdo 4.75.
14. ¿Es necesario el estudio familiar en pacientes con criterios de CG familiar?
En los individuos con agregación familiar de CG se recomienda excluir los síndromes hereditarios asociados al CG.
Calidad de la evidencia muy baja, nivel de recomendación fuerte a favor.
Acuerdo 5.
15. ¿Se recomienda cribado endoscópico en el CG familiar sin causa genética conocida?
En los individuos que cumplen criterios de CG familiar se sugiere el cribado endoscópico del CG.
Calidad de la evidencia muy baja, nivel de recomendación débil a favor.
Acuerdo 4,25.
Evidencia
La etiología del CG es multifactorial, y entre los agentes ambientales principales se encuentran H.pylori, la dieta y el tabaco. Si bien la mayoría de los CG son esporádicos, se observa una agregación familiar en aproximadamente el 10% de los casos77,78. El CG hereditario, es decir, en el contexto de una mutación germinal asociada, representa un 1-5% de todos los CG79. Entre las características familiares que sugieren una predisposición hereditaria se incluyen el presentar varios familiares afectos, un patrón de herencia autosómico dominante, afectación a edades tempranas y la asociación a otras neoplasias extragástricas. En base a la historia familiar y personal, así como el tipo histológico del tumor (difuso o intestinal), se debe valorar si el paciente cumple criterios clínicos diagnósticos de alguna situación con base hereditaria asociada a un mayor riesgo de CG. En caso afirmativo, está indicado realizar el estudio genético germinal correspondiente y el cribado endoscópico se establece en base al síndrome hereditario asociado79. En caso de descartar un síndrome hereditario, se establece el diagnóstico de CG familiar si cumple los criterios de agregación familiar. Si no cumple criterios, se orientará como CG esporádico.
Los familiares de primer grado (FPG) de un paciente afecto con CG tienen un riesgo incrementado de padecer este tumor. Sin embargo, la magnitud de dicho riesgo varía en base al grupo étnico, la región geográfica y el grado de agregación familiar. En diversos estudios de casos y controles el mayor riesgo en FPG oscila en general entre 1,5 y 3,5 veces80, pero puede ser de hasta 10 veces mayor dependiendo del país, en relación con la población general81. Un metaanálisis reciente incluyó 32 estudios que evaluaban el riesgo de CG en FPG, revelando un aumento de riesgo de CG de alrededor de 2,5 en los familiares de FPG con respecto a la población general. Sin embargo, en la gran mayoría de los estudios no se realizó estudio genético para excluir un componente hereditario82. Específicamente en nuestra población, existe un estudio caso-control que incluyó individuos con 1FPG o 2FSG con CG reportando una OR de 3,4 (IC95%: 1,9-6,0) con respecto al grupo control83.
Dentro de las situaciones clínicas que comportan mayor riesgo se encuentra la entidad conocida como CGF, en la que se observa una agregación familiar de CG de histología intestinal sin una causa genética identificada. El riesgo de CG aumenta en base al número de familiares afectos. Así, un estudio en 2010 demostró que el riesgo de CG con un FPG era de 2,7 (OR: 2,7; IC95%: 1,7-4,3), aumentando dicho riesgo hasta 9,6 (OR: 9,6; IC95%: 1,2-73,4) en individuos con 2 o más FPG afectos84. Otro estudio previo también demostró que el tener 2 o más FPG conlleva mayor riesgo de CG que si se tiene solo 1FPG afecto (OR: 5,5; IC95%: 3,0-10,2 vs. OR: 1,7; IC95%: 1,3-2,1), siendo el riesgo mayor si el FPG afecto es un hermano en comparación de si se trata de un progenitor (hermanos: OR: 2,6; IC95%: 1,8-3,7; padres: OR: 1,7; IC95%: 1,3-2,2)85.
Los miembros de una misma familia tienden a tener un ambiente similar en cuanto a factores como el estado socioeconómico, el hábito dietético, e incluso pueden compartir la misma cepa de H.pylori. Por lo tanto, los resultados de los estudios orientados a evaluar la historia familiar del CG como factor de riesgo independiente de dicha neoplasia deben interpretarse con cautela. Por ejemplo, un estudio de casos y controles identificó que la infección por H.pylori y una historia familiar fueron factores de riesgo independientes para el CG, aunque ambos estaban positivamente relacionados entre sí. Así, los individuos con un FPG con CG e infección de H.pylori presentaban un riesgo de CG 8 veces mayor (OR: 8,2; IC95%: 2,2-30,4) y un riesgo de CG no cardial 16 veces mayor (OR: 16,0; IC95%: 3,9-66,4) que los individuos sin historia familiar ni infección por H.pylori), sin poder analizar el riesgo de CG en individuos con historia familiar pero sin infección por H.pylori, dado que el 82% de la cohorte con historia familiar era H.pylori positiva86.
No existe evidencia científica ni consenso general en la conveniencia de gastroscopias periódicas y el intervalo entre ellas. La recomendación más ampliamente aceptada en la actualidad es la detección y erradicación de H.pylori en los FPG de pacientes con CG77,78,87. En este sentido, un ECA publicado recientemente demuestra que, con un seguimiento de 9,2años, la erradicación del H.pylori reduce el riesgo de CG tanto por intención de tratar (erradicación 1,2%, placebo 2,7%, HR: 0,45; IC95%: 0,21-0,94) como por erradicación efectiva (erradicación 0,8%, no erradicación 2,9%, HR: 0,2; IC95%: 0,1-0,7)88.
Respecto de la vigilancia endoscópica en el CG familiar, las recomendaciones están basadas en consensos de expertos. Dichas recomendaciones son muy heterogéneas, variando desde la recomendación de no hacer gastroscopias rutinarias (solo en el marco de investigación) a realizar gastroscopias anuales, cada 3 o cada 5años. Como se mencionó previamente, el presentar historia familiar de CG conlleva un mayor riesgo de infección por H.pylori, gastritis atrófica y MI, y existe evidencia que sugiere que las lesiones preneoplásicas gástricas en individuos con FPG con CG tienen un mayor riesgo de progresión89. En base a esto, algunos grupos de expertos sugieren realizar gastroscopias de vigilancia (con alta definición y/o cromoendoscopia y toma de biopsias dirigidas) cada 3años en pacientes con gastritis atrófica o MI y antecedente de FPG con CG10.
En este mismo sentido, en individuos que cumplen criterios de CG familiar el consenso de expertos de la European Society of Digestive Oncology (ESDO) de 2018 recomienda cribado anual con EDA, similar al utilizado en el seguimiento de individuos que cumplen criterios de CG difuso hereditario sin mutación germinal identificada, a partir de los 40años o 5años antes del familiar afecto más joven90. Dicha exploración ha de realizarse de acuerdo al protocolo de Cambridge91: a)uso de endoscopio de alta definición; b)inspección cuidadosa durante 30min; c)maniobras de tensión/distensión gástrica; d)uso de mucolíticos; e)biopsia de todas las anomalías mucosas; f)biopsias seriadas: se recomiendan 30 biopsias aleatorias, 6 de cada región (antro, incisura, cuerpo, fundus y cardias); g)detección y erradicación de H.pylori.
Opinión de expertoEn base que España es un país de riesgo bajo para CG, en espera de evidencia científica sólida se recomendará gastroscopias con biopsias siguiendo el protocolo Sídney y determinación de H.pylori en las biopsias cada 3años10 a partir de los 40años o 5años antes del familiar afecto más joven, exclusivamente en individuos que pertenezcan a familias con criterios de CG familiar. En individuos con antecedente familiar de CG sin cumplir criterios de CG familiar ni síndrome hereditario se recomendará la determinación y la erradicación de H.pylori. Finalmente, dada la falta de evidencia científica, y a que existe una gran heterogeneidad en el seguimiento de individuos con antecedentes familiares de CG, es fundamental realizar estudios prospectivos que permitan profundizar en el conocimiento del riesgo de CG en base a la agregación familiar y establecer las medidas de cribado y de vigilancia adecuadas.
Manejo de los pacientes con LPCGErradicación de H.pylori en pacientes con LPCG16. ¿Se recomienda investigar y tratar la infección porH.pylorien pacientes con atrofia o MI?
Se recomienda la investigación y el tratamiento de la infección delH.pylorien pacientes con atrofia gástrica o metaplasia intestinal.
Calidad de evidencia baja, nivel de recomendación fuerte a favor.
Acuerdo 4,64.
17. ¿Se recomienda investigar y tratar la infección porH.pylorien pacientes con displasia o carcinoma in situ?
Se recomienda la investigación y el tratamiento de la infección porH.pyloritras la resección endoscópica de displasia o carcinoma in situ.
Calidad de evidencia alta, nivel de recomendación fuerte a favor.
Acuerdo 4,64.
Evidencia
- •
Neoplasia avanzada. En una búsqueda no sistemática no se han detectado datos que sugieran un efecto relevante de la erradicación de H.pylori en el tratamiento o la supervivencia de pacientes con CG avanzado.
- •
Neoplasia in situ/DAG. Se han publicado ECA de alta calidad92,93 y varios metaanálisis94–97 con resultados altamente concordantes. Dichos estudios muestran que la erradicación efectiva de H.pylori reduce la aparición de lesiones metacrónicas en aproximadamente el 50% de los pacientes que han requerido una resección mucosa endoscópica por CGP o neoplasia in situ.
- •
MI/atrofia gástrica y DBG. En la revisión técnica realizada por la American Gastroenterological Association (AGA) para la guía de práctica clínica sobre MI, la erradicación de H.pylori redujo el riesgo de mortalidad (RR: 0,67; IC95%: 0,38-1,17) y la incidencia (RR: 0,68; IC95%: 0,48-0,96) de CG tanto de forma global como específicamente en los pacientes con MI, aunque, en el caso de la MI, de forma no significativa (RR 0,76; IC95%: 0,36-1,61)98. Además, ECA recientes muestran que la erradicación de H.pylori se asociaba a la regresión de la MI a los 6 y 12años de seguimiento en un porcentaje significativo de los pacientes47,48. En este estudio también se evidenció regresión de algunos casos con DBG47,48. Por el contrario, la DAG es muy infrecuente que regrese49.
Opinión del experto
El tratamiento de la infección por H.pylori tiene un claro efecto protector de la aparición de lesiones metacrónicas en los pacientes sometidos a resección endoscópica de lesiones gástricas de alto grado. Aunque los datos sobre la eficacia del tratamiento de la infección por H.pylori en función de la histología previa son limitados, tenemos datos que sugieren que podría ser eficaz reduciendo la incidencia de CG en pacientes con atrofia y, especialmente, MI. Así:
- a)
Los metaanálisis publicados muestran una tendencia numérica no significativa favorable al tratamiento de H.pylori.
- b)
Dicho tratamiento es efectivo para prevenir lesiones metacrónicas en pacientes que han recibido tratamiento endoscópico de lesiones neoplásicas y la mayoría de estos pacientes son portadores de atrofia y/o MI.
- c)
Existe evidencia de que el tratamiento de H.pylori podría inducir la regresión de las lesiones avanzadas en un porcentaje no determinado de pacientes.
Por otro lado, el tratamiento de H.pylori tiene una morbimortalidad muy baja y los costes económicos asociados son bajos. Todo ello permite etiquetar la evidencia como baja pero hacer una recomendación fuerte a favor.
Vigilancia y manejo endoscópico de las LPCGAtrofia gástrica no metaplásica18. ¿Se recomienda vigilancia endoscópica en pacientes con atrofia gástrica sin MI?
No se recomienda vigilancia endoscópica en los pacientes con atrofia gástrica sin MI, independientemente del grado de extensión.
Calidad de la evidencia muy baja, recomendación fuerte en contra.
Acuerdo 4,8.
Evidencia
La incidencia anual del CG se ha establecido en 0,1-0,25% en pacientes con gastritis crónica atrófica99,100. Sin embargo, existe importante variabilidad en el cálculo de dicha incidencia. Por ejemplo, en un estudio sueco la incidencia acumulada a los 20años fue de aproximadamente el 2% en los pacientes con gastritis crónica atrófica101; otro estudio japonés encuentra una mayor incidencia acumulada de CG a los 5años, alcanzando el 1,9-10% en pacientes con gastritis crónica atrófica extensa102. Una revisión sistemática reciente incluyó 19.749 pacientes con gastritis atrófica, de los cuales 261 progresaron a CG de un total de seguimiento de 171.170 personas-año. El rango de incidencia de CG en esta cohorte era de 0,53 a 15,24 por 1.000 personas-año. La mayoría de los estudios reportaban una tasa de incidencia de 1,0 a 5,2 por 1.000 personas-año y tan solo dos estudios tenían resultados más extremos103. Específicamente en España, González et al.104 reportaron un CG en 156 individuos con gastritis crónica atrófica durante un periodo de seguimiento de 12años.
El riesgo de CG se incrementa con la mayor extensión y grado de atrofia gástrica; por ejemplo, se ha descrito un aumento del riesgo relativo de CG de hasta 5,76 en pacientes con gastritis atrófica corporal grave en comparación con aquellos en los que esta es mínima o no presentan gastritis100,105. Otro estudio japonés describió un riesgo relativo de CG de 1,7 en pacientes con gastritis atrófica moderada y de 4,9 en pacientes con gastritis atrófica grave, en comparación con individuos sin atrofia o atrofia leve106. En otro estudio la extensión de la atrofia gástrica se relacionó con el riesgo de detección de CG: 5,33% en pacientes con atrofia presente en todo el estómago vs 0% y 0,25% en pacientes con atrofia limitada a antro y atrofia en la incisura o cuerpo, respectivamente107.
Finalmente, en cuanto al riesgo de displasia, en un estudio retrospectivo de pacientes con estadio indefinido para displasia en la endoscopia basal y con estadificación OLGA con una mediana de seguimiento de 31meses no se detectó displasia en ningún paciente con OLGA0/I/II y sin embargo se detectaron 6 casos de displasia en 25 pacientes con OLGAIII/IV durante el mencionado seguimiento108.
Opinión de experto
La incidencia de cáncer en pacientes con atrofia extensa es desconocida, pero puede oscilar alrededor de 1 caso por cada 1.000 pacientes y año. Una de las potenciales causas de la diferencia del riesgo reportado en los diferentes estudios es probablemente que la extensión y el grado de atrofia en algunos de ellos no se tomaron en consideración para calcular la incidencia de CG y/o displasia. Otra limitación importante es que la clasificación OLGA no discrimina entre la atrofia metaplásica y no metaplásica en la clasificación de gastritis atrófica, lo que dificulta la interpretación de los resultados. Por otro lado, el diagnóstico de atrofia aislada sin tener en cuenta MI presenta una muy elevada variabilidad interobservador, por lo que sería un mal marcador de riesgo. Adicionalmente, no se recomienda cribado dado que no se cumplen varias de las condiciones clave establecidas por las agencias reguladoras para recomendar un cribado. En este sentido, no hay datos sobre la aceptabilidad de un programa de cribado y, sobre todo, no hay evidencia ni en estudios aleatorizados ni en estudios observacionales de que el cribado reduzca la mortalidad. Tampoco hay datos sobre el potencial impacto en el sistema sanitario y no existe ninguna provisión de recursos para el cribado. En este contexto no se recomienda cribado, a la espera de datos de futuros estudios prospectivos. Este razonamiento es aplicable a todas las LPCG, pero tiene un peso más importante en las más difíciles de caracterizar —como la atrofia gástrica— o en las situaciones de riesgo más bajo —como, por ejemplo, la MI completa y/o localizada.
Metaplasia intestinal19. ¿Es necesario repetir la EDA en los pacientes tras el diagnóstico inicial de MI?
Se recomienda realizar una EDA de alta calidad y estadificación mediante OLGIM en 6 a 12meses cuando el diagnóstico de MI se realice en una EDA de baja calidad
Calidad de la evidencia baja, grado de recomendación débil a favor.
Acuerdo 4,8.
20. ¿Se recomienda vigilancia endoscópica en pacientes con MI?
No se recomienda vigilancia endoscópica en los pacientes con OLGIM I-II (MI focal).
Calidad de la evidencia baja, recomendación fuerte en contra.
Acuerdo: 4,75.
Se sugiere no realizar vigilancia endoscópica en los pacientes con OLGIMIII-IV (MI extensa) sin factores adicionales.
Calidad de la evidencia muy baja, grado de recomendación débil en contra.
Acuerdo: 4,08.
Se sugiere vigilancia endoscópica cada tres años en los pacientes con MI extensa (OLGIMIII-IV) con MI incompleta o antecedentes familiares de CG.
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 4,64.
Evidencia
La MI debe ser considerada como un factor de riesgo de CG si afecta tanto a mucosa del cuerpo como del antro. Un total de 10 estudios de cohortes, incluyendo a 25.912 pacientes con MI y un seguimiento de 159.756 pacientes-año, han evaluado la progresión de la MI hacia CG. La densidad de incidencia de CG fue de 12,4 (IC95%: 10,7-14,3) CG por 10.000 pacientes-año con una incidencia acumulada de CG a los 3, 5 y 10años del 0,4, del 1,1 y del 1,6%, respectivamente98,109.
Dentro de la revisión técnica de la AGA para informar la guía de práctica clínica sobre MI, se identificaron tres factores que incrementaban el riesgo de desarrollo de CG en pacientes con MI98,109. La presencia de un FPG con CG incrementó el riesgo 4,5 veces (OR: 4,53; IC95%: 1,33-15,46) en los cuatro estudios que evaluaron este factor en comparación con los que no tenían un FPG. Por otra parte, siete estudios evaluaron el riesgo de desarrollo de CG en función del tipo histológico de la MI. La MI incompleta se asoció con un incremento del riesgo de CG durante un seguimiento de 3-12,8años (RR: 3,33; IC95%: 1,96-5,64). En cuanto a la extensión de la MI, solo dos estudios aportaron información para evaluar el riesgo durante el seguimiento. En este sentido, la MI extensa se asoció a un incremento no significativo del riesgo de CG (RR: 2,07; IC95%: 0,97-4,42). Estos datos concuerdan con los obtenidos con diversos estudios de casos-control en los que se observa una asociación entre la MI extensa (OLGIMIII/IV) y la detección de CG110–113.
Otro factor de riesgo ampliamente asociado a un incremento de riesgo de CG —la anemia perniciosa— fue evaluado en esta revisión. Solo se identificó un estudio que evaluó la prevalencia de MI en esta condición. Aunque la incidencia de MI era alta: 88,9% (IC95%: 70,8-96,6%), el estudio tenía múltiples limitaciones: tamaño muestral (27 pacientes), criterios diagnósticos y potenciales sesgos de selección. Por este motivo, en este documento no se realiza una recomendación separada para los pacientes con anemia perniciosa/gastritis autoinmune y se propone establecer la indicación de vigilancia en estos pacientes del mismo modo que en la población general, en función de la lesión histológica y los factores de riesgo adicionales98,109.
En el ámbito europeo, un reciente estudio sueco que analiza más de 400.000 pacientes concluye que la MI (independientemente del grado de extensión) aumenta de forma significativa el riesgo de CG. Este estudio mostró que una segunda EDA con biopsias puede tener valor pronóstico significativo, ya que se puede producir una regresión de la LPCG, al no detectar MI, que se asocia a un menor riesgo de progresión a CG durante el seguimiento101.
Sin embargo, la prevalencia de MI focal en la población europea se encuentra entre el 16 y el 18% y parece poco razonable plantear el seguimiento de estos pacientes114. Además, aunque los mismos autores consideran que aunque la MI podría aumentar el riesgo de CG comparado con la ausencia de MI o incluso solo con atrofia, el riesgo parece demasiado escaso para justificar el seguimiento42.
De nuevo y en la misma línea de lo comentado en la atrofia mucosa gástrica, no hay ECA sobre el beneficio o los riesgos de la vigilancia endoscópica en los pacientes con LPCG98,109. La evidencia proviene de estudios no experimentales con sesgos de selección, diversos criterios diagnósticos y esquemas de vigilancia40,110,115. Así, un estudio de cohortes comparó el riesgo de detección de CG y el estadio al diagnóstico entre un grupo de 166 individuos con vigilancia endoscópica durante 10años con los diagnósticos de MI, displasia, úlceras o pólipos y un grupo de 1.753 pacientes sin vigilancia. Entre los pacientes sometidos a vigilancia hubo un mayor porcentaje de CG diagnosticados en estadios iniciales y un incremento en la supervivencia a los 5años de los pacientes operados115. Sin embargo, la mayoría de los cánceres se detectaron durante el seguimiento de úlceras gástricas sospechosas y/o durante el primer año de seguimiento, lo que sugiere que muchas de las lesiones eran neoplasias incipientes no diagnosticadas en la EDA índice. En este sentido, los resultados no son aplicables al cribado. En el estudio más recientemente publicado, 279 pacientes con LPCG realizaron al menos una endoscopia de vigilancia durante un intervalo de seguimiento medio de 57meses. Se detectaron 4 casos con DAG o CG, todos ellos en individuos con OLGIMIII-IV110. Otro estudio retrospectivo publicado recientemente analizó los factores asociados a la aparición de CG en 332 pacientes con gastritis atrófica y un seguimiento medio de 9,2años en población asiática. Durante el periodo de seguimiento se detectaron 16CG con una incidencia de 0,53/1.000 pacientes-año. Este estudio corrobora que los factores asociados al riesgo de detección de CG son la extensión de las LPCG y la infección por H.pylori. De forma global la vigilancia endoscópica no redujo el riesgo de CG. Sin embargo, en los individuos con LPCG extensas un análisis multivariado sugirió que la vigilancia endoscópica en intervalos de 2-3años redujo el riesgo de CG (HR: 0,01; IC95%: 0,001-0,34). Las limitaciones de este estudio son la falta de definición de la extensión de las LPCG, el carácter retrospectivo del estudio y que incluyen diferentes periodos de vigilancia116.
Opinión de experto
El aumento de riesgo de CG asociado a la presencia de MI es limitado. En los pacientes con LPCG el riesgo de desarrollo de CG se circunscribe especialmente en los pacientes con displasia o MI extensa (OLGIMIII-IV). En el caso de la MI extensa este riesgo se incrementa cuando se asocian otros factores de riesgo como la MI incompleta y los antecedentes familiares de CG. No hay evidencia, en cambio, que relacione la gastritis atrófica autoinmune con un mayor riesgo de detección de CG en la MI98,109,114. Por otro lado, el riesgo de CG en pacientes con MI focal (OLGIMI-II) es muy bajo, no significativamente superior al de la población general. Tal como queda reflejado en la revisión técnica de la AGA98,109, no existe evidencia de calidad que permita recomendar la vigilancia endoscópica en los pacientes con MI. Se requieren estudios prospectivos que evalúen el efecto de la vigilancia endoscópica sobre la incidencia de CG en estos pacientes.
Adicionalmente, no se cumplen las condiciones requeridas por las agencias reguladoras. No hay datos sobre la aceptabilidad de un programa de cribado, no hay datos sobre el potencial impacto en el sistema sanitario y no existe ninguna provisión de recursos para el cribado. En este contexto no se recomienda cribado, a la espera de datos de futuros estudios prospectivos.
El panel está de acuerdo en que es necesaria la investigación en este campo. Por ello se recomienda discutir el riesgo-beneficio con los pacientes con MI extensa, dejando claras la no recomendación y la falta de evidencia de eficacia. Dada la baja calidad de la evidencia, sería razonable realizar cribado si el paciente muestra preferencias en este sentido. Se debe incluir tanto a los que acepten como a los que no en un registro que evalúe la eficacia del cribado a largo plazo. Fuera de la investigación clínica, no hay evidencia científica para recomendar cribado.
Sin embargo, en aquellos que acumulan varios factores de riesgo (MI extensa asociada a MI incompleta y/o antecedentes familiares de CG) se ha considerado razonable proponer la vigilancia endoscópica, siempre valorando con el paciente la reducción de riesgo de CG no probada versus los riesgos e incomodidades asociadas al cribado endoscópico. Con esto se pretende, en primer lugar, ofrecer el cribado a los pacientes con un potencial riesgo más elevado y, en segundo lugar, disponer de datos de la potencial utilidad del cribado en nuestro medio en estos pacientes de riesgo más elevado, que permitan evaluar su eficacia.
Por otra parte, no existe información sobre el efecto del riesgo del origen autoinmune en el riesgo de desarrollo de CG en la MI asociada a la anemia perniciosa. Por este motivo no recomendamos vigilancia específica en estos pacientes. En base a la opinión de expertos, algunos consensos sugieren que un intervalo de 2-3años podría ser adecuado en los pacientes con MI extensa y que requieran vigilancia endoscópica. En nuestro caso, dada la ausencia de evidencia, se optó por recomendar el uso de los mismos criterios para el seguimiento propuestos para los pacientes con LPCG.
Displasia y carcinoma in situ21. ¿Se recomienda la resección endoscópica en pacientes con lesiones con displasia?
Se recomienda la resección de las lesiones visibles con displasia para un correcto diagnóstico histológico.
Calidad de la evidencia alta, nivel de recomendación fuerte a favor.
Acuerdo 4,83.
22. ¿Se recomienda nueva endoscopia tras el diagnóstico de displasia sin lesión visible?
Se recomienda endoscopia de calidad para reevaluación antes de 6meses tras el diagnóstico de displasia de cualquier grado.
Calidad de la evidencia muy baja, grado de recomendación fuerte a favor.
Acuerdo 4,66.
Evidencia
Tradicionalmente se ha descrito que la DBG tiene un riesgo significativo de progresión a CG, aunque no hay ningún estudio que haya evaluado este riesgo en un elevado número de pacientes y todos los estudios incluyen la DBG y la displasia moderada en el mismo grupo. Además, en estos estudios no existe información sobre si se trata de lesiones visibles o no visibles. Por ejemplo, un estudio realizado en Estados Unidos que incluyó 141 individuos con DBG bajo seguimiento endoscópico describió una incidencia de CG de 7,7/1.000 personas-año, con un riesgo relativo de 25,6 (IC95%: 9,4-55,7), con una mediana de tiempo de 2,6años para la progresión a CG117. Así mismo, un estudio de cohortes realizado en los Países Bajos reportó un riesgo anual de progresión de la displasia leve/moderada a CG del 0,6%100. Sin embargo, estos resultados no han sido confirmados en un estudio más reciente realizado también en los Países Bajos, en el que ningún caso con DBG seguido prospectivamente progresó a DAG/CG tras un periodo de seguimiento medio de 4,7años110.
Por otro lado, no existen estudios que hayan evaluado si la resección endoscópica de las lesiones visibles con DBG reduce la incidencia/mortalidad de CG y/o DAG frente a no tratamiento100. En todo caso, el hallazgo de displasia es un marcador riesgo de CG. En algunos estudios100 se detectó un elevado número de pacientes con CG el primer año de seguimiento de pacientes con DAG, y por ello en estos se recomienda una reevaluación a corto plazo. En los que tienen displasia leve-moderada también debe revalorarse, pero el intervalo no está bien definido y podría ser de entre 6meses y un año. Así, la presencia de DBG también resulta un dato potencial de malignidad, puesto que muchas biopsias de lesiones visibles pueden ser negativas para displasia y esconder una verdadera neoplasia debido a un error de muestreo118. En una serie occidental que estudió especímenes de disecciones endoscópicas submucosas se observó que se produce una estadificación histológica al alza después de la resección endoscópica (RE) del 33% de las lesiones119. De forma similar, en un estudio oriental que analizó 1.850 lesiones se detectó una discrepancia entre las biopsias endoscópicas y los especímenes de RE del 32%118. Un metaanálisis que específicamente investigó la posibilidad de reestadificación al alza de la DBG después de la RE demostró que esto sucede en el 25% de las lesiones, con un 7% que son definitivamente establecidas como CG120.
Opinión de experto
El diagnóstico de DBG es problemático, ya que se ha descrito que las biopsias infraestadifican la displasia y, de hecho, muchas lesiones visibles con DBG en realidad ya son malignas121. En un metaanálisis que analizaba el cambio de estadificación de la DBG después de la resección endoscópica se describe una reclasificación a estadios más avanzados hasta en el 25% de las lesiones, siendo un 7% ya malignas120. La exploración detallada de las lesiones con endoscopia de magnificación y cromoendoscopia virtual como el Narrow Band Imaging permite identificar algunas características sugestivas de una peor histología122, pero esta técnica no está ampliamente disponible en nuestro medio. Por ello la reciente guía «Management of epithelial precancerous conditions and lesions in the stomach» (MAPSII) recomienda que todas las lesiones visibles (incluyendo las que tienen DBG) deben ser resecadas10.
23. ¿Cuál debe ser el seguimiento endoscópico tras la resección de una lesión con displasia?
Se sugiere vigilancia endoscópica anual durante 2años y posteriormente en función del riesgo basal tras la resección endoscópica de una DBG.
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 4,41.
Tras la resección de DAG o carcinoma in situ se sugiere vigilancia endoscópica semestral el primer año, anualmente durante tres años y posteriormente en función del riesgo basal.
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 4,42.
Evidencia
La prevalencia de displasia (en general) en las endoscopias de rutina oscila entre el 0,5 y el 3,75% en los países occidentales y entre el 9 y el 20% en las regiones con una alta incidencia de CG, como Colombia y China123. Existe evidencia que sugiere que los pacientes con DAG tienen un alto riesgo de progresión a cáncer110 y de neoplasia sincrónica124. Un estudio de cohortes reciente demostró que la DAG era un factor de riesgo independiente para CG (HR: 18,8; IC95%: 9,0-39,5). Así, la incidencia estandarizada de CG en el subgrupo de individuos sin displasia fue de 2,0 (IC95%: 1,5-2,6) y de 35,2 (IC95%: 15,2-69,4) en el subgrupo de DAG125. Sin embargo, el riesgo real de progresión de la secuencia displasia-cáncer no está bien definido debido a la dificultad de contar con estudios prospectivos, bien diseñados, con correcta toma de biopsias que evalúen la historia natural de la displasia. Así, la tasa de malignización de la DAG varía desde el 25 al 85% con un intervalo de tiempo entre 4 y 48meses, dependiendo del estudio126. Por ejemplo, un estudio holandés reportó que el 25% de los pacientes diagnosticados con DAG desarrollaron CG dentro del año siguiente100. Un factor importante en la variabilidad de la incidencia de CG secundaria a DAG gástrica es la alta tasa de discrepancia en el diagnóstico de DAG. Si bien la biopsia es el método estándar para el diagnóstico de DAG, existe un infradiagnóstico de lesiones malignas del 40 al 66% de los casos en comparación con el análisis tras su resección127–129.
Por otro lado, tras la RE curativa de una neoplasia gástrica pueden aparecer otras lesiones en las gastroscopias realizadas durante el seguimiento. Estas lesiones pueden ser de nueva aparición, lesiones no detectadas en gastroscopias previas o consecuencia de la evolución de una lesión previa no visible que ya estaba presente en fase preclínica. Dado que esta distinción suele ser difícil de realizar, se definen por consenso las nuevas lesiones (metacrónicas) como aquellas que aparecen a distancia de la neoplasia original y al menos un año después de la RE130. Las lesiones que aparecen durante el primer año se consideran, por tanto, neoplasias sincrónicas no detectadas durante la gastroscopia inicial. Los datos de incidencia global de CG metacrónico tras RE muestran una variabilidad amplia en la literatura, con cifras entre el 2,7 y el 15,6%130.
En un estudio retrospectivo que incluyó 947 pacientes se evaluó la incidencia de neoplasias gástricas tras la RE de CGP con una mediana de seguimiento de 2,3años131 La incidencia de CG fue de 14,4 casos por 1.000 personas-año tras la resección de DBG y de 18,4 casos por 1.000 personas-año tras la resección de DAG y/o CGP, sin diferencias estadísticamente significativas. Tampoco hubo diferencias en la incidencia acumulada de neoplasias gástricas y, únicamente, se identificó un incremento de riesgo en la detección de CG invasivo en el grupo de DBG. En otro estudio retrospectivo, publicado por Cho y cols.132 se incluyeron 2,779 pacientes con 2,981 lesiones (518 DAG y 2,463 CGP) con una mediana de seguimiento de 42 meses. La incidencia acumulada de lesiones metacrónicas a 5 y 10 años fue de 4,6 y 10,5%, respectivamente y su incidencia anual del 0,9%, sin diferencias estadísticamente significativas entre los pacientes con DAG y con CGP. Así, la incidencia anual de lesiones metacrónicas fue del 1,02% en el grupo DAG y de 0,88% en el grupo CGP. De nuevo, una de las limitaciones más relevantes de este estudio fue el elevado porcentaje de abandonos en el seguimiento durante el primer año. Otro estudio unicéntrico, retrospectivo, de origen coreano133 comunicó la incidencia de neoplasias metacrónicas en 641 pacientes sometidos a RE por lesiones gástricas displásicas (84% DBG y 16% DAG) tras una mediana de seguimiento de 29 meses. La incidencia anual de lesiones metacrónicas fue del 1,26% y la incidencia acumulada de neoplasias metacrónicas a los 5 años tras la RE de lesiones displásicas fue del 31%. En el análisis multivariante, el sexo masculino (OR 2,3, IC 95%: 1,3-4,2), la MI (OR 1,9, IC 95%: 1,2-3,0) y la DAG (OR 2,7, IC 95% 1,16-6,26) fueron factores de riesgo independientes para la aparición de lesiones metacrónicas. Finalmente, un estudio retrospectivo reciente, que incluyó 316 neoplasias gástricas resecadas endoscópicamente evaluó también el riesgo de aparición de lesiones metacrónicas en función de 3 grupos histológicos: DBG, DAG y CGP durante una mediana de seguimiento de 4,2 años.134 La incidencia de CG tras la RE fue de 15,2 casos por 1.000 personas-año en el grupo DBG, 18,5 casos por 1.000 personas-año en el grupo DAG y 20,9 casos por 1.000 personas-año en el grupo CGP. La incidencia de las neoplasias metacrónicas fue de 28,6, 45,7 y 39,7 casos por 1.000 personas-año en los grupos DBG, DAG y CGP, respectivamente, sin diferencias estadísticamente significativas entre los distintos grupos. En el análisis multivariante el único factor de riesgo independiente para la aparición de neoplasias o CG metacrónico fue el sexo masculino.
Opinión de experto
Los estudios disponibles tienen múltiples limitaciones en el diseño y en el seguimiento. Además, los datos proceden en exclusiva de población asiática, por lo que su extrapolación a un entorno occidental implica cierta probabilidad de sesgo. Sin embargo, los resultados de incidencia de neoplasias metacrónicas resultan consistentes en los diferentes estudios analizados. Así, de forma global, la aparición de nuevas lesiones tras la RE de lesiones con DAG/neoplasia intraepitelial es muy alta, con entre 10 y 20 casos por 1.000 personas-año. Ello permite recomendar un seguimiento estrecho, especialmente tras la resección de DAG o carcinoma in situ.
24. ¿Cuál debe ser el seguimiento endoscópico en la displasia sin lesión visible?
Ante el diagnóstico de displasia sin lesión visible tras una EDA de calidad con cromoendoscopia se sugiere seguimiento endoscópico entre 6 (DAG) y 12meses (DBG).
Calidad de la evidencia muy baja, grado de recomendación débil a favor.
Acuerdo 4,46.
Evidencia
En el año 2011, Simone et al.135 llevaron a cabo un estudio prospectivo en el que tres endoscopistas expertos reevaluaron a 20 pacientes con diagnóstico de displasia no visible. Las exploraciones se realizaron con endoscopios de alta definición, lavado con mucolítico y CE virtual o convencional. Se identificaron un total de 18 lesiones visibles: 13 displasias de alto grado y 5 carcinomas. En el año 2016, Yep-Gamarra et al.136 realizaron un estudio prospectivo en nuestro medio incluyendo a 50 pacientes con diagnóstico histológico de una lesión premaligna en los 6meses previos. Los autores realizaron una gastroscopia protocolizada con cromoendoscopia con índigo carmín y ácido acético, lo que se tradujo en un mayor porcentaje de pacientes con diagnóstico de displasia y lesión visible.
Opinión de experto
La detección de displasia en biopsias aleatorias no es infrecuente. Como se detalla en este documento, existen numerosos factores que pueden contribuir a la no detección de una lesión en una gastroscopia convencional. Aunque la evidencia que sustenta esta recomendación procede de estudios observacionales, consideramos que una gastroscopia de calidad enfocada a la detección de lesiones displásicas es el paso fundamental ante una displasia no visible, ya que permite identificar lesiones resecables en un porcentaje significativo de pacientes.
No se han encontrado estudios que evalúen el intervalo óptimo de seguimiento en pacientes con displasia no visible tras una gastroscopia de calidad. Teniendo en cuenta que la presencia de displasia es un factor para el desarrollo de carcinoma gástrico137 y la posibilidad de no haber detectado una lesión existente, consideramos conveniente una reevaluación endoscópica de alta calidad en un término máximo de 6 a 12meses dependiendo de si se trata de una DAG o de una DBG10.
FinanciaciónEste documento de posicionamiento no ha contado con financiación externa. Joaquín Cubiella ha recibido una financiación del Instituto de Salud CarlosIII a través del proyecto PI17/00837 (cofinanciado por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa» / «Invirtiendo en tu futuro».
Conflicto de interesesXavier Calvet ha recibido becas para investigación de Abott, MSD y Vifor; honorarios por reuniones de asesoramiento de Abott, MSD, Takeda, Pfizer, Janssen y VIFOR, y ha dado conferencias para Abbott, MSD, Janssen, Pfizer, Takeda y Allergan.
El resto de autores no declaran conflictos de intereses.