La infección por el coronavirus SARS-COV-2 produce síntomas especialmente a nivel respiratorio. No obstante, también es conocida su capacidad de afectación sistémica. En este sentido, se han descrito alteraciones en las enzimas hepáticas en más de la mitad de los pacientes hospitalizados1.
Desde el inicio de la pandemia, son varios los casos reportados de pacientes que desarrollan una colangitis esclerosante secundaria o colangiopatía post-COVID-19. Se trata de una nueva entidad que parece ser causada por factores ya descritos en la colangitis esclerosante secundaria del paciente críticamente enfermo (CES-PCE), pero en la que además se añade el potencial daño directo producido por el SARS-COV-2 a nivel del epitelio biliar. Se sabe que el virus puede entrar en las células a través del receptor de la enzima conversora de angiotensina 2 (ECA2), un receptor expresado en diferentes células del cuerpo humano, incluyendo los colangiocitos, por lo que es posible que exista una interacción directa entre SARS-COV-2 y el epitelio biliar2.
El objetivo del presente estudio es evaluar el desarrollo de colangiopatía y posterior colangitis esclerosante en pacientes que requirieron ingreso en la Unidad de Cuidados Intensivos (UCI) por infección por coronavirus SARS-COV-2 en un área sanitaria.
Material y métodosEn este estudio retrospectivo observacional se incluyó a todos los pacientes que ingresaron en la UCI de un área sanitaria de la Comunidad de Madrid, entre marzo del 2020 y septiembre del 2021, con sintomatología relacionada con infección por SARS-COV-2 y con PCR positiva para el mismo. Los pacientes con alteración persistente del perfil hepático de predominio colestásico (entendiéndose como un aumento de FA > 1,5 o GGT> 3 el límite superior de la normalidad, tras la salida de la UCI) fueron tratados mediante estudio de hepatopatía, que incluyó en todos los casos serologías de virus hepatotropos, inmunidad hepatoespecífica, inmunoglobulinas, Doppler hepático y colangiografía por resonancia magnética nuclear.
ResultadosDurante el periodo de estudio se incluyó a 334 pacientes con ingreso en UCI. De ellos, se identificaron 6 casos de colangiopatía post-COVID (1,8%), ninguno de los cuales presentaban antecedentes de hepatopatía previa. En la tabla 1 se describen las características de estos pacientes.
Características de los pacientes
| Características | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 |
|---|---|---|---|---|---|---|
| Edad, años | 63 | 66 | 60 | 65 | 44 | 68 |
| Sexo | Varón | Mujer | Varón | Varón | Mujer | Varón |
| IMC | 23,9 | 33,9 | 28,4 | 25 | 40,8 | 22,4 |
| Comorbilidades | ||||||
| Fumador | No | No | Exfumador | Exfumador | No | Exfumador |
| Consumo OHa | No | No | Sí | No | No | No |
| HTA | No | Sí | No | Sí | No | No |
| Diabetes mellitus | No | Sí | No | No | No | Sí |
| Dislipidemia | No | No | Sí | Sí | No | Sí |
| Hepatopatía | No | No | No | No | No | No |
| Días de ingreso total | 98 | 37 | 61 | 81 | 77 | 79 |
| Ingreso en la UCI | ||||||
| Días de ingreso | 60 | 19 | 24 | 46 | 33 | 31 |
| APACHE II | 11 | 10 | 5 | 20 | 5 | 16 |
| VMI | Sí | Sí | Sí | Sí | Sí | Sí |
| PEEP máxima | 13 | 16 | 15 | n.a. | n.a. | n.a. |
| N.° pronos | 6 | 2 | 6 | 8 | 4 | 4 |
| NPT | No | No | No | No | No | No |
| Vasopresores | NAe y DAf | NA y DA | NA | NA | NA | NA |
| Tratamiento | ||||||
| Hidroxicloroquina | Sí | No | No | No | No | No |
| Corticoides | Sí | Sí | Sí | Sí | Sí | Sí |
| Tocilizumab | Sí | Sí | Sí | Sí | Sí | Sí |
| Baricitinib | Sí | No | No | No | No | No |
| Anakinra | No | No | No | No | No | No |
| Remdesivir | No | No | No | No | No | No |
| Enoxaparina | Sí, anticoagulante | Sí, profiláctica | Sí, anticoagulante | Sí, anticoagulante | Sí, profiláctica | Sí, anticoagulante |
| Antibióticos | Sí | Sí | Sí | Sí | Sí | Sí |
| Antifúngicos | Sí | No | No | Sí | Sí | Sí |
| Otros antivirales | No | No | No | Sí | No | No |
| Otras complicaciones | ||||||
| SDRA | Sí | Sí | Sí | Sí | Sí | Sí |
| TEP | Sí | No | Sí | No | No | Sí |
| Fallo renal agudo | Sí | No | No | No | No | No |
| Datos analíticos | ||||||
| Día 1 de ingreso | ||||||
| FA (U/l) | 55 | 80 | 80 | 65 | 78 | 50 |
| GGT (U/l) | 27 | 15 | 143 | 65 | 83 | 26 |
| AST (U/l) | 29 | 20 | 48 | 82 | 85 | 29 |
| ALT (U/l) | 17 | 17 | 32 | 57 | 52 | 13 |
| Bi, total (mg/dl) | 0,42 | 0,43 | 0,89 | 0,86 | 0,48 | 0,73 |
| Colesterol (mg/dl) | 162 | 141 | 126 | 122 | 213 | 117 |
| Dímero D | 2419 | 200 | 463 | 397 | 999 | 945 |
| Albúminab (g/dl) | 4.2 | 4,2 | 3.8 | 3.8 | 3.2 | 3 |
| Plaquetasb | 154.000 | 138.000 | 126.000 | 59.000 | 363.000 | 147.000 |
| INR | 1,04 | 1,28 | 1,15 | 1,74 | 1,09 | 1,06 |
| Valor máximo (días desde inicioc) | ||||||
| FA (U/l) | 1.310 (81) | 1.097 (163) | 248 (60) | 1.237 (71) | 312 (74) | 1.650 (58) |
| GGT (U/l) | 2.594 (68) | 2.172 (30) | 1.130 (60) | 3.550 (71) | 851 (74) | 2.323 (30) |
| AST (U/l) | 1.520 (55) | 1.048 (26) | 60 (60) | 250 (61) | 148 (73) | 500 (58) |
| ALT (U/l) | 1.000 (55) | 1.966 (30) | 125 (60) | 265 (67) | 458 (59) | 337 (71) |
| Bi. total (mg/dl) | 6,21 (329) | 2,82 (172) | 1,45 (293) | 3,24 (247) | 0,77 (73) | 15,03 (150) |
| Colesterol (mg/dl) | 875 (329) | 296 (30) | 217 (124) | 252 (87) | 231 (24) | 1.240 (91) |
| Dímero D | 7.418 (22) | 1.068 (24) | 58.325 (10) | 7.059 (30) | 3.807 (16) | 1,470 (14) |
| Albúminab (g/dl) | 2,5 (68) | 2,7 (162) | 2,7 (11) | 2,2 (386) | 2.9 (16) | 2,1 (82) |
| Plaquetasb | 37.000 (41) | 76.000 (416) | 94.000 (30) | 90.000 (44) | 200.000 (30) | 145.000 (31) |
| INR | 1,56 (23) | 2,08 (157) | 1,27 (40) | 1,34 (46) | 1,4 (35) | 1,56 (258) |
| Últimos datos (días desde inicioc) | ||||||
| FA (U/l) | 941 (452) | 541 (416) | 81 (293) | 787 (394) | 135 (298) | 544 (158) |
| GGT (U/l) | 1.129 (452) | 571 (416) | 69 (293) | 627 (394) | 103 (298) | 538 (158) |
| AST (U/l) | 217 (452) | 106 (416) | 11 (293) | 148 (394) | 33 (298) | 157 (158) |
| ALT (U/l) | 181 (452) | 82 (416) | 16 (293) | 75 (394) | 27 (298) | 136 (158) |
| Bi total (mg/dl) | 5,63 (452) | 2,12 (416) | 1.45 (293) | 1,54 (394) | 0,6 (298) | 13.05 (158) |
| Colesterol (mg/dl) | 649 (452) | 196 (416) | 180 (293) | 137 (394) | 170 (298) | 616 (154) |
| Dímero D | 551 (452) | 200 (282) | 378 (158) | 917 (69) | 383 (89) | 1.218 (37) |
| Albúmina (g/dl) | 3,6 (452) | 3,1 (416) | 4,5 (293) | 2,7 (394) | 4,3 (298) | 2,8 (158) |
| Plaquetas | 261.000 (452) | 76.000 (416) | 123.000 (293) | 95.000 (394) | 301.000 (298) | 235.000 (158) |
| INR | 1,36 (452) | 1,43 (416) | 0,95 (293) | 1,06 (394) | 1,07 (147) | 1,14 (158) |
| Días desde inicio síntomas-inicio de colestasisd | 47 | 22 | 7 | 30 | 9 | 7 |
| AUDC | Sí | Sí | Sí | Sí | Sí | Sí |
| Colangio-RM | ||||||
| Vía extrahepática | No afectada | No afectada | No afectada | No afectada | No afectada | No afectada |
| Vía intrahepática | Afectada | Afectada | Afectada | Afectada | Afectada | Afectada |
| Datos de HPT | Sí | Sí | No | Sí | No | No |
| Días desde inicio de síntomas | 428 | 421 | 281 | |||
| Tombocitopenia | No | Sí | Sí | |||
| Hipoalbuminemia | No | Sí | Sí | |||
| Esplenomegalia | No | Sí | Sí | |||
| Porta> 13 mm | Sí | Sí | Sí | |||
| Varices | Sí | –e | –e | |||
| Gastropatía HTP | Sí | –e | –e | |||
| Descompensación | No | No | Sí, ascitis | |||
| Complicaciones tras el diagnóstico | ||||||
| Fallecimiento | No | No | No | No | No | No |
| Prurito | No | No | No | No | No | Sí |
| Colangitis | No | No | No | No | No | Sí |
| Valoración TH | Sí | No | No | No | No | No |
| Otros | No | No | No | No | Colecistectomía | No |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; AUDC: ácido ursodesoxicólico; DA: dopamina; FA: fosfatasa alcalina; GGT: gamma-glutamil transferasa; HPT: hipertensión portal; HTA: hipertensión arterial; IMC: índice de masa corporal; INR: índice internacional normalizado; n.a: no aplicable; NA: noradrenalina; NPT: nutrición parenteral; PEEP: presión positiva al final de la espiración; RM: resonancia magnética; SDRA: síndrome distrés respiratorio agudo; TEP: tromboembolia pulmonar; TH: trasplante hepático; VMI: ventilación mecánica invasiva.
Se diagnosticaron 4 varones y 2 mujeres con una media de edad de 61±8,8 años. El 66% con un índice de masa corporal> 25, ninguno fumador activo y 5 sin consumo abusivo de alcohol (> 4 unidades de bebida estándar al día [> 2 en mujeres]).
El 100% desarrolló síndrome de distrés respiratorio agudo precisando ventilación mecánica invasiva, fármacos vasoactivos (noradrenalina, dopamina), enoxaparina y ciclos de pronosupinación (rango 2-8). Tuvieron una estancia media en UCI de 35,5 días. Al menos el 50% precisó de una elevada presión positiva al final de la espiración (PEEP> 10).
En todos los casos se objetivaron alteraciones de la vía biliar intrahepática en la colangiografía por resonancia magnética. Se describieron en todos ellos múltiples estenosis cortas y pequeñas dilataciones saculares sin imágenes sugestivas de litiasis. No se observaron alteraciones de la vía biliar extrahepática.
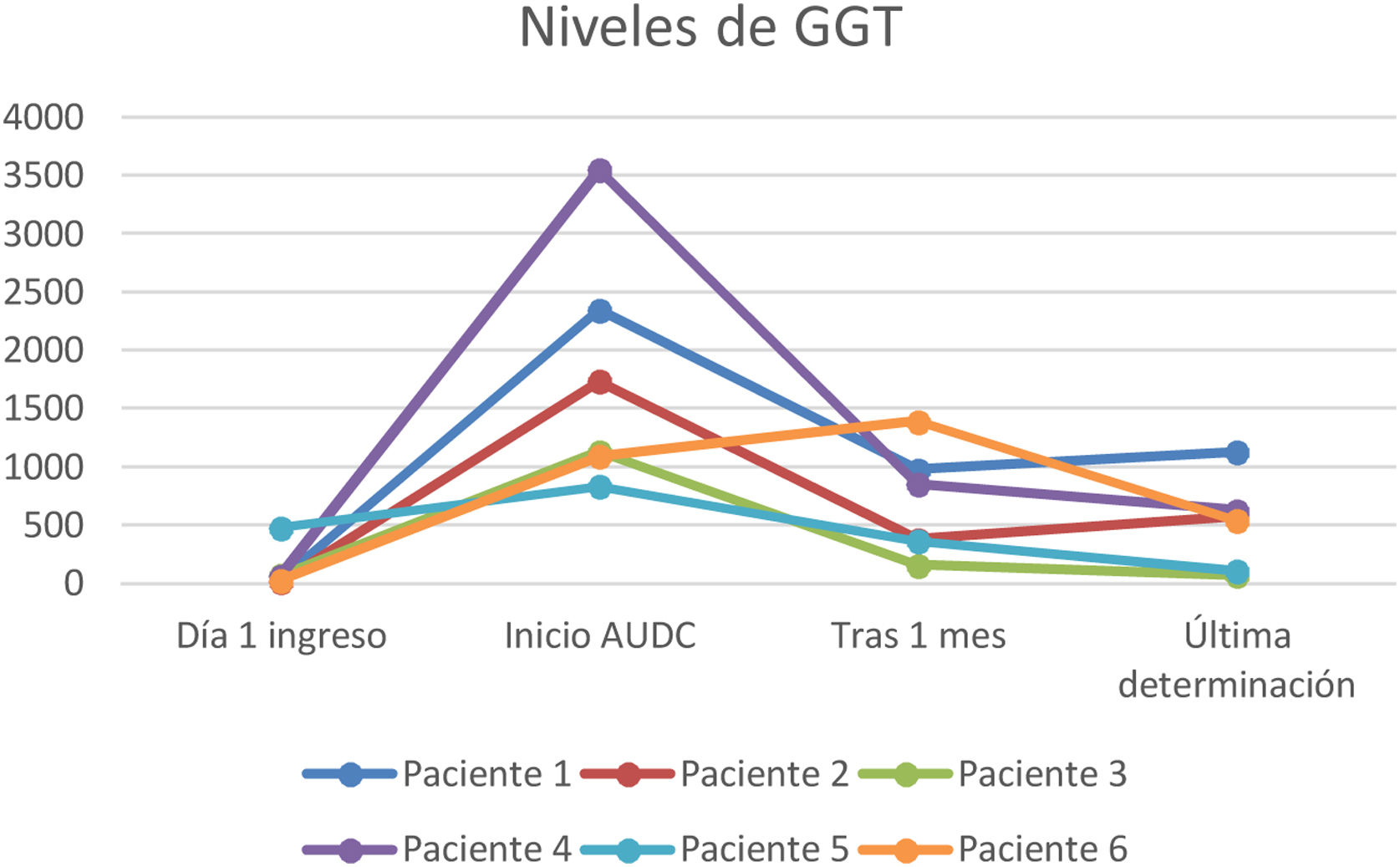
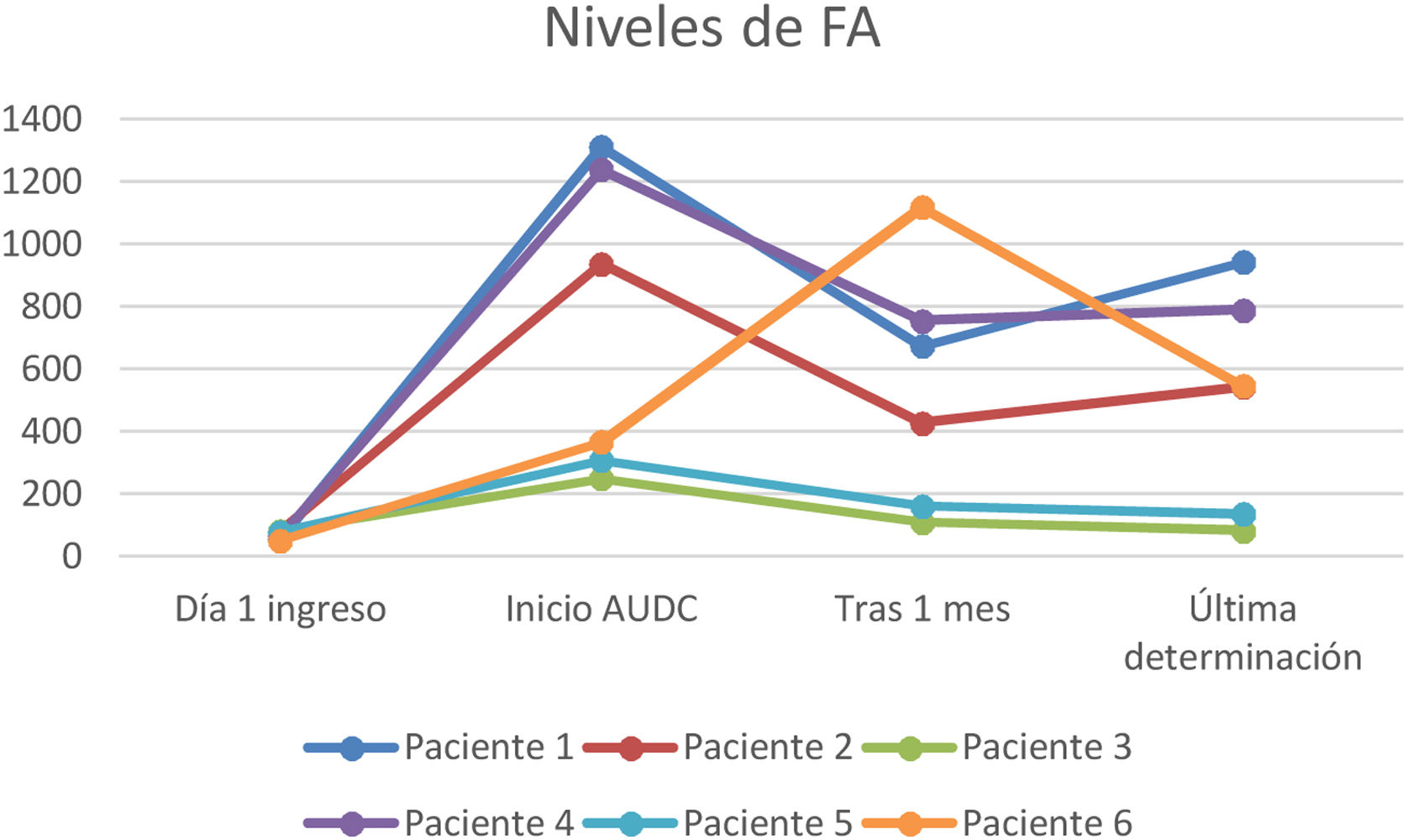
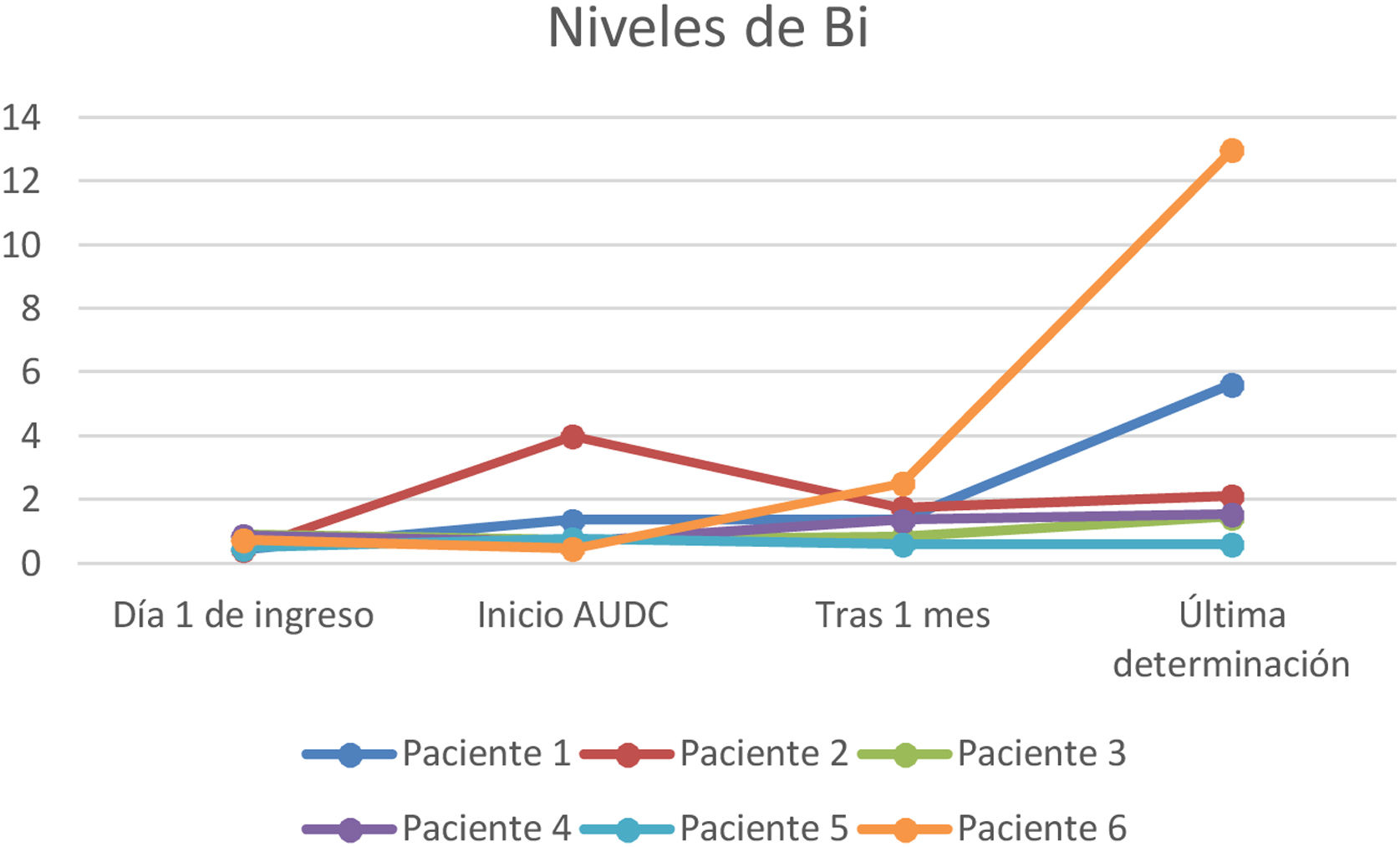
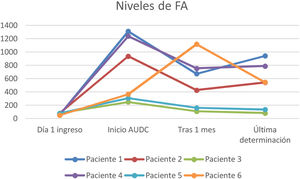
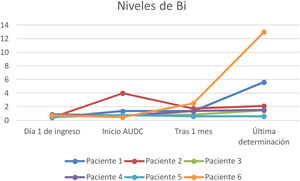
A todos los pacientes se les pautó ácido ursodesoxicólico a dosis de 10-15mg/kg, observándose en todos los casos un descenso de las enzimas de colestasis (GGT y FA) pero sin evidenciar un descenso paralelo de los valores de bilirrubina (figs. 1-3).
Tras un periodo de seguimiento con una mediana de 282 días (rango 89-452), ningún paciente ha normalizado completamente el perfil hepático y 3han desarrollado datos de hipertensión portal. En la paciente 2 se realizó durante su seguimiento una medición de la rigidez hepática con FibroScan® (402, echosens) obteniendo 38 KPa (F4). No se ha realizado biopsia hepática en ninguno de los pacientes de la muestra.
Todos los casos desarrollaron hipercolesterolemia durante el ingreso, incluso en pacientes no dislipidémicos previamente. En el caso de los pacientes 1 y 6, fue preciso el inicio de tratamiento con alirocumab, un anticuerpo monoclonal que se une a la proteína PCSK9, por resistencia a otros hipolipidemiantes, siendo estos además los casos que han presentado mayor deterioro de su función hepática, manteniendo un valor de bilirrubina> 5mg/dl en el último seguimiento.
Tras el alta, 3pacientes han precisado un nuevo ingreso. El paciente 4 desarrolló un empiema pleural y, en este contexto, se diagnosticó su primera descompensación en forma de ascitis. La paciente 5 consultó por dolor en el hipocondrio derecho de repetición, por lo que fue colecistectomizada bajo la sospecha de cólicos biliares. El paciente 6 ingresó por un primer episodio de colangitis aguda sin coledocolitiasis, precisando tratamiento con antibioterapia. Ningún paciente ha fallecido durante el seguimiento. A día de hoy uno de los pacientes está en proceso de ser evaluado para trasplante hepático en un hospital terciario.
DiscusiónLa colangitis esclerosante secundaria engloba un grupo de enfermedades colestásicas crónicas que afectan a la vía biliar intra o extrahepática con riesgo de evolucionar a cirrosis. En el caso de la CES-PCE, el desarrollo de fibrosis avanzada parece ser especialmente rápido frente a otras etiologías3, objetivando en nuestra muestra una evolución a hipertensión portal en el 50% de los pacientes en un rango de 281-428 días tras el inicio de la sintomatología por COVID-19.
Se trata de una entidad rara, poco descrita en la literatura, con una prevalencia estimada del 0,05% de los pacientes que ingresan en la UCI4. En nuestra muestra, la colangiopatía post-COVID acumula una incidencia del 1,8%. En otras series de casos de colangiopatía post-COVID-19, se calculan incidencias del 0,595, el 2,61 y el 12%6, lo que, junto a nuestro reporte, hace pensar que pueda existir un factor etiológico añadido a los factores ya conocidos en el desarrollo de la colangitis esclerosante del paciente críticamente enfermo. En este sentido, es probable que se sume el daño directo del SARS-COV-2 sobre los colangiocitos al interaccionar con receptores como ECA2, el desarrollo de microtrombos a nivel de la vascularización del árbol biliar con relación al estado de hipercoagulabilidad producido durante la infección por COVID-19 y la magnitud de la cascada inflamatoria que se genera en estos pacientes5.
Sin embargo, hay que tener en cuenta que todos los pacientes requirieron el uso fármacos vasoactivos y ventilación mecánica con PEEP elevada, factores que pueden favorecer el desarrollo de colangiopatía isquémica7, y recibieron fármacos potencialmente hepatotóxicos.
En nuestra muestra se inició tratamiento con ácido ursodesoxicólico en todos los pacientes, objetivando durante el seguimiento una mejoría de los valores de GGT y en menor medida de FA. Sin embargo, no se ha objetivado un descenso paralelo de los valores de bilirrubina. Son precisos mayores estudios en este sentido, ya que la evidencia del beneficio de este fármaco en los pacientes con CES-PCE no está del todo aclarada y nuestros resultados podrían verse interferidos por la propia evolución de esta entidad que a día de hoy sigue siendo incierta por su reciente descripción.
En cualquier caso, parecen necesarios nuevos estudios prospectivos para conocer la fisiopatología, la prevención y el tratamiento de esta nueva entidad que supone un potencial riesgo de daño hepático progresivo.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNo existen conflictos de intereses para ninguno de los autores del presente manuscrito.
Al Dr. Santos Arrontes, por su ayuda en la revisión del presente manuscrito.