INTRODUCCIÓN
La enfermedad celíaca (EC) o enteropatía sensible al gluten se origina por una intolerancia permanente al gluten, un componente proteico de cereales habituales en la dieta occidental (trigo, centeno, cebada). La ingestión de estos cereales desencadena en personas genéticamente predispuestas una activación de los linfocitos T CD4+ de la lámina propia intestinal1. Esta estimulación inmunológica anormal produce, en último término, una enteropatía característica, con atrofia vellositaria e hiperplasia de las criptas2. Es la única enfermedad autoinmunitaria en que se conoce de forma precisa el antígeno exógeno desencadenante3.
Su prevalencia parece ser más elevada de lo que se suponía hasta hace unos años. Estudios recientes muestran una afectación de 1/200 en países de nuestro entorno4-7. En nuestra comunidad, la prevalencia en adultos estimada a partir de una muestra de donantes de sangre asintomáticos fue del 0,6% (intervalo de confianza del 95%, 0,015-3,3%)8. En escolares finlandeses (7-16 años) se han encontrado prevalencias de 1/999.
La determinación de anticuerpos antiendomisio (AEA) de clase IgA por inmunofluorescencia indirecta (IFI) se ha considerado el método de referencia en la serología utilizada para el cribado diagnóstico de la EC10. La identificación de la enzima transglutaminasa tisular (TGt) como el autoantígeno principal de los AEA ha despertado gran interés, al ser posible su detección por la técnica de enzimoinmunoanálisis (ELISA)11,12, que es cuantitativa, estandarizable, más económica y más ecológica que la inmunofluorescencia indirecta. La eficacia de los anticuerpos antitransglutaminasa (ATG) de tipo IgA se ha demostrado en varios estudios, donde alcanza una sensibilidad entre el 85 y el 100% y una especificidad entre el 76 y el 100%13,14.
Las formas clínicas de presentación pueden variar ampliamente, y se dignostican cada vez con mayor frecuencia formas oligosintomáticas y pacientes asintomáticos con enfermedad latente o potencial15,16. Probablemente, en estos casos con escasa expresividad clínica, sea donde tengan aún mayor importancia las nuevas pruebas serológicas de diagnóstico.
El objetivo de este estudio fue analizar la utilidad de los ATG recombinante humana de tipo IgA, utilizados de forma rutinaria en el diagnóstico, frente a los habituales antiendomisio IgA y antigliadina (IgG e IgA).
MATERIAL Y MÉTODO
Pacientes
Se seleccionó a todos los pacientes a los que se realizó una biopsia duodenal por sospecha de EC durante los años 2000, 2001 y 2002. Se incluyeron muestras duodenales tomadas en adultos y en niños. Se excluyeron las biopsias duodenales tomadas por otro motivo (sospecha de tumor, proceso inflamatorio) y los casos de atrofia vellositaria sin relación con la EC como gastroenteritis o enfermedad de Crohn.
En los pacientes adultos se revisó el motivo que llevó al diagnóstico y el tiempo de evolución de la clínica antes de éste.
Anticuerpos
Para la determinación de anticuerpos antigliadina se usó la técnica de fluoroenzimoinmunoanálisis (Pharmacia Diagnostics, USA). Los valores normales para nuestro laboratorio son de 0 a 3,5 mg/l para la antigliadina IgA (AGA) y para la antigliadina IgG (AGG) de 0-20 mg IgG/l (> 3 años) y 0- 30 mg IgG/l (< 3 años).
Los AEA se detectaron por inmunofluorescencia indirecta usando tejido de esófago de mono como antígeno (Atom Biosystems, Barcelona). Se consideraron títulos positivos a partir de una dilución 1/5.
Los ATG de tipo IgA se determinaron por enzimoinmunoanálisis (ELISA) (Celikey, Pharmacia Diagnostics, Uppsala, Sweden) y se usó TGt recombinante humano como antígeno. El valor de corte para normalidad se estimó en 3 U/ml, y se basó en el análisis previo de 923 muestras remitidas para estudio al laboratorio de inmunología8.
Biopsia intestinal
La biopsia intestinal en adultos se obtuvo mediante endoscopia con 2 biopsias obtenidas de la segunda y la tercera porciones del duodeno. Se utilizó en todos los casos videoendoscopio de calibre y longitud habituales para la realización de endoscopia digestiva alta.
En los niños, la mucosa duodenal se biopsió mediante la cápsula de Watson-Crosby por el servicio de pediatría.
Los resultados de la biopsia se clasificaron según la clasificación de Marsh modificada en los siguientes grados17: 0 = mucosa normal; 1= infiltrativa; 2a = hiperplasia sin atrofia; 2b = hiperplasia con atrofia parcial; 3 = atrofia total con hiperplasia, y 4 = atrofia total con hipoplasia.
En los pacientes adultos se evaluaron la clínica y el tiempo de evolución hasta el diagnóstico.
Análisis estadístico
La variables cualitativas se describen mediante número absoluto y porcentajes, y las cuantitativas en términos de media y desviación estándar.
La sensibilidad, la especificidad y el valor predictivo positivo y negativo de las 4 pruebas serológicas se compararon y se tomó como patrón la biopsia duodenal.
RESULTADOS
Se evaluó a 220 pacientes sometidos a biopsia duodenal. Se excluyó a 84 porque no disponían de analítica para cribado de EC, solamente tenían realizada una biopsia duodenal directamente desde la unidad de endoscopia; todos ellos eran pacientes adultos y en el estudio anatomopatológico no se observaban alteraciones. Otros 14 casos se excluyeron porque la atrofia vellositaria se atribuyó a otros motivos distintos de la EC: proceso infeccioso gastrointestinal y toma de antibióticos con diarrea secundaria en 5 y 4 pacientes, respectivamente, en todos ellos con recuperación clínica y morfológica posteriormente, y 5 pacientes con enfermedad de Crohn.
Finalmente se incluyó para el análisis a 122 pacientes con biopsia y serología. Treinta y seis eran niños (< 14 años) y los 86 restantes eran pacientes adultos. Cumplieron criterios diagnósticos de EC 41 personas, de las que 15 fueron adultos y 26 niños. El grupo control lo constituyeron las 81 restantes (71 adultos y 10 niños) que no tenían alteraciones en la biopsia y la serología fue negativa. La edad media de diagnóstico en los pacientes pediátricos fue de 4,8 ± 3,9 años y en los adultos de 39,4 ± 18,4 años.
Las biopsia duodenal mostró diferentes grados de atrofia vellositaria al diagnóstico según la clasificación de Marsh (tabla I). En los niños se observó un predominio de atrofia vellositaria total (estadios 3 y 4 de la clasificación de Marsh) en 19 de las 26 (73%) biopsias, mientras que solamente 5 de los 15 (33%) adultos mostraban una atrofia total (p = 0,03).
En la mayoría de los pacientes adultos las formas de presentación que llevaron al diagnóstico fueron las oligosintomáticas. Solamente 2/15 (13%) presentaban un claro síndrome de malabsorción en el momento del diagnóstico (tabla II).
El tiempo transcurrido desde el inicio de los síntomas hasta el diagnóstico de la enfermedad en los pacientes adultos fue de 6-120 meses, y en 12 (80%) de los 15 casos habían transcurrido más de 2 años.
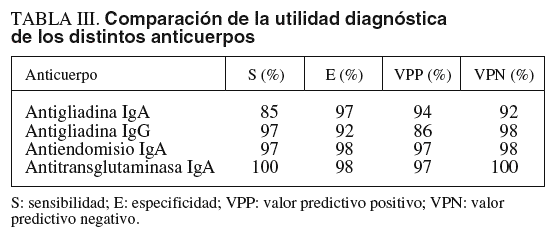
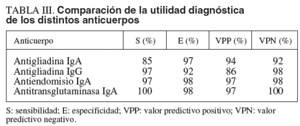
En la tabla III se muestra la comparación de los distintos marcadores serológicos: la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo. Es importante destacar que entre los ATG no hubo ningún falso negativo (sensibilidad del 100%), a diferencia de los AEA y AGA que fueron negativos en 1 caso de enfermedad.
DISCUSIÓN
El presente estudio tiene un carácter retrospectivo con todas las limitaciones que ello conlleva. Sin embargo, para responder al objetivo de evaluar una técnica diagnóstica es un diseño perfectamente útil.
La sintomatología de la enfermedad en los niños se inicia con la introducción de cereales en la dieta. En las edades más tempranas se suele observar retraso en el crecimiento, diarrea, vómitos, distensión y dolor abdominal. Sin embargo, en niños mayores se puede presentar con anemia, talla corta, trastornos del comportamiento y, en general, sintomatología menos típica14. En el presente estudio no se analizó la clínica presente en los niños, solamente la de los diagnosticados en la edad adulta. Al momento del diagnóstico la mayoría de los adultos presentaba síntomas inespecíficos como anemia ferropénica, diarrea, dispepsia o hipertransaminasemia, sin manifestar el cuadro de malabsorción clásica.
En la biopsia duodenal la mayoría de los adultos presentaba atrofia parcial, hecho que se correlaciona bien con la clínica paucisintomática en el momento del diagnóstico, sin llegar a desarrollar el cuadro de malabsorción florido ni una atrofia vellositaria total. Entre los adultos en los que se estableció un diagnóstico de EC, hay un grupo que se diagnosticó en el contexto de un cribado realizado en formas oligosintomáticas en nuestro hospital (hipertransaminasemia y dispepsia funcional)8. La diarrea y la presencia de anemia son síntomas muy frecuentes, tanto de sospecha de la enfermedad como de clínica del paciente en el momento del diagnóstico18. En el adulto, cuando la anemia es de origen ferropénico, hoy día está establecido que es necesario descartar la presencia de EC basándose en la elevada prevalencia de diagnósticos con esta única manifestación16,19. También la presencia aislada de hipertransaminasemia de origen no filiado se ha asociado de forma significativa con EC oculta8,20-22.
Aunque no era un objetivo del estudio, se observó de forma significativa una atrofia vellositaria más severa en las formas presentes en la infancia. Esta diferencia podría atribuirse a la técnica de obtención de biopsia: yeyunal en niños y duodenal en adultos con endoscopia. Sin embargo, la correlación morfológica entre estas formas de obtención de muestras es elevada, sin apreciarse diferencias anatomopatológicas significativas23. Lo más probable es que la clínica menos marcada en adultos pueda relacionarse con una menor lesión anatomopatológica frente a niños, pero sería necesario hacer un estudio comparativo dirigido a evaluar estas diferencias.
Destaca la larga evolución clínica presente en el momento del diagnóstico de los pacientes adultos. La explicación podría estar en el elevado número de formas oligosintomáticas que hacen sospechar menos la EC que cuando se presenta de forma típica con malabsorción y desnutrición24,25. El tiempo de evolución de la enfermedad es importante a la hora de establecer un pronóstico, puesto que cuanto más tiempo de clínica sin hacer dieta libre de gluten, mayor es la posibilidad de desarrollar complicaciones neoplásicas y disminuir la supervivencia26.
Durante muchos años, la determinación de anticuerpos séricos AEA por inmunofluorescencia indirecta se ha considerado como la prueba de referencia para el diagnóstico de EC por su elevada sensibilidad y especificidad, y aún hoy lo es en la mayoría de los laboratorios. Tiene el inconveniente de ser laboriosa, semicuantitativa y subjetiva. La identificación y posterior detección de la enzima TGt como el antígeno que reconocen los AEA, mediante una técnica de enzimoinmunoanálisis (más objetiva, cuantitativa, barata y ecológica que la inmunofluorescencia) ha despertado gran interés como prueba de cribado12,13.
En nuestro hospital el algoritmo para el diagnóstico serológico de EC incluía, hasta hace poco, la determinación simultánea de los anticuerpos AGA y AGG junto con los AEA. Ante la evidencia de que los anticuerpos ATGA presentaban una rentabilidad en el diagnóstico al menos similar a la de los AEA; se planteó el presente estudio con la intención de valorar la posibilidad de sustituir estos últimos.
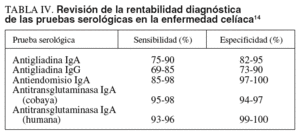
En la tabla IV se observan la sensibilidad y la especificidad descritas por otros autores para los diferentes anticuerpos14. Los AEA y ATGA son los que presentan una mayor sensibilidad y especificidad, principalmente los ATGA con antígeno recombinante humano, a diferencia de los basados en antígeno de cobaya que se han mostrado menos específicos27. Los resultados descritos en nuestro estudio son similares a los que se encuentran en la
bibliografía médica, con una sensibilidad y una especificidad similares entre ATG y AEA. No obstante, en uno de los casos de EC confirmada los ATG fueron positivos y los AEA negativos. Series más amplias a la aquí descrita apuntan una ligera superioridad en la sensibilidad de los ATG frente a los AEA27,28. Recientemente se ha demostrado también la utilidad de los ATG en la detección de pacientes con EC silente9. Los datos aquí presentados confirman la opinión de varios autores que proponen el uso de ATG como prueba de cribado capaz de sustituir a los AEA en el diagnóstico de la EC.