Determinar la comorbilidad y las potenciales interacciones-farmacológicas (IFs) entre los antivirales de acción-directa pangenotípicos (AADp) y la medicación-concomitante asociada a los pacientes con hepatitis C crónica (HCC) en práctica clínica habitual en España.
MétodosDiseño observacional retrospectivo. Se incluyeron pacientes ≥18 años con diagnóstico de HCC, en tratamiento antiviral y visitados durante el año 2017. Se diferenciaron 2 grupos en función de la edad (<50 y ≥50 años). Las variables recogidas fueron: edad, género, comorbilidad general/específica, medicación-concomitante y potenciales IFs (www.hep-druginteractions.org). Los AADp analizados fueron: a) sofosbuvir/velpatasvir (SOF/VEL); b) glecaprevir/pibrentasvir; y c) sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX). Análisis-estadístico bivariante: p<0,05.
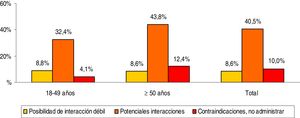
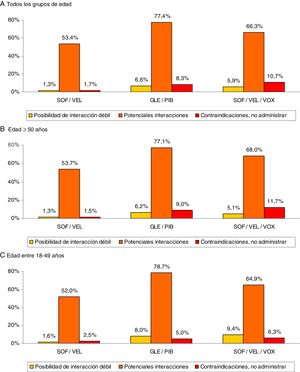
ResultadosSe reclutaron 3.430 pacientes, edad-media de 56,9 años y el 60,3% varones. El promedio del índice Charlson fue 0,8 puntos. Distribución por rangos de edad: 18-49 (28,9%) y ≥50 años (71,1%). El promedio de medicamentos fue: 3,1 (DE: 2,6) por paciente. El porcentaje total de potenciales IFs fue: 8,6% débil, 40,5% clínicamente significativas y 10,0% medicación contraindicada. Estas interacciones fueron mayores en los pacientes ≥50 años (8,6%; 43,8% y 12,4%, respectivamente, p<0,001). Para todas las edades SOF/VEL en comparación con glecaprevir/pibrentasvir y SOF/VEL/VOX presentó un menor porcentaje de interacciones-débiles (1,3% vs. 6,6% y 5,9%, p<0,001); interacciones clínicamente-significativas (53,4%, vs. 77,4% y 66,3%, p<0,001) y medicación-contraindicada (1,7% vs. 8,3% y 10,7%, p<0,001).
ConclusionesLos sujetos con HCC presentan una elevada comorbilidad y consumo de medicación concomitante, especialmente en pacientes mayores, circunstancia que repercute en una mayor exposición a potenciales IFs. Aunque la tasa de IFs fue considerable con las 3 combinaciones analizadas, SOF/VEL mostró una menor proporción clínicamente relevante.
To determine the comorbidity and potential for drug-drug interactions (DDIs) among pangenotypic direct-acting-antivirals (pDAAs) and the concomitant medications associated with chronic hepatitis C (CHC) patients in routine clinical practice in Spain.
MethodsRetrospective observational study. Included patients were ≥18 years, diagnosed with CHC, on antiviral treatment and required medical attention during 2017. Two groups were differentiated according to age ranges (<50 and ≥50 years). The variables collected were: age, gender, general/specific comorbidity, concomitant medication and potential DDIs (www.hep-druginteractions.org). The pDAAs analysed were: a) Sofosbuvir/Velpatasvir (SOF/VEL), b) Glecaprevir/Pibrentasvir (GLE/PIB) and c) Sofosbuvir/Velpatasvir/Voxilaprevir (SOF/VEL/VOX). Bivariate statistical analysis, P<.05.
Results3,430 patients with a mean age of 56.9 years and 60.3% males were enrolled. The average Charlson index was 0.8. Age range distribution: 18–49 years (28.9%) and ≥50 years (71.1%). The average number of medications per patient/year was 3.1 (SD 2.6). The total percentage of potential DDIs was: 8.6% minor DDIs, 40.5% clinically significant DDIs and 10.0% contraindicated medication. These DDIs were greater in patients ≥50 years (8.6%, 43.8% and 12.4%, respectively, P<.001). For all ages, SOF/VEL showed a lower percentage of: minor interactions (1.3% vs. 6.6% and 5.9%, P<.001); clinically significant interactions (53.4%, vs. 77.4% and 66.3%, P<.001) and contraindicated medication (1.7% vs. 8.3% and 10.7%, P<.001) compared to GLE/PIB and SOF/VEL/VOX, respectively.
ConclusionsPatients with CHC present high comorbidity and concomitant medication use, particularly elderly patients, thus implying a greater exposure to potential DDIs. Although the DDI rate was considerable with the three combinations analysed, SOF/VEL showed a lower number of clinically significant interactions.
La infección crónica por el virus de la hepatitis C (VHC) constituye un problema de salud de ámbito mundial, afectando a 120-150 millones de personas, y situándose con una prevalencia inferior al 1% de la población general1–4. Siguiendo la progresión natural de la enfermedad, entre el 55-85% de los pacientes infectados desarrollarán una hepatitis C crónica (inflamación y/o fibrosis); aproximadamente un 15-30% de estos pacientes desarrollarán una cirrosis, y la descompensación de esta puede causar insuficiencia hepática o carcinoma hepatocelular (3-5%)1,3–5. Siguen detectándose nuevos casos de adquisición de la enfermedad, sobre todo entre jóvenes y adictos a drogas por vía parenteral. Por lo tanto, la detección temprana y el tratamiento precoz son aspectos importantes para la prevención de la enfermedad1,2,6.
El objeto de la terapia consiste en la erradicación de la infección por VHC, evidenciada por la negativización del ARN VHC a las 12 semanas de finalizar el tratamiento (respuesta virológica sostenida-RVS12)5,7–10. La respuesta a tratamientos previos o el grado de fibrosis hepática tienen una gran importancia en la elección del tratamiento y la eficacia del mismo1,3,5,10.
Las nuevas moléculas de los AAD frente al VHC, aprovechando las numerosas dianas terapéuticas que ofrece el ciclo de replicación del virus, han revolucionado el tratamiento de la hepatitis C crónica (HCC)8. Su finalidad es lograr una mayor eficacia y una disminución de los posibles efectos secundarios8,11–13. La progresiva investigación de los mecanismos de replicación del virus ha permitido la identificación de potenciales dianas terapéuticas. En este sentido, tenemos 3 clases/familias diferentes de AAD, con diferencias farmacocinéticas: inhibidores de proteasa NS3/4A (terminados en «-previr»), inhibidores del complejo de replicación NS5A (terminados en «-asvir») e inhibidores de la polimerasa NS5B (terminados en «-buvir»). Con estos fármacos se puede incidir en 3 fases del proceso replicativo del VHC: inhibiendo la proteasa viral, inhibiendo la polimerasa e inhibiendo la proteína NS5A. Con los inhibidores de la proteasa se deben comprobar las posibles interacciones farmacológicas antes de recomendar su uso; los inhibidores de la proteína NS5A son potentes y eficaces, pero presentan una barrera baja contra la resistencia y perfiles de toxicidad variables; mientras que los inhibidores de la polimerasa NS5B tienen una alta barrera genética (baja barrera a las resistencias) y su metabolismo generalmente no depende del citocromo P4501,5,8.
Un único AAD no puede evitar por sí solo la reproducción del VHC (mutaciones), por este motivo el tratamiento debe constar de 2/3 fármacos de diferentes familias de inhibidores. Las moléculas actuales se presentan en diversas combinaciones pangenotípicas y en un solo comprimido, por lo que se simplifica el tratamiento1,12. Además, presentan menor duración de los tratamientos, mejores perfiles de seguridad e interacciones medicamentosas12. Algunas evidencias muestran que la combinación de sofosbuvir (inhibidor de la polimerasa, NS5B) generalmente tiene menos reacciones adversas que los tratamientos basados en inhibidores de proteasa13.
En algunos de estos pacientes con VHC es frecuente la presencia de comorbilidades, pudiendo recibir, además, múltiples medicaciones, circunstancia que puede ocasionar efectos adversos, interacciones medicamentosas o errores en la toma de la medicación4,9. Además, las interacciones farmacológicas de los medicamentos utilizados para tratar estas comorbilidades pueden interferir o contraindicar el uso de medicamentos para el tratamiento del VHC (AAD)11,13. Algunos estudios muestran que 2/3 de los pacientes pueden tener potenciales interacciones con fármacos AAD, mientras que aproximadamente el 20% pueden estar contraindicados. En general, se aconseja una revisión cuidadosa de la medicación de estos pacientes9,11,13-15. Actualmente se dispone de poca información sobre el riesgo real de los AAD pangenotípicos asociados a los patrones de uso de los medicamentos a nivel poblacional, por lo que es necesario aportar datos para aumentar el conocimiento de las posibles interacciones con los AAD pangenotípicos. El objetivo del estudio fue estimar la comorbilidad y las potenciales interacciones medicamentosas entre los AAD pangenotípicos y la medicación concomitante asociada a los pacientes con HCC en situación de práctica clínica habitual en España.
Pacientes y métodosDiseño y población de estudioSe realizó un estudio observacional, multicéntrico y longitudinal (de carácter retrospectivo). La población de estudio se obtuvo a partir de los registros sanitarios de proveedores de salud de diversos centros de España (unificados en la base de datos disociada BIG-PAC; Real Life Data; http://www.encepp.eu/encepp/search.htm). Los datos procedieron de diversas historias clínicas informatizadas y de otras bases de datos complementarias de 7 comunidades autonómicas españolas (1,9 millones de pacientes). La población asignada a los centros fue en su mayoría urbana, de nivel socioeconómico medio-bajo, con predominio industrial.
Criterios de inclusión y exclusiónSe incluyeron en el estudio los pacientes con diagnóstico de VHC, visitados y en tratamiento con cualquier combinación de AAD durante el año 2017. Los pacientes debían reunir las siguientes características: a) edad≥18 años; b) estar diagnosticados de VHC un mínimo de 12 meses antes del inicio del estudio (pacientes activos en la base de datos); c) estar en el programa de prescripciones crónicas para la obtención de las recetas médicas (con registro constatado de la dosis diaria, el intervalo de tiempo y la duración de cada tratamiento, ≥2 recetas durante el periodo de seguimiento para cualquier medicación administrada); y d) que se pudiera garantizar el seguimiento regular de estos pacientes durante el periodo de estudio (≥2 registros sanitarios en el sistema informático). Fueron excluidos del estudio los pacientes trasladados a otros centros, los desplazados y/o fuera de zona. Se diferenciaron 2 grupos de estudio en función de la edad (<50 años y ≥50 años).
Selección del diagnóstico y comorbilidadesEl diagnóstico de VHC se obtuvo según la Clasificación internacional de enfermedades, 9.ª revisión, modificación clínica (CIE-10-MC [B18.2]). En los pacientes incluidos en el estudio se comprobó la detección de anticuerpos anti-VHC (exposición/contacto) y se confirmó con la presencia del ARN del VHC (viremia/infección activa). Las variables incluidas en el estudio fueron: sexo, índice de masa corporal (IMC=kg/m2) y el tiempo de evolución de la enfermedad (hepatitis C), así como los antecedentes personales detallados en la tabla 1; presencia de cirrosis y comorbilidades asociadas (CIE-10-MC). Como variable resumen de la comorbilidad general se utilizó el índice de comorbilidad de Charlson16 como una aproximación a la gravedad del paciente.
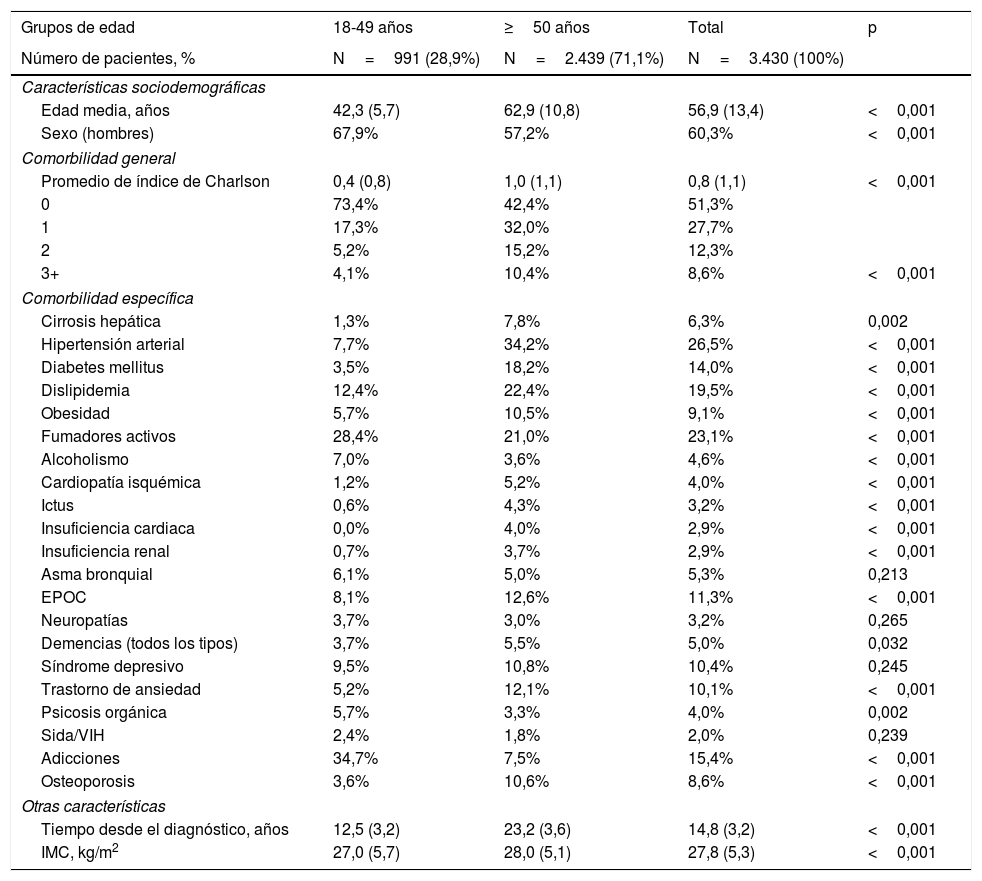
Características basales y comorbilidad de la serie estudiada por rangos de edad
| Grupos de edad | 18-49 años | ≥50 años | Total | p |
|---|---|---|---|---|
| Número de pacientes, % | N=991 (28,9%) | N=2.439 (71,1%) | N=3.430 (100%) | |
| Características sociodemográficas | ||||
| Edad media, años | 42,3 (5,7) | 62,9 (10,8) | 56,9 (13,4) | <0,001 |
| Sexo (hombres) | 67,9% | 57,2% | 60,3% | <0,001 |
| Comorbilidad general | ||||
| Promedio de índice de Charlson | 0,4 (0,8) | 1,0 (1,1) | 0,8 (1,1) | <0,001 |
| 0 | 73,4% | 42,4% | 51,3% | |
| 1 | 17,3% | 32,0% | 27,7% | |
| 2 | 5,2% | 15,2% | 12,3% | |
| 3+ | 4,1% | 10,4% | 8,6% | <0,001 |
| Comorbilidad específica | ||||
| Cirrosis hepática | 1,3% | 7,8% | 6,3% | 0,002 |
| Hipertensión arterial | 7,7% | 34,2% | 26,5% | <0,001 |
| Diabetes mellitus | 3,5% | 18,2% | 14,0% | <0,001 |
| Dislipidemia | 12,4% | 22,4% | 19,5% | <0,001 |
| Obesidad | 5,7% | 10,5% | 9,1% | <0,001 |
| Fumadores activos | 28,4% | 21,0% | 23,1% | <0,001 |
| Alcoholismo | 7,0% | 3,6% | 4,6% | <0,001 |
| Cardiopatía isquémica | 1,2% | 5,2% | 4,0% | <0,001 |
| Ictus | 0,6% | 4,3% | 3,2% | <0,001 |
| Insuficiencia cardiaca | 0,0% | 4,0% | 2,9% | <0,001 |
| Insuficiencia renal | 0,7% | 3,7% | 2,9% | <0,001 |
| Asma bronquial | 6,1% | 5,0% | 5,3% | 0,213 |
| EPOC | 8,1% | 12,6% | 11,3% | <0,001 |
| Neuropatías | 3,7% | 3,0% | 3,2% | 0,265 |
| Demencias (todos los tipos) | 3,7% | 5,5% | 5,0% | 0,032 |
| Síndrome depresivo | 9,5% | 10,8% | 10,4% | 0,245 |
| Trastorno de ansiedad | 5,2% | 12,1% | 10,1% | <0,001 |
| Psicosis orgánica | 5,7% | 3,3% | 4,0% | 0,002 |
| Sida/VIH | 2,4% | 1,8% | 2,0% | 0,239 |
| Adicciones | 34,7% | 7,5% | 15,4% | <0,001 |
| Osteoporosis | 3,6% | 10,6% | 8,6% | <0,001 |
| Otras características | ||||
| Tiempo desde el diagnóstico, años | 12,5 (3,2) | 23,2 (3,6) | 14,8 (3,2) | <0,001 |
| IMC, kg/m2 | 27,0 (5,7) | 28,0 (5,1) | 27,8 (5,3) | <0,001 |
Valores expresados en porcentaje o media.
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; p: significación estadística.
La descripción del tratamiento se obtuvo según la Anatomical Therapeutic Chemical Classification System (ATC)17. Se obtuvo la información de los principios activos y grupos terapéuticos (descritos en la tabla 2). Para determinar el potencial efecto de interacción se siguieron las recomendaciones de la Universidad de Liverpool, un recurso internacional recomendado por la European Association for the Study of the Liver1 y las guías de tratamiento del VHC18 (http://www.hep-druginteractions.org/Interactions.aspx). Las potenciales interacciones medicamentosas se clasificaron en 3 grupos: a) posibilidad de interacción débil (amarillo); b) potenciales interacciones (naranja); y c) medicación contraindicada. La información se obtuvo de la prescripción farmacéutica. La elección del medicamento a un paciente en concreto fue a criterio del médico (práctica clínica). Los AAD pangenotípicos seleccionados fueron: a) sofosbuvir/velpatasvir (SOF/VEL); b) glecaprevir/pibrentasvir (GLE/PIB); y c) sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX). Cabe destacar que la medicación concomitante se analizó durante el periodo del tratamiento antiviral y únicamente con la medicación crónica o habitual administrada a los pacientes.
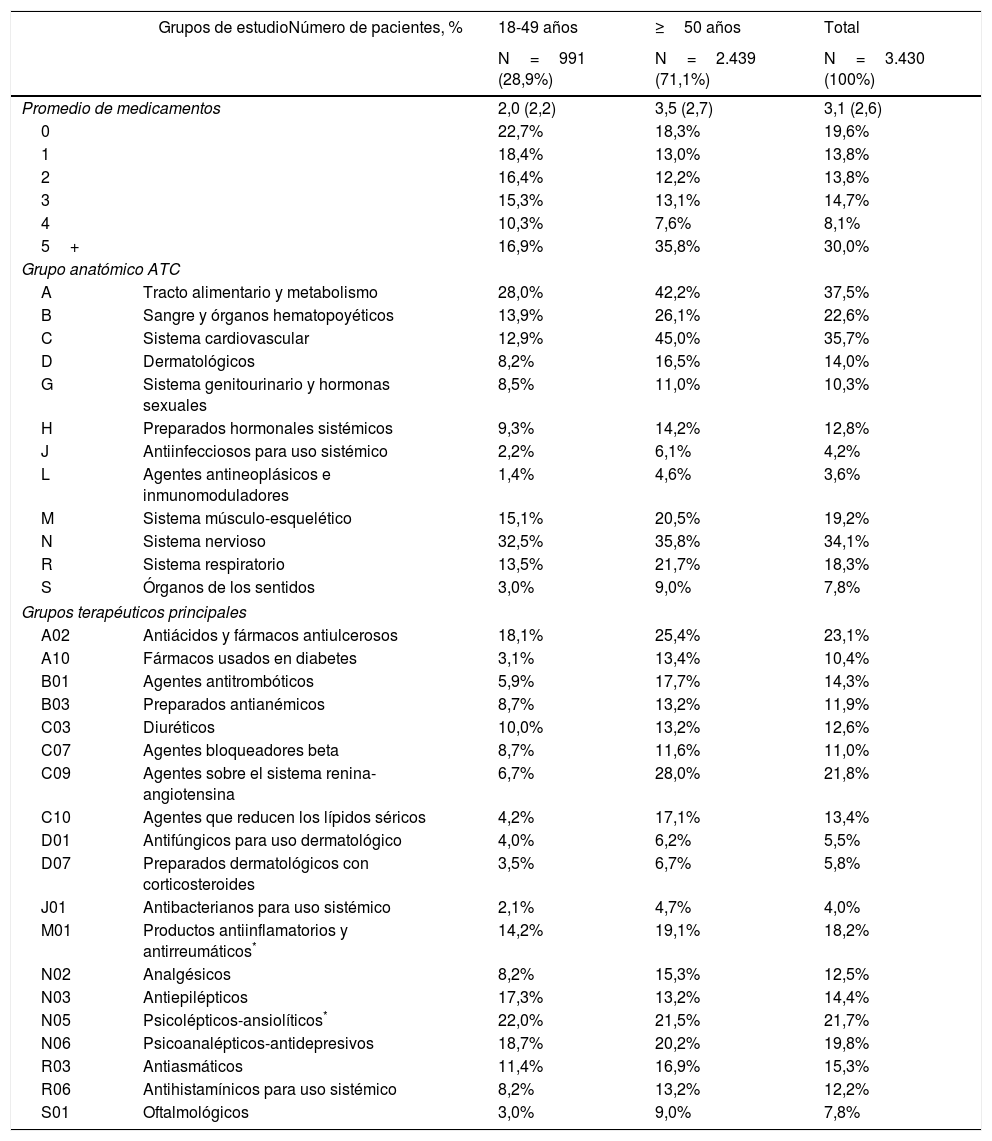
Medicación concomitante administrada durante el periodo de seguimiento por rangos de edad
| Grupos de estudioNúmero de pacientes, % | 18-49 años | ≥50 años | Total | |
|---|---|---|---|---|
| N=991 (28,9%) | N=2.439 (71,1%) | N=3.430 (100%) | ||
| Promedio de medicamentos | 2,0 (2,2) | 3,5 (2,7) | 3,1 (2,6) | |
| 0 | 22,7% | 18,3% | 19,6% | |
| 1 | 18,4% | 13,0% | 13,8% | |
| 2 | 16,4% | 12,2% | 13,8% | |
| 3 | 15,3% | 13,1% | 14,7% | |
| 4 | 10,3% | 7,6% | 8,1% | |
| 5+ | 16,9% | 35,8% | 30,0% | |
| Grupo anatómico ATC | ||||
| A | Tracto alimentario y metabolismo | 28,0% | 42,2% | 37,5% |
| B | Sangre y órganos hematopoyéticos | 13,9% | 26,1% | 22,6% |
| C | Sistema cardiovascular | 12,9% | 45,0% | 35,7% |
| D | Dermatológicos | 8,2% | 16,5% | 14,0% |
| G | Sistema genitourinario y hormonas sexuales | 8,5% | 11,0% | 10,3% |
| H | Preparados hormonales sistémicos | 9,3% | 14,2% | 12,8% |
| J | Antiinfecciosos para uso sistémico | 2,2% | 6,1% | 4,2% |
| L | Agentes antineoplásicos e inmunomoduladores | 1,4% | 4,6% | 3,6% |
| M | Sistema músculo-esquelético | 15,1% | 20,5% | 19,2% |
| N | Sistema nervioso | 32,5% | 35,8% | 34,1% |
| R | Sistema respiratorio | 13,5% | 21,7% | 18,3% |
| S | Órganos de los sentidos | 3,0% | 9,0% | 7,8% |
| Grupos terapéuticos principales | ||||
| A02 | Antiácidos y fármacos antiulcerosos | 18,1% | 25,4% | 23,1% |
| A10 | Fármacos usados en diabetes | 3,1% | 13,4% | 10,4% |
| B01 | Agentes antitrombóticos | 5,9% | 17,7% | 14,3% |
| B03 | Preparados antianémicos | 8,7% | 13,2% | 11,9% |
| C03 | Diuréticos | 10,0% | 13,2% | 12,6% |
| C07 | Agentes bloqueadores beta | 8,7% | 11,6% | 11,0% |
| C09 | Agentes sobre el sistema renina-angiotensina | 6,7% | 28,0% | 21,8% |
| C10 | Agentes que reducen los lípidos séricos | 4,2% | 17,1% | 13,4% |
| D01 | Antifúngicos para uso dermatológico | 4,0% | 6,2% | 5,5% |
| D07 | Preparados dermatológicos con corticosteroides | 3,5% | 6,7% | 5,8% |
| J01 | Antibacterianos para uso sistémico | 2,1% | 4,7% | 4,0% |
| M01 | Productos antiinflamatorios y antirreumáticos* | 14,2% | 19,1% | 18,2% |
| N02 | Analgésicos | 8,2% | 15,3% | 12,5% |
| N03 | Antiepilépticos | 17,3% | 13,2% | 14,4% |
| N05 | Psicolépticos-ansiolíticos* | 22,0% | 21,5% | 21,7% |
| N06 | Psicoanalépticos-antidepresivos | 18,7% | 20,2% | 19,8% |
| R03 | Antiasmáticos | 11,4% | 16,9% | 15,3% |
| R06 | Antihistamínicos para uso sistémico | 8,2% | 13,2% | 12,2% |
| S01 | Oftalmológicos | 3,0% | 9,0% | 7,8% |
Valores expresados en porcentaje o media.
DE: desviación estándar; p: significación estadística.
Se respetó la confidencialidad de los registros (anónimos y disociados) según la Ley orgánica de protección de datos (Ley 15/1999 de 13 de diciembre). El estudio fue clasificado por la Agencia Española del Medicamento y Productos Sanitarios (EPA-OD), y posteriormente fue aprobado por el Comité de Ética de Investigación Clínica de la Unió Catalana Balears de Hospitales de Barcelona.
Análisis estadísticoSe realizó una validación de los datos para asegurar la calidad de los registros. Se efectuó un análisis estadístico descriptivo-univariante y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. En el análisis bivariante se utilizaron las pruebas de ANOVA y Chi al cuadrado para variables independientes. Se utilizó el programa SPSSWIN versión 23, estableciéndose una significación estadística para valores de p<0,05.
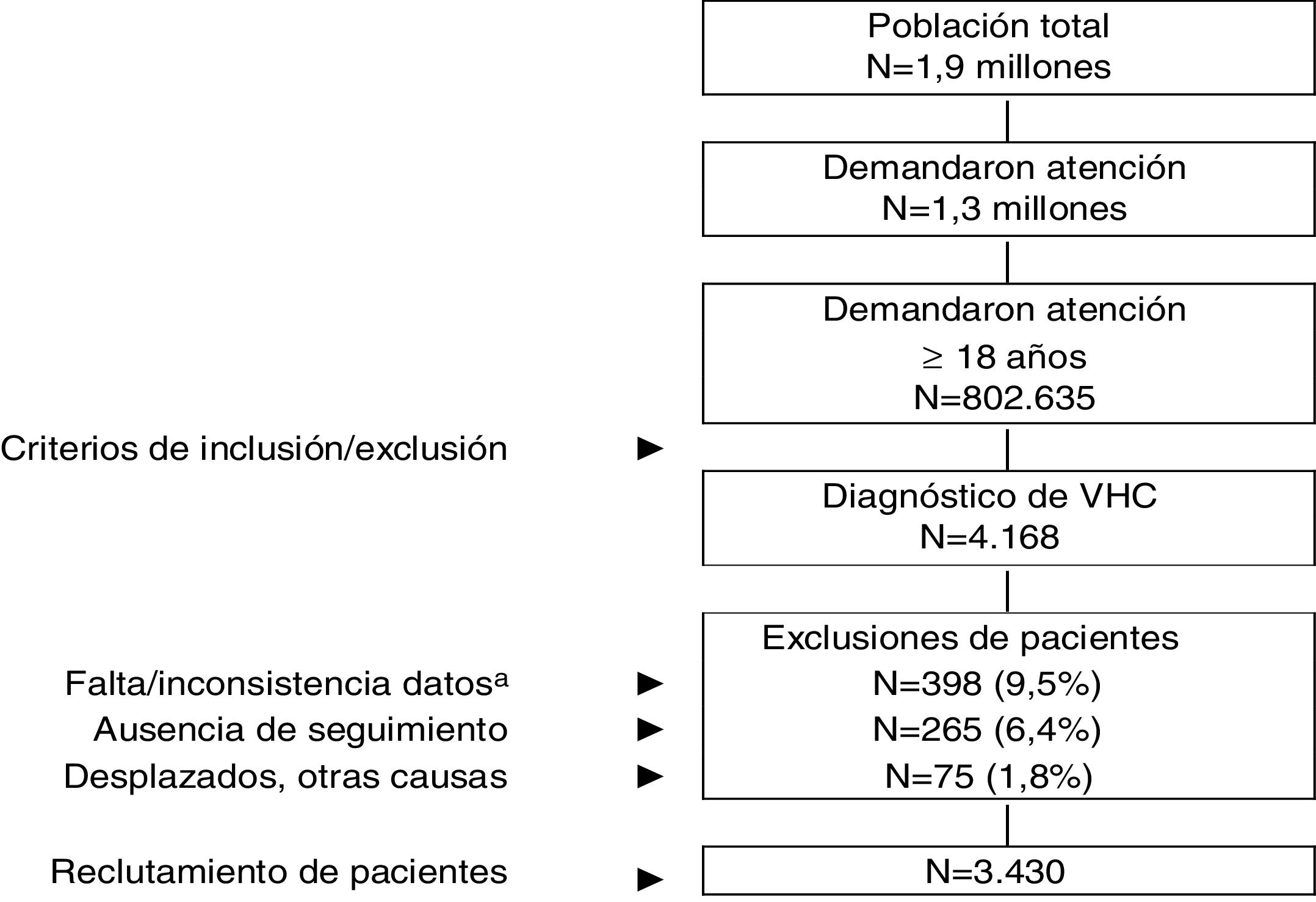
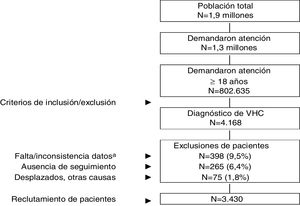
ResultadosDe una población inicial de 1,9 millones de habitantes fueron atendidos 802.635 pacientes ≥18 años entre el 1 de enero de 2017 y el 31 de diciembre de 2017. De estos 4.168 sujetos estaban diagnosticados de VHC. Finalmente se analizaron 3.430 pacientes que cumplían con los criterios de inclusión/exclusión y pudieron seguirse durante el período de estudio (fig. 1). En la tabla 1 se muestran las características basales de la serie estudiada por rangos de edad. En general, la edad media fue de 56,9 años, un 60,3% fueron hombres y el promedio del índice de Charlson fue de 0,8 puntos por paciente. Las enfermedades cardiovasculares y mentales fueron los antecedentes personales más prevalentes. El tiempo desde el diagnóstico fue de 14,8 años y el IMC de 27,8kg/m2. La distribución por grupos de estudio fue la siguiente: a) 18-49 años (n=991; 28,9%); y b)≥50 años (n=2.439; 71,1%). Por grupos de estudio la proporción del sexo (hombres) fue decreciendo con la edad (67,9% vs. 57,2%, respectivamente; p<0,001) y el promedio del índice de Charlson fue incrementando (0,4 vs. 1,0 puntos, respectivamente; p<0,001). Se observó un aumento en la presencia de comorbilidades con el incremento de la edad.
Esquema general del estudio.
VHC: virus de la hepatitis C crónica. Se efectuó un diseño observacional de carácter retrospectivo, realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos anonimizados y disociados) de pacientes que demandaron atención durante el año 2017.
aIncluye pacientes que no recibieron tratamiento antiviral.
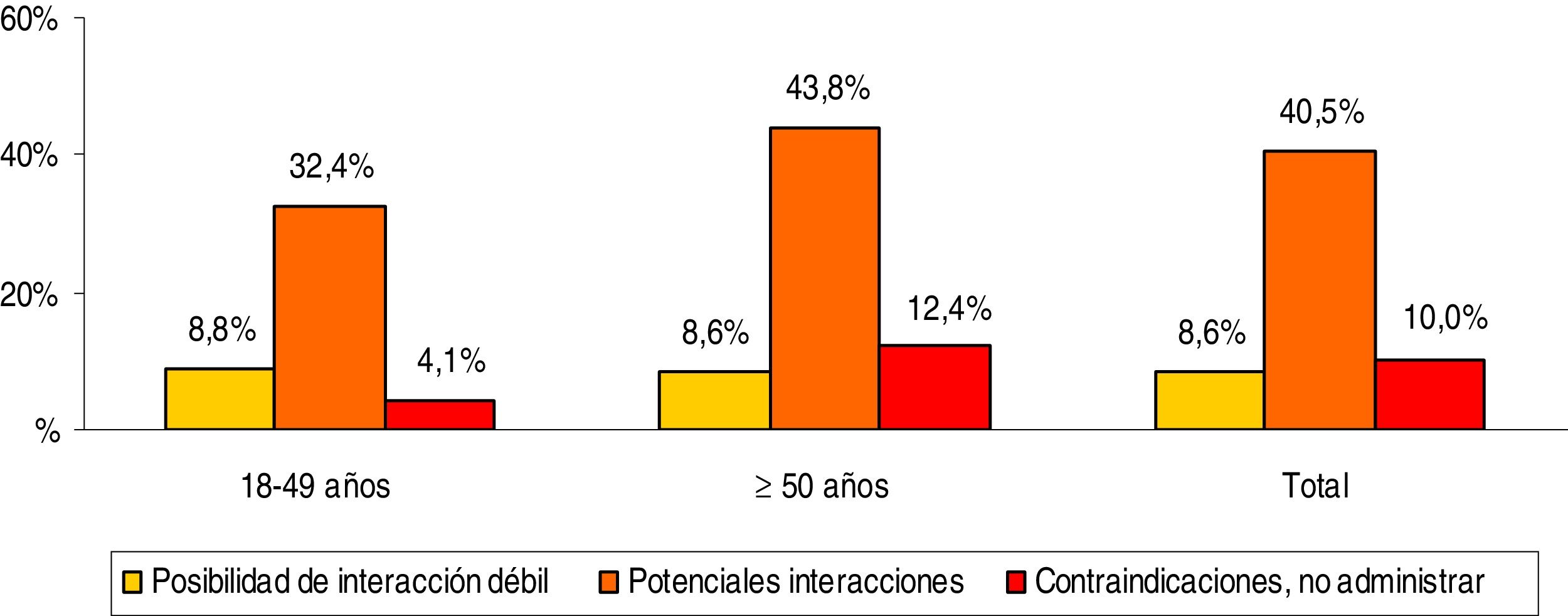
La medicación concomitante prescrita a los pacientes durante el periodo de seguimiento se describe en la tabla 2. El promedio de medicamentos fue de 3,1 (DE: 2,6) por paciente. En general, los grupos terapéuticos (ATC) más consumidos fueron: tracto alimentario y metabolismo (37,5%), sistema cardiovascular (35,7%) y sistema nervioso (34,1%). Mientras que los grupos terapéuticos principales fueron: A02-antiácidos (23,1%), C09-agentes sobre el sistema renina-angiotensina (21,8%) y N05-psicolépticos-ansiolíticos (21,7%). La prescripción de fármacos se incrementó con el aumento de la edad. Las potenciales interacciones medicamentosas por rangos de edad se detallan en la figura 2. El porcentaje total fue el siguiente: 8,6% interacción débil, 40,5% potenciales interacciones y 10,0% medicación contraindicada. Estas interacciones fueron mayores en los pacientes ≥50 años (8,6%; 43,8% y 12,4%, respectivamente; p<0,001). En general el 35,6% de los pacientes mostraron una interacción, 2 el 19,5% y 3 el 2,4%.
Potenciales interacciones medicamentosas por rangos de edad.
Comparaciones por pares entre los grupos de edad: diferencias significativas en todos los casos (p<0,01).
Comparaciones entre los grupos de interacción: posibilidad de interacción débil (no significativo), potenciales interacciones (p<0,001) y contraindicaciones (p<0,01).
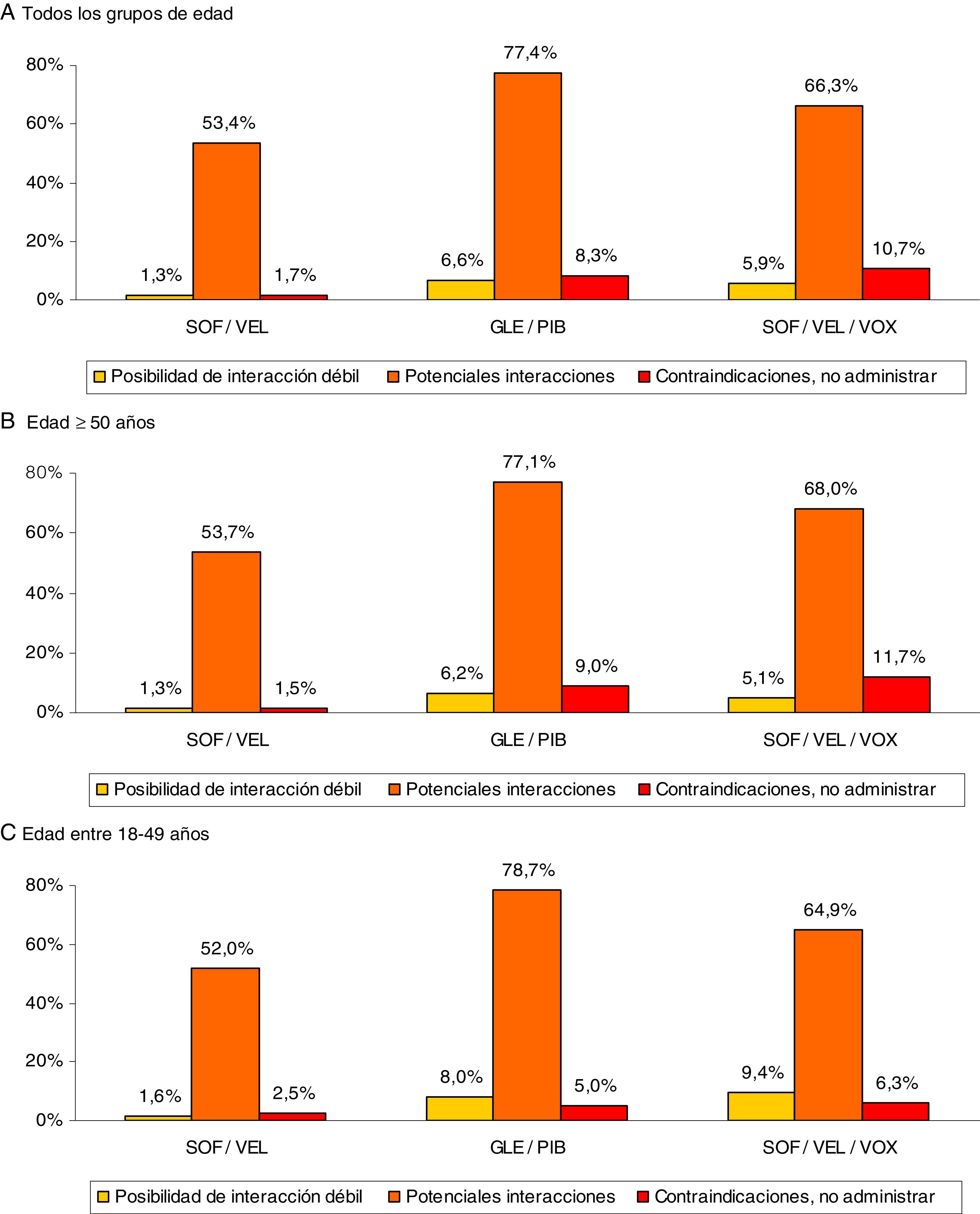
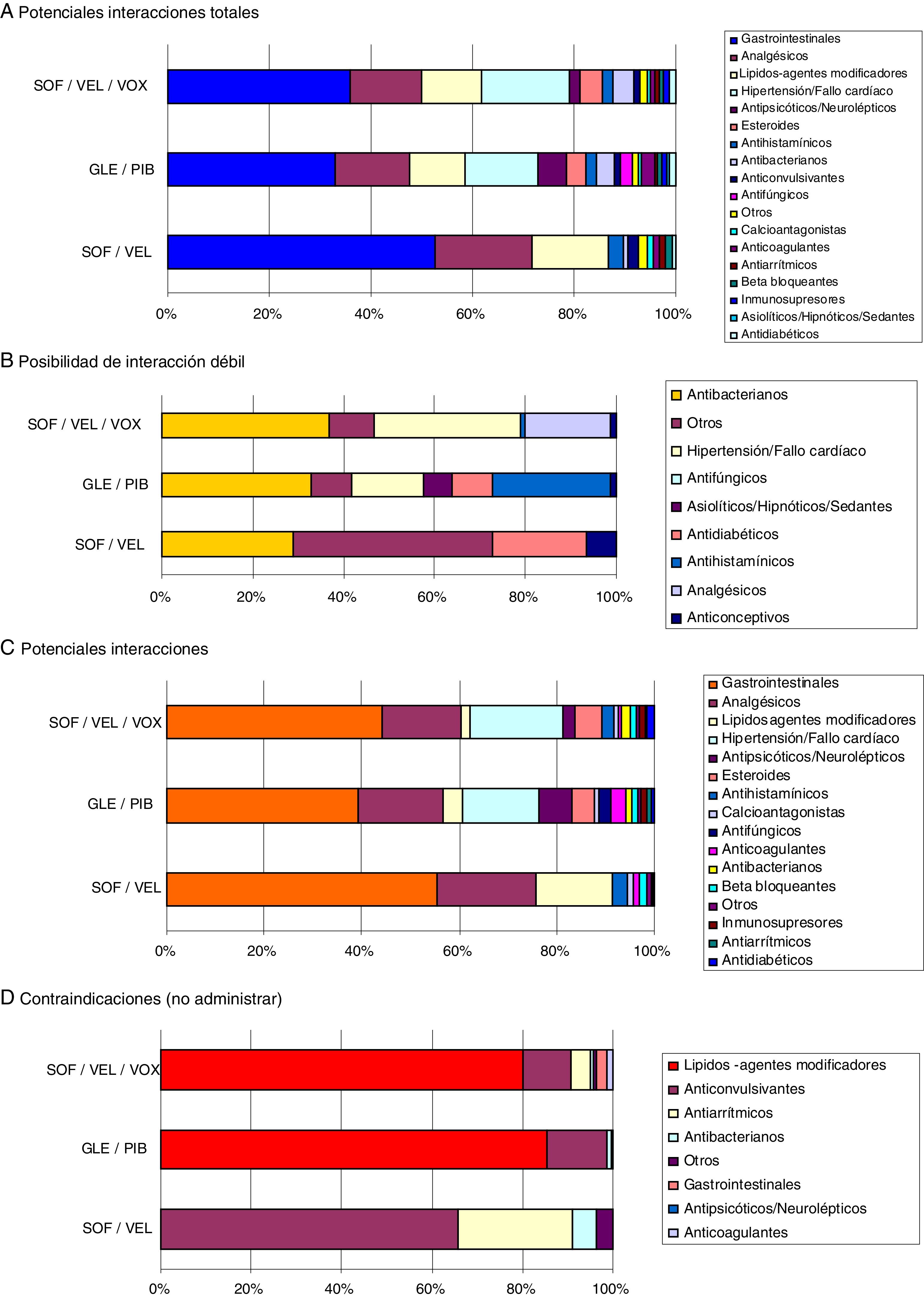
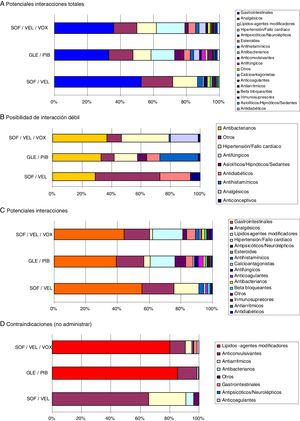
En la figura 3 se muestran las interacciones medicamentosas según los diferentes AAD pangenotípicos estudiados y grupos de edad. Para todas las edades SOF/VEL en comparación con GLE/PIB y SOF/VEL/VOX presentó un menor porcentaje de interacciones débiles (1,3% vs. 6,6% y 5,9%, p<0,001), potenciales interacciones (53,4%, vs. 77,4% y 66,3%, p<0,001) y medicación contraindicada (1,7% vs. 8,3% y 10,7%, p<0,001). En la figura 4 se describen las interacciones medicamentosas totales según los AAD pangenotípicos por los principales grupos terapéuticos. En general, los grupos terapéuticos de fármacos/medicamentos gastrointestinales (SOF/VEL: 52,1%; GLE/PIB: 32,7%; SOF/VEL/VOX: 35,3%; p<0,001), analgésicos (SOF/VEL: 19,0%; GLE/PIB: 14,3%; SOF/VEL/VOX: 14,2%; p<0,001) e hipolipidemiantes (SOF/VEL: 14,8%; GLE/PIB: 11,0%; SOF/VEL/VOX: 11,4%; p=0,003) fueron los más frecuentes.
Interacciones medicamentosas según AAD pangenotípicos y grupos de edad.
Comparaciones por pares entre los grupos de edad: diferencias significativas en todos casos (p<0,01).
AAD: antivirales de acción directa; GLE/PIB: glecaprevir/pibrentasvir; SOF/VEL: sofosbuvir/velpatasvir; SOF/VEL/VOX: sofosbuvir/velpatasvir/voxilaprevir.
Las principales contraindicaciones para SOF/VEL fueron con anticonvulsivantes (61,2%) y antiarrítmicos (23,5%); para GLE/PIB hipolipidemiantes (82,3%) y anticonvulsivantes (13,0%) y para SOF/VEL/VOX hipolipidemiantes (77,1%) y anticonvulsivantes (10,2%), respectivamente. Los principios activos más prescritos en este colectivo de pacientes con VHC y que podrían causar una potencial interacción fueron: omeprazol (20,5%, gastrointestinales), diazepam (11,0%, ansiolíticos-sedantes), lorazepam (6,5%, ansiolíticos-sedantes) y enalapril (6,4%, hipertensión-cardíacos). Atorvastatina (4,0%) y clonazepam (2,8%) fueron el hipolipidemiante y el anticonvulsivante más habituales.
DiscusiónLos resultados del estudio ponen de manifiesto que los sujetos portadores del VHC se asocian a una importante comorbilidad y a un elevado consumo de medicación, principalmente en los pacientes ≥50 años, circunstancia que repercute en una mayor exposición a potenciales interacciones medicamentosas en el momento de recibir tratamiento antiviral. Cabe destacar que los datos se basan en resultados obtenidos en situación de práctica clínica habitual, alejados de las condiciones ideales de los ensayos clínicos o de colectivos de pacientes específicos. En los próximos años es previsible que siga la tendencia a la reducción del número de casos nuevos de hepatitis C, aunque todavía existen muchos pacientes diagnosticados de hepatitis C que por diferentes motivos no han recibido tratamiento antiviral1,3. El conocimiento de las interacciones medicamentosas representa un reto para el tratamiento de la infección por el VHC1,11,13. Nuestro estudio es uno de los primeros publicados sobre la base de AAD pangenotípicos, y además, fue realizado con un elevado número de pacientes; estos 2 aspectos podrían considerarse como una fortaleza del artículo.
En nuestro estudio la carga de morbilidad general (índice de Charlson, BUR) relacionada con los pacientes portadores de VHC fue elevada. Las enfermedades cardiovasculares, metabólicas, mentales y osteomusculares fueron las más prevalentes. Estos resultados son consistentes con la bibliografía revisada19,20. A modo de ejemplo Basseri21, en un estudio trasversal, detalló que la enfermedad renal, la diabetes y la obesidad eran más prevalentes en pacientes con VHC en comparación con la población general de Estados Unidos. Chen22 detectó un 28,8% de obesos en una cohorte de 1.118 pacientes con VHC; los factores independientes asociados con la obesidad fueron la edad y la carga viral. En 2 estudios publicados McKibben23 y Serres24 concluyen que el VHC puede aumentar el riesgo de enfermedad cardiovascular, aunque se debería determinar si la duración de la infección o el tratamiento administrado pueden influir en el desarrollo de la placa de ateroma. Nuestros resultados son similares a los reportados en la bibliografía consultada.
Las crecientes tasas de comorbilidad observadas están relacionadas con el envejecimiento de la población (pacientes mayores; polimedicados), por lo que tiene implicaciones en la complejidad de la evaluación de potenciales interacciones; el porcentaje de estas fue del 40,5%, mientras que el 10,0% fueron medicaciones contraindicadas25. Maasoumy26 investigó el riesgo de potenciales interacciones en sujetos tratados con inhibidores de la proteasa (telaprevir, boceprevir) en un hospital alemán, y determinó que la mitad de los pacientes estuvieron expuestos a un fármaco con potencial interacción. En un estudio de diseño similar al nuestro se observó que, de los 40 principales medicamentos ambulatorios, un 62% de los pacientes estaba expuesto al menos a uno de los 22 medicamentos con potencial ineracción15. En nuestro caso se realizó con todos los medicamentos crónicos prescritos, sin limitación de principios activos, y también se analizaron los medicamentos ambulatorios y hospitalarios27. Smolders28 (n=461; sofosbuvir/velpatasvir, sofosbuvir/simeprevir, sofosbuvir/ledipasvir, sofosbuvir/ daclatasvir, elbasvir/grazoprevir, paritaprevir/ritonavir/ombitasvir/dasabuvir) observó que los antidepresivos (7,4%), los inhibidores de la bomba de protones (7,1%) y las benzodiacepinas (7,1%) se usaron con mayor frecuencia. Muchos pacientes estaban en riesgo de presentar una interacción medicamentosa clínicamente relevante con al menos uno de los AAD. Los AAD de reciente comercialización se asocian a un menor riesgo de interacciones farmacológicas. Langness29 identificó que los agentes hipertensivos, los analgésicos y los medicamentos psiquiátricos causan interacciones frecuentes con los AAD (sofosbuvir/simeprevir, sofosbuvir/ledipasvir, sofosbuvir/ribavirin, paritaprevir/ritonavir/ombitasvir/dasabuvir). Los autores concluyen que las interacciones farmacológicas son frecuentes (1,2 por paciente), y que el tratamiento con AAD puede requerir ajustes en los medicamentos concomitantes. Kondili30 (estudio PITER, n=449; sofosbuvir/ribavirin, sofosbuvir/simeprevir, sofosbuvir/daclatasvir, sofosbuvir/ledipasvir, paritaprevir/ritonavir/ombitasvir/dasabuvir) destaca que podemos estimar que el 30-44% de los pacientes sometidos a AAD presentan riesgo de interacciones clínicamente significativas. Los autores destacan la necesidad de una mayor concienciación en la administración de estos medicamentos, especialmente en pacientes con enfermedad hepática moderada/severa. Nuestros resultados están en consonancia con estos autores, aunque hemos observado una menor proporción de interacción medicamentosa clínicamente relevante. Esta circunstancia se debe a que el estudio se realizó con AAD pangenotípicos, con medicamentos de más reciente comercialización, aunque con escasa bibliografía disponible para su comparación.
En este sentido SOF/VEL presentó una menor proporción de IFs. SOF es un inhibidor de la polimerasa NS5B, mientras que VEL es un inhibidor del complejo de replicación NS5A. GLE es un inhibidor pangenotípico de la proteasa de NS3/4A del VHC esencial para la replicación viral. Mientras que PIB es un inhibidor pangenotípico del NS5A del VHC; la administración concomitante de GLE/PIB puede aumentar la exposición a determinados medicamentos (digoxina, dabigatrán, estatinas, etinilestradiol, CYP3A). La vía de activación metabólica intracelular de SOF está mediada por vías de fosforilación de nucleótidos e hidrolasas generalmente de baja afinidad y alta capacidad, por lo que es improbable que resulten afectadas por los medicamentos concomitantes31. Recientes revisiones constatan que la combinación medicamentosa con SOF generalmente tiene menos interacciones que los regímenes basados en inhibidores de proteasa. Sin embargo, el análisis de cada interacción es teórico y serían necesarios más estudios de interacción para confirmar su efecto real31. Parece que la clave para interpretar las IFs se basa en el conocimiento de los perfiles farmacocinéticos de los medicamentos y su capacidad para inhibir el CYP450-3A4 y los transportadores (hepáticos e intestinales), en relación con sus potenciales consecuencias clínicas12,13.
A nivel práctico cabe mencionar que las potenciales IFs de medicación contraindicada (rojo) y potenciales interacciones (naranja) son las de mayor relevancia clínica, y por tanto las que requieren una mayor atención. En este sentido, al introducir los AAD, algunos medicamentos concomitantes podrían sustituirse o reducir la dosis administrada; dado el corto periodo de administración de los AAD. Esta circunstancia podría emplearse con las estatinas (simvastatina, atorvastatina, etc.) e inhibidores de la bomba de protones (lansoprazol, pantoprazol, etc.); medicamentos ampliamente prescritos en nuestro estudio (fig. 4). En otros casos, como los pacientes coinfectados por VIH/VHC (2,0% de la población) quizás sería preferible otro tipo de intervención, como seleccionar con más detenimiento el tipo de AAD. Además, siempre será necesario interrogar al paciente sobre el uso de otros fármacos, como los no financiados (homeopáticos, suplementos, vitaminas, etc.) o los comprados sin receta médica.
En el artículo se muestran las limitaciones propias de los estudios retrospectivos como, por ejemplo, el infrarregistro de la enfermedad, o la posible variabilidad de los profesionales y pacientes, al ser un diseño observacional. Cabe destacar que este tipo de diseños no está exento de sesgos (factores no tenidos en cuenta), como el nivel económico-social, cultural o de escolarización, las dosis farmacológicas consumidas, la duración del tratamiento, la adherencia al mismo o la adecuación terapéutica. Además, no se tuvieron en cuenta para el estudio los medicamentos de venta libre, la automedicación de los pacientes o las recetas emitidas en otras instituciones sanitarias (públicas o privadas). La principal objeción al estudio es su indudable sesgo de selección por parte del médico responsable a la hora de administrar unos u otros fármacos, y la validez externa, por lo que la interpretación de los resultados debe hacerse con prudencia.
Las potenciales interacciones pueden ser un problema en la práctica clínica, aunque muchas de ellas se podrían evitar ajustando la dosis farmacológica o seleccionando una alternativa más segura, pero solo si se tiene el conocimiento y la experiencia suficiente para gestionar estos problemas farmacocinéticos11,13. Nuevos modelos de asistencia, que incluyan, entre otras, herramientas de ayuda a la prescripción electrónica o sistemas de ayuda a la decisión clínica, pueden proporcionar a los cínicos una ayuda considerable. El éxito de la atención a los pacientes portadores del VHC está en la prevención2,10, es decir, en reducir el riesgo de exposición al virus en entornos de atención sanitaria, en los grupos de población de alto riesgo; además se deberían realizar estrategias encaminadas a disminuir la progresión de la enfermedad1,2,5,9. El conocimiento de las secuelas del VHC puede ser útil a los decisores políticos para determinar el valor de la detección precoz y el tratamiento (AAD) en fases avanzadas de la enfermedad.
En conclusión, los sujetos portadores del VHC se asocian a una elevada comorbilidad y consumo de medicación concomitante, especialmente en los pacientes de mayor edad, circunstancia que repercute en una mayor exposición a potenciales IFs. La disponibilidad de AAD pangenotípicos proporciona la oportunidad de expandir el tratamiento y maximizar la curación en pacientes VHC. Aunque la tasa de IFs fue considerable con las 3 combinaciones analizadas, SOF/VEL mostró una menor proporción clínicamente relevante. La ausencia de inhibidor de la proteasa podría justificar este diferente perfil de interacciones potenciales.
AutoríaLa concepción y el diseño del manuscrito fueron realizados por A. Sicras y R. Navarro, la recogida de los datos por I. Hernández y el análisis estadístico por A. Sicras y la interpretación de los datos, redacción, revisión y aprobación del manuscrito remitido, por todos los autores.
FinanciaciónEl estudio fue patrocinado por Gilead Sciences.
Conflicto de interesesA. Sicras es un consultor independiente en relación con el desarrollo de este manuscrito. Los demás autores declaran no tener conflicto de intereses.