Introducción La pandemia producida por el virus SARS-CoV-2 ha generado un grave impacto en el funcionamiento de las unidades de endoscopia digestiva. La Asociación Española de Gastroenterología y la Sociedad Española de Endoscopia Digestiva (AEG-SEED) han propuesto la utilización de la guía European Panel on the Appropriateness of Gastrointestinal Endoscopy II (EPAGE) para la gestión de las colonoscopias pospuestas.
ObjetivoEvaluar la guía EPAGE como herramienta de gestión en comparación con el test de sangre oculta en heces inmunológico (TSOHi) y con una calculadora de riesgo (CR), que incluye la edad, el sexo y el TSOHi, para la detección de cáncer colorrectal (CCR) y lesión significativa colónica (LSC).
MétodosEstudio unicéntrico prospectivo. Se incluyeron 743 pacientes derivados para una colonoscopia diagnóstica. Se clasificó cada solicitud según EPAGE en apropiada, indeterminada e inapropiada. Se les entregó un TSOHi y se calculó el valor de la CR.
ResultadosEl TSOHi (p<0,001), pero no EPAGE (p = 0,742), fue una variable independiente de riesgo de CCR. El área bajo la curva receiver operating characteristic (ROC) de EPAGE, TSOHi y CR fue: 0,61(IC 95% 0,49 a 0,75), 0,95 (0,93 a 0,97) y 0,90 (0,87 a 0,93) para CCR; y 0,55 (0,49 a 0,61), 0,75 (0,69 a 0,813) y 0,78 (0,73 a 0,83) para LSC, respectivamente. El número necesario de colonoscopias para detectar un CCR y una LSC fue de 38 y siete para EPAGE, de siete y dos para TSOHi, y de 19 y cuatro para CR ≥ cinco puntos, respectivamente.
ConclusiónLa EPAGE, a diferencia del TSOHi, no es adecuada para seleccionar a los pacientes candidatos a colonoscopia diagnóstica para la detección de CCR. El TSOHi, en combinación con la edad y el sexo, es la estrategia correcta para gestionar la demanda de endoscopia en un escenario de acceso restrictivo.
The pandemic caused by the SARS-CoV-2 virus has had a serious impact on the functioning of gastrointestinal endoscopy Units. The Asociación Española de Gastroenterología (AEG) and the Sociedad Española de Endoscopia Digestiva (SEED) have proposed the EPAGE guidelines for managing postponed colonoscopies.
ObjectiveTo evaluate the EPAGE guidelines as a management tool compared to the immunologic faecal occult blood test (iFOBT) and compared to risk score (RS) that combines age, sex and the iFOBT for the detection of colorectal cancer (CRC) and significant bowel disease (SBD).
MethodsA prospective, single-centre study enrolling 743 symptomatic patients referred for a diagnostic colonoscopy. Each order was classified according to the EPAGE guidelines as appropriate, indeterminate or inappropriate. Patients underwent an iFOBT and had their RS calculated.
ResultsThe iFOBT (p<0.001), but not the EPAGE guidelines (p = 0.742), was an independent predictive factor of risk of CRC. The ROC AUCs for the EPAGE guidelines, the iFOBT and the RS were 0.61 (95% CI 0.49-0.75), 0.95 (0.93-0.97) and 0.90 (0.87-0.93) for CRC, and 0.55 (0.49-0.61), 0.75 (0.69-0.813) and 0.78 (0.73-0.83) for SBD, respectively. The numbers of colonoscopies needed to detect a case of CRC and a case of SBD were 38 and seven for the EPAGE guidelines, seven and two for the iFOBT, and 19 and four for a RS ≥5 points, respectively.
ConclusionThe EPAGE guidelines, unlike the iFOBT, is not suitable for screening candidate patients for a diagnostic colonoscopy to detect CRC. The iFOBT, in combination with age and sex, is the most suitable strategy for managing demand for endoscopy in a restricted-access situation.
La situación de emergencia sanitaria debida a la pandemia por la COVID-19, causada por el virus SARS-CoV-2, ha generado un grave impacto en la actividad de las unidades de endoscopia digestiva a nivel mundial. La necesidad de limitar el acceso al hospital y la identificación de las endoscopias digestivas como procedimientos de alto riesgo1 han llevado a la anulación de la práctica totalidad de estas exploraciones, realizando únicamente aquéllas consideradas urgentes bajo estrictas medidas de protección.
Durante este tiempo, varios autores han referido un elevado riesgo de contagio y de transmisión del virus SARS-CoV-2 en las unidades de endoscopia, debido a la generación de microgotas en el aire1–3. Se han constatado infecciones por la producción de aerosoles peri endoscópicos hasta tres a seis horas en salas cerradas1–3. Además, se ha demostrado la presencia de virus vivos en las heces de los pacientes con la COVID-191–4. Por lo tanto, no podemos despreciar el riesgo de transmisión durante los procedimientos de endoscopia digestiva baja.
En el contexto del descenso progresivo de los casos hospitalizados por la enfermedad COVID-19, se plantea el desafío de retomar la actividad en unas salas de endoscopia muy mermadas por múltiples limitaciones. En primer lugar, la reducción del personal disponible (enfermería, endoscopia y anestesia) afectado por la propia infección SARS-CoV-2 o por haber sido destinados a salas de atención a pacientes con la COVID-19. En segundo lugar, los equipos de ventilación mecánica han sido destinados temporalmente a las áreas improvisadas de cuidados intensivos. En tercer lugar, la necesidad de reducir la exposición de los pacientes en las salas de espera y de recuperación, la limpieza de las salas de endoscopia y la obligatoriedad de utilizar equipos de protección están limitando el número de exploraciones por sala. Por último, el riesgo de transmisión del SARS-CoV-2 ha causado un cambio en la relación del riesgo-beneficio de las exploraciones endoscópicas. A estos problemas estructurales, que impiden el inicio de la actividad a la máxima capacidad, se añade el aumento de la lista de espera de las exploraciones no realizadas en este período.
Ante la preocupante situación descrita, diferentes sociedades científicas como la Societat Catalana de Digestologia (SCD)5, la Sociedad Española de Endoscopia Digestiva (SEED)6 y la Asociación Española de Gastroenterología (AEG)6, han centrado sus esfuerzos en elaborar protocolos de priorización de aquellas exploraciones con un mayor rendimiento diagnóstico y terapéutico. Concretamente, en el caso de la colonoscopia diagnóstica, la AEG-SEED recomienda valorar la correcta indicación en función del resultado del European Panel on the Appropriateness of Gastrointestinal Endoscopy II (EPAGE)7. Se trata de una guía actualizada en el año 2008 que determina la adecuación de la indicación de la endoscopia con base en la evidencia científica evaluada por un comité de expertos internacional8. En el caso de la colonoscopia diagnóstica, se centra en el valor de los síntomas abdominales con una mayor precisión en la identificación de un cáncer colorrectal (CCR)9–12.
En los últimos años, ha proliferado la evidencia científica sobre la utilidad del test de sangre oculta en heces inmunológico (TSOHi) en la detección de CCR o de lesión significativa colónica (LSC), demostrando una mejor capacidad discriminatoria que los síntomas abdominales13–16. Además, se ha descrito una calculadora de riesgo (CR) basada en el TSOHi, la edad y el sexo que permite estimar, de forma sencilla y precisa, el riesgo de neoplasia avanzada (NA), es decir, adenoma avanzado o cáncer16.
Debido a la excepcional situación en la que nos encontramos, una gestión eficiente de la lista de espera es crítica para evitar el retraso diagnóstico de pacientes con CCR u otras lesiones significativas y evitar la práctica de pruebas innecesarias que compitan con las indicaciones de solicitudes preferentes o prioritarias. El objetivo de nuestro estudio, por lo tanto, es evaluar si el TSOHi o la citada CR, son una mejor herramienta de priorización y adecuación de la colonoscopia diagnóstica para la detección de CCR y LSC comparada con la guía EPAGE.
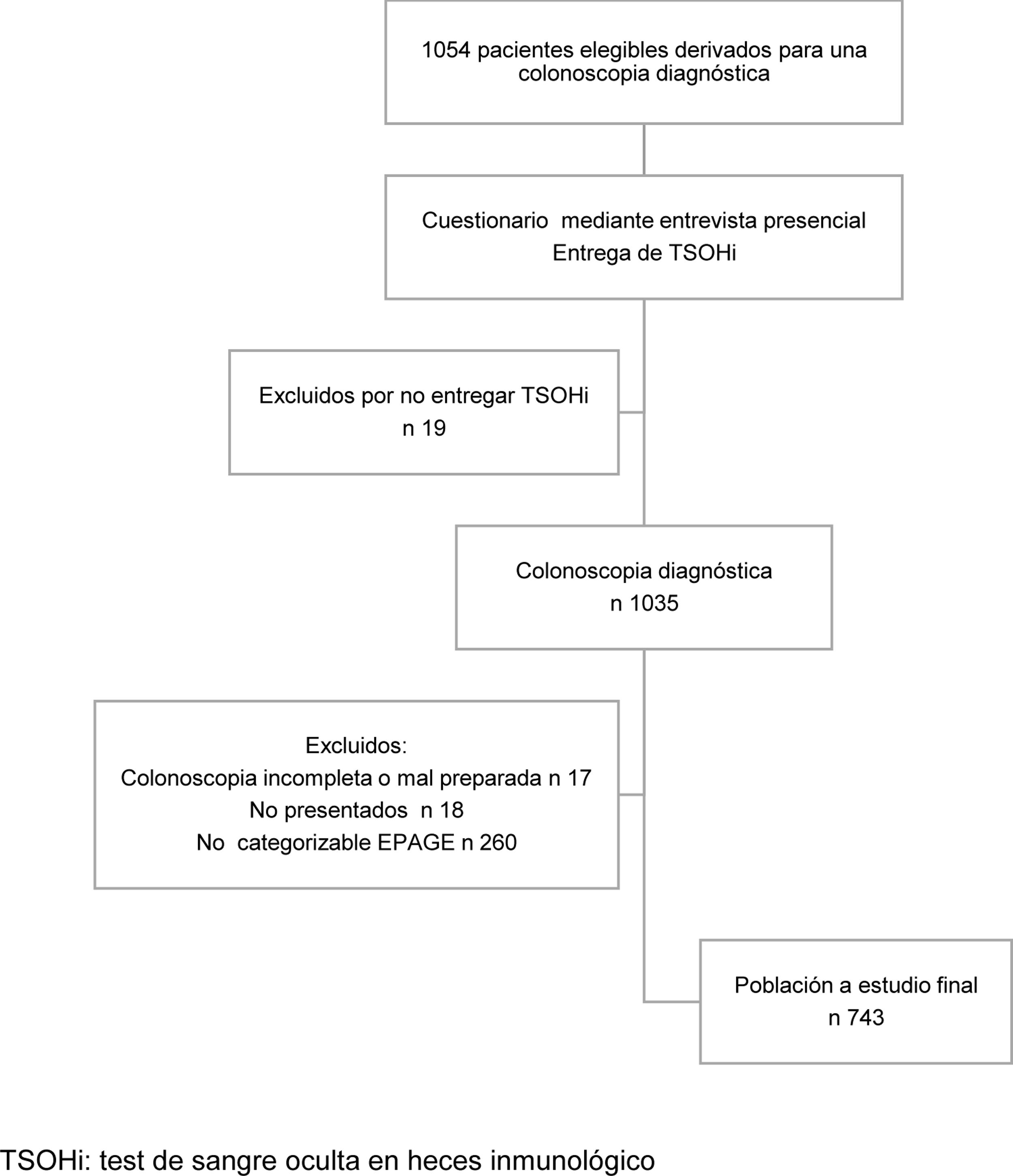
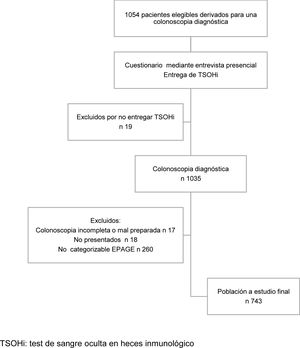
Material y métodosDiseño del estudioSe trata de un análisis post hoc de un estudio previo que calificó el valor del TSOHi como estrategia de priorización de colonoscopias diagnósticas para la detección de NA en pacientes sintomáticos16. Brevemente, se trata de un estudio prospectivo unicéntrico en el que invitamos a participar a todos los pacientes mayores de 18 años a los que se les había solicitado una colonoscopia diagnóstica en el Hospital Universitario de Bellvitge entre septiembre del 2011 y octubre del 2012. Excluimos a aquellas personas a quienes se les había requerido la colonoscopia para el seguimiento de síndromes polipósicos, vigilancia post polipectomía endoscópica o como vigilancia tras la resección de CCR. También, se excluyeron los pacientes hospitalizados con colectomía o con antecedentes personales de enfermedad inflamatoria intestinal (EII). Se descartaron a aquellos individuos que, por sus síntomas o motivo de solicitud de colonoscopia, no se pudieron catalogar en ninguna categoría EPAGE. En el Anexo A se muestra el diagrama de flujo de la selección de pacientes.
Las personas elegibles fueron invitadas a una consulta con la investigadora, en la que se realizó un exhaustivo cuestionario sobre su historial médico, hábitos tóxicos, consumo de fármacos, así como síntomas digestivos. Por último, se confirmó o descartó la presencia de anemia ferropénica en la analítica efectuada como estudio preanestésico previo a la endoscopia. Los pacientes que aceptaron participar, tras firmar el consentimiento informado, recibieron un test de sangre oculta en heces OCSensor Eiken Chemical®, así como las instrucciones para su realización. Las muestras que no fueron adecuadamente recogidas o almacenadas fueron excluidas del estudio. El resto fueron analizadas por un técnico experto mediante el procesador OC sensor MICRO desktop analyser (Eiken Chemical 1 Co., Ltd., Tokyo, Japan). Tanto el técnico como el endoscopista fueron ciegos a los datos del paciente y al resultado del TSOHi.
Todas las colonoscopias fueron efectuadas por endoscopistas experimentados. La colonoscopia se consideró completa si se alcanzó la intubación cecal, demostrada por la visualización de la válvula ileocecal o el orificio apendicular. La preparación intestinal se consideró adecuada según la escala validada de preparación intestinal de Boston. Los datos registrados incluyeron el número, el tamaño y la histología de los pólipos y la presencia o ausencia de CCR. El estudio fue aprobado por el comité científico del Hospital Universitario de Bellvitge-IDIBELL y su comité ético (referencia PR283/11).
Variables a estudioLas variables dependientes analizadas fueron la detección de un CCR y una LSC (definida como la presencia de CCR, adenoma avanzado [AA] o EII). Se definió AA como la presencia de un adenoma ≥ 10 mm, con componente velloso o displasia de alto grado. Se registraron las siguientes variables por su potencial asociación con CCR o LSC: sexo, edad, índice de masa corporal (IMC), diabetes mellitus, dislipemia, antiinflamatorios no esteroides (AINE), terapia antiagregante o anticoagulante, consumo de alcohol y tabaco, antecedentes familiares de riesgo de CCR, historia personal de adenomas colorrectales, anemia ferropénica (AF), síntomas o signos abdominales y la concentración de hemoglobina fecal (Hb-f) medida por el TSOHi. La presencia de AF significativa fue conceptualizada según la definición del National Institute for the Health and Care Excellence (NICE) como una concentración de hemoglobina ≤ 10 g/dL en mujeres y de ≤ 11 g/dL en hombres. Se registró la procedencia de la solicitud, el motivo de derivación, así como la adecuación de la misma, en función de la guía EPAGE. Se consideró el resultado del TSOHi como una variable cuantitativa y cualitativa, utilizando, en este último caso, los siguientes puntos de corte de Hb-f: ≥ 10 μg Hb/g de heces, ≥ 15 μg Hb/g y ≥ 20 μg Hb/g.
Se calculó, además, el valor de un índice de riesgo de NA, es decir CCR o AA, basado en la edad, el sexo y una Hb-f ≥ 10 μg Hb/g de heces, desarrollado en un estudio previo16. De forma resumida, para realizar esta CR de NA, a cada factor independiente de riesgo se le asignó un valor ponderado de acuerdo con sus coeficientes respectivos en el modelo de regresión logística múltiple16. Este sistema de puntuación de riesgo presenta un rango de 0 a 11 puntos en función de la presencia o ausencia de una característica o factor de riesgo en cada sujeto. En la tabla 1 se muestra los factores de riesgo y la calificación asignada a cada uno de ellos.
European Panel on the Appropriateness of Gastrointestinal Endoscopy IIEPAGE II es una guía online de acceso libre diseñada para ayudar a los profesionales de la salud a evaluar la idoneidad de la colonoscopia. Se basa en un cuestionario que incluye signos y síntomas abdominales, edad, antecedentes familiares y personales de CCR y exploraciones previas. Se obtiene una puntuación del 1 al 9, considerando una calificación del 1 al 3 como inapropiada, entre 4 a 6 como indeterminada y del 7 al 9 como apropiada. Para efectuar el análisis estadístico, se plantearon dos categorías de EPAGE. La primera se denominó EPAGE I-A y consideró adecuadas tanto las solicitudes de colonoscopias clasificadas como indeterminadas como aquellas calificadas como apropiadas por el cuestionario que ofrece la guía. La segunda se denominó EPAGE A e incluyó como adecuadas únicamente las solicitudes de colonoscopias clasificadas como apropiadas.
Análisis estadísticoLas variables categóricas se presentaron en formato de número y proporción respecto a la población a estudio (%). Se realizó un análisis univariado de las variables categóricas mediante el análisis X2 y la prueba F de Fisher, y de las variables cuantitativas por medio de la t de Student. Se efectuó un análisis multivariado a través de la regresión logística binaria para identificar los factores predictivos independientes de CCR y LSC, incluyendo a aquellas variables significativas en el análisis univariante (p < 0,05). Se evaluaron, además, las variables no significativas, pero consideradas como relevantes en la literatura científica previa. Los resultados son presentados como odds ratio (OR) y 95% del intervalo de confianza (IC).
La precisión diagnóstica tanto de la guía EPAGE como del TSOHi para la predicción de CCR y LSC fue determinada mediante la valoración del área bajo la curva receiver operating characteristic (ROC). Por último, se calculó el número necesario de endoscopias (NNE) definido como la cantidad de personas con unas determinadas características que deben realizarse una colonoscopia para la detección de un caso de CCR o LSC.
ResultadosHallazgos descriptivosDurante el período del estudio, 1.054 pacientes fueron derivados para la realización de una colonoscopia diagnóstica y, por tanto, candidatos potencialmente elegibles. Finalmente, 743 individuos fueron incluidos en el análisis. Entre los 743 pacientes, 428 (57,6%) fueron remitidos desde atención primaria y 203 (42,4%) desde atención secundaria o terciaria. Se detectaron 17 (2,3%) casos de CCR y 103 (13,9%) casos de LSC, incluyendo 68 (9,2%) AA y 6 (0,8%) casos de EII.
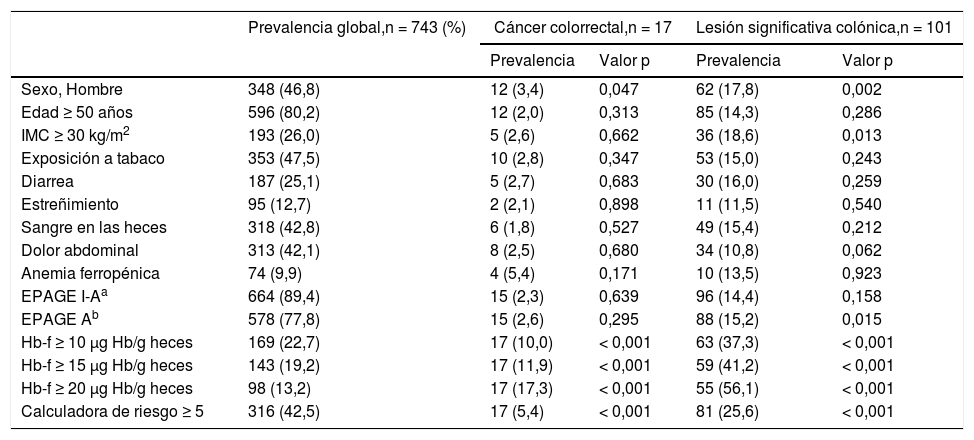
Análisis univariado y multivariado para predicción de cáncer colorrectal y lesión significativa colónicaPara la detección de CCR, el análisis univariado mostró que, el sexo masculino, un TSOHi positivo (en cualquier punto de corte) y un valor ≥ 5 en la CR, fueron factores de riesgo de CCR con diferencias estadísticamente significativas. Ni el EPAGE I-A ni el EPAGE A se asociaron con CCR (tabla 2). El análisis multivariado evidenció que el valor de la Hb-f fue una variable independiente de riesgo de CCR, ajustado por sexo, IMC, edad y EPAGE tanto introducido como variable EPAGE I-A como EPAGE A. Asimismo, el valor obtenido en la CR fue una variable independiente de riesgo de CCR, ajustado por EPAGE, tanto introducido como variable EPAGE I-A ni el EPAGE A (tabla 3, Anexo A).
Prevalencia de cáncer colorrectal y lesión significativa colónica en función de las variables de riesgo
| Prevalencia global,n = 743 (%) | Cáncer colorrectal,n = 17 | Lesión significativa colónica,n = 101 | |||
|---|---|---|---|---|---|
| Prevalencia | Valor p | Prevalencia | Valor p | ||
| Sexo, Hombre | 348 (46,8) | 12 (3,4) | 0,047 | 62 (17,8) | 0,002 |
| Edad ≥ 50 años | 596 (80,2) | 12 (2,0) | 0,313 | 85 (14,3) | 0,286 |
| IMC ≥ 30 kg/m2 | 193 (26,0) | 5 (2,6) | 0,662 | 36 (18,6) | 0,013 |
| Exposición a tabaco | 353 (47,5) | 10 (2,8) | 0,347 | 53 (15,0) | 0,243 |
| Diarrea | 187 (25,1) | 5 (2,7) | 0,683 | 30 (16,0) | 0,259 |
| Estreñimiento | 95 (12,7) | 2 (2,1) | 0,898 | 11 (11,5) | 0,540 |
| Sangre en las heces | 318 (42,8) | 6 (1,8) | 0,527 | 49 (15,4) | 0,212 |
| Dolor abdominal | 313 (42,1) | 8 (2,5) | 0,680 | 34 (10,8) | 0,062 |
| Anemia ferropénica | 74 (9,9) | 4 (5,4) | 0,171 | 10 (13,5) | 0,923 |
| EPAGE I-Aa | 664 (89,4) | 15 (2,3) | 0,639 | 96 (14,4) | 0,158 |
| EPAGE Ab | 578 (77,8) | 15 (2,6) | 0,295 | 88 (15,2) | 0,015 |
| Hb-f ≥ 10 μg Hb/g heces | 169 (22,7) | 17 (10,0) | < 0,001 | 63 (37,3) | < 0,001 |
| Hb-f ≥ 15 μg Hb/g heces | 143 (19,2) | 17 (11,9) | < 0,001 | 59 (41,2) | < 0,001 |
| Hb-f ≥ 20 μg Hb/g heces | 98 (13,2) | 17 (17,3) | < 0,001 | 55 (56,1) | < 0,001 |
| Calculadora de riesgo ≥ 5 | 316 (42,5) | 17 (5,4) | < 0,001 | 81 (25,6) | < 0,001 |
Hb-f: concentración de hemoglobina fecal; IMC: índice de masa corporal.
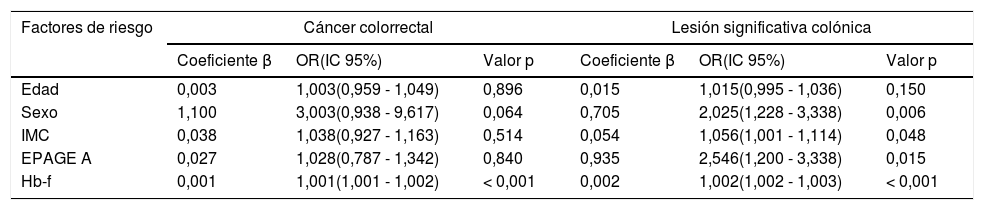
A) Análisis multivariado para la detección de cáncer colorrectal y lesión significativa colónica ajustado por una solicitud considerada apropiada según EPAGE y concentración de hemoglobina fecal
| Factores de riesgo | Cáncer colorrectal | Lesión significativa colónica | ||||
|---|---|---|---|---|---|---|
| Coeficiente β | OR(IC 95%) | Valor p | Coeficiente β | OR(IC 95%) | Valor p | |
| Edad | 0,003 | 1,003(0,959 - 1,049) | 0,896 | 0,015 | 1,015(0,995 - 1,036) | 0,150 |
| Sexo | 1,100 | 3,003(0,938 - 9,617) | 0,064 | 0,705 | 2,025(1,228 - 3,338) | 0,006 |
| IMC | 0,038 | 1,038(0,927 - 1,163) | 0,514 | 0,054 | 1,056(1,001 - 1,114) | 0,048 |
| EPAGE A | 0,027 | 1,028(0,787 - 1,342) | 0,840 | 0,935 | 2,546(1,200 - 3,338) | 0,015 |
| Hb-f | 0,001 | 1,001(1,001 - 1,002) | < 0,001 | 0,002 | 1,002(1,002 - 1,003) | < 0,001 |
| B) Análisis multivariado para la detección de cáncer colorrectal y lesión significativa colónica ajustado por una solicitud considerada apropiada según EPAGE y el valor de la calculadora de riesgo de NA | ||||||
|---|---|---|---|---|---|---|
| Factores de riesgo | Cáncer colorrectal | Lesión significativa colónica | ||||
| Coeficiente β | OR(IC 95%) | Valor p | Coeficiente β | OR(IC 95%) | Valor p | |
| IMC | 0,026 | 1,027(0,917- 1,149) | 0,648 | 0,046 | 1,048(1,300-1,537) | 0,061 |
| EPAGE A | 0,388 | 1,474(0,317- 6,852) | 0,620 | 0,756 | 2,130(1,067-4,252) | 0,032 |
| Calculadora de riesgo | 0,567 | 1,762(1,383-2,2) | < 0,001 | 0,346 | 1,414(1,300-1,537) | < 0,001 |
EPAGE A: solicitud de colonoscopia considerada como apropiada; Hb-f: concentración de hemoglobina fecal. Valor cuantitativo μg Hb/g heces; IMC: índice masa corporal.
Para la detección de LSC, el análisis univariado mostró que el sexo masculino, el IMC, EPAGE, tanto introducido como variable EPAGE I-A como EPAGE A, un TSOHi positivo (en cualquier punto de corte) y un valor ≥ 5 en la CR fueron factores de riesgo de LSC, con diferencias estadísticamente significativas (tabla 2). El análisis multivariado demostró que el sexo masculino, el IMC, EPAGE, tanto introducido como variable EPAGE I-A como EPAGE A, y la Hb-f fueron variables independientes de riesgo de LSC. Asimismo, el valor obtenido en la CR fue una variable independiente de riesgo de LSC ajustado por una solicitud apropiada según EPAGE (tabla 3, Anexo A).
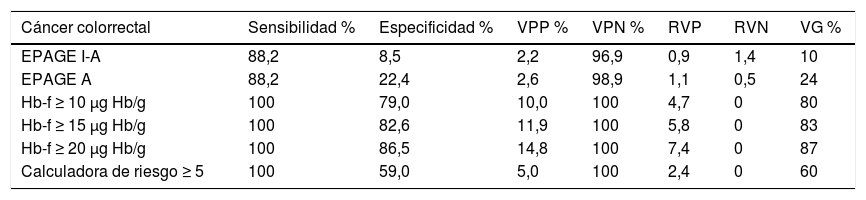
Precisión diagnóstica de EPAGE, del test de sangre oculta en heces y la calculadora de riesgoLa precisión diagnóstica para la detección de CCR y LSC se muestra en la tabla 4. El área bajo la curva ROC del EPAGE para la detección de CCR y LSC fue de 0,61 (IC 95% 0,49 a 0,75) y 0,55 (IC 95% 0,49 a 0,61) respectivamente; del TSOHi fue de 0,95 (IC 95% 0,93 a 0,97) y 0,75 (IC 95% 0,69 a 0,813), respectivamente y de la CR fue 0,90 (IC 95% 0,87 a 0,93) y 0,78 (IC 95% 0,73 a 0,83), respectivamente.
Parámetros de precisión diagnóstica de la guía EPAGE y del valor del test de sangre oculta en heces para el diagnóstico de cáncer colorrectal y lesión significativa colónica
| Cáncer colorrectal | Sensibilidad % | Especificidad % | VPP % | VPN % | RVP | RVN | VG % |
|---|---|---|---|---|---|---|---|
| EPAGE I-A | 88,2 | 8,5 | 2,2 | 96,9 | 0,9 | 1,4 | 10 |
| EPAGE A | 88,2 | 22,4 | 2,6 | 98,9 | 1,1 | 0,5 | 24 |
| Hb-f ≥ 10 μg Hb/g | 100 | 79,0 | 10,0 | 100 | 4,7 | 0 | 80 |
| Hb-f ≥ 15 μg Hb/g | 100 | 82,6 | 11,9 | 100 | 5,8 | 0 | 83 |
| Hb-f ≥ 20 μg Hb/g | 100 | 86,5 | 14,8 | 100 | 7,4 | 0 | 87 |
| Calculadora de riesgo ≥ 5 | 100 | 59,0 | 5,0 | 100 | 2,4 | 0 | 60 |
| Lesión significativa colónica | Sensibilidad % | Especificidad % | VPP % | VPN % | RVP | RVN | VG % |
|---|---|---|---|---|---|---|---|
| EPAGE I-A | 95,0 | 9,2 | 14,1 | 92,2 | 1,0 | 0,5 | 21 |
| EPAGE A | 87,1 | 23,7 | 15,2 | 92,1 | 1,1 | 0,5 | 32 |
| Hb-f ≥ 10 μg Hb/g | 62,3 | 83,5 | 37,2 | 93,4 | 3,7 | 0,4 | 81 |
| Hb-f ≥ 15 μg Hb/g | 58,4 | 83,0 | 41,2 | 93,0 | 4,4 | 0,5 | 83 |
| Hb-f ≥ 20 μg Hb/g | 54,4 | 90,6 | 47,8 | 92,7 | 5,8 | 0,5 | 86 |
| Calculadora de riesgo ≥ 5 | 80,0 | 63,0 | 26,0 | 95,0 | 2,2 | 0,3 | 66 |
EPAGE A: considera adecuadas las solicitudes de colonoscopias clasificadas como apropiadas por EPAGE; EPAGE I-A: considera adecuadas las solicitudes de colonoscopias clasificadas como indeterminadas y apropiadas por la guía EPAGE; Hb-f: concentración de hemoglobina fecal; RVN: razón de verosimilitud negativa; RVP: razón de verosimilitud positiva; VG: valor global; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
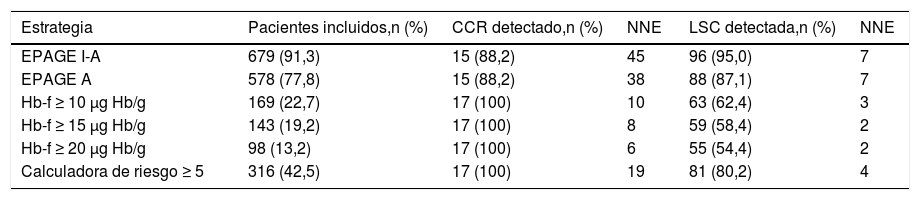
El número de pacientes cuya solicitud fue clasificada como adecuada según EPAGE I-A, EPAGE A y el TSOHi positivo con valores de Hb-f ≥ 10 μg, Hb/g, ≥ 15 μg Hb/g, ≥ 20 μg Hb/g fue de 91,3, 77,8, 22,7, 19,2 y 13,2%, respectivamente. EPAGE I-A y EPAGE A detectaron el 88,2% de los casos de CCR. El TSOHi en cualquiera de sus puntos de corte identificó el 100% del CCR. La tabla 5 muestra las diferentes estrategias de gestión en cuanto al número de pacientes seleccionados y el NNE para detectar un caso de CCR y LSC.
Comparación de las diferentes estrategias de gestión en función del número de pacientes incluidos, cáncer colorrectal y lesión significativa colónica detectada y número necesario de endoscopia para detectar una lesión
| Estrategia | Pacientes incluidos,n (%) | CCR detectado,n (%) | NNE | LSC detectada,n (%) | NNE |
|---|---|---|---|---|---|
| EPAGE I-A | 679 (91,3) | 15 (88,2) | 45 | 96 (95,0) | 7 |
| EPAGE A | 578 (77,8) | 15 (88,2) | 38 | 88 (87,1) | 7 |
| Hb-f ≥ 10 μg Hb/g | 169 (22,7) | 17 (100) | 10 | 63 (62,4) | 3 |
| Hb-f ≥ 15 μg Hb/g | 143 (19,2) | 17 (100) | 8 | 59 (58,4) | 2 |
| Hb-f ≥ 20 μg Hb/g | 98 (13,2) | 17 (100) | 6 | 55 (54,4) | 2 |
| Calculadora de riesgo ≥ 5 | 316 (42,5) | 17 (100) | 19 | 81 (80,2) | 4 |
CCR: cáncer colorrectal; EPAGE A: considera adecuadas las solicitudes de colonoscopias clasificadas como apropiadas por EPAGE; EPAGE I-A: considera adecuadas las solicitudes de colonoscopias clasificadas como indeterminadas y apropiadas por la guía EPAGE; Hb-f: concentración de hemoglobina fecal; LSC: lesión significativa colónica; NNE: número necesario de endoscopias.
Nuestro estudio demuestra que la Hb-f medida por un TSOHi es una herramienta de priorización y adecuación para la detección de CCR superior a la guía EPAGE en los pacientes a los que se les ha solicitado una colonoscopia diagnóstica.
La actual pandemia por el virus SARS-CoV-2 ha supuesto la paralización de las unidades de endoscopia digestiva, provocando una lista de espera difícilmente asumible por un sistema que, además, debe iniciar su actividad de forma progresiva. Nos planteamos, por tanto, cuál es la mejor forma de gestionar esta lista de espera en términos de adecuación y priorización. Es decir, no solo es relevante seleccionar qué pacientes realmente requerirán un estudio endoscópico, sino también identificar, dentro de la lista de espera, cuáles necesitarán un estudio endoscópico prioritario.
En términos de priorización, debemos ser conscientes de que el rendimiento de los síntomas abdominales para identificar CCR es bajo. De forma global, solo el 2% de los pacientes con síntomas abdominales fueron diagnosticados de CCR9,10,17,18. Por ello, una gestión basada únicamente en estos puede llevar a la pérdida o al retraso diagnóstico de personas con lesiones relevantes. Además, no existe en la literatura ningún síntoma o signo abdominal que se haya asociado con la presencia de AA. La guía de práctica clínica NICE para el diagnóstico de CCR, utiliza una combinación de síntomas relacionados con la edad, lo que aumenta el valor predictivo positivo (VPP) de los síntomas por separado19,20. Asimismo, existe evidencia sobre la superioridad del TSOHi respecto a las guías clínicas basadas en síntomas como circuito de diagnóstico rápido de CCR16,21. Desde el año 2018, y con base en la evidencia científica disponible, la guía NICE incluye el TSOHi como herramienta de priorización en los circuitos de diagnóstico rápido de CCR20.
A pesar de ser criterios simples, el uso de los síntomas de alarma o del TSOHi no se encuentra extendido en la práctica diaria en nuestro medio. Es más, en nuestro país, no existe consenso sobre cuáles son los signos o síntomas que deben ser considerados como preferentes. En la mayoría de los casos, el médico decide la priorización basándose en una explicación subjetiva de una solicitud. Por lo tanto, la situación generada por la COVID-19 ha dejado patente nuestras deficiencias en los circuitos de priorización de endoscopias digestivas.
En términos de adecuación, diferentes sociedades científicas han elaborado guías para establecer las indicaciones de colonoscopia. Concretamente, el EPAGE desarrolló una que determina la adecuación de la colonoscopia con base en la evidencia científica evaluada por un comité de expertos internacional. La SEED y la AEG han propuesto la guía EPAGE como estrategia de adecuación de colonoscopias en el momento actual7. La aplicabilidad de esta fue validada en nuestro medio11,12, demostrando una asociación significativa entre la correcta indicación de la exploración y el hallazgo de lesiones significativas (42 vs. 21%, p < 0,001). De este trabajo, se deduce que, ajustarse a la EPAGE podría seleccionar mejor a los pacientes que requieren una colonos-copia, si bien demuestra limitaciones. Por un lado, más de la mitad de los individuos evaluados como indicación adecuada no tenían ninguna lesión, mientras que, hasta un 20% de las colonoscopias identificadas como inadecuadas tenían una lesión significativa11.
En los últimos años, se ha centrado la atención en la búsqueda de biomarcadores que nos permitan predecir la presencia de CCR o LSC entre aquellos pacientes que muestran síntomas abdominales, siendo el más estudiado el TSOHi13,14,21–23. McDonald et al. evaluaron si la determinación de Hb-f, medida a través de un TSOHi, podía ayudar a decidir qué personas con síntomas abdominales se beneficiarían de una colonoscopia22. Los autores observaron que los sujetos con enfermedad colorrectal significativa presentaron una mediana de Hb-f de 15 μg Hb/g heces, significativamente superior a la de los participantes sin enfermedad relevante (p < 0,0001). Westwood et al. realizaron una revisión sistemática incluyendo nueve estudios que evaluaban el valor de la Hb-f en población sintomática. Los autores concluyeron que una Hb-f ≥ 10 μg Hb/g heces permitía detectar correctamente los pacientes con CCR y evitaba el 75 a 80% de las colonoscopias en individuos sintomáticos24.
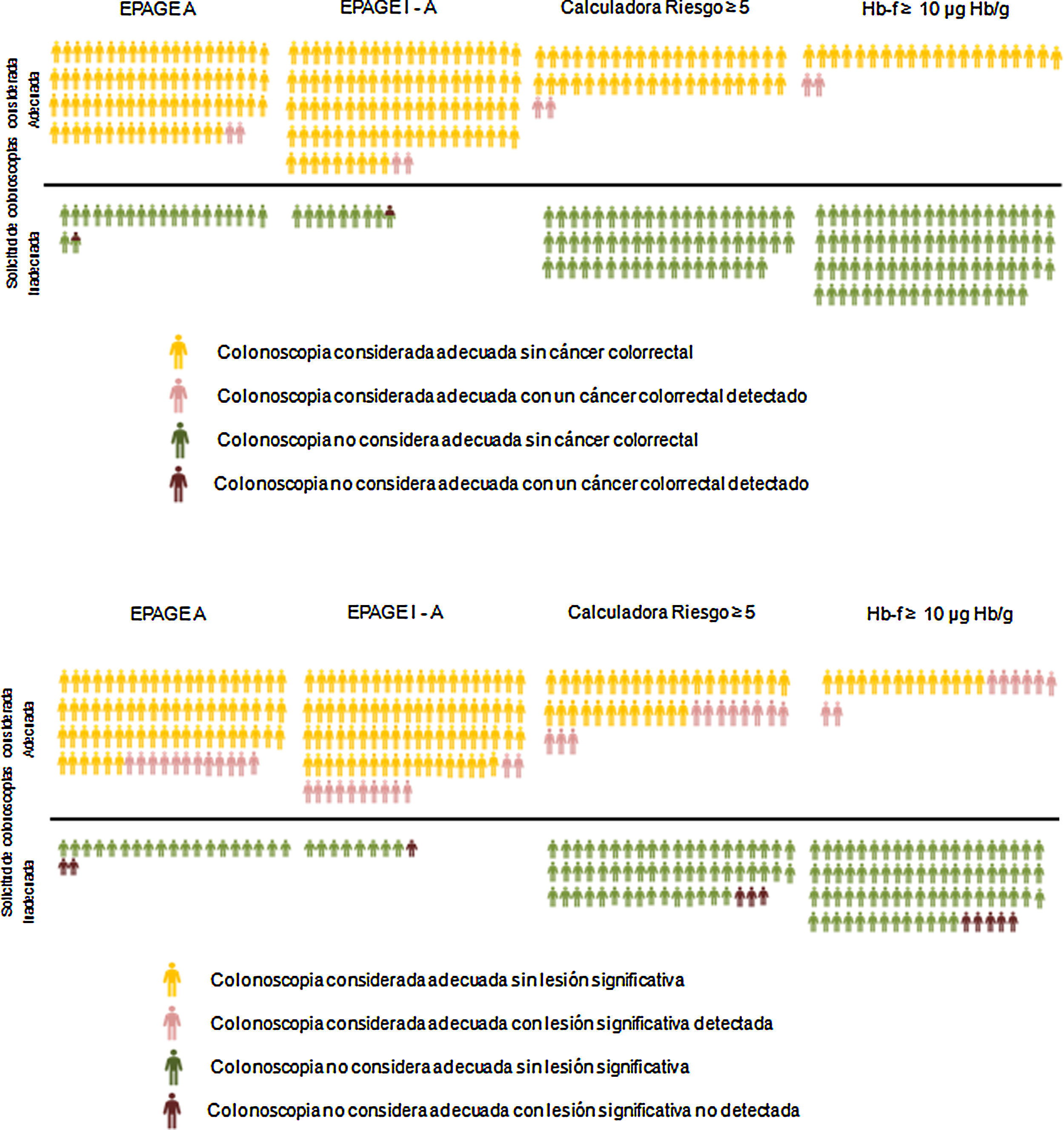
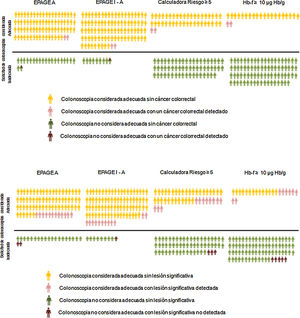
En nuestro estudio, el valor de la guía EPAGE no se asocia con el diagnóstico de CCR. Sin embargo, el TSOHi fue una variable independiente de riesgo para el diagnóstico de CCR, siendo el área bajo la curva ROC claramente superior para la Hb-f medida por el TSOHi respecto al EPAGE (95,3 vs. 61,8). Si comparamos, como estrategia de gestión de la lista de espera de colonoscopia, la EPAGE con el TSOHi positivo, en sus diferentes puntos de corte, observamos que la primera considera como indeterminado o apropiado prácticamente todas las solicitudes (92% del total) sin embargo, hay dos pacientes con CCR que serían clasificados como inadecuados, y por tanto, no hubieran sido diagnosticados. El TSOHi considera adecuado un porcentaje menor de solicitudes (13 a 22%), clasificando como solicitudes adecuadas a todos los pacientes con CCR. Debemos ser conscientes de que entre los individuos pendientes de la realización de la prueba existen algunos con CCR no detectado. Por lo tanto, debemos centrar nuestros esfuerzos en identificar a estos pacientes. En este sentido, el concepto del NNE nos puede ayudar a identificar la mejor estrategia (tabla 5). Si empleamos la guía EPAGE I-A o EPAGE A deberíamos efectuar 45 o 38 colonoscopias, respectivamente, para identificar un CCR. Si utilizamos el TSOHi como estrategia de gestión, deberíamos realizar entre seis a 10 pruebas para detectar un CCR. En la figura 1 se muestra de forma gráfica el porcentaje de solicitudes de colonoscopias consideradas adecuadas en función de la estrategia usada, así como el número de CCR y LSC detectados tanto en las solicitudes adecuadas como inadecuadas.
A) Porcentaje de solicitudes de colonoscopias consideradas adecuadas en función de la estrategia utilizada y el número de individuos con cáncer colorrectal detectado tanto en las solicitudes adecuadas como inadecuadas. B) Porcentaje de solicitudes de colonoscopias consideradas adecuadas en función de la estrategia utilizada y el número de individuos con lesión significativa colónica detectada tanto en las solicitudes adecuadas como inadecuadas.
En términos de adecuación, también es relevante la detección de LSC, no solo el diagnóstico de CCR. Se trata de identificar a aquellos pacientes a los que una colonoscopia no les aportará valor añadido en su proceso diagnóstico. Si bien, la guía EPAGE detecta aproximadamente el 90% de las LSC, lo hace a expensas de la realización de prácticamente todas las exploraciones solicitadas (91%). Si consideramos una solicitud de colonoscopia adecuada a aquélla con un TSOHi positivo, con valores de Hb-f ≥ 10 μg Hb/g, se seleccionaría aproximadamente al 20% de los pacientes. Con esta estrategia detectaríamos el 60% de las LSC, incluyendo al 100% de aquellos con CCR. El NNE para EPAGE y TSOHi para la detección de una LSC es de siete y tres, respectivamente.
La precisión diagnóstica del TSOHi es limitada en cuanto a la detección de adenoma avanzado. Por ello, en un estudio previo, diseñamos una CR de NA mediante el cálculo sencillo de tres variables que se muestran en la tabla 116. A mayor puntuación obtenida, mayor riesgo de que el paciente fuese diagnosticado de NA en el estudio endoscópico. En nuestro estudio, el valor obtenido por esta CR, que abarcaba un rango de 0 a 11, fue un factor de riesgo independiente tanto para CCR como para LSC. Con base en el área bajo la curva, consideramos que una puntuación superior a 5 en dicho cálculo, mostraba un punto óptimo entre sensibilidad y especificidad para la detección de LSC. Por lo tanto, una puntuación superior o igual a 5 en la CR, implica la posible anulación del 58% de las solicitudes de colonoscopia, detectando el 100% del CCR y el 80% de LSC. Es más, este sistema de clasificación numérico, permitiría no solo la adecuación de las exploraciones, sino también su priorización, realizandose, en primer lugar, a aquellos pacientes con mayor puntuación, que presentan más riesgo de CCR o LSC.
Nuestro estudio presenta varias limitaciones. En primera instancia, fue realizado en un hospital terciario por lo que puede existir un sesgo de selección. Sin embargo, se trata de una unidad de endoscopia de acceso abierto y la mayor parte de las solicitudes proceden del ámbito de atención primaria. En segundo lugar, evaluamos el valor de un TSOHi para adecuar solicitudes de colonoscopia. En la práctica clínica, muchos de los pacientes derivados para una colonoscopia diagnóstica no poseen el resultado de un TSOHi. No obstante, se trata de un test sencillo de realizar, no sometido a subjetividad como los síntomas, económico y cuyo resultado puede estar disponible en 24 a 48 horas. En el contexto actual, consideramos que las dificultades técnicas que pueden surgir por solicitar un TSOHi a los pacientes en lista de espera de colonoscopia, son ampliamente superadas por sus beneficios a la hora de adecuar y priorizar exploraciones. Por otro lado, determinar de forma fiable la adecuación de EPAGE, utilizando el motivo de solicitud de colonoscopia puede ser una tarea complicada que depende de la información recibida para la derivación y que puede ser incompleta. Por último, tener un resultado cuantitativo, como el ofrecido por el TSOHi o la CR, permite adoptar el punto de corte óptimo en función de la disponibilidad de nuestras unidades de endoscopia.
Como conclusión, el TSOHi es un método de priorización y adecuación superior a EPAGE para la detección de CCR. Para el diagnóstico de LSC, el cálculo sencillo de tres variables (edad, sexo y valor del TSOHi) puede ayudarnos a seleccionar los pacientes que realmente requieran una colonoscopia y priorizar a aquéllos con mayor riesgo. Es importante ser consciente de que la adecuación o priorización solo por síntomas supone asumir la pérdida de un porcentaje no despreciable de pacientes con CCR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Ester Quilez por su soporte administrativo y a Natividad Valera por su asistencia técnica en la lectura del test de sangre oculta en heces.