Los ovarios son sitios frecuentes de metástasis, siendo el principal órgano reproductor afectado. Se describe que entre el 10 al 20% de los tumores bilaterales de ovario serán de origen metastásico. Es posible dividirlos en tumores metastásicos no Krukenberg y tumores de Krukenberg; cada uno de ellos puede tener características particulares en cuanto a edad de presentación y pronóstico. El diagnóstico histopatológico puede ser un verdadero reto, requiriéndose en ocasiones estudios especiales de inmunohistoquímica para poder identificar el sitio del tumor primario. No es posible definir un protocolo de tratamiento para estas pacientes, ya que los múltiples orígenes primarios de las neoplasias y su diversa extensión lo dificultan, conllevando a un mal pronóstico al momento de su diagnóstico. Las características evolutivas y pronósticas son determinadas por el comportamiento biológico del tumor primario y no tanto por la presencia de enfermedad metastásica al ovario.
The ovaries are common sites of metastases, being the most common reproductive organ affected. Between 10% and 20% of bilateral ovarian tumours are considered to be metastatic disease. They can be divided into non-Krukenberg metastatic tumours or Krukenberg tumours, each of which can have particular characteristics regarding age of presentation and prognosis. Histopathological diagnosis can be a real challenge, which will require of special immunohistochemistry stains to identify the primary tumour site. It is not possible to define a treatment protocol for these patients, since the multiple primary sources of neoplasms and its diverse extension hinder this, leading to a poor prognosis at the time of diagnosis. Clinical course and prognosis are determined by the biological behaviour of primary neoplasm and not so much by the presence of metastasis to the ovary.
El ovario es un blanco frecuente de metástasis de neoplasias malignas provenientes de sitios distantes y constituye el principal órgano reproductor femenino afectado por este tipo de lesiones1-4.
Los tumores metastásicos a ovario representan aproximadamente del 5 al 6% de la totalidad de los tumores malignos de ovario en la literatura internacional. Sin embargo, en zonas geográficas donde el cáncer gástrico se considera endémico, esta incidencia puede ser tan alta como hasta del 30%1,4,5.
Los tumores metastásicos a ovario carecen de un abordaje diagnóstico y un tratamiento estandarizado en la literatura internacional, lo que conlleva un mal pronóstico al momento de su diagnóstico, siendo difícil conocer con precisión la incidencia real de este tipo de tumores, ya que pueden ser encontrados incidentalmente durante la cirugía como tratamiento primario de alguna otra patología, en la autopsia o en el momento de realizarse una ooforectomía profiláctica1,2,6,7.
Se estima que el 70% de las metástasis a ovario son bilaterales. Por otra parte se describe que entre el 10 y el 20% de los tumores bilaterales de ovario son de origen metastásico. Un bajo porcentaje de las pacientes afectadas tienen bien documentado el diagnóstico de neoplasia maligna en algún otro sitio, ya que en la mayoría de los casos ocurre como primera manifestación de la enfermedad3,8.
Tumor metastásico no KrukenbergLa mayoría de los tumores metastásicos no Krukenberg a ovario son originados del tracto gastrointestinal, mama y de origen ginecológico, más comúnmente: estómago, colon-recto, vía biliar, mama y endometrio; otros sitios primarios pero de raro involucro son: intestino delgado, apéndice cecal, páncreas, cuerpo uterino, cérvix, vejiga y pelvis renal1,2,5,9,10. La leucemia y los linfomas también han sido descritos como neoplasias que afectan estos órganos; sin embargo, a estos se les denomina infiltración, y no propiamente enfermedad metastásica11.
Las pacientes con metástasis ováricas tienden a ser más jóvenes que las que presentan el mismo tipo de tumor primario sin afección ovárica. Esto mismo se describe al comparar tumores metastásicos a ovario de origen ginecológico contra los de origen no ginecológico2,6,12-14.
Se han descrito varias vías de propagación para las metástasis a ovario: por contigüidad, vía sanguínea, vía linfática y transperitoneal. El mecanismo por el cual las células metastásicas de origen no ginecológico llegan al ovario es incierto, a excepción del caso de diseminación directa, si bien se acepta que en la mayor parte de los casos el mecanismo es por vía linfática o sanguínea1,3,9,11,15,16.
Megibow et al., en un intento por explicar la selectividad de las células neoplásicas hacia el ovario, postularon en 1985 que la vascularidad ovárica aumentada de la mujer fértil o la superficie lesionada por una reciente ovulación pueden ser factores determinantes para la alta incidencia de metástasis a ovario en las mujeres premenopáusicas17. Por su parte, Lou et al. proponen que la sobreexpresión del factor vascular-endotelial de crecimiento (VEGF), las metaloproteínas proteolíticas tipo2 y 9 y la molécula de adhesión CD44v6 son factores determinantes en el proceso de invasión y metástasis de los tumores18.
Desde el punto de vista clínico, los tumores metastásicos a ovario, al igual que los primarios de ovario, suelen evolucionar silenciosa y libremente hacia el abdomen sin producir molestias, hasta que adquieren un volumen considerable. Aunque se ha descrito que hasta en el 90% de las ocasiones las pacientes presentan sintomatología de involucro ovárico como lo es el dolor pélvico y signos de compresión de órganos pélvicos, no resulta extraño que se consulte por aumento del perímetro abdominal, o que sea detectado al azar durante un examen físico2,4,5,19.
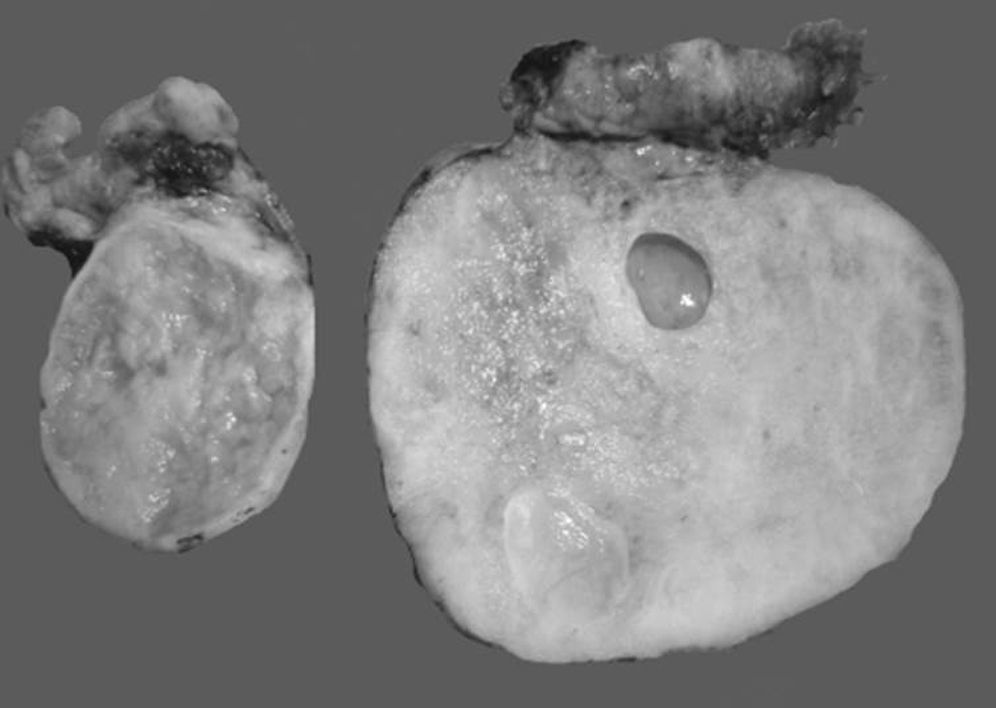
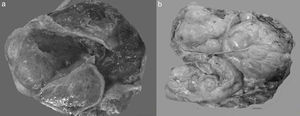
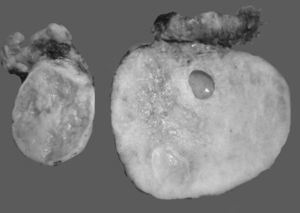
En algunos casos es difícil distinguir si se trata de un tumor primario de ovario o metastásico. Esto especialmente ocurre con el cáncer de colon, en el cual se describe que el 45% de los tumores metastásicos de colon a ovario se diagnostican previamente como primarios de ovario. Las metástasis de adenocarcinoma de colon son los tumores que simulan con mayor frecuencia un carcinoma primario de ovario, estimándose que del 10 al 30% de las mujeres con carcinoma de colon presentarán focos tumorales secundarios en el ovario1,2,13,20,21. A simple vista son indistinguibles del carcinoma ovárico primario, y en el examen macroscópico se ve que en muchas ocasiones simulan un cistadenocarcinoma primario del ovario22,23, tal como se muestra en la figura 1.
Fotos comparativas de una neoplasia mucinosa primaria de ovario (a) y un adenocarcinoma mucinoso metastásico a ovario (b). A simple vista no es posible distinguir entre una neoplasia primaria y una metastásica, ya que ambas son de gran tamaño, multiloculares y con presencia de abundante mucina.
Una interesante neoplasia de ovario de carácter metastásico es, sin duda, el denominado tumor de Krukenberg, que puede llegar a constituir del 30 al 40% de los cánceres metastásicos en este órgano, incidencia que puede variar según el área geográfica estudiada y la incidencia propia de los tumores primarios. El tumor de Krukenberg puede constituir del 1 al 2% de los tumores malignos de ovario en algunas instituciones7,14,19,24.
El término «tumor de Krukenberg» es frecuentemente usado de manera errónea para designar todas las metástasis a ovario provenientes del tracto gastrointestinal, o cualquier metástasis que afecte al ovario, sin importar su origen, pasando por alto las características histológicas propias del tumor de Krukenberg11.
Este tumor fue descrito por primera vez en 1896 por Friedrich Krukenberg7,8,19,24,25 como un fibroma primitivo que se distingue por células mucosecretoras en forma de bague à châton (anillo de sello)8. En 1854, sir James Paget fue uno de los primeros en describir un tumor similar al que porta el nombre de tumor de Krukenberg en la actualidad: en su escrito Lectures notes on surgical pathology describió una distintiva forma de tumor de ovario asociado a cáncer mamario o gástrico de naturaleza firme y fibrosa, mas no describe si el tumor en ovario era primario o secundario5,8.
Puede ocurrir a cualquier edad, se observa más frecuentemente alrededor de 30 a 40 años, y es mucho menor su incidencia durante la menopausia. Su evolución clínica se caracteriza por el crecimiento rápido; el proceso ocurre de manera bilateral en el 60 al 80% de los casos, a menudo acompañado de ascitis5,8,10,11,24,26-28.
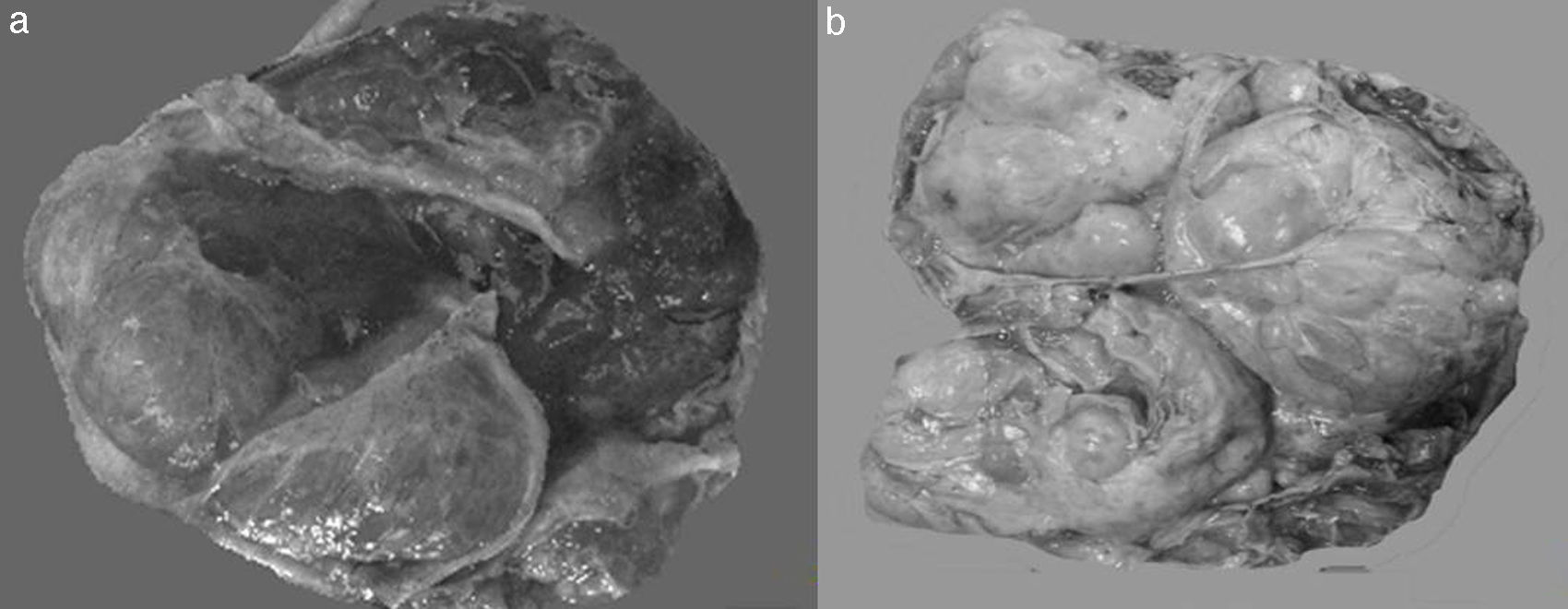
Desde el punto de vista macroscópico, constituyen tumores sólidos que tienden a conservar la forma general de los ovarios; su superficie es lisa, irregularmente esférica, aunque puede ser francamente nodular. Además, aunque hayan alcanzado un tamaño considerable, están generalmente propensos a quedar libres, sin adherencias a estructuras circundantes, son de tamaño promedio de 10cm y rara vez exceden los 20cm. En la superficie de corte son predominantemente blanco grisáceo o amarillo pálido, con frecuentes áreas de coloración café o roja en presencia de necrosis o hemorragia. Presentan una consistencia firme, carnosa (esponjosa) o gelatinosa, lo que depende de la cantidad de edema o mucina dentro del estroma, de la hipercelularidad estromal y de la fibrosis (fig. 2)3,5,8,16,27.
Al examen microscópico se observan como pequeñas agrupaciones de células epiteliales mucíparas, incluidas en un estroma fibroso, más o menos maduro (infiltración difusa del estroma ovárico), que en algunos casos puede adoptar un aspecto francamente sarcomatoide. Las células mucosecretoras muestran un perfil peculiar, en pequeñas o grandes agrupaciones, de contorno tenue, redondeado u oval; presentan un citoplasma generalmente pálido y vacuolado, que puede ser basófilo o eosinófilo, caracterizado por la acumulación de material mucoso y consiguiente desplazamiento periférico del núcleo, el cual se aplana y comprime contra la membrana, confiriendo en conjunto la forma de una sortija o anillo de sello; estas células deben estar presentes en al menos en el 10% de la totalidad del tumor5,7,8,10,19,27. El estroma es usualmente edematoso, pero puede recordar un típico fibroma, y las acumulaciones de mucina suelen ser copiosas. Pueden observarse células estromales luteinizadas, sobre todo en pacientes embarazadas5.
El panel de inmunohistoquímica puede ser imprescindible para determinar el sitio del tumor primario; ciertos marcadores, como cdx2+/hep par 1+/er-/, sugieren origen gástrico; muc2+/cdx2+/muc5ac+/muc-1/her par 1-/er-/ sugiere origen en colon; muc1+/ck7+/er+/ sugiere origen en mama5.
Se han intentado describir características propias del tumor de Krukenberg en imágenes de resonancia magnética nuclear/T2 para el diagnóstico temprano de la enfermedad, como son la frecuente bilateralidad de la lesión, los márgenes y su configuración oval, el observar tumores sólidos que muestran imágenes heterogéneas de alta y baja intensidad. Se describen áreas de intensidad disminuida de localización al azar o periférica que histológicamente corresponden al incremento de la celularidad y fibrosis, y áreas de intensidad aumentada que representan áreas de edema del tejido conectivo al corte. Sin embargo, los resultados son sugestivos, mas no específicos para el diagnóstico de tumor de Krukenberg11,28.
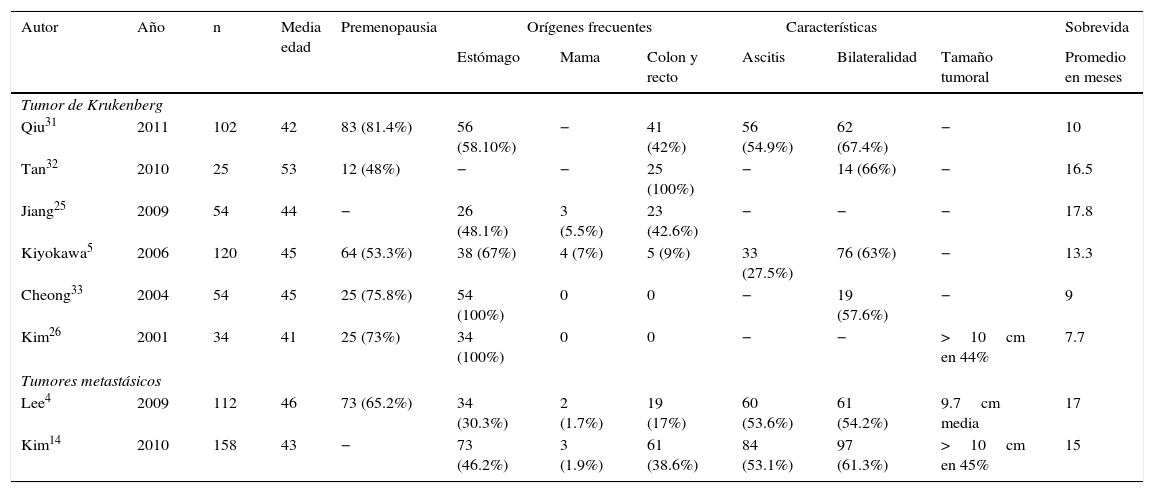
Pronóstico de la enfermedad metastásica a ovariosLos tumores metastásicos a ovario son neoplasias infrecuentes y de pobre pronóstico al momento de su diagnóstico, ya que la gran mayoría de los pacientes afectados mueren dentro del primer año al diagnóstico de esta enfermedad incluso con tratamiento29. Kim et al. mencionan una sobrevida global (SG) de 7.7 meses aun con tratamiento en 34 pacientes durante un seguimiento de 32.2 meses promedio; en pacientes sin enfermedad residual posterior a tratamiento quirúrgico se describe una SG de 10.9 meses, y de 7.5 meses para aquellas con enfermedad residual postratamiento; además describen que los pacientes con enfermedad limitada a la pelvis presentaban SG de 10.9 meses contra SG de 3.6 meses para aquellas pacientes con enfermedad fuera de abdomen y pelvis, documentando que la ausencia de enfermedad macroscópica postratamiento y la extensión de la enfermedad son factores pronósticos favorables26. Por otra parte, Petru et al. describen SG del 18% a 5 años con enfermedad residual <2cm y del 4% con residual >2cm, con una SG a 5 años del 10% en pacientes con cáncer metastásico no genital30. De manera similar, Ayhan et al. describen una SG del 36% a 5 años para este mismo tipo de pacientes, describiendo también el efecto beneficio en SG de la citorreducción óptima2.
En la tabla 1 podemos observar que las series internacionales que muestran datos al respecto de estas neoplasias tienen un número reducido de pacientes, y así mismo es evidente que la sobrevida de estas pacientes es pobre. Debemos hacer notar que existe una importante heterogeneidad en el reporte de los datos clínicos de las pacientes en las diferentes series mencionadas. Es claro que no es posible definir un protocolo de tratamiento para estas pacientes, ya que los múltiples orígenes de los tumores primarios, así como su diversa extensión, dificultan la estandarización del manejo hasta nuestros días.
Tumores metastásicos a ovarios
| Autor | Año | n | Media edad | Premenopausia | Orígenes frecuentes | Características | Sobrevida | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Estómago | Mama | Colon y recto | Ascitis | Bilateralidad | Tamaño tumoral | Promedio en meses | |||||
| Tumor de Krukenberg | |||||||||||
| Qiu31 | 2011 | 102 | 42 | 83 (81.4%) | 56 (58.10%) | − | 41 (42%) | 56 (54.9%) | 62 (67.4%) | − | 10 |
| Tan32 | 2010 | 25 | 53 | 12 (48%) | − | − | 25 (100%) | − | 14 (66%) | − | 16.5 |
| Jiang25 | 2009 | 54 | 44 | − | 26 (48.1%) | 3 (5.5%) | 23 (42.6%) | − | − | − | 17.8 |
| Kiyokawa5 | 2006 | 120 | 45 | 64 (53.3%) | 38 (67%) | 4 (7%) | 5 (9%) | 33 (27.5%) | 76 (63%) | − | 13.3 |
| Cheong33 | 2004 | 54 | 45 | 25 (75.8%) | 54 (100%) | 0 | 0 | − | 19 (57.6%) | − | 9 |
| Kim26 | 2001 | 34 | 41 | 25 (73%) | 34 (100%) | 0 | 0 | − | − | >10cm en 44% | 7.7 |
| Tumores metastásicos | |||||||||||
| Lee4 | 2009 | 112 | 46 | 73 (65.2%) | 34 (30.3%) | 2 (1.7%) | 19 (17%) | 60 (53.6%) | 61 (54.2%) | 9.7cm media | 17 |
| Kim14 | 2010 | 158 | 43 | − | 73 (46.2%) | 3 (1.9%) | 61 (38.6%) | 84 (53.1%) | 97 (61.3%) | >10cm en 45% | 15 |
Es necesario especificar si se trata de un tumor metastásico a ovario con o sin características de tumor de Krukenberg, ya que esta diferencia pudiera orientar al tratamiento de la paciente. Sin embargo, las características clínicas, evolutivas y pronósticas son determinadas por el comportamiento biológico del tumor primario y no tanto por la presencia de enfermedad metastásica al ovario en forma específica; dicho de otra manera, el hecho de tener la enfermedad pélvica es lo que da el pronóstico desfavorable, debido a que el tumor primario ha invadido órganos distantes.
El beneficio de la cirugía es limitado; sin embargo, se sugiere que la citorreducción óptima puede ser un factor asociado a una supervivencia global mayor. La probabilidad de recurrencia y/o progresión es independiente del tipo de enfermedad metastásica de que se trate, ya sea tumor de Krukenberg o tumor metastásico no Krukenberg.
Es necesario continuar el estudio de la enfermedad metastásica al ovario, ya que es un evento relativamente frecuente y un reto diagnóstico por no cursar con un cuadro clínico característico, además de requerir una evaluación histopatológica exhaustiva y experimentada, que precisa un manejo integral multidisciplinario; así mismo es necesario explorar biomarcadores que pudieran ser de utilidad tanto pronóstica como para orientación terapéutica.
FinanciaciónNo se han recibido apoyos para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.