El plasmocitoma óseo solitario (POS), es el menos frecuente de las neoplasias de células plasmáticas, aparece más a menudo en la quinta década de vida, su sintomatología está relacionada al dolor óseo crónico.
A continuación, presentamos el primer reporte en la literatura médica de una rara coexistencia de una lesión vertebral infiltrante por un plasmocitoma solitario con un absceso en el músculo psoas, caracterizamos este cuadro y relacionamos esta coincidencia que confunde en el diagnóstico de POS.
The solitary bone plasmacytoma (SBP) is the least common of the plasma cell neoplasms, most often appears in the fifth decade of life, and their symptoms are related to chronic bone pain.
We present the first case report in the literature of a rare coexistence of an infiltrating spinal injury by a solitary plasmacytoma with an abscess in the psoas muscle; we characterize this coincidence that confuses the diagnosis of SBP.
Introducción
El plasmocitoma óseo solitario (POS) hace algunos años fue considerado como una forma de mieloma múltiple (MM), sin embargo posee una clínica, serología e imagenología particular; el diagnóstico se fundamenta en comprobar una lesión única y aislada en un tejido óseo específico1. El caso fue investigado en el Hospital José Carrasco Arteaga (HJCA) en Ecuador con un seguimiento de 6 meses; se trata de un paciente masculino, procedente de Azogues, Cañar, Ecuador, con antecedentes de complicaciones por su diabetes, no tiene antecedentes familiares de enfermedad semejante; el cuadro debutó con una lumbalgia crónica con presentación de sintomatología radicular y ante la ausencia de antecedentes traumáticos se descartó compresiones radiculares, mecánicas, frecuentes como hernias discales. Al inicio se trató como una infección estafilocócica por la positividad en el cultivo de lesiones del músculo psoas, y después de realizar estudios minuciosos de imagen y patología se evidenció el POS, iniciándose la radioterapia (RT); a continuación se describe como una patología infecciosa coexiste con un cuadro oncológico en la misma localización, objetivo de este manuscrito.
Presentación de caso
Masculino de 54 años de edad, con antecedentes de: diabetes mellitus tipo 2 (DM2) diagnosticado hace 21 años, hipertensión arterial tipo 2 (HTA2) hace 5 años y enfermedad renal crónica (ERC) estadio 5D (tratado con hemodiálisis trisemanal) hace un año. Acude a emergencia del HJCA refiriendo cuadro de lumbalgia derecha intensa, con irradiación hacia todo el miembro inferior, de tipo punzante, de 3 meses de evolución, que se acompaña de sensación de parestesias intensas en la misma región anatómica y disminución de fuerza muscular en miembro inferior derecho. En sus antecedentes personales patológicos recientes, destaca hace 2 meses y medio al ingreso, colocación de injerto arteriovenoso protésico en brazo izquierdo con complicación de infección en lugar de herida quirúrgica con el aislamiento de Staphylococcus aureus (S. aureus) en el cultivo de la misma. Los signos vitales en el ingreso fueron normales, se observa palidez central y periférica, en región lumbar existe dolor a la palpación profunda y limitación en movimientos de la columna vertebral con presencia de signo del músculo psoas, la curvatura lumbar no se aplana en flexión vertebral. El resto de regiones anatómicas sin alteración.
En el examen neurológico se evidencia: disminución en fuerza muscular de extremidad inferior derecha (3/5), hiporreflexia rotuliana (L2-L4) derecha (+/+++), ausencia de clonus, signo de Babinski y sucedáneos en ambos miembros inferiores. Al examen de sensibilidad superficial y profunda: dolor irradiado a la cara interna del muslo (niveles L2 y L3) e hipostesia en región interna de éste (niveles L2 y L3).
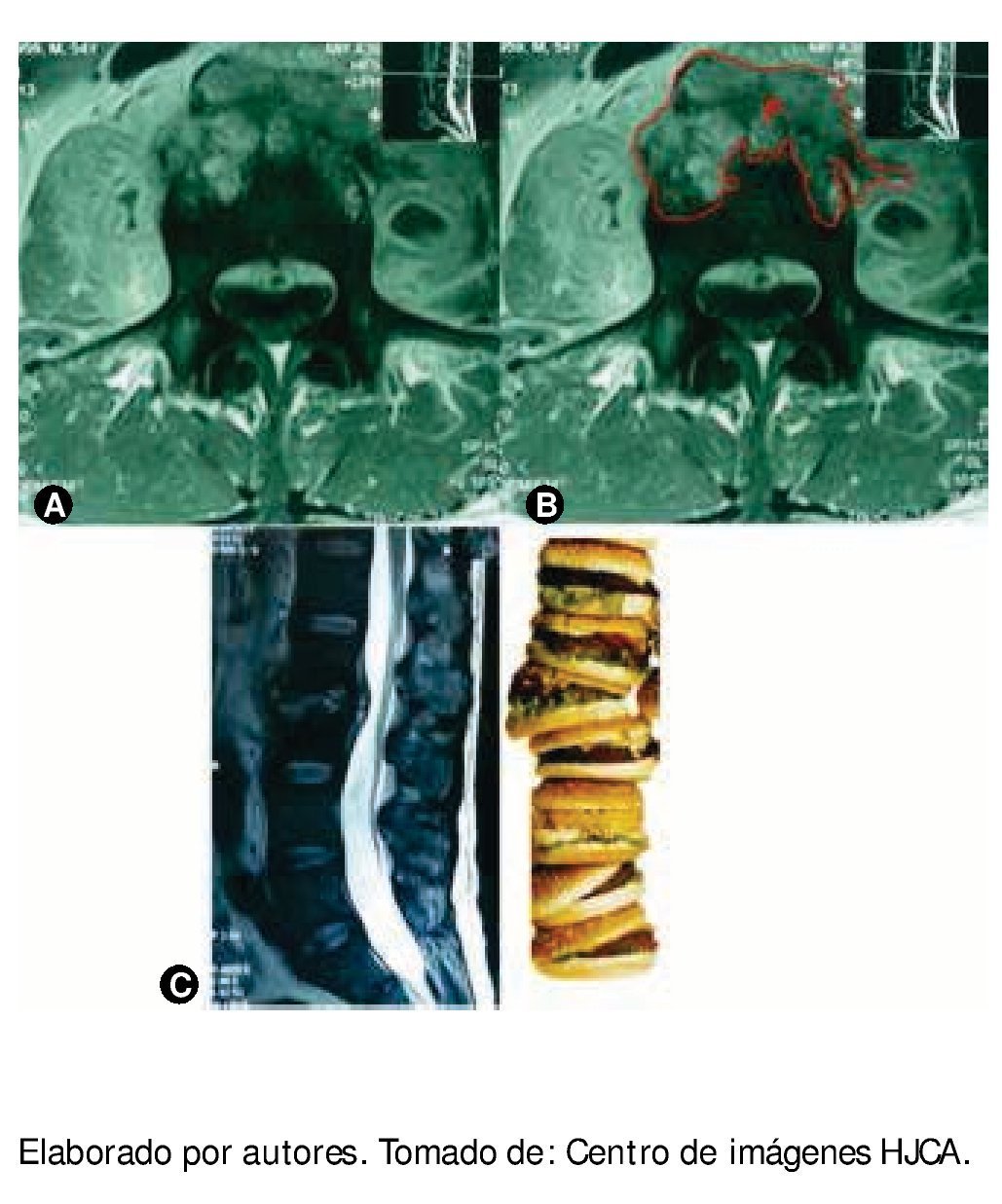
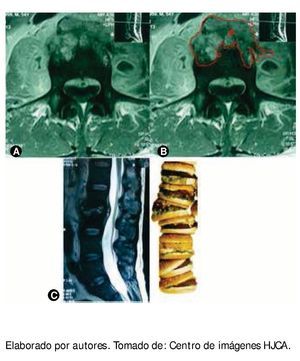
Se practicaron los siguientes exámenes complementarios: — En el estudio de imagen de resonancia magnética nuclear (RMN), se evidencia gran rectificación de lordosis lumbar, fusión de cuerpos vertebrales L2 y L3, con masa de partes blandas, que invaden a músculo psoas. Con contraste existe captación de una lesión entre L2 y L3, que comprime canal dural y lo rechaza, existe algo de destrucción ósea en L3 (fig. 1).
Figura 1 A) Resonancia magnética, proyección coronal, se observa lesión lítica de cuerpo vertebral de gran extensión, bilateral; de la misma manera se ve asimetría en las masas musculares de músculos iliopsoas. B) Resonancia magnética con la misma lesión, se localiza el plasmocitoma (P). C) Resonancia magnética, proyección sagital, donde se observa la pérdida de la anatomía entre L2 y L3 con protrusión del contenido discal por la extensa infiltración y por efecto de la gravedad, como si fuera una "pila de hamburguesas".
— En la serología oncológica no se encontraron marcadores tumorales elevados (antígeno carcinoembrionario, CA19-9, antígeno prostático específico [APE] total, APE libre y alfa-fetoproteína).
— En el estudio de Patología de punción de médula ósea al azar, no se halló alteración.
— En la inmunoelectroforesis de suero sanguíneo y proteína de Bence-Jones, se descartó MM.
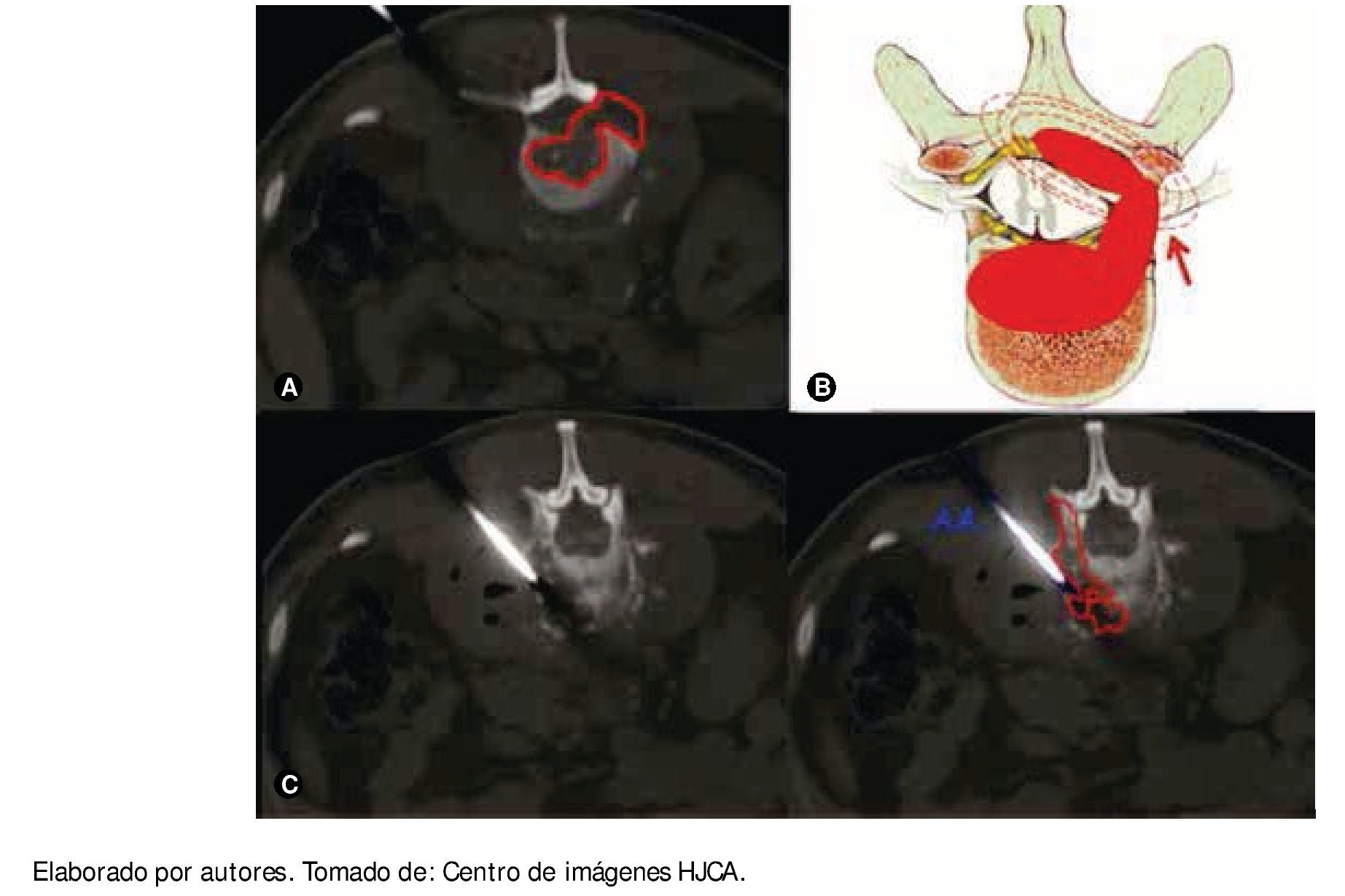
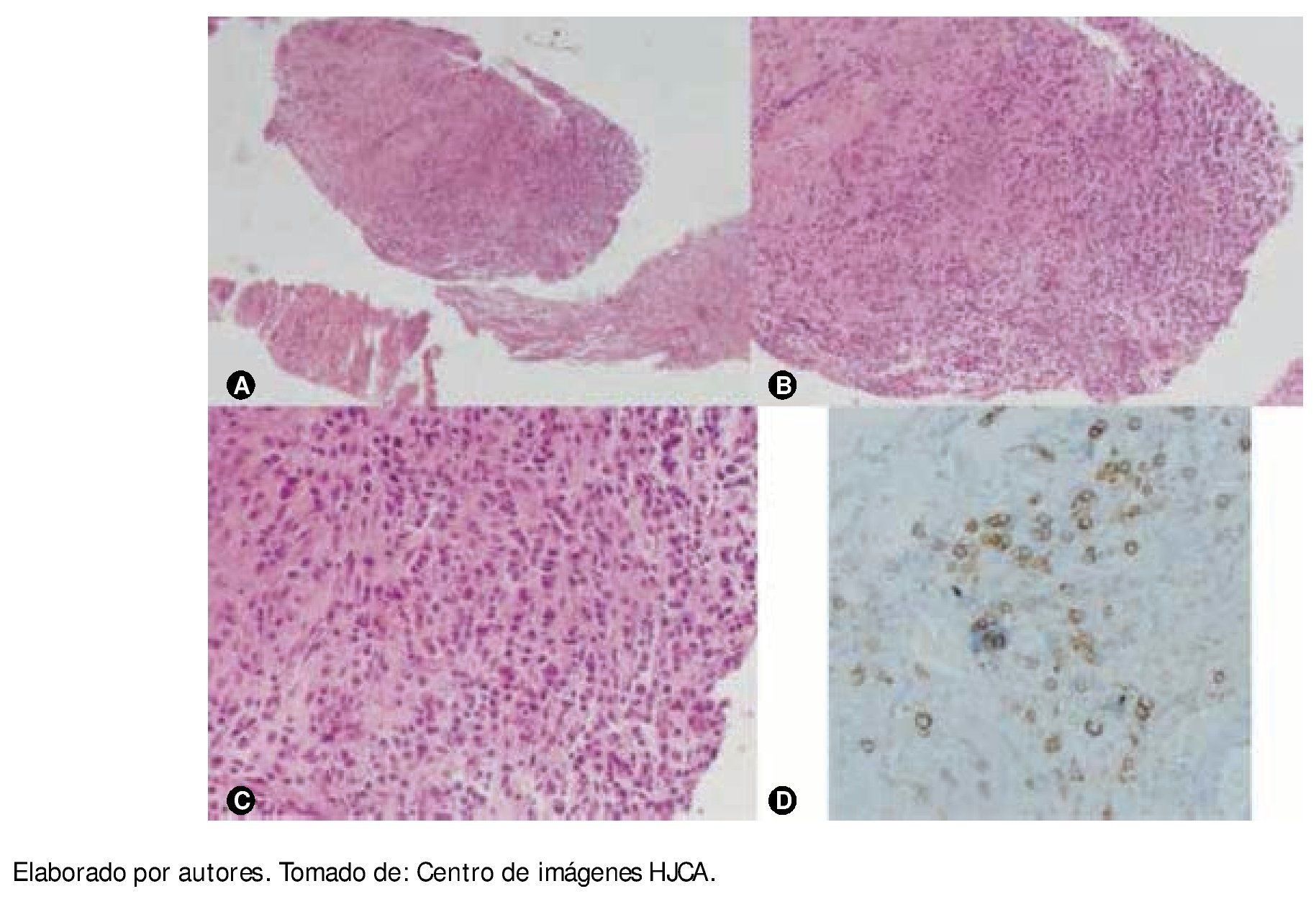
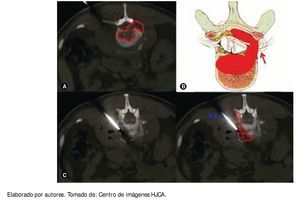
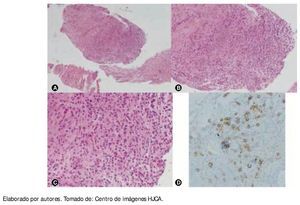
Cuatro meses después el paciente refiere incremento del dolor a nivel de la cintura y en el examen físico presenta fiebre de 38°C; en ese momento se procedió a realizar biopsia de lesión lítica de cuerpos vertebrales L2 y L3 y músculo psoas derecho, dirigida por tomografía computarizada (TC) (fig. 2); se cultiva la muestra y se encuentra S. aureus sensible a clindamicina, linezolid y trimetoprim sulfametoxazol. En el estudio de Patología se reporta: examen macroscópico con cilindros pardos, y en el microscópico con infiltraciones por neoplasia de células plasmáticas de crecimiento difuso en medio de escaso tejido conectivo; en la inmunohistoquímica se encuentra población de células CD139 (fig. 3); en las pruebas de BAAR seriado, KOH y tinción de Gram: todos ellos negativos; comprobándose así la presencia de absceso en músculo psoas y un POS, en la misma localización.
Figura 2 A) Tomografía simple en el momento de la biopsia guiada por ésta, proyección coronal, se observa lesión lítica de cuerpo vertebral de gran extensión, bilateral. B) Ilustración que muestra el crecimiento del plasmocitoma que rechaza el canal dural y produce sintomatología radicular. C) Tomografía simple en el momento de la biopsia, se observa el plasmocitoma (P) y la aspiración de la aguja empleada (AA).
Figura 3 A) B) y C) Histología de la biopsia de músculo psoas, vista con objetivo de x10, x40 y x100, respectivamente, se observa infiltración de células mononucleadas de crecimiento difuso en medio de las fibras musculares de psoas. D) Con técnica de inmunohistoquímica se logró comprobar que aquellas células mononucleadas son células plasmáticas, que se tiñen de color marrón ante el reactivo para células CD139.
Los criterios usados en el diagnóstico del caso son los planteados para diferenciar el POS del MM y otras neoplasias de células plasmáticas, dictaminados por la Sociedad de Mieloma Múltiple de Reino Unido1; para comprobar el diagnóstico también se procedió a la gammagrafía ósea, como prueba para diferenciar del MM no secretor, demostrando así lesión única y aislada de un tejido óseo específico, con los siguientes criterios todos cumplidos por el paciente reportado:
• Área única de destrucción ósea debido a las células plasmáticas clonales.
• Aspirado aleatorio de médula ósea de cualquier hueso histológicamente normal (< 5% células plasmáticas).
• Resultados normales en el examen del esqueleto, serie radiológica ósea.
• La ausencia de anemia, hipercalcemia o insuficiencia renal debido a neoplasias de células plasmáticas.
• Suero ausente o bajo nivel urinario de anticuerpos monoclonales: inmunoglobulina (nivel de > 20 g/l sospechoso de MM).
• Sin lesiones adicionales en RMN de la columna vertebral.
Además, en el reporte de la gammagrafía ósea con Tc-99m metildifosfonato (MDP), en dosis de 20 mCi (milicurie), después de 4 horas en fase tardía, se comprobó única captación del radiotrazador entre L2 y L3.
La infección se trató con clindamicina 600 mg vía venosa, cada 8 horas. El manejo del dolor se hizo con tramadol 50 mg vía venosa y parche de buprenorfina. Para el tratamiento de plasmocitoma se empleó RT local, considerando que es una lesión mayor de 5 cm, se utilizó 3,000cGy en 10 fracciones y aumentando a 45Gy en 5 fracciones por persistencia del dolor.
Discusión
El plasmocitoma solitario es una neoplasia de células plasmáticas poco reportada en la literatura médica, con características de malignidad, pero de buen pronóstico; tiene las mismas particularidades histológicas del MM, por lo tanto es éste el principal diagnóstico diferencial a descartar. La diferencia principal es su localización única y aislada, de ahí su nombre; se reconocen 2 tipos de plasmocitoma: el óseo solitario, proveniente de la médula ósea de los huesos (motivo a discusión) y el solitario extramedular, cuyo origen es en tejidos no medulares principalmente pulmonares y gastrointestinales2. La presentación del caso es atípica, pues no está reportado en la bibliografía un plasmocitoma coexistiendo con lesiones infecciosas locales.
Epidemiología
El POS representa sólo el 5% de todas las neoplasias de células plasmáticas3, la proporción entre hombres a mujeres es de 2:1, la edad media de aparición es de 55 años, aumentando la incidencia de forma exponencial a causa de la edad avanzada. La tasa de incidencia más alta es en la raza negra4. La principal localización de la lesión por el POS es en los huesos del esqueleto axial, como las vértebras y el cráneo4, característica observada en el caso.
Fisiopatología
La aparición del plasmocitoma depende de la alteración de 3 mecanismos:
1. Alteración en la regulación de la generación de células plasmáticas: hacen referencia a la sobreexpresión de genes que codifican protooncogenes, entre ellos, el EEF1A2 que inhibe la apoptosis y activa segundos mensajeros intracelulares como JAK/ STAT y, la señalización AKT que aumentan los eventos de mitosis celular5; así como los mecanismos cromosómicos donde está involucrado el alargamiento de los telómeros y la trisomía en el cromosoma 11 en su porción E2, identificados en modelos experimentales en roedores6.
2. Fenómenos alterados en la proliferación celular: con la expresión aberrante de genes que codifican proteínas como ciclina D1, ciclina D2, Blimp1, survivina, IL-10 e IL-15 y STAT3, y la activación de NF-κB2, encargados en procesos que aumentan la reproducción celular7.
3. Alteraciones en la supervivencia celular, las células plasmáticas pueden sobrevivir durante largos periodos de tiempo por una conexión directa entre una señal externa, con producción de citoquinas sintetizadas in situ (anticuerpos protectores) tales como: IL-6 y SDF-1α, que modifican a moléculas intracelulares como el microARN 24-3p para mejorar el nicho de supervivencia8.
Cuadro clínico
La presentación habitual del POS es el dolor de un tejido óseo específico; sin embargo, un 25% desarrollan disfunción neurológica en forma de compresión neural9, como en la experiencia citada del caso en discusión, la neuropatía periférica se asocia con todos los trastornos de células plasmáticas9.
Diagnóstico
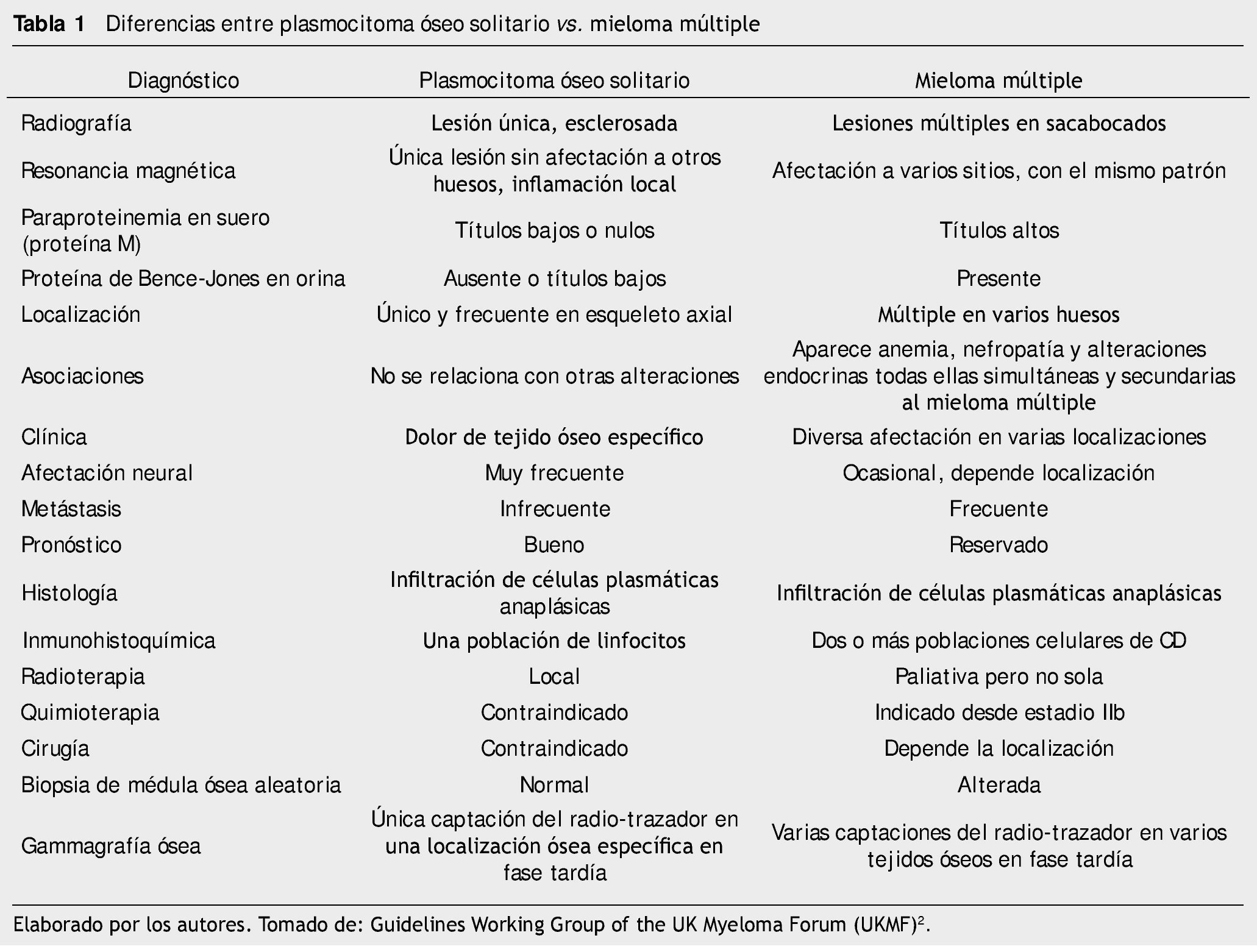
El diagnóstico consiste en criterios histopatológicos, serológicos e imagenológicos, descartando siempre el MM, es decir, se requiere de células plasmáticas monoclonales demostradas por biopsia, que produzcan infiltración de una sola lesión ósea lítica; ausencia de células plasmáticas clonales en una muestra de médula ósea aleatoria de cualquier hueso; y la ausencia de evidencia de mieloma sistémico (normocalcemia, ausencia de anemia o enfermedad renal atribuible a mieloma )10 (tabla 1).
Patología estructural
En la biopsia de la única lesión lítica se encuentra infiltrado de células plasmáticas, con patrón de crecimiento maligno semejante al MM; el estudio de biopsia se debe complementar con inmunohistoquímica, las células neoplásicas pueden expresar antígenos de células plasmáticas para CD138, CD139 y CD38, pero sin CD19 y CD20, también se pueden encontrar: CD79a, CD56, CD27 y CD44v611. La muestra de biopsia mostró en la inmunohistoquímica una sola estirpe celular que fue CD139.
Imagenología
El diagnóstico imagenológico de POS requiere la presencia de una lesión ósea solitaria confirmada por estudio óseo, incluyendo RMN o una gammagrafía ósea12. Estudios recientes proponen la gammagrafía de receptores de somatostatina para detectar anomalías esqueléticas en pacientes con plasmocitoma y para evaluar la actividad de la enfermedad, especialmente en los pacientes con recidiva o en riesgo a evolucionar a MM13. Las imágenes del paciente fueron sugerentes y concordantes con las características de lesión única de POS.
Laboratorio
Se diferencia del MM por los títulos bajos o nulos de proteína monoclonal (proteína M) en el suero y la misma característica con la ausencia de proteína de Bence-Jones en orina10.
Historia natural
El POS en ausencia de tratamiento tiene 4 posibilidades en su evolución, éstas son: el desarrollo de MM (65%), la recidiva local (12%), la difusión de una nueva lesión solitaria (15%), y la curación completa. En cuanto al tiempo hasta la progresión a MM, oscila entre 24 a 36 meses4,11. Por la dificultad de predecir el pronóstico, la mayoría de los pacientes necesitan un seguimiento posterior para detectar la posible progresión a MM con la vigilancia regular de suero u orina, siendo la inmunoelectroforesis de proteínas séricas, el indicador más preciso de aparición de MM4. En cuanto a las recidivas, si éstas aparecen lo hacen con mayor frecuencia tempranamente. También se han realizado investigaciones que proponen a los síntomas neurológicos, presencia de suaves masas de tejido anexo, enfermedad voluminosa (≥ 5 cm), edad > 55 años y la respuesta a RT, como factores importantes para el pronóstico14; se indicaron revisiones periódicas evaluando la evolución neurológica del cuadro y la intensidad del dolor, pero considerando la gran extensión de la lesión, es un factor de riesgo latente para evolucionar a MM.
Tratamiento
Está contraindicado los procedimientos quirúrgicos puesto que disminuye los linfocitos Natural Killer (nK)15, la actividad de las células nK es importante para combatir las células cancerosas; también se ha relacionado a la angiogénesis del proceso cicatricial como factores de riesgo a la recidiva, ya que puede suministrar flujo sanguíneo al tumor remanente, esto puede beneficiar a la recurrencia local, la formación de la enfermedad metastásica y la activación de micrometástasis latentes15. La RT es el tratamiento de elección para Pos, ya que favorece al control local de la enfermedad en un 90% de los pacientes; la dosificación depende del tamaño del plasmocitoma en la RMn, se recomienda que si es menor de 2 cm, el tratamiento debe ser a una dosis de 40Gy en 20 fracciones (grado de recomendación B, evidencia de nivel III ), mientras que para los tumores > 5 cm una dosis mayor de 50Gy en 25 fracciones (grado de recomendación C, evidencia de nivel IV)1,12, el tumor del paciente es de gran extensión y se encuentra en el psoas, por lo tanto se trató con dosis de 50Gy.
La quimioterapia adyuvante no tiene ningún efecto beneficioso sobre el control de la enfermedad o la prevención de la progresión del Pos a MM3, la quimioterapia debe restringirse ya que la exposición temprana puede acelerar la progresión de los subclones resistentes y, por lo tanto, limitar las opciones terapéuticas posteriores3. En el presente caso se recurrió al aumento de la dosificación de RT ante el aumento del dolor; actualmente se realizan controles imagenológicos y serológicos periódicos y hasta el momento no se ha evidenciado paraproteinemia, ni en suero ni en orina.
Conclusiones
Después de la revisión bibliográfica se puede decir que el caso se correlaciona con la clínica, la epidemiología y obedece todos los criterios diagnósticos para garantizar la correcta etiología del cuadro, la peculiaridad de coexistencia de infección en músculo psoas puede tener su causalidad sabiendo que el paciente está expuesto a elementos intravenosos en su tratamiento con hemodiálisis, donde la diseminación hematógena de un organismo productor de abscesos como el S. aureus puede atacar una zona vulnerable con tejidos inflamados, membranas celulares lábiles y muy irrigados como lo es el área del plasmocitoma, por lo tanto la infección es incidental y no está reportada en la literatura médica; el paciente tiene lesiones extensas, por lo que se debe seguir el caso con mayor minuciosidad y cuidar el periodo de 6 meses de posibles complicaciones, ya que el mayor riesgo se presenta tempranamente y después de este tiempo será menor la probabilidad de progresión a MM y mejorará su pronóstico.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Hospital José Carrasco Arteaga,
Fray Gaspar de Villaroel y Miguel Cabello Balboa,
C.P. 010219, Cuenca, Ecuador.
Teléfono: (+59) 374056596.
Correo electrónico: juanmig_18@hotmail.com (Juan Miguel Alemán-Iñiguez)