Lo único favorable del proyecto de real decreto es que,
por fin, los medicamentos tradicionales de plantas
se configuran como verdaderos medicamentos, a los que se pueden atribuir indicaciones terapéuticas y que tienen limitada su comercialización al canal farmacéutico
A finales del pasado mes de febrero el Ministerio de Sanidad sometió a información pública un proyecto de Real Decreto sobre el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano que, aparte de incorporar varios defectos, incluye una regulación que perjudica gravemente a los medicamentos sin receta. En el proyecto aparece nuevamente el concepto de «medicamentos publicitarios», una figura superada por las directivas y por la nueva Ley de Garantías y Uso Racional del Medicamento, en la que ya sólo cabe la distinción de medicamentos «con receta» y «sin receta».
En el presente artículo se revisa el proyecto de real decreto y se hacen consideraciones sobre el mercado de medicamentos sin receta, una categoría que en España se encuentra en recesión y recibe continuos agravios por la vía reglamentaria, por las restricciones a la publicidad y por la competencia de los medicamentos financiados por el sistema público, muy al contrario de lo que ocurre en los demás países de la UE.
El proyecto de real decreto
Tras la publicación de la Ley 29/2006 de 26 de julio de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios era de esperar un rápido desarrollo reglamentario de los aspectos que tienen que ver con el registro y la adaptación de los medicamentos a las directivas 2004/27/CE del Parlamento Europeo y del Consejo; la directiva 2001/83/CE por la que se establece un código de medicamentos para uso humano y la Directiva 2004/24/CE referida a los medicamentos tradicionales de plantas. Estos desarrollos se llevan a cabo, aunque de forma incompleta, en unos casos, o inadecuada, en otros, en el proyecto que ha sometido al trámite de audiencia pública, por lo que todos los sectores han presentado alegaciones al mismo, algunas de gran calado como las que se refieren a los medicamentos sin receta. Las alegaciones relacionadas con estos medicamentos tienen que ver fundamentalmente con los artículos 23, 24 y 34, que se revisan a continuación.
Art. 23. Condiciones de prescripción y dispensación de los medicamentos
En este artículo comienzan por definirse las dos grandes categorías establecidas en las directivas, que son: medicamentos sometidos y no sometidos a prescripción médica, aunque los de prescripción puedan acogerse a ciertas restricciones como sucede con los medicamentos de prescripción especial o restringida, o los de dispensación en medios especializados. De ahí que cuando el proyecto aborda en este mismo artículo los medicamentos sin receta, no pueda hacer ninguna salvedad ni volver a crear la categoría de medicamentos publicitarios. Hay, además, una omisión importante, que es la referencia a los medicamentos para el autocuidado de la salud --sobre los que sería posible hacer publicidad-- lo que supone una vulneración clara de lo establecido en la Ley. Por ello, la Asociación para el Autocuidado de la Salud (ANEPF) ha propuesto una nueva redacción1, más próxima a la del artículo 19.4 de la Ley de Garantías.
Art. 24. Medicamentos publicitarios
La redacción entra en contradicción con la Ley 29/2006 y con las directivas europeas, tal como puso de manifiesto el Consejo de Estado en su informe sobre la Ley de Garantías. Todo esto hace pensar que el texto del este real decreto sometido a informe es anterior a la propia ley y debería ser revisado. Ya el Consejo de Estado llegó a proponer una redacción del artículo 78 de la Ley 29/2006 que resultó finalmente incorporado, y que ahora el proyecto de real decreto trata de modificar con criterios de la Ley 25/1990 ya derogada. La denominación de medicamentos publicitarios, a pesar la amplia tradición que tiene en España, no responde a ninguna categoría establecida en las directivas, en las que sólo se reconocen medicamentos con receta y sin receta. Del mismo modo, el artículo 7 de la ley que se refiere a medicamentos legalmente reconocidos no contiene ninguna categoría que corresponda a medicamentos publicitarios. Estos medicamentos tampoco quedan definidos en la ley en las definiciones contenidas en el artículo 8. La propuesta, por tanto, es que los medicamentos calificados «sin receta» puedan, con las autorizaciones previas correspondientes, ser publicitados. Esto no obsta para que en algunos casos esta publicidad sólo pueda realizarse en el punto de venta o para que definitivamente se pueda impedir su publicidad en medios de comunicación. Otra restricción, y no menor, del proyecto es la elaboración de una lista positiva de sustancias, dosificaciones y vías de administración sobre las que pueda hacerse publicidad. Esta restricción no se reconoce ni en la directiva ni en la Ley 29/2006, por lo que el proyecto, al introducir previsiones contra legem sería nulo de pleno derecho. Sin embargo, hay una situación de hecho que no se recoge, como la existencia de medicamentos «sin receta, no financiados», situación que, a nuestro entender, debe continuar, como debe continuar la de «sin receta, financiados» ya que en algún caso son imprescindibles a pesar de la amplia experiencia sobre su uso y a que atienden a síntomas menores. Por todo lo que se acaba de exponer, el título de este artículo debería sustituirse por el de «Publicidad de los medicamentos (o garantías de publicidad de los medicamentos)».
Art. 34. Garantías de correcta identificación. Nombre del medicamento
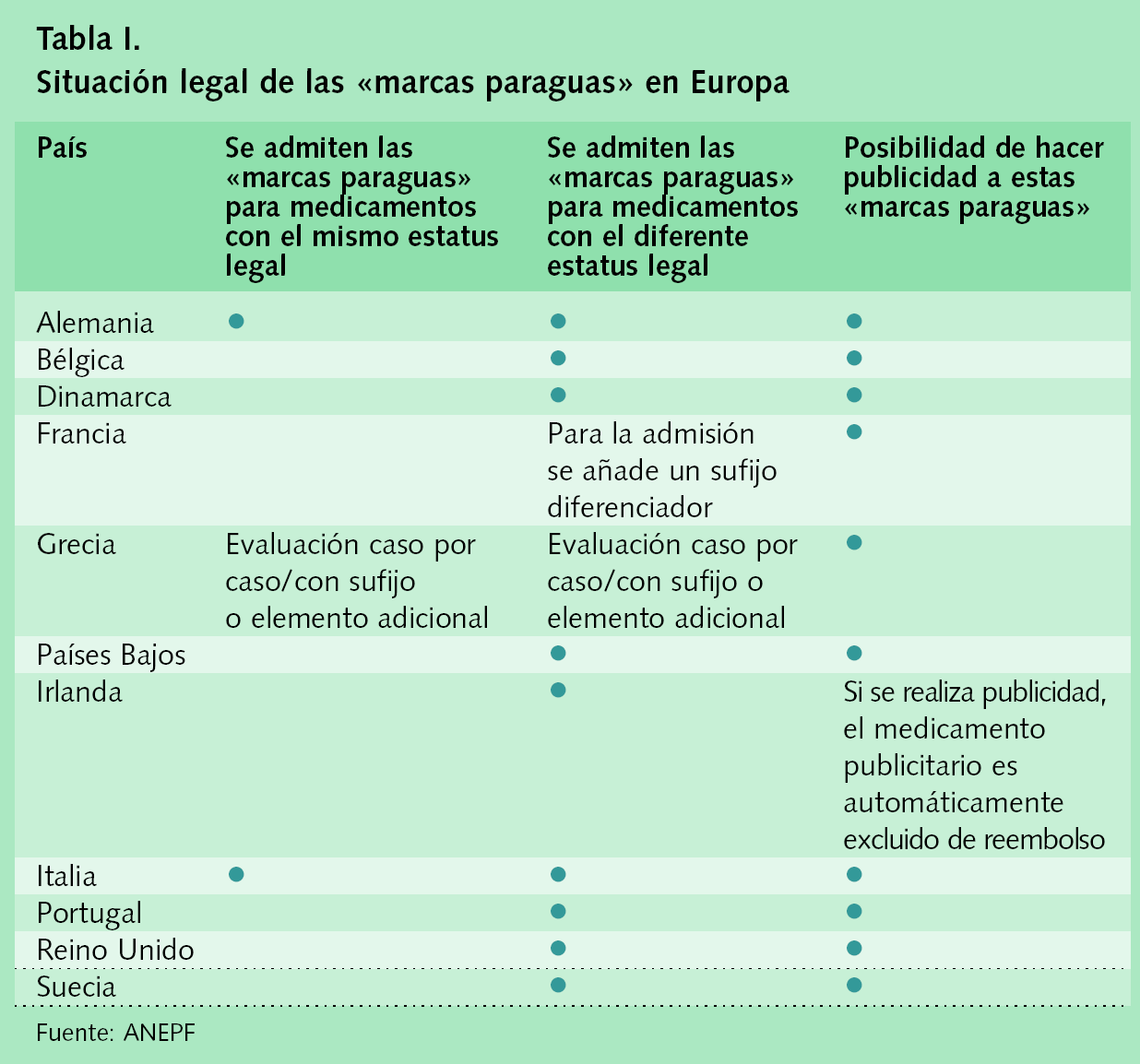
Dentro de este artículo hay un apartado, concretamente el 3.d), que impediría la existencia de las llamadas «marcas paraguas», que son medicamentos con algunos formatos financiados y otros con la misma marca --normalmente ampliada con un calificativo que las distingue--. También se aplica cuando tienen distinto estatus legal, como por ejemplo con receta o sin receta. Esta es una circunstancia admitida en la mayor parte de los países europeos. Una regulación cautelosa de esta modalidad de denominaciones no tiene por qué significar pérdida de garantías de seguridad para los pacientes. Una salida adecuada a esta situación se consigue en toda Europa mediante la adición de otros calificativos a la denominación como «labial», «externo», «suave» o cualquier otro que diferencie claramente el medicamento financiado del no financiado2, o el de con receta del de sin receta. Al no tratarse de la misma palabra, ya que se introduce un elemento que singulariza al medicamento, puede producirse una correcta identificación, se excluye la posibilidad de error y se evita cualquier confusión, lo que además está de acuerdo con el texto de la Ley 29/2006 y con la Directiva 2004/27/CE, por la que se establece un Código comunitario sobre medicamentos de uso humano3. Por tanto, la introducción de previsiones en este sentido parece razonable, no es contraria a la Ley de Garantías y además nos equipara a la tendencia general en todos los Estados de la UE. El texto legal que desarrolla la Ley de Garantías debería contener los elementos necesarios para que esta práctica se pueda desarrollar. En la tabla I podemos observar la situación de las llamadas «marcas paraguas» en los principales países de la UE, distinguiendo aquellos en los que se admiten para medicamento con el mismo estatus legal, aquellos en los que se admiten APRA medicamentos con distinto estatus legal y aquellos que permiten realizar publicidad de los no financiados.
Medicamentos tradicionales de plantas y homeopáticos
El proyecto de real decreto lleva a cabo la esperada transposición de la Directiva 2004/24/CE y quizá pueda evitar el procedimiento judicial ya iniciado por la Comisión Europea en el Tribunal de Luxemburgo contra el Reino de España, que ha supuesto su retraso. Sin embargo, hay que señalar que el proyecto se queda corto, ya que el contenido de la directiva es mucho más amplio e introduce nuevos elementos de distorsión, como por ejemplo el exigir sin excepción documentación acreditativa de las autorizaciones o denegaciones obtenidas en otro Estado miembro o en un tercer país, con especificación de los motivos correspondientes a la decisión, lo que hace inviable que un solicitante español pueda presentar un registro de este tipo de productos a no ser que trate de registrarlos previamente en otro Estado miembro de la UE. Esta obligación es a todas luces desproporcionada e incluso podría calificarse de antipatriótica. En lo que se refiere a estos medicamentos, y también a los homeopáticos, el proyecto no indica cuál va a ser el destino de los actuales medicamentos de plantas medicinales y sitúa de nuevo en transitoriedad a los homeopáticos que no han podido adaptarse en los últimos 12 años por esta misma causa. Quizá lo único favorable es que, por fin, los medicamentos tradicionales de plantas se configuran como verdaderos medicamentos a los que se pueden atribuir indicaciones terapéuticas y que tienen limitada su comercialización al canal farmacéutico. Para evitar distorsiones y polémicas, el Ministerio debería regular a la vez las plantas medicinales que se puedan vender libremente, actualizando la lista de la orden del año 1973 que, por cierto, no resulta derogada en el proyecto de Real Decreto con lo que podría haber medicamentos tradicionales de venta en farmacia y preparados de venta libre con la misma composición, aunque sin indicaciones terapéuticas, en los herbolarios.
La realidad del mercado
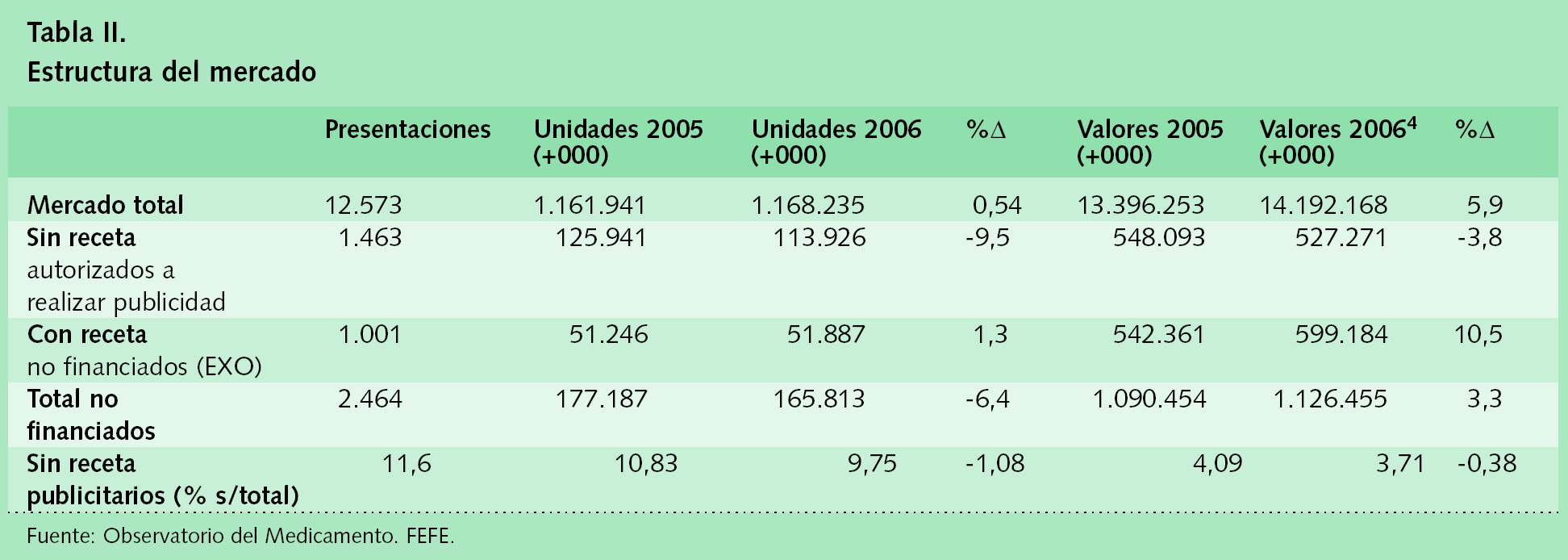
Tal como indicábamos al principio, el mercado de los medicamentos sin receta recibe 3 tipos de agravios: los reglamentarios como el del proyecto que se ha puesto en trámite de audiencia, la competencia de los medicamentos financiados y las restricciones a la publicidad. Acabamos de revisar los reglamentarios que se proponen en el proyecto de real decreto y ahora vamos a ver las consecuencias que tiene la competencia de los medicamentos financiados y las restricciones a la publicidad que condicionan un crecimiento no sólo insuficiente y contrario a lo que ocurre en los demás países de la UE, sino incluso el progresivo retroceso del mercado de los medicamentos sin receta sobre los que puede hacerse publicidad, tal como puede verse en la tabla II.
Los medicamentos «sin receta» autorizados para realizar publicidad son 1.463 --en sus diferentes formatos--. En el último año se vendieron 113,9 millones de unidades, por un valor de 527,2 millones de euros, lo que significa que este mercado supone el 9,75% de las unidades totales dispensadas en las oficinas de farmacia y sólo el 3,71% de las ventas en valor. La realidad del descenso de este mercado hay que atribuirla directamente a la posibilidad de encontrar tratamientos alternativos financiados para cualquier dolencia, incluidas las de carácter leve. Si tenemos en cuenta que más del 75% de la factura de los medicamentos financiados por el Sistema Nacional de Salud es generada por pensionistas que no pagan nada, es fácil llegar a la conclusión de que los medicamentos sin receta que pueden hacer publicidad se hundan ante una competencia imposible de vencer: no pagar nada por algo muy parecido en el caso de los pensionistas, o pagar un 40% en el caso de los trabajadores activos. Hay otra circunstancia curiosa en la tabla II, que se refiere a los medicamentos con receta no financiados --y que, por tanto, no pueden hacer publicidad-- comúnmente denominados EXO. Estos son medicamentos excluidos de financiación pero que se consiguen únicamente con receta médica, por lo que, si tenemos en cuenta el poder del prescriptor para orientar el consumo, podremos entender que tengan una evolución mejor que aquellos que se basan exclusivamente en la publicidad. El tercer elemento son las restricciones legales, los plazos y las dificultades para ampliar la lista de los principios activos y dosificaciones de los medicamentos que pueden hacer publicidad, acompañados también de las restricciones a una publicidad más imaginativa y abierta. A esto último se le suma la competencia añadida de productos alimentarios no sujetos a autorización previa --todavía-- que en los últimos se vienen publicitando con unas impresionantes alegaciones de propiedades terapéuticas que jamás se hubieran permitido a los medicamentos sin receta5.
La realidad del descenso del mercado sin receta hay que atribuirla directamente a la posibilidad de encontrar tratamientos alternativos financiados para cualquier dolencia, incluidas las de carácter leve
Conclusiones y recomendaciones
Aunque tengamos confianza en que las alegaciones que han realizado las organizaciones farmacéuticas y las patronales del sector sobre el proyecto de Real Decreto sean atendidas, es casi imposible modificar la situación de indefensión en que se encuentran los medicamentos sin receta que pueden realizar publicidad frente a los financiados, con o sin receta. Esta situación sólo puede cambiar si el nivel de aportación de los beneficiarios de la Seguridad Social se aproxima a la media europea, algo que desgraciadamente no está en ningún programa político6. Partiendo de esa base de desigualdad, los medicamentos que pueden hacer publicidad sólo pueden crecer por la vía de obtener mayores facilidades de registro --una rápida introducción en el mercado o la eliminación de las listas positivas-- y la supresión definitiva de la competencia desleal en la publicidad de los productos alimentarios, que prometen verdaderas propiedades terapéuticas, mientras a ellos se les niegan. Las marcas paraguas pueden ayudar, pero tampoco son una solución mágica, ya que hemos visto casos de medicamentos no financiados con la misma o similar denominación --aunque no habilitados para hacer publicidad-- que no se venden, mientras que el producto financiado tiene importantes ventas.
Una cuestión muy positiva es que, por fin, se van a regular, mediante un registro simplificado, los medicamentos tradicionales de plantas, y que se eliminan las dudas existentes sobre su dispensación en las oficinas de farmacia, al ser una clase más de medicamentos. Sin embargo, queda la incógnita de qué medicamentos son éstos, porque necesitan haberse usado tradicionalmente más de 30 años en Europa, y realmente esta cuestión depende de su aceptación por un comité de la Agencia Europea del Medicamento. A la vez que se regulan los medicamentos tradicionales de plantas, debería regularse la venta libre de plantas medicinales --prevista en la Ley-- para no abrir un frente de lucha con canales no farmacéuticos, cuya presión ha sido muy negativa en otros tiempos.
En cuanto a los medicamentos homeopáticos, el proyecto debería incidir más en aquellos que son con receta o sin receta y abrir algún tipo de registro, no limitándose a colocar en la transitoriedad lo que ya viene siendo transitorio desde hace más de 12 años, algo que no ha permitido ninguna renovación del sector.
La conclusión final de todo este proceso de adaptación a la normativa europea y a nuestra recién estrenada Ley de Garantías es que todos tenemos que abandonar las rutinas del pasado --comenzando por los funcionarios encargados de la evaluación de los medicamentos sin receta-- y abordar la nueva situación con otra mentalidad en lo que se refiere al autocuidado de la salud, el papel imprescindible del farmacéutico y la lucha activa contra la publicidad de remedios milagrosos y alimentos con indicaciones terapéuticas, que perjudica extraordinariamente a los verdaderos medicamentos y a toda la cadena farmacéutica.
Los medicamentos que pueden hacer publicidad sólo pueden crecer por la vía de obtener mayores facilidades de registro y la supresión definitiva de la competencia desleal en la publicidad de los productos alimentarios
Notas
1. La Agencia Española de Medicamentos y Productos Sanitarios podrá autorizar medicamentos no sujetos a prescripción médica cuando vayan destinados a procesos o condiciones que no necesiten un diagnóstico preciso y cuyos datos de evaluación toxicológica o clínica o de utilización y vía de administración no exijan prescripción médica, de modo que dichos medicamentos puedan ser utilizados para el autocuidado de la salud mediante su dispensación en la oficina de farmacia por un farmacéutico que informará, aconsejará e instruirá sobre su correcta utilización.
2. En España se autorizó una prueba piloto con Iniston Antitusivo e Inistron Mucolítico en la que se pudo determinar que no existe posibilidad de error en la prescripción y dispensación, lo que permitiría que un formato estuviese financiado y otro no.
3. Esta directiva prevé en su considerando 4 que «Toda regulación en materia de fabricación y distribución de los medicamentos de uso humano debe tener por objetivo esencial la salvaguarda de la salud pública. No obstante, los medios que se utilicen para la consecución de ese objetivo no deben obstaculizar el desarrollo de la industria farmacéutica y los intercambios de medicamentos en el seno de la comunidad».
4. Estas cifras se dan a PVP.
5. Esta situación puede cambiar pronto si se desarrolla adecuadamente la Directiva de complementos alimenticios y otras normas legales de la Unión Europea que restringen los mensajes publicitarios que pueden hacer los productos alimenticios.
6. Mientras la aportación media (entre activos y pensionistas) se encuentra en España en el 6%, la media en la Unión Europea es el 16%.