El incentivo para que la industria farmacéutica que realiza la investigación y el desarrollo de nuevos productos continúe su labor radica en contar con un marco legal confiable, que le garantice la protección de la patente y la confidencialidad de su información. Al vencimiento de la misma, es lícito y conveniente que terceros fabriquen y comercialicen copias del medicamento original, toda vez que estén en condiciones de demostrar la calidad de sus productos y su equivalencia terapéutica con el producto original.
En España y otros países se han introducido numerosas medidas para moderar el incremento del gasto, y entre ellas la promoción del uso de los genéricos. El consumo de genéricos en España ha sido históricamente muy pequeño. Según un estudio realizado sobre el consumo de genéricos en el ámbito ambulatorio del Sistema Nacional de Salud (SNS) en el período 1991-1993, el consumo con relación al total de medicamentos dentro del SNS no llegó ni al 0,1% del consumo en envases o en coste. En un estudio de intervención realizado en un área sanitaria de Madrid después de una intervención de tipo informativa y formativa se llegó a un 4,5% del consumo total en envases en 1994.
El consumo de genéricos en 2001, según la patronal de laboratorios de EFG (AESEG), fue del 3,46% sobre el mercado total farmacéutico (basado en datos de IMS). La cuota media del mercado en valores durante el año 2002 apenas alcanzó el 3,6%, y en unidades, el 4,5% (AESEG 2/03). Sobre el mercado de prescripción supuso un 3,8% en valores y un 5,1% en unidades.
En 2003, según Farmaindustria, los genéricos representaron el 6,7% en unidades (un 1,6% más que en el ejercicio anterior), y el 4,5% en valores del mercado de prescripción (un dato un 0,7% superior al registrado en 2002). Las diferencias entre los servicios autonómicos de salud iban desde el 15,38% de Madrid al 3,95% de Galicia.
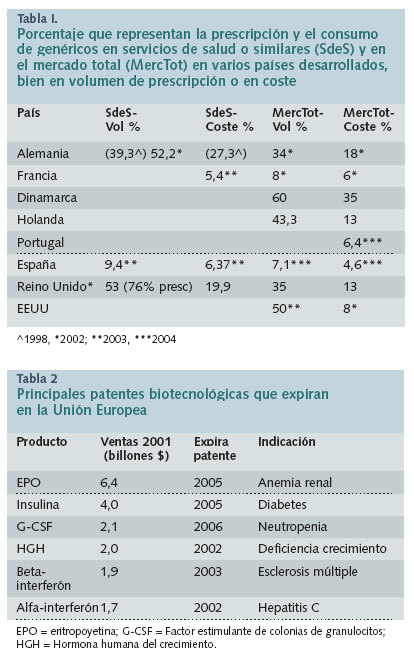
Según datos de AESEG de agosto de 2004, los genéricos representan el 7,1% en unidades y el 4,6% en valores del mercado de prescripción, lo que contrasta con la situación de estos medicamentos en otros países de la UE, ya que la media de los Quince ronda el 15%.
Reino Unido (RU). En Inglaterra, el coste medio de un genérico es 4,07 £, mientras que el coste del producto original es de 18,49 £. Si no hubiera genéricos y todas las prescripciones tuvieran que ser dispensadas como marcas, la factura farmacéutica aumentaría desde los 6.500 millones a 11.100 millones de libras, con lo que estas especialidades ahorran al NHS 4.600 millones de libras. Inglaterra representa el 85% del mercado de RU.
En Inglaterra, en 2002, la prescripción de genéricos fue del 76% y la dispensación del 53%, a un coste del 19,9% de la factura de medicamentos. Los médicos del NHS proporcionan servicio sanitario bajo un estricto presupuesto. El gobierno del RU ha proporcionado fuertes incentivos para promover la prescripción de genéricos. A los médicos en formación se les enseña a prescribir por DCI, incluso para productos bajo patente. La prescripción de genéricos es uno de los indicadores para evaluar la actuación en atención primaria.
Alemania. En este país, la cuota de mercado de prescripciones de genéricos ha aumentado constantemente durante los pasados 10 años. El porcentaje de estas prescripciones frente a las de marcas originales en el esquema estatutario alemán del seguro médico en 2002 fue del 52,2%. La prescripción creciente de genéricos ha generado ahorros de 2,7 mil millones de euros en el año 2002.
Francia. En Francia, en 2003, los genéricos representaron un 5,4% de las ventas de los medicamentos reembolsables, frente a un 4,1% en 2002. En abril de 2004 representaron el 6% del mercado del medicamento reembolsable y el 13% de las unidades dispensadas en farmacias.
Dinamarca. En este país escandinavo los genéricos representan el 60% en volumen y el 35% en valor del mercado farmacéutico.
Holanda. En Holanda, en 1998, los médicos de familia prescribieron genéricos en el 43,3% de sus recetas y los especialistas, en el 31,1%.
Italia. En Italia, en 2002, los genéricos representaron en volumen el 3% y el 2% en valor del mercado.
Estados Unidos. En EE.UU., el consumo de genéricos en 2000 se cifró en más de un 44% del total de prescripciones dispensadas, lo que representó unos 13.000 millones de dólares, más de un 8% del mercado de prescripción en valores (los genéricos pueden costar del 25 al 80% menos que su marca de referencia). En 2003 más del 50% de las prescripciones fueron de genéricos.
Portugal. En Portugal, la proporción de medicamentos genéricos sobre el mercado total (PVP) en marzo de 2004 fue del 6,4% (en marzo de 2003 era del 5% del mercado total).
La nueva legislación farmacéutica de la UE aprobada en 2004 y que será obligatoria a finales de 2005 ha creado una disposición de exclusividad de los datos, armonizada en la UE, de 8 años, con una disposición de 2 años adicional de exclusividad de mercado. Esta exclusividad efectiva del mercado de 10 años puede ampliarse por un máximo de 1 año adicional si, durante los primeros 8 de esos 10 años el propietario de la autorización de comercialización obtiene una autorización para una o más nuevas indicaciones terapéuticas que, durante la evaluación científica anterior a su autorización, supongan una ventaja clínica significativa en comparación con terapias existentes. En términos prácticos, esto significa que una solicitud de autorización para la comercialización de un genérico puede realizarse después del año 8, pero que el producto no se puede comercializar hasta después del año 10 u 11.
También la adopción de la definición de genérico y biogenérico ampliaría beneficiosamente la oferta de estos medicamentos. El medicamento genérico es el producto que tiene la misma calidad y cantidad de sustancia activa y la misma forma farmacéutica que la marca de referencia (MR), y cuya bioequivalencia con la MR se ha demostrado con estudios apropiados de bioequivalencia. Las diferentes sales, ésteres, éteres, isómeros, mezclas de isómeros, complejos o derivados de un principio activo son consideraradas un mismo principio activo, a menos que tengan propiedades considerablemente diferentes en cuanto a seguridad y o eficacia.
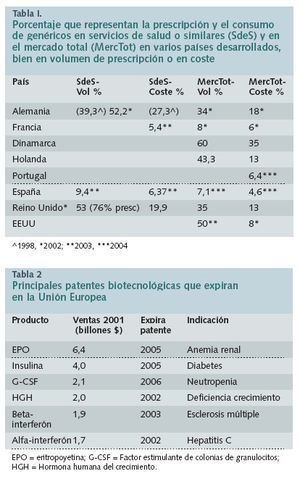
Cuando un producto genérico biológico que es similar a otro biológico de referencia no cumple las condiciones de definición de genérico, debido, en particular, a diferencias en materiales poco estudiados o variaciones en el proceso de fabricación del biogenérico, deberán presentarse resultados de ensayos preclínicos y clínicos apropiados. El foco será dirigido en el futuro cada vez más a los productos biosimilares competitivos (biogenéricos). Los expertos del Committee for Proprietary Medicinal Products (CPMP) de la Agencia Europea del Medicamento (EMEA) de la Unión Europea han dado luz verde al desarrollo de estos nuevos medicamentos comparables. La legislación farmacéutica recientemente adoptada en la UE crea un procedimiento regulador para su registro en la Unión. Debido a la complejidad de muchos de estos productos y de los costes implicados en desarrollar las versiones biosimilares, se espera que solamente algunas compañías de genéricos los provean. Por tanto, pasará cierto tiempo antes de que lleguen a estar disponible para los pacientes.
Bibliografía
Calvo Alcántara MJ, Iñesta García A. Impacto de una estrategia de intervención en la prescripción de genéricos en un área de atención Primaria. Aten Primaria. 1999;23;419-24.
Iñesta García A. Genéricos y precios de referencia, rango de precios y fuentes de información. Ars Farmac. 2000;41(4):365-78.
Directiva 27/2004/CE, Diario Oficial n.° L 136 de 30/04/2004.
Reglamento CE 726/2004 de 11/03/04, Diario Oficial n.° L 136 de 30/04/2004.