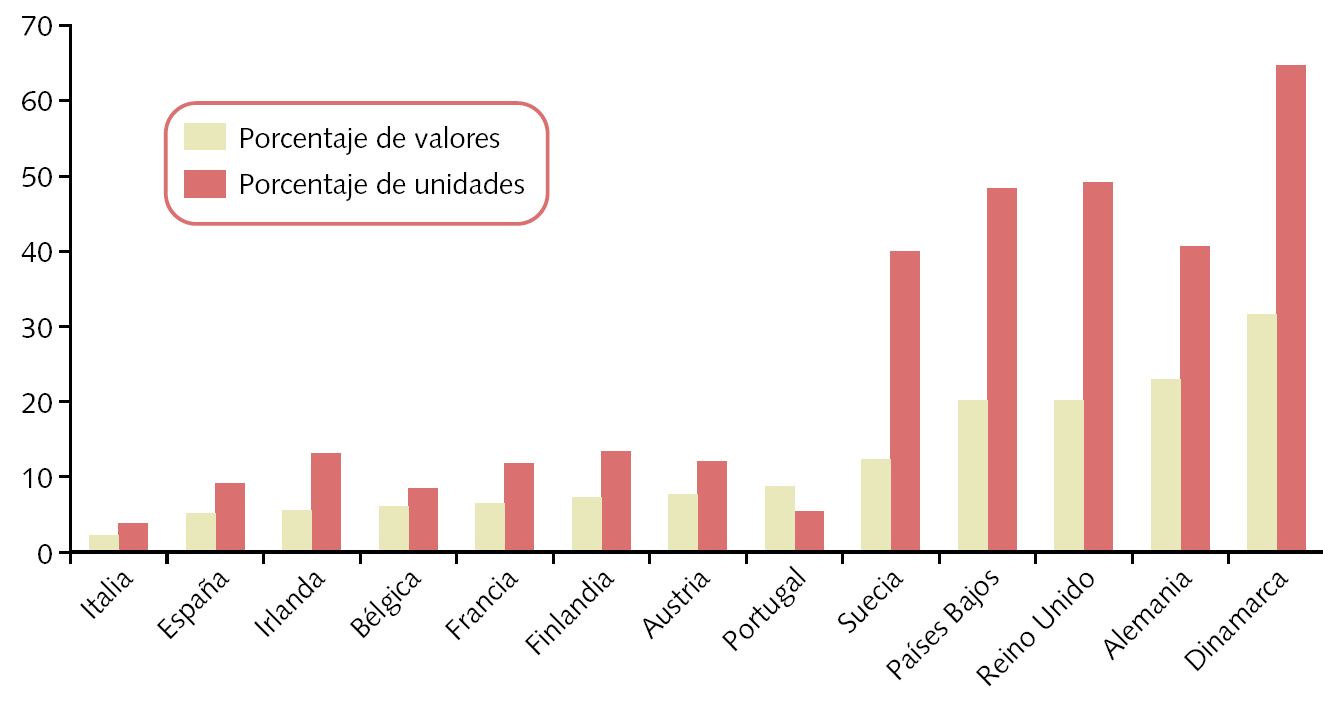Los medicamentos genéricos se van introduciendo con dificultad en el mercado de prescripción y en el Sistema Nacional de Salud, mientras que los biogenéricos, todavía no disponibles en España, representarán un gran mercado en el futuro.
Medicamento genérico es todo medicamento que tenga la misma composición cualitativa y cuantitativa en principios activos y la misma forma farmacéutica que el de referencia y cuya bioequivalencia con éste haya sido demostrada por estudios adecuados de biodisponibilidad. Se designan con una denominación oficial española de principio activo y, en su defecto, con la denominación común internacional (DCI), acompañada, en su caso, del nombre o marca del titular o fabricante. Se identifican con las siglas EFG (equivalente farmacéutico genérico).
Nuevo marco legal
La Ley de garantías y uso racional de los medicamentos y productos sanitarios (Ley 29/2006), a partir de ahora «nueva Ley», transpone la legislación europea sobre genéricos aprobada en 2004 y establece 8 años de exclusividad de datos + 2 años de exclusividad de mercado + 1 año si hay nueva indicación, lo que en términos prácticos significa que una solicitud de autorización para la comercialización de un genérico puede realizarse después del año 8, pero que el producto no se puede comercializar hasta después del año 10 o del año 11 si hay nueva indicación.
La nueva Ley tiene un aspecto negativo para los genéricos: cuando permite la sustitución de un medicamento porque éste forma parte de un conjunto de precios de referencia, ni siquiera obliga a sustituir genérico por genérico, sólo «menor precio».
Un aspecto ambivalente es que las administraciones sanitarias fomentarán la prescripción por principio activo, sin embargo, el farmacéutico dispensará el medicamento que tenga menor precio y, en caso de igualdad de precio, el genérico, si lo hubiere.
Economicismo
La prescripción por principio activo beneficia a los servicios de salud y a las farmacias, pero en el fondo es economicista: no importa que se sustituya por genérico o no, lo importante es que lo que se dispense sea más barato. Cabe argumentar que con esta estrategia se consigue lo fundamental --la prescripción por principio activo con su doble valor económico y educativo-- pero se dispensa un genérico o una marca, el que sea más barato. Esto tiene un inconveniente: en enfermedades crónicas se puede estar variando continuamente de medicamento y esto, aunque sea dentro de los límites que marca la bioequivalencia, origina fluctuaciones en el efecto terapéutico. Además, hay que apuntar el efecto negativo sobre el cumplimiento terapéutico en pacientes que ven cambiar continuamente sus referencias. Aquí es donde debe entrar la actuación farmacéutica para velar por la continuidad más homogénea del tratamiento y se puede conseguir con acuerdos a través de las guías farmacoterapéuticas de área o distrito sanitario.
Gradualidad
Luego está la gradualidad en el impacto de los precios de referencia, que establece la nueva Ley cuando el precio industrial de un producto de marca se vea afectado en más de un 30%. En estos casos, el laboratorio podrá optar por asumir toda la rebaja en un año o hacerlo en mínimos de un 30% al año hasta alcanzar el precio de referencia. La consecuencia: al prescribirse uno de estos productos de marca, como no entrará a formar parte del sistema de precios de referencia hasta que se haya producido toda la rebaja, no se podrá sustituir por uno bioequivalente con el menor precio existente dentro del conjunto de precios de referencia y se librará durante 3 años más (un tercio de bajada de la diferencia cada año) de su sustitución por uno más barato. Por tanto, por una vía extraña (tener precios muy altos en el período de exclusividad) se prorroga 3 años más la exigencia que se persigue con los genéricos --bajar los precios--, y ya se encargará el área comercial del laboratorio de que se siga prescribiendo como marca.
Promoción
La penetración de los genéricos depende de la cantidad de genéricos comercializados y de la imagen de calidad que éstos proyecten ante prescriptores, dispensadores y consumidores. Una de las medidas importantes para el fomento de estos medicamentos es la puesta en marcha de medidas de sensibilización social y de promoción, como programas de formación para médicos y farmacéuticos y campañas informativas dirigidas a la población, como la que se presentó en noviembre de 2005 bajo el lema «Medicamentos genéricos: nos beneficiamos todos», que contó con un presupuesto de 1,2 millones de euros.
Según el Barómetro Sanitario 2005, un 69,5% de los españoles sabe qué son los genéricos, aunque un 30,3% todavía no los conoce. Por otro lado, un 76,5% afirma que aceptaría de buen grado uno de estos medicamentos si se lo recetara su médico, aunque un 10,3% declara que trataría de conseguir que su médico le recetase uno de marca.
Conseguir un consumo aceptable de genéricos requiere una política de genéricos coherente, que incluya medidas en precios y reducción de aportación del paciente, además de proporcionar incentivos a los médicos por prescribir, a los farmacéuticos por dispensar y a los pacientes por utilizar estos medicamentos.
El fomento de la prescripción por principio activo desde las administraciones públicas ha emergido con fuerza en fechas recientes en varias comunidades autónomas, al considerar sus responsables de gestión que los beneficios económicos que genera compensan los inconvenientes y riesgos sanitarios que se derivan de continuos cambios de envases en la medicación de los pacientes.
Variedad de sistemas
Pero hay diferentes modelos de prescripción por principio activo en España. Por ejemplo, el Servicio Andaluz de Salud no contempla límites a esta práctica y fomenta activamente su aplicación sistemática al entender que todos los medicamentos autorizados con el mismo principio activo han de tener el mismo comportamiento terapéutico. Por otra parte, el modelo castellano-leonés circunscribe la prescripción por principio activo a los medicamentos que cuentan con genérico, excluye de la misma a los medicamentos con rango terapéutico estrecho y trata de evitar que los pacientes --especialmente los crónicos y polimedicados-- tengan que cambiar continuamente de medicación por este motivo. Cantabria apuesta por los dobles precios de referencia para las recetas prescritas por principio activo (DCI).
Situación de los biogenéricos
Cuando un genérico biológico que es similar a un biológico de referencia no cumple las condiciones de definición de genérico, deberán presentarse resultados de ensayos preclínicos y clínicos apropiados.
Europa
La legislación farmacéutica de la Unión Europea (UE) ha creado un procedimiento regulador para su registro en la UE estableciendo una base legal para los biogenéricos, que, en la nueva legislación, se llaman «productos medicinales biológicos similares».
En la actualidad, la Agencia Europea del Medicamento (EMEA) ha aprobado 2 biosimilares: Omnitrope (12 abril de 2006) y Valtropin (24 abril de 2006), que son 2 somatotropinas u hormonas humanas del crecimiento. Sin embargo, la patronal europea de los fabricantes de genéricos (European Generic Medicines Association, EGA) está preocupada por el hecho de que los retrasos en la revisión de las guías de la Organización Mundial de la Salud en la denominación de proteínas están creando cierta confusión. De hecho, asegura que esto podría llevar a la EMEA a rechazar que el mismo DCI sirva para denominar los productos biosimilares y los de referencia.
En Europa, Sandoz, el subsidiario de genéricos de Novartis, comercializó Omnitrope en Alemania con un 20% de descuento y también está intentando hacerlo disponible cuanto antes en Austria. Mientras tanto, Biopartners está tratando de introducir Valtropin en el mercado antes de fin de año y también está desarrollando una versión de liberación sostenida de Valtropin que está actualmente en ensayos clínicos de fase III, así como las versiones biogenéricas del interferón beta, interferón alfa y epoetin.
Estados Unidos
En Estados Unidos, la FDA (agencia responsable de la regulación en el ámbito de los alimentos y los medicamentos) acaba de dar luz verde a la comercialización de Omnitrope de Sandoz (30 de mayo de 2006), a pesar de que dicha agencia no había tomado posición sobre el tema y no se había establecido reglamentación sobre biosimilares. La patronal de los fabricantes y distribuidores de genéricos estadounidenses (Generic Pharmaceutical Association, GPhA) cree que es posible, bajo la estructura actual de la FDA, permitir la aprobación y comercialización de un arsenal extenso de biogenéricos con complejidad relativamente baja-moderada, y ampliar el sistema en los próximos años para permitir la aprobación de productos más complejos a medida que la ciencia vaya avanzando. La FDA, según la GPhA, debería autorizar esos productos mediante el proceso abreviado de aprobación 505(b)(2), como hace para medicamentos sintéticos en la actualidad.
A finales de septiembre de 2006 se presentó en el Congreso de Estados Unidos el proyecto Access to Life-Saving Medicine Act (Ley de acceso a medicamentos que salvan vidas), que servirá para proporcionar medicamentos biofarmacéuticos seguros, efectivos y accesibles a los consumidores. Actualmente, los pacientes que necesitan medicamentos biofarmacéuticos críticos no tienen alternativas genéricas disponibles porque la FDA no ha podido proporcionar un camino viable para su aprobación. La aprobación de esta legislación establecería un camino claro, abreviado y eficiente, necesario para la aprobación de genéricos biofarmacéuticos, lo que ahorraría a los consumidores y al sistema de asistencia sanitaria miles de millones de dólares1.
Omnitrope fue autorizado y está actualmente disponible (desde noviembre de 2005) en Australia. Hay firmas europeas que comercializan los biogenéricos en otras áreas como Asia, donde la legislación no distingue a los medicamentos biogenéricos de los otros genéricos. En países como China, India y Malasia los medicamentos biogenéricos no tienen un tratamiento normativo diferente al de los genéricos de productos de base química, lo que hace que en estos territorios sea más fácil la comercialización de biogenéricos.
Mercado de genéricos en España
El consumo de genéricos en España ha sido históricamente muy pequeño. Ha ido creciendo durante los últimos años gracias a las campañas de las Administraciones sanitarias y a los incentivos establecidos por los servicios de salud para su prescripción. A pesar de esto, los datos de 2004 (fig. 2) nos sitúan en los últimos lugares de la UE de 15 países (faltan datos de Luxemburgo y Grecia).
Fig. 2. Consumo de genéricos en la Unión Euoropea: porcentaje del mercado de prescripción en la Unión Europea (2004) Fuente: EGA internal survey (2005), modificado por el autor.
En el año 2005, si hablamos del mercado de prescripción en España, cabe señalar que no ha crecido mucho: un 5,7% en valores (5,2 en 2004) y un 10,5% en unidades (10,5 en 2004). Por grupos terapéuticos, las ventas están muy concentradas en 4 -- digestivo (inhibidores secreción gástrica, antagonistas H2); cardiovascular (antihipertensivos, terapia coronaria); sistema nervioso central (equilibradores del estado de ánimo, antidepresivos), y respiratorio-- que suponen dos terceras partes del total de ventas.
Según indicaba el Ministerio de Sanidad y Consumo2, en diciembre de 2005 el consumo de genéricos en el Sistema Nacional de Salud (SNS) alcanzó un 7,68% en importe económico y un 15,02% en número de envases vendidos. Esta cifra supone un importante incremento respecto a 2004, año en el que el consumo de genéricos supuso el 6,58% en valores con respecto al total del SNS y el 12,03% en unidades (envases).
Consumo de genéricos en la Unión Europea y Estados Unidos
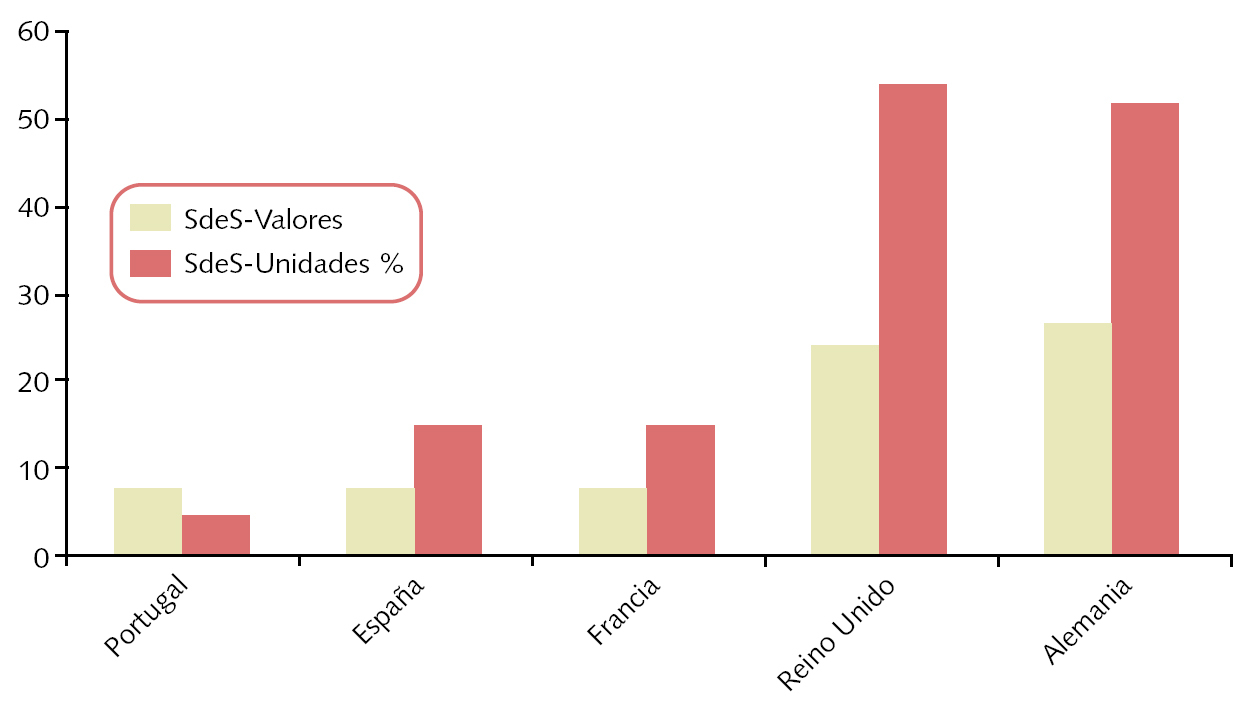
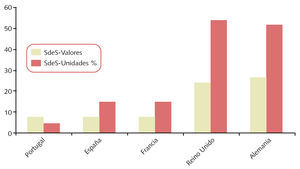
Sobre el consumo de medicamentos genéricos en servicios de salud de otros países de la UE hay disponible menos información y no referida al mismo año (fig. 1) . Portugal presenta una inversión (los valores superan a las unidades) en comparación con los otros países, porque tiene genéricos más caros.
Fig. 1. Consumo de genéricos (valores y unidades) en servicios de salud (SdeS) o similares de varios países de la Unión Europea: porcentaje con relación al total de medicamentos
Nota: en Alemania los datos sobre unidades se refieren a 2002. Los datos sobre valores en Alemania y sobre valores y unidades en Reino Unido se refieren a 2003. Los datos de Portugal (valores y unidades) se refieren a 2004. Los de España y Francia (valores y unidades) corresponden a 2005. En Reino Unido el 76% de la prescripción se realiza por nombre del principio activo, aunque sólo se dispensa el 55%, por no existir los genéricos correspondientes.
Fuente: EGA internal survey (2005), modificado por el autor.
En Estados Unidos, en 2005 los genéricos representaban un 56% de todas las prescripciones dispensadas, pero sólo suponían el 13,1% de la factura farmacéutica en medicamentos de prescripción. Los genéricos costaban, como media, un 30-80% menos que sus equivalentes de marca. En 2005, el precio medio de un genérico de prescripción era de 29,71 dólares y el precio medio de un medicamento de marca de prescripción, 101,71 dólares3.
Los genéricos, tradicionalmente un segmento volátil del mercado farmacéutico, registraron en Estados Unidos un crecimiento de ventas del 20,6% en (2005). El crecimiento de estos medicamentos demuestra la influencia creciente que las empresas de gestión de la prestación farmacéutica están ejerciendo, al inducir a sus pacientes a optar por las terapias de bajo coste4. En Estados Unidos, los productos superventas que pierden la patente se valoran en 22.000 millones de dólares en 2006, 27 mil millones en 2007, y 29 mil millones en 2008, y aún más en 2009 y 20105. La lista de aquellos cuya patente expira en 2006 incluye medicamentos con ventas superiores a mil millones de dólares en 2005: Ambien (zolpidem, de Sanofi-Aventis), Pravachol (pravastatina, de Bristol-Myers Squibb), Wellbutrin XL (bupropion, de GlaxoSmithKline), Zocor (simvastatina, de Merck), y Zoloft (sertralina, de Pfizer)6.
De las 5 primeras compañías farmacéuticas de Estados Unidos (si se atiende al número de prescripciones de sus productos dispensadas), 4 son compañías de genéricos: Novartis (Sandoz), Teva, Mylan Laboratories and Watson Pharmaceuticals5. 8.400 de los 11.167 medicamentos listados en el Orange Book7 de la FDA en junio de 2005 tenían un equivalente genérico8.
El Informe Simoens9 fue particularmente claro en un punto: para que la industria de los genéricos sea sostenible y capaz de proporcionar las ventajas en materia de precios requeridas por los gobiernos, debe tener un volumen grande de mercado pospatente. Éste no es el caso de España, Italia, Bélgica y Francia. La EGA anima a los países que están en los últimos puestos en consumo de genéricos en Europa a que se fijen un objetivo mínimo del 30% sobre el total de unidades dispensadas en sus mercados farmacéuticos antes de 2009.
Mercado de biogenéricos
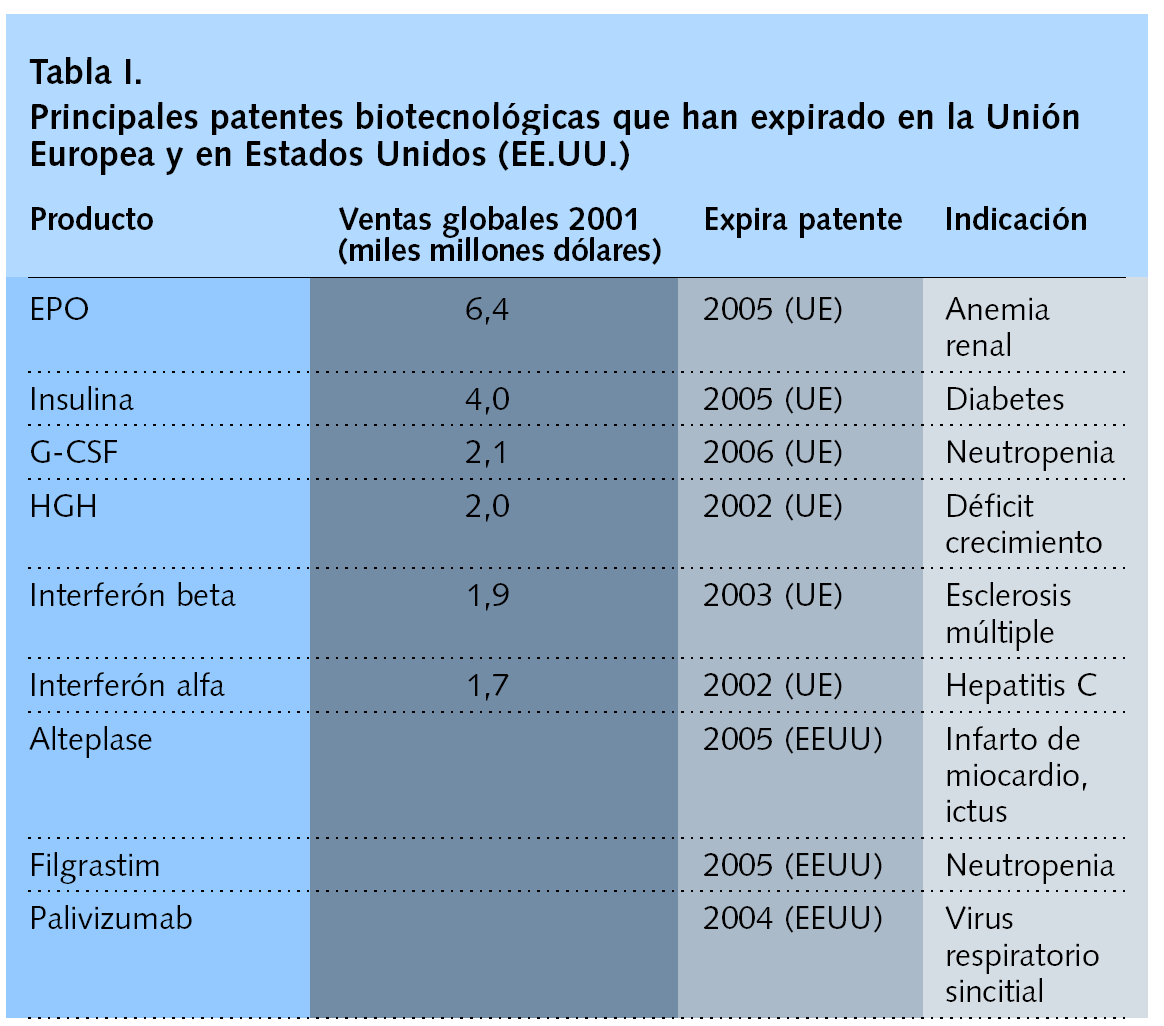
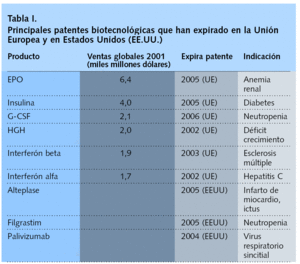
La primera ola de biogenéricos (tabla I), formada por sólo 6 productos, generará ahorros en la UE de alrededor de 2,8 mil millones de euros por año.
Para ilustrar la importancia económica de este hecho cabe señalar que los 3 productos biotecnológicos más importantes en ventas en Estados Unidos --filgrastim, un factor estimulante de colonias de granulocitos humanos (G-CSF) producido por tecnología de ADN recombinante; epoetin alfa, una eritropoyetina que estimula la producción de glóbulos rojos, e interferón alfa-2b, un interferón alfa producido por tecnología de ADN recombinante-- cuestan aproximadamente 15.000, 10.000, y 23.000 dólares, respectivamente por paciente y año, según la GPhA10.
Según IMS Healthcare, el volumen de negocio mundial de los productos biofarmacéuticos se estima en 20.000 millones de dólares, aproximadamente. Así, si los biogenéricos lograsen una saturación del 10-15%, similar a la de los genéricos estándar, estaríamos hablando de un mercado potencial de 2 mil millones de dólares.
Bibliografía general
EGA. Competition and Affordability in Biopharmaceuticals. Disponible en: http://www.egagenerics.com/gen-biogenerics.htm
EMEA. Biosimilar medicinal products. En: Guidance documents. Biosimilar products. Disponible en: http://www.emea.europa.eu/index/indexh1.htm
EMEA. Guideline on Similar Biological Medicinal Products (CHMP adopted September 2005). Disponible en: http://www.emea.eu.int/pdfs/human/biosimilar/043704en.pdf
FDA. Saving Money On Prescription Drugs. Disponible en: http://www.fda.gov/fdac/features/2005/505_save.html
Iñesta A. Políticas del medicamento. En: Repullo JR, Iñesta A, editores. Sistemas y Servicios Sanitarios. Madrid: Díaz de Santos; 2006. p. 335-81.