El dolor es el síntoma más temido e incapacitante para el paciente oncológico. Diversos estudios han demostrado que la mitad de los pacientes con cáncer que sufre dolor recibe tratamiento analgésico inadecuado. Por otra parte, el primer problema a la hora de tratar el dolor oncológico es, desde luego, realizar una correcta valoración. Así pues, la evaluación del paciente y su dolor es imprescindible antes de emprender ningún tratamiento. En el presente artículo se hace una revisión de la farmacoterapia aplicable a este tipo de dolor.
Actualmente la patología cancerosa representa la primera causa de muerte en España. Aproximadamente uno de cada 4 fallecimientos la tienen como causa. Casi un 35% de los enfermos oncológicos sometidos a tratamiento activo refiere dolor y éste es el síntoma que causa mayor temor en este colectivo. El consumo de morfina es el indicador propuesto por la Organización Mundial de la Salud (OMS) para valorar el control del dolor oncológico en un determinado país. A pesar de los progresos realizados en los últimos años, este consumo en España permanece por debajo de la media de los países de nuestro entorno. Factores como falta de conocimiento sobre una adecuada valoración del dolor y uso de fármacos opioides, persistencia de mitos entre los profesionales (y pacientes) sobre el uso de morfina, barreras legales para la dispensación de estos fármacos y mala coordinación entre los distintos niveles asistenciales son algunas de las razones que justifican estos pobres resultados.
Como se acaba de mencionar, es fundamental realizar una correcta valoración del dolor. En el paciente oncológico, este síntoma es producido frecuentemente de forma simultánea por diferentes mecanismos, requiriendo, por tanto, estrategias terapéuticas diferentes. Un aspecto clave es conocer el tipo o tipos de dolor desde la perspectiva fisiopatológica (neuropático, somático, visceral), su irradiación, intensidad (medida objetivamente mediante alguna escala), evolución en el transcurso del día, circunstancias exacerbantes y atenuantes, síntomas asociados, impacto psicológico en el paciente y respuesta a tratamientos previos.
Otro de los aspectos claves en el manejo del dolor oncológico es conocer su intensidad, para lo cual pueden utilizarse diferentes escalas: la escala numérica verbal y la escala analógica visual.
En el paciente oncológico, el dolor tiene 3 posibles orígenes:
Efecto directo del tumor.
Tratamiento antitumoral.
Sin relación con el cáncer.
Analgésicos no opioides
Los analgésicos no opioides constituyen un grupo amplio de medicamentos, químicamente heterogéneos. Tienen techo terapéutico, lo que significa que hay una dosis máxima diaria por encima de la cual no se consigue un mayor efecto analgésico.
No hay una evidencia clara que demuestre superioridad de un antiinflamatorio no esteroideo (AINE) respecto a otro. Sus indicaciones son: dolor de intensidad leve a moderada con afectación ósea o musculotendinosa y en la compresión mecánica de pleura o peritoneo; también pueden potenciar la acción analgésica de los opioides en el dolor moderado e intenso.
El paracetamol puede administrarse usando una dosis inicial comprendida entre 650 y 1.000 mg cada 4 o 6 h por vía oral o rectal; la dosis máxima es de 1.000 mg cada 4 h. Su potencia analgésica es similar a la del ácido acetilsalicílico. Entre sus efectos secundarios destaca la toxicidad hepática, por lo que la dosis máxima diaria es de 2 g para pacientes caquécticos, alcohólicos o con patología hepática.
El ácido acetilsalicílico se administra a dosis comprendidas entre 500-1.000 mg cada 4 o 6 h. La vía de administración es la oral; la dosis máxima diaria es de 6.000 mg.
Respecto al ibuprofeno, la dosis inicial oscila entre 400 y 600 mg, cada 4 o 6 h. La vía de administración puede ser oral o rectal; la dosis máxima diaria es de 2.400 mg.
El naproxeno se administra con dosis iniciales comprendidas entre 250 y 500 mg cada 8 o 12 h. La vía de administración puede ser oral o rectal. La dosis máxima diaria es de 1.500 mg.
El diclofenaco se administra con una dosis inicial de 50 mg cada 6 u 8 h, por vía oral o rectal. La dosis máxima diaria es de 200 mg.
Finalmente, con relación al metamizol, la dosis inicial oscila entre 500 y 2.000 mg, cada 6 u 8 h, administrado por vía oral, rectal o parenteral. La dosis máxima diaria es de 8.000 mg.
Los principales efectos adversos de los AINE incluyen manifestaciones gastrointestinales (dispepsia, pirosis, úlcera gastroduodenal, hemorragia), renales (insuficiencia renal, nefritis intersticial, síndrome nefrótico y necrosis papilar), pulmonares (broncoespasmo), hematológicos (interfieren en la agregación plaquetaria) y reacciones de hipersensibilidad (shock anafiláctico, urticaria).
Analgésicos opioides débiles
El grupo de los analgésicos opioides débiles incluye los siguientes compuestos: codeína, dihidrocodeína, dextropropoxifeno y tramadol. Estos fármacos se encuentran en diferentes presentaciones:
Preparados de formulación única y simple.
Preparados de liberación retardada o controlada.
En combinación fija con analgésicos antipiréticos o analgésicos AINE.
La codeína se usa con una dosis inicial de 30 mg cada 4 o 6 h; la dosis máxima es de 60 mg cada 4 h. La vía de administración puede ser oral o rectal. En cuanto a potencia analgésica, 30 mg de codeína equivalen a 650 mg de ácido acetilsalicílico. Se debe administrar con precaución en pacientes con insuficiencia hepática o renal. Puede producir sensación de mareo, náuseas y estreñimiento, en intensidad relacionada con la dosis.
La dihidrocodeína se emplea en dosis comprendidas entre 60 y 120 mg cada 12 h. Sus efectos son similares a los de la codeína, aunque se formula en presentaciones de liberación retardada.
El tramadol se emplea con una dosis inicial de 50 mg cada 6 u 8 h; la dosis máxima es de 400 mg diarios repartidos cada 6-8 h. La vía de administración incluye las vías oral, rectal, subcutánea, intramuscular e intravenosa. Una vez controlado el dolor con las presentaciones de liberación normal, pueden usarse presentaciones de liberación retardada. Es prudente evitar este compuesto en pacientes con predisposición a sufrir ataques epilépticos, ya que disminuye el umbral convulsivo; esto puede ocurrir en enfermos con tumores o metástasis cerebrales. Frecuentemente produce náuseas y vómitos, sudoración, mareo y sedación. El dextropropoxifeno es un análogo de la metadona. Su acción analgésica moderada dura unas 4 h. La dosis recomendada es de 50-100 mg por vía oral cada 4 o 6 h.
Analgésicos opioides potentes
En el grupo de analgésicos opioides potentes, el fármaco de elección según todos los consensos y revisiones es la morfina. La razón de esta preferencia está basada no sólo en su eficacia analgésica, sino también en su amplia experiencia clínica, flexibilidad de dosis, múltiples formulaciones y vías de administración, unidos a un coste relativamente bajo. A pesar de ello, desde la comercialización del fentanilo transdérmico, el uso de este último ha crecido espectacularmente.
Los opioides de tercer escalón tienen una eficacia analgésica similar, siendo la característica definitoria del grupo el hecho de que son fármacos que no tienen techo analgésico, de modo que a mayor dosis, mayor es la eficacia analgésica. El límite de dosis viene dado por la presencia de efectos secundarios intolerables. El supuesto mejor perfil del fentanilo respecto a la morfina sólo ha resultado ser cierto en lo que respecta al estreñimiento.
Morfina
El alcaloide natural más abundante obtenido del jugo extraído de la planta Papaver somniferum es la morfina, que es el prototipo de analgésico opioide, ya que a su eficacia analgésica une su hidrosolubilidad, lo que permite su utilización en solución por todas las vías de administración; al mismo tiempo posee una buena biodisponibilidad para poder ser administrada por vía oral.
Todas estas razones convierten a la morfina en el opioide más utilizado en el tratamiento del dolor intenso, agudo y crónico, aunque conviene no olvidar las siguientes puntualizaciones:
A pesar de que los opioides son los analgésicos más eficaces, hay algunos dolores que no remiten con ellos y responden mejor a otra farmacoterapia analgésica.
Algunos enfermos que requieren opioides para el alivio de su dolor toleran mal la morfina, y sin embargo, responden mejor a otros fármacos opioides.
El manejo clínico de la morfina es relativamente sencillo, aunque para la instauración del tratamiento deben tenerse en cuenta las dosis previas de opioides de segundo escalón.
Hay diferentes presentaciones farmacéuticas:
Morfina de acción rápida, que se presenta en forma de comprimidos de 10 y 20 mg que pueden fraccionarse o pulverizarse. También existe la solución oral en monodosis con concentraciones de 2, 6 y 20 mg/ml, y la solución oral en frasco con una concentración de 20 mg/ml.
Morfina de liberación retardada, que se presenta en forma de comprimidos que, obviamente, deben tragarse enteros.
No hay diferencia en cuanto a potencia analgésica entre las 2 presentaciones. Al inicio del tratamiento se aconseja usar morfina oral rápida, puesto que las dosis analgésicas pueden ajustarse con mayor rapidez.
Al inicio del tratamiento, si el paciente no ha sido tratado previamente con opioides, la dosis inicial será de 5-10 mg cada 4 h. Pasadas 24 h desde que se inicia el tratamiento, pueden darse 2 situaciones:
Que el enfermo no tenga dolor, en cuyo caso se mantienen las mismas dosis cada 4 h.
Que el enfermo continúe con dolor, situación ésta en la que se aumentará la dosis diaria total en un 50% y así cada 24 h hasta obtener un alivio adecuado del dolor.
Tras controlar el dolor del paciente con morfina rápida, se pasará a utilizar morfina de liberación retardada, usando la misma dosis diaria repartida cada 12 h.
En aquellos pacientes que tengan dificultad para la ingesta oral, podrá utilizarse la vía subcutánea, debiendo tenerse en cuenta que la dosis diaria de morfina subcutánea será un tercio de la dosis diaria total de morfina oral.
Si el dolor es controlado con terapia antitumoral, el paciente necesitará menor cantidad de morfina o incluso ésta podrá ser suspendida. La reducción de la dosis de morfina oral o subcutánea se realizará de modo gradual.
Metadona
La metadona es un opioide sintético capaz de sustituir perfectamente a la morfina en aquellos pacientes que no toleren esta última. Su peculiar mecanismo de acción hace que la metadona sea eficaz en el tratamiento de cuadros dolorosos que no responden a otros opioides o incluso en aquellos dolores en los que se ha desarrollado tolerancia a la morfina. Estudios de dosis única han demostrado que la metadona tiene una potencia similar a la morfina, aunque en la práctica, cuando se administra de forma crónica, su potencia es varias veces superior a la de la morfina, lo que obliga a ajustar la dosis convenientemente.
Por otra parte, una vez iniciado el tratamiento con metadona o incrementada la dosis, su concentración aumenta lentamente, lo que puede dar lugar a que los efectos adversos aparezcan con retraso, y si se administran nuevas dosis a intervalos fijos y cortos, se puede originar una importante acumulación.
Fentanilo
El fentanilo es un opioide sintético, cuya principal acción es la analgésica. Hasta hace poco su uso estaba restringido a las unidades de anestesia como analgesia preoperatoria, o bien, a cuidados intensivos. Sin embargo, su alta potencia y buena liposolubilidad han facilitado el desarrollo de la vía espinal (situaciones agudas o crónicas) y de la vía transcutánea para el dolor crónico de origen oncológico o no; esta última forma de administración ha disparado su uso, lo que obliga a los profesionales de atención primaria a estar familiarizados con él. El uso de fentanilo como analgésico por vía parenteral es excepcional. Finalmente, la vía transmucosa oral para situaciones de rescate es otra nueva y práctica aportación en el tratamiento del dolor.
A pesar de todas estas ventajas, el manejo clínico del fentanilo, en concreto de la presentación transdérmica, es más complejo en comparación con el de otros opioides. Los parches de fentanilo para utilizar por vía transdérmica están diseñados para liberar 25 mg/h por cm2 de forma constante durante 72 h. Tras ser aplicado el parche, el efecto analgésico comienza al cabo de 12-14 h; al retirarlo e interrumpir su uso, la analgesia persiste durante un período comprendido entre 16-24 h.
La cantidad de fármaco liberada desde el parche presenta una gran variabilidad interindividual, dependiendo de factores tales como:
La permeabilidad de la piel.
La zona del cuerpo donde se coloque el parche.
El estado de la piel (hidratación, irritación, irradiación previa, vello, higiene).
La eliminación corporal del fármaco.
Los parches de fentanilo resultan especialmente útiles en las siguientes situaciones:
Pacientes con dificultad o imposibilidad para tragar.
Intolerancia a los efectos adversos de otros opioides.
Pacientes con obstrucción intestinal parcial.
Pacientes con obstrucción del conducto biliar.
Pacientes con insuficiencia renal.
El uso de parches transdérmicos de fentanilo deberá realizarse con precaución en pacientes ancianos, caquécticos o febriles. Su uso está desaconsejado en dolor agudo postoperatorio, ya que puede causar depresión respiratoria.
Al inicio del tratamiento en pacientes no tratados con opioides potentes se utilizarán parches que aporten 12 o 25 mg/h de fentanilo junto con morfina oral de liberación rápida (5-10 mg) o subcutánea (5 mg), dosis esta que podrá repetirse cada 2 o 4 h si el paciente continúa con dolor. Los parches de fentanilo transdérmico se cambian cada 3 días, si bien un 25% de los pacientes tratados con este fármaco precisa cambiar el parche cada 48 h. Si se producen agudizaciones del dolor, el enfermo tomará dosis suplementarias de morfina oral rápida que podrá repetir cada 2-4 h. En el caso de que sea preciso interrumpir el tratamiento de fentanilo transdérmico, la retirada se realizará de forma gradual.
Además de la presentación transdérmica de fentanilo, también existe el denominado citrato de fentanilo oral transmucoso, una «pastilla para chupar», caracterizada por una acción más rápida y menos duradera en comparación con la vía transdérmica. La principal indicación de esta presentación son las agudizaciones del dolor crónico oncológico tratado con opioides. El fentanilo transmucoso no puede utilizarse si el paciente presenta mucositis.
Oxicodona
La oxicodona es un opioide comercializado en forma de comprimidos de liberación prolongada de 10, 20, 40 y 80 mg, que se administran cada 12 h y que deben tragarse enteros. Su principal indicación es el dolor oncológico intenso. La dosis inicial en pacientes no tratados con opioides es de 10 mg cada 12 h. Si el enfermo precisa incrementar la dosis, esto se hará aumentando un 50% la dosis diaria total que se repartirá cada 12 h. Los incrementos se espaciarán 48 h. La administración de oxicodona deberá realizarse con precaución en pacientes con insuficiencia hepática o renal de moderada a grave.
Buprenorfina
La buprenorfina es un opioide agonista-antagonista, hecho éste que condiciona su acción analgésica. Es un compuesto que tiene techo terapéutico y actualmente es considerado como un opioide potente de segunda línea, siendo sus indicaciones el dolor moderado o intenso.
En pacientes no tratados con opioides potentes, el tratamiento con buprenorfina transdérmica se realizará usando parches de 35 mg/h y administrando conjuntamente un comprimido sublingual de este mismo fármaco. Los parches de buprenorfina transdérmica se cambian cada 3 días. Si se produce una agudización del dolor, el paciente puede recibir un comprimido de buprenorfina sublingual (0,2 mg), toma que puede repetir a las 12 h. El uso de este fármaco no está autorizado en pacientes menores de 18 años; debe emplearse con precaución en enfermos con insuficiencia hepática y en enfermos con cuadros febriles o caquécticos.
Efectos secundarios
Los principales efectos secundarios de los opiodes son:
Estreñimiento: es la reacción adversa que con mayor frecuencia aparece en los tratamientos prolongados, hasta el punto de que debe ser considerada y prevenida sistemáticamente, para lo cual se utilizan laxantes de acción osmótica como primera medida, y si el estreñimiento persiste se pasa a laxantes estimulantes. En los casos en que se produce impactación fecal se administra un enema rectal o se procede a la desimpactación manual. Este efecto adverso adquiere proporciones mayores en personas encamadas, que realizan poco ejercicio, en ancianos y en pacientes con patología intrínseca gastrointestinal.
Náuseas y vómitos: la incidencia de ambos efectos adversos oscila entre el 10-40%, especialmente tras administrar las primeras dosis de opioides, aunque, por otra parte, se crea tolerancia con relativa facilidad. Estos efectos adversos se deben a varios factores, entre los que se incluyen un aumento de tono en el antro gástrico por gastroparesia y contracción pilórica, estimulación de la zona gatillo quimiorreceptora del área postrema situada en el suelo del cuarto ventrículo y sensibilización del aparato vestibular. Si las náuseas y vómitos son posprandiales, están indicados los antieméticos procinéticos, y si ocurren con el movimiento, el fármaco de elección es la cinarizina. Si no se cumplen ninguna de las 2 condiciones anteriores, puede usarse haloperidol, corticoides o antagonistas de la serotonina.
Sedación y deterioro cognitivo: ante su presencia es obligatorio evaluar posibles alteraciones metabólicas o patológicas del sistema nervioso central. En los tratamientos crónicos, estos síntomas pueden ser muy limitantes, si bien hay personas en las que se crea tolerancia relativa con rapidez y, pasadas las primeras dosis se recuperan; en otras, por el contrario, existe una gran susceptibilidad y persiste la sedación. Si el opioide da lugar a reacciones delirantes, tras comprobar que no hay otra causa que las genere, se intentará controlarlas con haloperidol.
Depresión respiratoria: tradicionalmente esta reacción adversa ha significado una rémora en la aplicación de un tratamiento antiálgico eficaz por temor excesivo a su aparición; sin embargo, su riesgo en pacientes con dolor oncológico intenso es mínimo. No hay que olvidar, por otro lado, que la depresión respiratoria es un hecho real que aparece cuando hay sobredosificación o cuando el paciente tiene problemas respiratorios, ya que los opioides deprimen directamente el centro respiratorio y su sensibilidad al dióxido de carbono.
Mioclonías: la aparición de este efecto adverso guarda relación con la dosis de opioide. Pueden revertir con clonazepan e hidratación adecuada.
Retención urinaria: su presencia es infrecuente, aunque puede aparecer en hombres mayores o tras inyección espinal. Puede precisar sondaje.
Prurito: si aparece, se trata con antihistamínicos.
Sudoración: este efecto secundario de los opioides puede tratarse con corticoides o anticolinérgicos.
Dependencia física y adicción: ambos efectos adversos son los que más han contribuido a que los opioides se infrautilicen en numerosas ocasiones. Dependencia física no significa adicción, ya que la primera consiste en la aparición de un síndrome de abstinencia con todas sus manifestaciones físicas cuando se interrumpe la dosificación del opioide administrado de forma crónica, se reduce bruscamente la dosis, o se administra un antagonista en el curso de la administración crónica de un agonista puro; por el contrario, la adicción implica un cuadro conductual y psicológico en el cual el sujeto se esfuerza por conseguir nuevas dosis de opioide que le permitan seguir notando sus efectos. Aun cuando es posible que en el transcurso de un tratamiento prolongado aparezca la dependencia física, ésta no tiene por qué representar un problema médico si se tienen en cuenta las siguientes puntualizaciones: advertir al paciente que no suspenda ni reduzca la dosis con brusquedad, reducir lentamente la dosis cuando sea conveniente suprimir el tratamiento, evitar los opioides antagonistas e incluso los agonistas/antagonistas mixtos. En el contexto de un tratamiento con fines médicos, es muy raro que se desarrolle una adicción real.
Coadyuvantes analgésicos
Las posibilidades de la farmacoterapia del dolor oncológico no se agotan con los opioides o los AINE, sino que se extienden a otros grupos farmacológicos, que si bien son utilizados primariamente para otras indicaciones, poseen cualidades capaces de aliviar ciertos tipos específicos de dolor oncológico que, precisamente, se resisten o responden peor a los fármacos inicialmente comentados. Así pues, con la denominación de analgésicos coadyuvantes se conoce un grupo de medicamentos, químicamente heterogéneos, cuya acción y eficacia se entiende que complementa las de los analgésicos propiamente dichos. En este sentido, tienen carácter complementario porque estos fármacos, unidos a los opioides y/o a los AINE, potencian la acción e incrementan la eficacia analgésica de éstos. Esta es la forma en que debe entenderse la analgesia coadyuvante propuesta por la OMS en su escalera analgésica para el tratamiento del dolor oncológico. Se incluyen aquí los siguientes grupos de compuestos:
Antidepresivos
Es el grupo coadyuvante más ampliamente utilizado en el tratamiento del dolor; su principal indicación es el dolor neuropático.
La acción analgésica de los antidepresivos es independiente de su acción antidepresiva, aunque existen situaciones de dolor crónico con componente depresivo en las que el alivio de este factor contribuye a mejorar la actividad general del paciente, dolor incluido. El mecanismo de acción de su efecto analgésico continúa siendo objeto de controversia. El efecto analgésico suele comenzar a la semana, aunque en otras ocasiones han de transcurrir 2-4 semanas para percibir dicho efecto. Los fármacos con los que se tiene una experiencia más amplia han resultado ser amitriptilina, clomipramina, desipramina y doxepina, y muy especialmente el primero de ellos.
La amitriptilina presenta efectos sedantes, anticolinérgicos e hipotensores que pueden sumarse a los provocados por otros medicamentos que el paciente esté tomando. Otros efectos secundarios incluyen alteraciones de la conducción intracardíaca y arritmias, palpitaciones y temblor. Por todo ello se recomienda iniciar el tratamiento con dosis bajas, en concreto, 25 mg al acostarse (ancianos y pacientes debilitados, 10 mg). Si continúa el dolor, la dosis se incrementará a razón de 10-25 mg cada semana; la dosis máxima oscila entre 100-150 mg/día. Este fármaco está contraindicado en pacientes que sufran ataques epilépticos o alteraciones de la conducción cardíaca.
Los inhibidores selectivos de la recaptación de serotonina no han demostrado ser útiles.
Anticonvulsivantes
Este grupo de fármacos tiene su principal indicación en el dolor oncológico neuropático. Los más utilizados y con los que se tiene mayor experiencia son gabapentina, clonazepan, fenitoína, ácido valproico y carbamazepina. Dado lo heterogéneo de su estructura y de su mecanismo de acción, puede ocurrir que uno de ellos fracase y que otro sea eficaz, por lo que se impone la norma de la sustitución cuando uno de ellos haya fracasado.
La dosis analgésica adecuada para cada paciente se determina de modo individual, sin sobrepasar los niveles plasmáticos máximos de cada medicamento.
El tratamiento con gabapentina se realizará de la siguiente forma:
Dosis inicial: primer día, 300 mg (noche); segundo día, 300 mg cada 12 h; tercer día y siguientes, 300 mg cada 8 h.
El séptimo día, si el paciente continúa con dolor, se incrementará la dosis diaria en 300 mg, y así cada 5 o 7 días hasta alcanzar la dosis máxima de 3.600 mg/día. Las dosis deberán reducirse en pacientes con insuficiencia renal.
Respecto al clonazepan, la dosis inicial será de 0,5 a 1 mg administrado por la noche. Si es preciso incrementar la dosis, el cuarto día se pautarán 0,5-1 mg cada 8 o 12 h; cada semana pueden realizarse incrementos progresivos hasta alcanzar la dosis máxima, que habitualmente suele ser 4-8 mg diarios repartidos cada 8 h. Considerando el efecto sedante de este fármaco, puede ser útil en pacientes con ansiedad.
El efecto analgésico de los anticonvulsivantes puede tardar 4 semanas en aparecer.
Neurolépticos y ansiolíticos
Los neurolépticos y ansiolíticos no tienen propiedades analgésicas propias, a excepción de la levomepromazina. Potencian la acción depresora de los opioides pero, en principio, su uso no está justificado en el tratamiento del dolor salvo que vayan a aliviar un síntoma concreto que aparezca conjuntamente en el transcurso de la enfermedad.
Los neurolépticos habitualmente se usan para prevenir o suprimir las náuseas y vómitos debidos a los opioides. Suele utilizarse levomepromazina con dosis iniciales de 10-20 mg/día, que pueden aumentarse hasta los 300 mg/día.
Las benzodiacepinas se utilizan cuando el dolor se acompaña de un fuerte componente ansioso, debido principalmente, a que el paciente presente personalidad ansiosa. Su uso también está indicado en situaciones en las que sea difícil conciliar el sueño.
Corticoides
El efecto analgésico de los corticoides es debido fundamentalmente a su acción antiinflamatoria, aunque se discute si estos fármacos poseen, además, propiedades analgésicas intrínsecas. Los compuestos con los que se tiene mayor experiencia son prednisona, metilprednisona, triamcinolona y dexametasona.
En pacientes con dolor oncológico, los corticoides se administran por vía sistémica (oral o parenteral) y en asociación con los analgésicos adecuados al tipo e intensidad de dolor de acuerdo con la escalera analgésica de la OMS. En general, se utilizan corticoides de vida media biológica intermedia (prednisolona) o larga (dexametasona), en ciclos cortos de 6-9 días.
La dexametasona destaca por su potencia antiinflamatoria, siendo las dosis habituales de 8-40 mg cada 24 h durante 3 o 5 días. Como ya se ha indicado, puede usarse la vía oral o parenteral.
El tratamiento prolongado está indicado en dolor oncológico debido a metástasis óseas, hipertensión intracraneal, tumores de cara o cuello, compresión medular o nerviosa y hepatomegalia.
Las reacciones adversas más frecuentes son las infecciones secundarias al efecto inmunodepresor.
Recomendaciones generales de tratamiento del dolor oncológico
Las recomendaciones generales para el tratamiento del dolor en el paciente con patología tumoral continúan siendo las que en su momento definió un grupo de expertos de la OMS1, cuyos aspectos más destacados son los siguientes:
Hacer diagnóstico diferencial del dolor.
Mantener la vía oral siempre que sea posible.
Pautar los analgésicos con horario fijo y «reloj en mano», evitando tomas a demanda.
Valorar la respuesta al tratamiento, individualizándolo.
Prevenir los efectos secundarios.
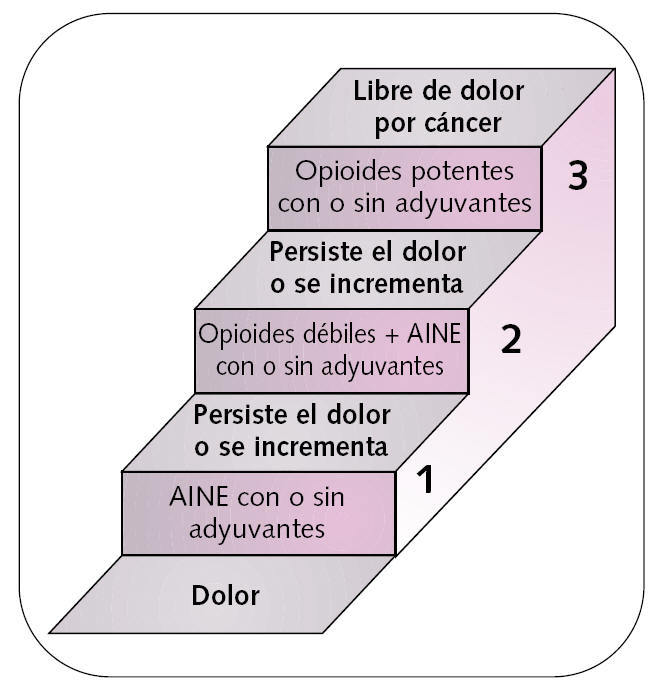
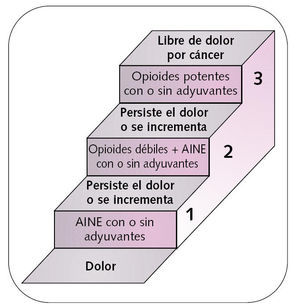
Seguir un tratamiento escalonado (escalera analgésica de la OMS) (fig. 1).
Fig. 1. Escalera analgésica de la OMS.
La escalera analgésica de la OMS fue diseñada como un sencillo esquema de tratamiento progresivo del dolor oncológico, habiendo sido validada posteriormente por numerosos estudios. Más del 80% de los pacientes puede ser controlado utilizando la escalera analgésica, cuyas recomendaciones generales de uso son las siguientes:
Debe empezarse en el escalón correspondiente en función de la intensidad del dolor.
El tratamiento deberá mantenerse mientras sea eficaz y se irá ascendiendo de escalón a medida que sea necesario.
Los medicamentos del primer escalón pueden, y deben, asociarse con los del segundo y tercero.
No es conveniente asociar medicamentos de un mismo escalón entre sí.
No se aconseja asociar analgésicos del segundo y tercer escalón entre sí.
Los adyuvantes pueden utilizarse en todos los escalones.
Algunas consideraciones a tener en cuenta a la hora de seleccionar los diferentes analgésicos son las siguientes:
Respecto a los antiinflamatorios no esteroideos (AINE), se aconseja utilizar un número limitado de ellos, manejando aquellos compuestos sobre los que exista suficiente evidencia de utilidad, que tengan buen perfil toxicológico y resulten coste-efectivos.
En lo que respecta al grupo de opioides débiles, la codeína se considera el compuesto de elección.
Con relación al grupo de los opioides potentes, la mayoría de las guías de recomendaciones y buena práctica clínica señalan la morfina por vía oral como el fármaco de elección, quedando como compuestos alternativos el fentanilo y la metadona. Sin embargo, llama poderosamente la atención el uso extendido que se está haciendo de las presentaciones transcutánea y transmucosa de fentanilo.
El estreñimiento es la reacción adversa que con más frecuencia aparece en los tratamientos oncológicos prolongados, hasta el punto de que debe ser considerada y prevenida sistemáticamente
Notas
1. OMS. Cancer pain relief. Ginebra: OMS; 1996.
www.doymafarma.com
Material complementario para suscriptores
FICHAS DE EDUCACIÓN SANITARIA
1 Ficha descargable:
• Prevención del cáncer
Personalizables con el logotipo de su farmacia para entregar como cortesía a sus clientes
Bibliografía general
Aliaga L, Baños J, Barrutell C, Molet J, Rodríguez A. Tratamiento del dolor, teoría y práctica. Barcelona: Permanger; 2002.
Alonso A. Tratamiento con opioides del dolor oncológico. Medifam. 2003;1:1-11.
Astudillo W, Mendinueta C, Astudillo E. Cuidados del enfermo en fase terminal y atención a su familia. 4.ª ed. Pamplona: Eunsa; 2002.
Flórez J. Fármacos y dolor (libro electrónico). Fundación Instituto Upsa del Dolor (consultado el 20 de abril de 2007). Disponible en: http://www.todoparacetamol.info/profesionales/pdf_libros/Farmacosydolorl.pdf
Sánchez FJ, Zubiaur A, Lizan L. Fentanilo transdérmico para el tratamiento del dolor: revisión. FMC. 1999;8:547-56.
Silva M, Aldamiz-Echevarría B, Lamelo F, Vidan L. Manejo del dolor oncológico. Guías clínicas 2006, (consultado el 20 de abril de 2007). Disponible en: http://www.fisterra.com/guias2/dolor_oncológico.asp
Sociedad Española de Cuidados Paliativos. Guía de cuidados paliativos (libro electrónico). SECPAL, (consultado el 20 de abril de 2007). Disponible en: http://www.secpal.com/guiacp
Torrejón M, Fernández J, Sacristán A. Uso de fentanilo en pacientes oncológicos terminales. ¿Está justificado su amplio uso? Información Terapéutica del Sistema Nacional de Salud. 2005; 3:69-73.
World Health Organization. Cancer pain relief. Ginebra: OMS; 1996.