Tanto el neuropático como el oncológico son dos tipos de dolor complejos que dan lugar a alteraciones importantes en la calidad de vida de la persona que los padecen. Pueden provocar importantes cambios emocionales, depresión, insomnio, irritabilidad, deterioro funcional, discapacidad laboral, repercutiendo incluso en las relaciones personales. Por ello es muy importante realizar una correcta anamnesis, ajustando el tratamiento a las necesidades personales de cada momento y un seguimiento adecuado a lo largo de todo el proceso.
El control del dolor, es decir la analgesia, es una prioridad en el tratamiento de estos dos tipos de dolor, siendo necesario en la mayoría de los casos un tratamiento multidisciplinar para conseguirlo: anestesia, cuidados paliativos, fisioterapia, medicina interna, neurología, neurocirugía, oncología, psicología, psiquiatría, rehabilitación, reuma y traumatología.
A continuación, analizaremos los componentes y características de cada uno de ellos.
Dolor neuropático
Definición
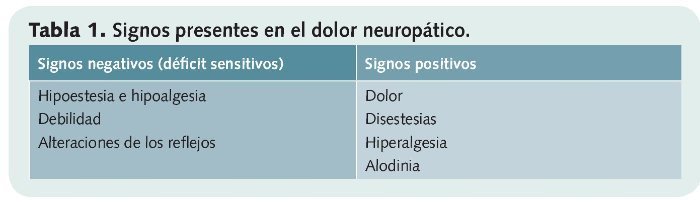
Según la IASP el dolor neuropático es el causado por una lesión o disfunción primaria del sistema nervioso central o de las vías periféricas. Se suele describir como punzante o/y quemante, acompañado frecuentemente de parestesias o disestesias y a menudo consiste en una respuesta aumentada a un estímulo doloroso (hiperalgesia) o en una reacción a un estímulo habitualmente no doloroso (alodinia) (tabla 1).
Epidemiología y etiología
Aunque no se dispone de muchos estudios epidemiológicos, el dolor neuropático podría afectar al 2-10% de la población mundial y se estima que en España afectaría a un 8% de la misma.
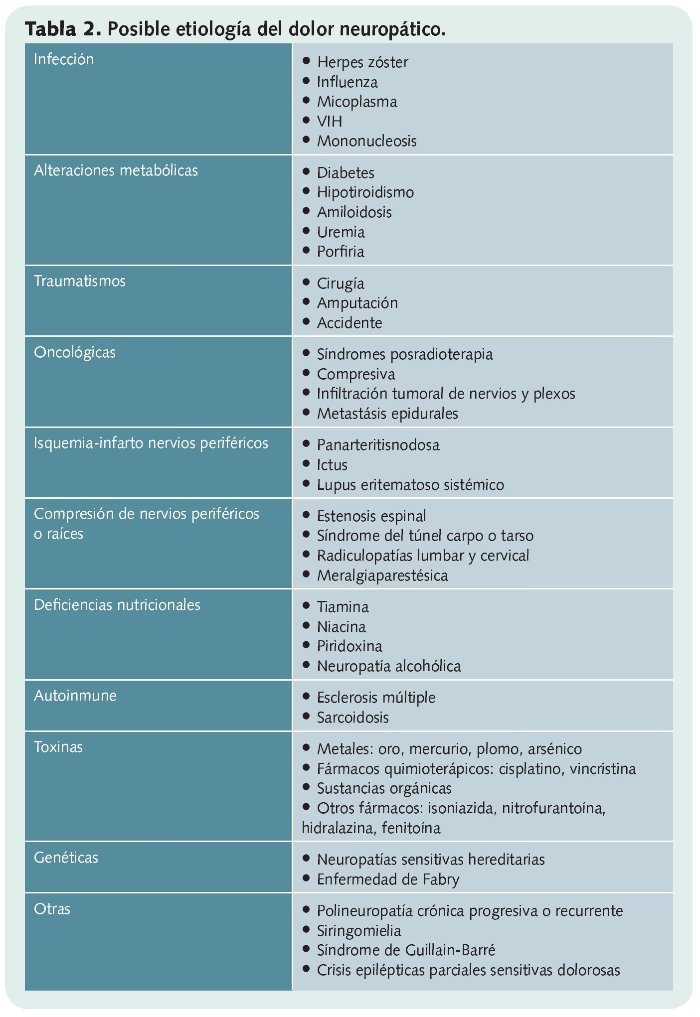
Su etiología parece estar relacionada con la sensibilización de las neuronas producida por diferentes eventos como pueden ser: infecciones, traumas, alteraciones metabólicas, cirugía, compresión neuronal… (tabla 2).
Clasificación
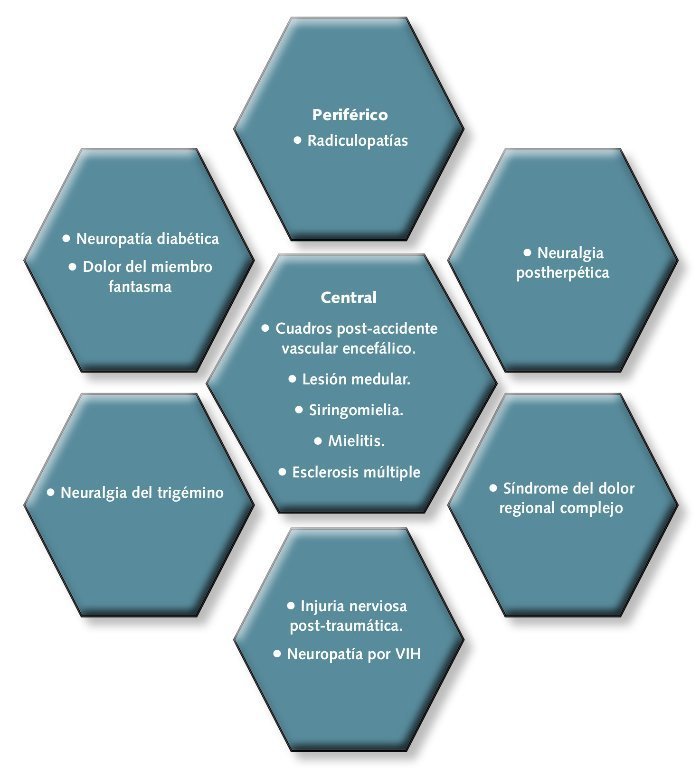
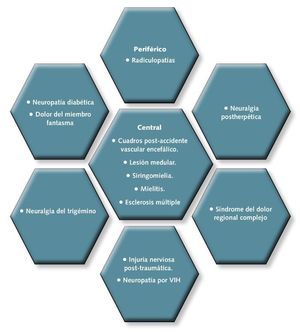
En función del origen, el dolor neuropático puede ser central, cuando la lesión afecta al cerebro o a la médula espinal, o periférico, cuando afecta al resto del sistema nervioso (fig. 1).
Fig 1. Tipos de dolor neuropático en función del origen.
• Síndrome doloroso regional complejo (SDRC). Se produce habitualmente tras una lesión o inmovilización. Puede resultar en un dolor espontáneo (urente) o provocado (alodinia, hiperalgesia) y normalmente va asociado con alteración de la función motora.
• Dolor de miembro fantasma. Aparece tras amputaciones traumáticas o terapéuticas. No está limitado a miembros, sino que también se ha descrito para otras regiones corporales (ano, pelvis, vejiga…). En el 80% de los pacientes, suele resolverse en menos de un año. Los síntomas más frecuentes son hormigueo, pinchazos, quemazón y parestesias más frecuentes que el propio dolor.
• Neuralgia postherpética (NPH). Es una secuela tras la infección por herpes zóster. Los pacientes describen su dolor como sordo, constante, urente, en ocasiones punzante, fluctuante en intensidad, asociado a periodos libres de dolor. A veces, se refieren a él como lancinante con exacerbaciones. Y otras veces se manifiesta como alodinia e hiperalgesia.
• Neuralgia del trigémino (NT). Se suele presentar de forma unilateral y casi siempre en las ramas maxilar o mandibular del trigémino. Se describe normalmente como un dolor corto (menos de 2 minutos), muy intenso y de inicio y final abruptos. Suele tener carácter lancinante, punzante o “eléctrico”. Tiene una “zona gatillo” en la cual incluso un suave estímulo desencadena dolor. Ocasionalmente, oprimir firmemente el área alrededor de la “zona gatillo”, ayuda a disminuir el dolor.
• Neuropatías diabéticas dolorosas (NPD). Las principales son: Neuropatía hiperglucémica. Suele presentarse en pacientes con diabetes de inicio reciente. Los síntomas más comunes suelen ser disestesias y dolor distal. Normalmente se resuelve con el control de la glucemia.
Polineuropatía (diabética) axonal, simétrica, mixta, sensitiva (PNPASS). Se trata de un trastorno sensitivo con expresión en forma de guante o calcetín. Suele ser subclínica durante mucho tiempo y finalmente hacerse evidente con la aparición de parestesias, entumecimiento y dolor. Neuropatía diabética autónoma. Como sucede con el PNPASS, es más frecuente en diabéticos tipo I. Se suele asociar a hipotensión ortostática, diarrea, gastroparesia o hipotonía vesical.
Neuropatía de fibras de pequeño diámetro. Es la polineuropatía diabética dolorosa más común y conocida. Suele aparecer en la evolución de algunos pacientes con PNPASS. Con frecuencia, los pacientes dicen sentir frío aunque también puede ser que refieran calor, “quemazón” o dolor.
Diagnóstico
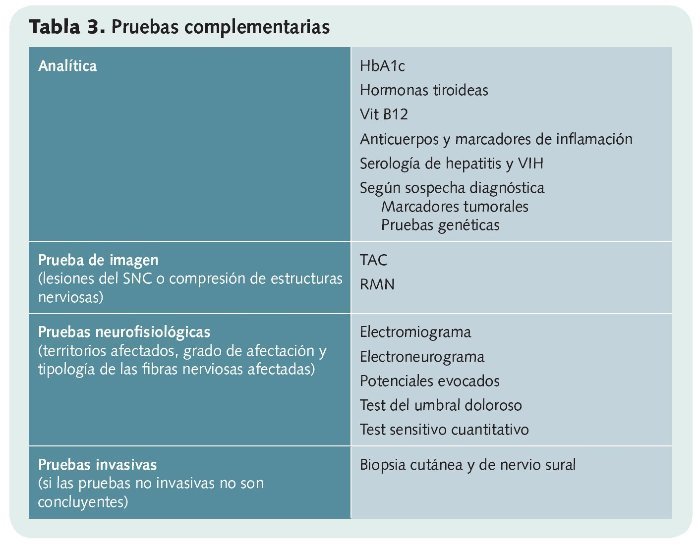
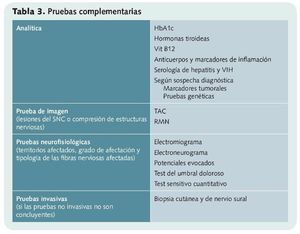
Es fundamentalmente clínico, y para efectuarlo, el médico debe disponer de la historia clínica, realizar un examen físico y apoyarse en posibles pruebas complementarias (analítica, pruebas de imagen, pruebas neurofisiológicas...).
Historia clínica
Es de especial importancia la descripción que el paciente hace del dolor que sufre. Palabras como pinchazo, calambre, hormigueo, quemazón, frío intenso… son orientativas de dolor neuropático y permiten diferenciarlo de otros tipos de dolor. Además se valoran los antecedentes que puedan indicar que se trata de este tipo de dolor (lesión, infección o proceso metabólico).
Para localizar mejor el dolor, son útiles los dibujos. Y para definir la intensidad, se suelen utilizar escalas, tanto verbales como numéricas. En el caso del dolor neuropático, el clínico puede rellenar además el cuestionario DN4 (Douleur Neuropathique en 4 questions), fig 2:
Fig 2. Cuestionario DN4.
Examen físico
En el examen físico se intenta localizar con la mayor precisión posible la zona afectada por si se relaciona con el recorrido de algún nervio. Además, se valoran posibles déficits motores o sensoriales y signos como palidez o rubor y se podrán realizar pruebas complementarias (tabla 3).
Tratamiento
En muchas ocasiones solo se consigue reducir el dolor hasta un nivel más tolerable y menos del 50% de los pacientes consiguen un beneficio significativo.
Este tipo de dolor no suele responder bien a los AINEs, por lo que se suelen utilizar diferentes familias de fármacos: antidepresivos, antiepilépticos, opioides, agentes tópicos, etc. Es importante individualizar el tratamiento porque ninguno de ellos funciona en todos los tipos y estadios del dolor y hay una gran variabilidad interindividual en la respuesta al tratamiento.
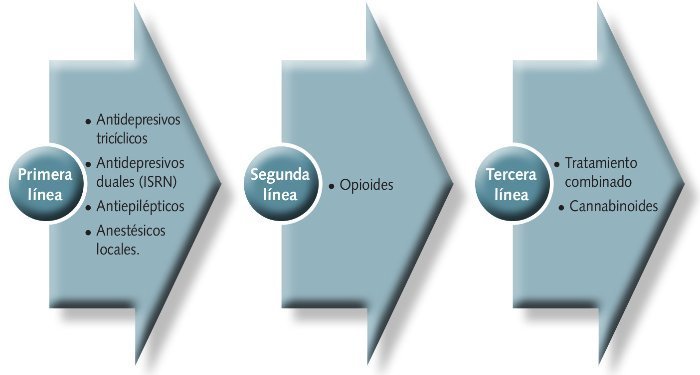
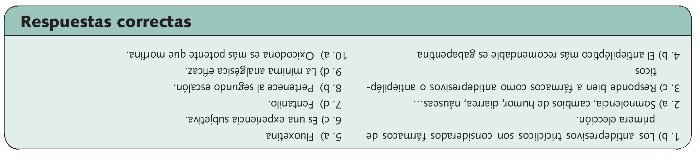
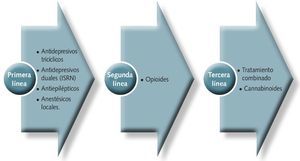
Se distinguen 3 líneas de tratamiento basadas en la efectividad de los medicamentos utilizados en el tratamiento del dolor neuropático (figura 3)
Fig 3. Líneas de tratamiento en el dolor neuropático, basadas en la efectividad de los medicamentos.
Tratamiento farmacológico
•Antidepresivos
Antidepresivos tricíclicos (ATC). Son considerados la primera elección. La eficacia analgésica es independiente de que exista o no depresión, y el control de dolor parece lograrse con menores dosis y en menor tiempo que el efecto antidepresivo. El principal inconveniente son sus efectos adversos, sobre todo a nivel cardiovascular. No se recomienda en ancianos debido a sus efectos anticolinérgicos.
El más estudiado y utilizado es amitriptilina aunque el perfil de seguridad de imipramina parece ser más favorable. Normalmente se administran por la noche, usando la dosis mínima eficaz y su retirada debe efectuarse de modo gradual.
Los inhibidores de la recaptación de serotonina-noradrenalina (IRSN) como venlafaxina o duloxetina han demostrado ser eficaces en la neuropatía diabética, aunque solo duloxetina tiene esa indicación aprobada. El principal efecto adverso a tener en cuenta son las náuseas, que pueden aliviarse con un antiemético empleado durante los primeros días de tratamiento. También son frecuentes los mareos, somnolencia y cefalea, sobre todo al inicio de su uso. Se recomienda evaluar su eficacia a los 2 meses del inicio del tratamiento y efectuar también la retirada de forma gradual.
• Antiepilépticos
Son útiles en el dolor neuropático crónico, especialmente cuando éste es de tipo lacerante, espontáneo o de quemazón. Generalmente se emplean las mismas pautas de utilización que en el tratamiento de la epilepsia, aunque algunos pacientes podrían responder a dosis más bajas.
Gabapentina es el antiepiléptico con mayor grado de evidencia en esta indicación y se considera de elección porque en general es bien tolerado y no presenta interacciones farmacológicas relevantes. Se debe reducir la dosis en insuficiencia renal y en ancianos y vigilar los posibles efectos adversos: somnolencia, alteraciones del humor, diarrea, ataxia, fatiga, náuseas y vértigo.
La experiencia de uso de pregabalina es mucho más limitada. La ventaja que posee frente a gabapentina, es que necesita un menor tiempo de titulación1. Los efectos adversos más frecuentes son: vértigo, estreñimiento, fatiga, náuseas, sedación, aumento de peso y visión borrosa. Se debe emplear con especial precaución si se asocia a con glitazonas, porque aumenta el riesgo de edema periférico e incremento de peso.
Carbamazepina está considerada como tratamiento de elección en la NT y la neuralgia esencial del glosofaríngeo, pero no tiene indicación aprobada en neuropatía diabética ni NPH. Sus principales efectos adversos son ataxia, vértigo, diplopia o náuseas. Raramente se han descrito casos de agranulocitosis, o anemia aplásica.
Otros antiepilépticos no han sido suficientemente evaluados y no está aprobado su uso en esta indicación.
• Anestésicos locales
Se administran por vía tópica en forma de parches o gel.
Lidocaína es útil en el tratamiento de la neuralgia postherpética y en la alodinia por diversas causas neuropáticas. Sus efectos adversos son escasos, habiéndose descrito de forma muy ocasional reacciones cutáneas locales como erupción o eritema. En pacientes en tratamiento con antiarrítmicos orales, se debe tener en cuenta la posible absorción de la lidocaína por vía sistémica.
Capsaicina se emplea para tratar la neuralgia postherpética y la NPD. La principal reacción adversa es la sensación de quemazón en la zona aplicada ocasionalmente acompañada de prurito y eritema que normalmente desaparecen al cabo de varios días de tratamiento. Su efecto es de breve duración, por lo que debe aplicarse de 4 a 5 veces al día.
• Opioides
Han demostrado ser eficaces en el tratamiento del dolor neuropático postherpético y en la neuropatía diabética.
Tramadol es menos potente que los opioides μ-puros, pero presenta mejor perfil de efectos adversos (mareo, vértigo, hipotensión postural, nauseas, sequedad de boca, cansancio, estreñimiento). Se deben ajustar las dosis en casos de enfermedad renal o hepática.
Morfina y oxicodona se emplean por vía oral, iniciando el tratamiento con presentaciones de acción rápida para pasar luego a las formas de liberación sostenida. También se recomienda comenzar con dosis bajas e incrementarlas progresivamente hasta alcanzar el alivio del dolor con efectos adversos tolerables. Si los pacientes no responden a dosis moderadas (40 mg de oxicodona o 60 mg de morfina cada 12 horas), no es probable que respondan a dosis mayores.
Aunque los parches de fentanilo se utilizan con frecuencia en esta indicación, apenas se dispone de estudios en los que hayan demostrado su eficacia en el dolor neuropático.
El tapentadol es un opioide de nueva generación indicado para controlar el dolor crónico intenso en pacientes con dolor por polineuropatía diabética. Los efectos secundarios más frecuentes, que habrá que controlar son náuseas, mareo, estreñimiento, somnolencia y cefalea. La mayoría de las veces estos efectos remiten en las 2 primeras semanas de tratamiento.
Tratamiento combinado
Debido a la escasa eficacia de los tratamientos habituales, y a pesar de que las evidencias existentes no son muy abundantes, con frecuencia se recurre a la utilización de un tratamiento combinado, especialmente en pacientes que presentan una respuesta sólo parcial a la monoterapia. En estos casos, la terapia con dos o más fármacos, con diferentes mecanismos de acción, y a dosis menores que las máximas utilizadas en monoterapia, puede dar mejores resultados, sin incrementar los efectos adversos.
En los últimos tiempos se están investigando nuevas alternativas entre las que se encuentran los cannabinoides cuyo principal problema es su baja disponibilidad oral, por lo que se están estudiando nuevos sistemas de administración.
Tratamiento no farmacológico
Existen alternativas no farmacológicas que habitualmente se han usado para tratar este tipo de dolor. Dentro de ellas podemos citar la fisioterapia, terapias manuales, quiropraxia, estimulación nerviosa eléctrica transcutánea (TENS), estimulación eléctrica percutánea (PENS), acupuntura, magnetoterapia, técnicas psicológicas cognitivo-conductuales, psicoterapia... pero las pruebas sobre su eficacia son escasas.
Dolor oncológico
Definición
Se considera dolor oncológico tanto al causado por el cáncer en sí mismo como al debido al tratamiento o/y las pruebas diagnósticas que se realizan.
Epidemiología
En alrededor del 40% de los casos, el dolor aparece a lo largo de todo el proceso de la enfermedad y llega a afectar al 90% de los pacientes en su último año de vida.
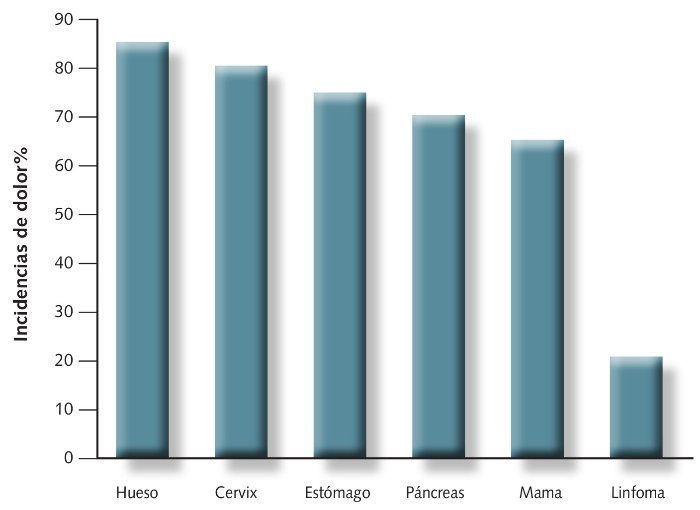
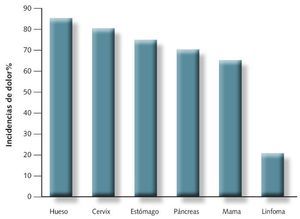
La incidencia más elevada corresponde a los cánceres óseos (85%) y la más baja a las leucemias (5%), tal y como puede verse en la fig 4.
Fig 4. Incidencia de dolor oncológico
Clasificación
En el 5% de los casos es un dolor mixto que desde el punto de vista de duración combina agudo y crónico y desde el de la tipología es tanto nociceptivo como neuropático.
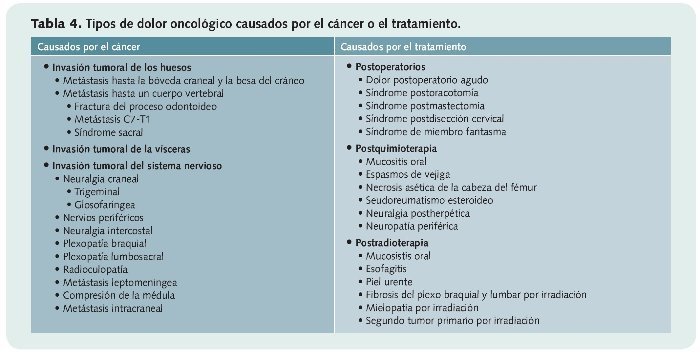
En la tabla 4 se describen los distintos tipos de dolor causados por el cáncer y los que son provocados por el tratamiento.
Diagnóstico
Para instaurar un tratamiento es de suma importancia realizar una correcta valoración del dolor y sus componentes psicológicos, sociales y espirituales, para lo que se deben seguir las siguientes fases:
• Creer en el dolor del paciente. El dolor es una experiencia subjetiva, así que hay que creer que realmente siente el dolor que dice tener.
• Evaluar el dolor. Para ello las herramientas más utilizadas por sencillez son las distintas escalas:
– Numérica: en la que el 0 significa que el paciente no tiene dolor y 10 el peor dolor imaginable. Del 0 al 3 es dolor leve, del 4 al 6 moderado, del 7 al 10 intenso.
– Descriptiva verbal: se elige la categoría que más se ajuste a la intensidad actual del dolor: ausencia, leve, moderado, intenso, muy intenso.
– Visual analógica (EVA): se marca en una línea el lugar que más se ajuste a su dolor siendo el inicio de la línea la ausencia del dolor y el final el peor dolor imaginable.
– Pictóricas: se elige entre varias caras que expresan desde la alegría a la tristeza la que más se identifique con su estado.
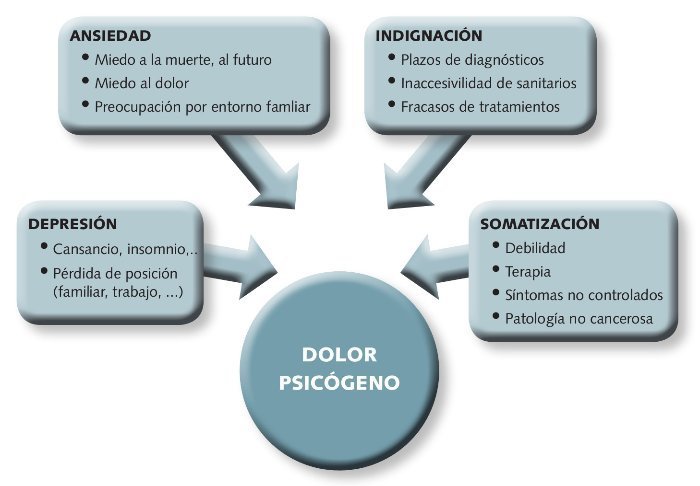
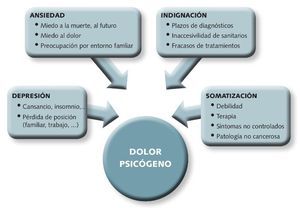
• Considerar aspectos psicológicos del paciente: para conocer así el componente psicógeno del dolor (Fig. 5)
Fig 5. Componentes psicógenos del dolor.
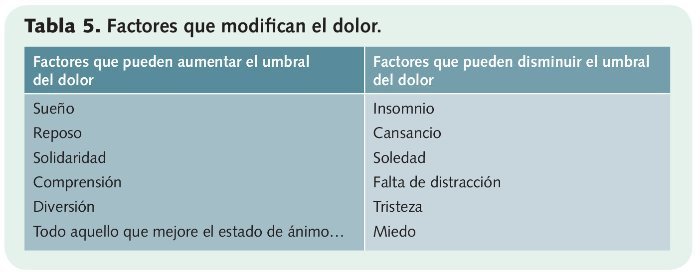
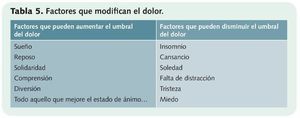
• Realizar una anamnesis detallada del dolor: para analizar su localización, tipología, patrón temporal, signos y síntomas asociados y factores que lo intensifican o lo atenúan (tabla 5).
• Efectuar una exploración física completa del paciente.
• Estudiar y valorar el tratamiento individualizado: con todos los datos recogidos se evalúa cual es la mejor opción de tratamiento, teniendo en cuenta:
– Si el dolor está causado por la enfermedad o por otro trastorno.
– Si representa un síndrome específico del cáncer
– Qué tipo de dolor lo compone.
– Componente psicógeno.
– Entorno familiar.
• Reevaluar de forma continuada la respuesta analgésica, así como la aparición de efectos adversos.
Tratamiento
A la hora de administrar un tratamiento contra el dolor oncológico, conviene tener en cuenta los siguientes principios generales:
• Evaluar la intensidad, las causas y la cronología del dolor…
• Abordar integralmente el paciente y su entorno con técnicas psicosociales y terapia analgésica adecuada tanto de acción periférica como central.
• Adelantarse a posibles reacciones adversas a la medicación (RAM) con medidas preventivas.
• Priorizar la vía oral
• Individualizar las dosis y pautar los analgésicos
• Comenzar por el escalón analgésico más adecuado según el tipo e intensidad de dolor
• No usar conjuntamente opioides potentes y débiles
• Tratar adecuadamente el dolor irruptivo (exacerbaciones del dolor crónico)
• Instruir al paciente y a su familia sobre las pautas a seguir en caso de dolor irruptivo, respuesta analgésica insuficiente o aparición de RAM
• Instruir claramente sobre la forma de contacto con el equipo profesional, en caso de dudas o problemas con el tratamiento
Tratamiento no farmacológico
• Terapia psicológica: Las terapias cognitivo-conductuales han mostrado ser eficaces en la reducción de la angustia y la discapacidad asociada al dolor, así como en la mejora de la adherencia terapéutica.
• Fisioterapia: incluye estimulación eléctrica, calor, crioterapia.
• Cirugía: Deben considerarse la relación beneficio/riesgo de la intervención, la duración de la hospitalización y convalecencia posterior.
• Radioterapia
Tratamiento farmacológico
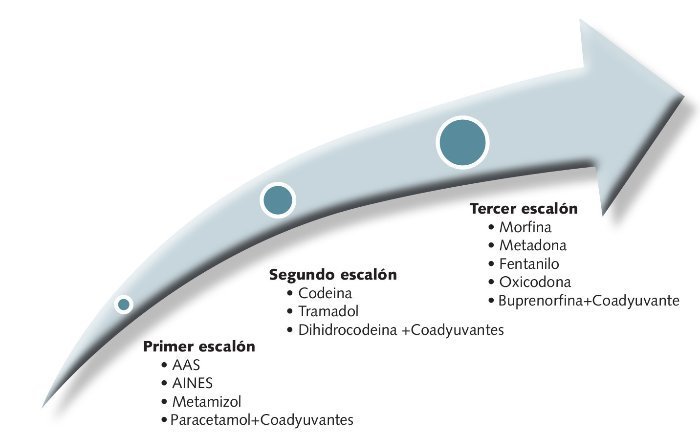
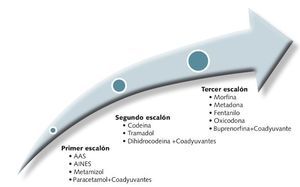
La OMS en 1986 estableció la escalera analgésica para el tratamiento y control del dolor en el cáncer. Consta de tres escalones terapéuticos (fig. 6) por lo que se debe ir ascendiendo a medida que el dolor aumenta o no es controlado con los medicamentos del escalón anterior.
Fig 6. Escalones terapéuticos del tratamiento del dolor oncológico.
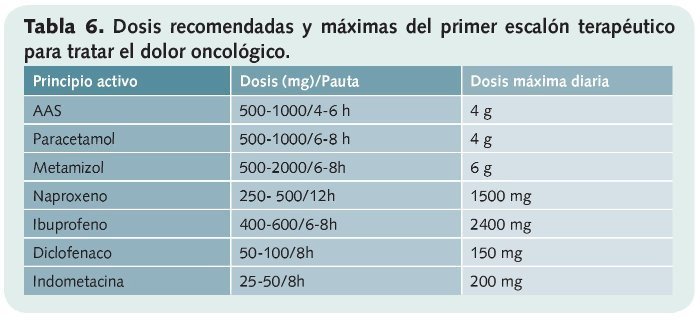
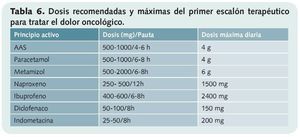
• Primer escalón (tabla 6). La constituyen los analgésicos no opioides y son los recomendados en el dolor leve a moderado (paracetamol y AINEs).
Todos ellos tienen techo terapéutico, es decir una dosis máxima por encima de la cual no se consigue mayor efecto analgésico.
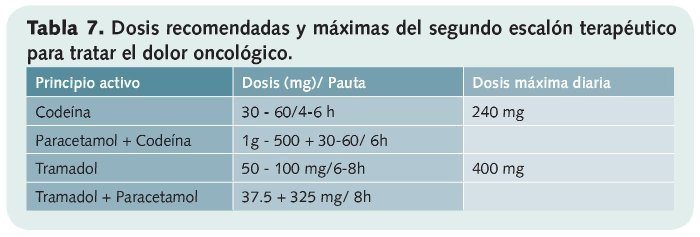
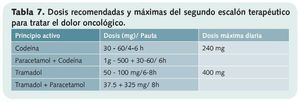
• Segundo escalón (tabla 7)
Forman parte de él los opioides débiles. Están indicados en dolor leve-moderado que no responde con analgésicos del primer escalón y en pacientes que presenten dolor moderado-intenso desde el inicio.
También poseen techo terapéutico y pueden asociarse a los fármacos del primer escalón, pero no entre sí ni a opioides de mayor potencia.
• Tercer escalón. Pertenecen a él los opioides potentes. No presentan techo terapéutico, por lo que la dosis máxima individual será aquella que resulte eficaz con los menores efectos adversos posibles.
Cuando se utilizan, se recomienda actuar de manera profiláctica para evitar o disminuir en la medida de lo posible la aparición de los efectos adversos como el estreñimiento (mediante el uso de laxantes osmóticos) o las náuseas y vómitos (con el uso de un antiemético al inicio del tratamiento y/o administrándoles de forma gradual).
Además se debe tener en cuenta que producen sedación y alteración de las funciones cognitivas, hiperalgesia, retención urinaria, mioclonías, prurito, sudoración e incluso pueden llegar a ocasionar depresión respiratoria.
La morfina es el tratamiento de elección para el dolor oncológico moderado a intenso. Si es posible se utiliza por vía oral comenzando con la mínima dosis eficaz de una presentación de acción rápida. Cuando el dolor está controlado, se pasa a formas de liberación retardada dividiendo la dosis diaria utilizada en dos administraciones diarias.
Además se emplean metadona, hidromorfona, oxicodona, tapentadol y también fentanilo y buprenorfina, que tienen especial interés porque están disponibles para vía transdérmica.
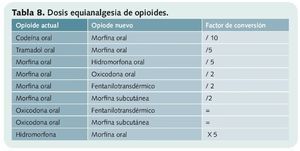
En ocasiones (reacciones adversas intolerables, insuficiente control del dolor, necesidad de cambiar de vía de administración o hiperalgesia) puede ser necesaria la rotación de opioides (ROP) del tercer escalón, para lo que se debe calcular la dosis equianalgésica.
Coadyuvantes
Son fármacos cuya indicación primaria no es el tratamiento del dolor pero poseen efecto analgésico en determinadas ocasiones. También pueden administrarse para reducir efectos adversos de otros fármacos o para tratar otros síntomas asociados al dolor. Se pueden añadir al tratamiento en cualquiera de los tres escalones terapéuticos. Algunos de éstos son fármacos de elección en el tratamiento del dolor neuropático solo o asociado al dolor oncológico.
Corticoides: son utilizados tanto por su efecto antiinflamatorio como su efecto antianorexígeno y euforizante, así como por su acción potenciadora del efecto de los analgésicos y antieméticos.
Bifosfonatos: Indicados para el dolor debido a metástasis óseas si no han sido efectivos los analgésicos, corticoides o radioterapia.
Antidepresivos.
Antiepilépticos.
Anestésicos tópicos.
1 Se denomina tiempo de titulación al necesario para alcanzar la dosis de mantenimiento eficaz.