Biogenéricos
BOFAC N.o 91
Boletín Atención Farmacéutica Comunitaria es una publicación derivada de una línea de investigación dirigida por el Dr. Antonio Iñesta de la ENS-ISCIII, destinada a los farmacéuticos que han seguido cursos de formación continuada en Atención Farmacéutica, para apoyar sus actividades y ponerles al día sobre aspectos útiles en su actividad. Este Boletín es una copia adaptada del que se publica en la web http://www.isciii.es/ens-atenfar/
Gracias al desarrollo de la biología molecular y la ingeniería genética, cada vez más nuevos tratamientos con medicamentos derivados de la biotecnología están disponibles para la asistencia sanitaria.
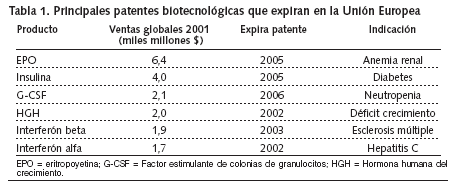
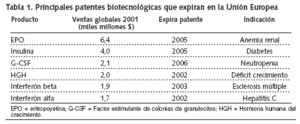
Estas opciones terapéuticas incluyen, por ejemplo, insulina humana recombinante para el tratamiento de la diabetes, hormona humana del crecimiento para el tratamiento del enanismo hipohipofisario, interferón, eritropoyetina para el tratamiento de la anemia en casos de insuficiencia renal crónica, varios factores de la coagulación y muchos otros.
Cuando un genérico biotecnológico que es similar a uno de referencia no cumple las condiciones de definición de genérico, debido en particular a diferencias en materiales poco estudiados o variaciones en el proceso de fabricación del mismo, entonces se trata de lo que llamaremos «biogenérico».
Legislación. La legislación farmacéutica recientemente adoptada en la Unión Europea (UE) crea un procedimiento regulador para su registro en la UE estableciendo una base legal para los biogenéricos, que en la nueva legislación se llaman «productos medicinales biológicos similares» (similar biological medicinal products).
El texto final de esta nueva legislación fue aprobado el 31 de marzo de 2004 por el Consejo y debería haberse hecho la transposición a la legislación de cada país de la UE antes del 1 de noviembre de 2005. No obstante, la norma comunitaria contempla un análisis caso por caso, lo que no ayuda mucho si lo que se busca es sólo claridad, pero sí permite decisiones que garanticen la seguridad necesaria para los pacientes.
Un problema clave para los biogenéricos ha sido cómo probar su semejanza con los productos biotecnológicos originales. Con la mayoría de los productos farmacéuticos, un fabricante de un genérico tiene que demostrar bioequivalencia, pero los productos biotecnológicos son mucho más difíciles de definir químicamente y su especificidad puede relacionarse con la forma en que son expresados, purificados, y fabricados.
Debido a la complejidad de muchos de estos productos y de los costes implicados en desarrollar las versiones biogenéricas, se espera que sólo un número reducido de compañías de genéricos provean estos productos. Por tanto, llevará un cierto tiempo lograr que estén disponibles para los pacientes. Con respecto a los biogenéricos, estamos hoy en una encrucijada similar a la que vivimos en 1984 en relación con los genéricos.
En la actualidad, no hay en el mercado europeo ningún producto biogenérico, pero la puerta para su comercialización está abierta desde el punto de vista legislativo. La directriz sobre productos medicinales biológicos similares fue adoptada por el Comité de medicamentos para uso en humanos (CHMP) de la Agencia Europea del Medicamento (EMEA) en septiembre de 2005 (CHMP/437/04 Guideline on Similar Biological Medicinal Products).
El proceso regulador de la UE ha progresado rápidamente durante los dos años pasados, y se espera que el primer biogenérico sea aprobado en 2006, ya que la EMEA ha recibido varias solicitudes, entre ellas la de una hormona humana del crecimiento, una insulina y una eritropoyetina. En Estados Unidos el progreso inmediato depende del uso del polémico 505(b)(2) de la FDA (Agencia de Alimentos y Medicamentos de ese país) para la insulina y la hormona del crecimiento. Sin embargo, se espera que los biogenéricos sean lanzados en Estados Unidos antes de 2009.
La primera ola de biogenéricos, formada por sólo 6 productos, generará ahorros de alrededor de 2.000 millones de euros por año.
Situación en Estados Unidos. Por otra parte, en Estados Unidos, alteplase, un activador del plasminógeno tisular producido por tecnología de ADN recombinante indicado en infarto agudo de miocardio e ictus, y filgrastim, indicado en la neutropenia, perdieron la patente en 2005. Ya en 2004 la había perdido palivizumab, un anticuerpo monoclonal humanizado, indicado para la prevención de enfermedad del tracto respiratorio inferior grave, producida por virus respiratorio sincitial en pacientes pediátricos.
Como ejemplo de su importancia económica, se puede decir que los tres productos biotecnológicos que generan un mayor volumen de ventas en Estados Unidos --filgrastim, un factor estimulante de colonias de granulocitos humanos (G-CSF) producido por tecnologia de ADA recombinante; epoetin alfa, una eritropoyetina que estimula la producción de glóbulos rojos, e interferon alfa-2b, un interferón alfa producido por tecnología de ADN recombinante-- cuestan aproximadamente 15.000, 10.000, y 22.000 dólares, respectivamente por paciente y año, de acuerdo con la Generic Pharmaceutical Association (GphA).
La GPhA cree firmemente que es posible, con la estructura actual de la FDA, permitir la aprobación y comercialización de un arsenal extenso de biogenéricos con complejidad de baja a modesta, y ampliar el sistema en los próximos años para permitir la aprobación de productos más complejos a medida que la ciencia vaya avanzando. La FDA debería dar vía libre a esos productos mediante el proceso abreviado de aprobación, como hace para medicamentos sintéticos en la actualidad.
Mercado mundial. Según IMS Healthcare, el mercado mundial para los productos biofarmacéuticos es aproximadamente de 20.000 millones de dólares. Así, si los biogenéricos logran una saturación del 10-15%, similar al del mercado genérico estándar, hay un mercado potencial de 2.000 millones de dólares. Si se toman las cifras de Datamonitor, que sugieren unas ventas globales de productos biofarmacéuticos de 56.200 millones de dólares en 2004 a cuenta de las 56 grandes compañías de este sector (30.800 millones de dólares corresponderían a Estados Unidos), entonces las cifras son superiores.
Dicho de forma sencilla, las oportunidades abundan para los primeros dispuestos a entrar en el mercado de productos biofarmacéuticos genéricos. Sin embargo, uno de los obstáculos principales para el mercado de biogenéricos es una carencia de normas claras y sencillas que regulen la aprobación de versiones de biogenéricos.
Los productos biofarmacéuticos están creciendo a una velocidad que casi dobla la de los productos farmacéuticos totales en conjunto: alrededor de 350 productos están en fase de ensayos clínicos y más de un millar se hallan en fases de desarrollo inicial.
Si bien en Europa no hay ningún biogénerico en el mercado, sí hay firmas europeas que los comercializan en otras áreas como Asia, donde la legislación no distingue los medicamentos biogenéricos de los otros genéricos. En países como China, India y Malasia los medicamentos biogenéricos no tienen un tratamiento normativo diferente al de los genéricos de productos de base química, lo que hace que en estos mercados sea más fácil la comercialización de biogenéricos.
La experiencia con biogenéricos en países que no son de la UE indica que se venden a precios un 25-40% inferiores a los de los productos de referencia.
Sin duda, la futura introducción de los biogenéricos en los mercados y en la asistencia sanitaria va a suponer un avance significativo en el uso eficiente de los recursos y una ayuda a la sostenibilidad del Sistema Nacional de Salud.
Bibliografía
EGA. Competition and Affordability in Biopharmaceuticals. http://www.egagenerics.com/gen-biogenerics.htm
EMEA. Biosimilar medicinal products. http://www.emea.eu.int/index/ indexh1.htm > lado derecho pinchar «Guidance documents» >> pinchar «Biosimilar products»
EMEA. Guideline on Similar Biological Medicinal Products (CHMP adopted September 2005) http://www.emea.eu.int/pdfs/human/biosimilar/043704en.pdf
GphA. Generic biopharmaceuticals. http://www.gphaonline.org/